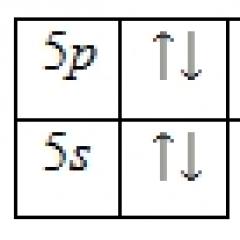
Kristal sahə nəzəriyyəsi anlayışı. Kimyəvi birləşmə modelləri. Kristal sahə nəzəriyyəsi. Aşağı və yüksək spinli komplekslər
Zəif sahə güclü sahə
Orta sahə
Frac34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
3d seriyasının elementləri olan zəif sahə liqandları yüksək spinli komplekslər, güclü sahəli liqandlar isə aşağı spinli komplekslər əmələ gətirir. Onların arasındakı fərq yalnız d 4 – d 7 konfiqurasiyaları üçün komplekslərin elektron quruluşuna təsir göstərir:
3+ gün 5 3– gün 5
yüksək fırlanma kompleksi aşağı fırlanma kompleksi
H 2 O – zəif sahə liqandı CN – – güclü sahə liqandı
Aşağı spinli komplekslər həmişə yüksək spinli komplekslərdən daha sabitdir. Orta sahəli liqandlar şəraitdən (mərkəzi atomun yükü və təbiətindən) asılı olaraq həm yüksək spinli, həm də aşağı spinli komplekslər yarada bilər.
Misal. TCP-yə əsaslanaraq, hexaammine kobalt(II) (Δo = 21600 sm–1, P = 21000 sm–1) və hexaammine kobalt(III) ionlarının (Δo = 9500 sm–1, P = 22500) elektron strukturu haqqında fərziyyə edin sm–1).
Ammonyak orta sahəli liqanddır və metalın oksidləşmə dərəcəsindən asılı olaraq həm yüksək spinli, həm də aşağı spinli komplekslər yarada bilər. Kobalt(II) və kobalt(III) üçün hansı komplekslərin enerji baxımından daha sabit olacağını öyrənək. Bunu etmək üçün güclü və zəif bir sahədə hər bir ionun ESC-ni müqayisə edin:
(a) 3+, d 6

güclü sahə zəif sahə
ESKP (güclü sahə) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 sm –1
ESKP (zəif sahə) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 sm – 1
Enerji qazancı aşağı fırlanma kompleksi vəziyyətində daha böyükdür.
(b) 2+ , d 7

güclü sahə zəif sahə
ESKP (güclü sahə) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 sm-1
ESKP (zəif sahə) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 sm – 1
Yüksək fırlanma kompleksi vəziyyətində enerji qazancı daha böyükdür.
Beləliklə, 3+ ion aşağı spinli, 2+ ion isə yüksək spinlidir.
ESC Δo-nun artması ilə artır, lakin yüksək fırlanma və aşağı fırlanma vəziyyətləri üçün fərqlidir (şək. 1.28. D 6 konfiqurasiyasına malik yüksək spinli və aşağı spinli komplekslər üçün ESC-nin Δo = 10Dq dəyərindən asılılığı. .Hər iki dövlətin mövcudluğunun mümkün olduğu region kölgədədir). Bu iki xəttin kəsişmə nöqtəsinə yaxın bölgə həm yüksək fırlanma, həm də aşağı fırlanma vəziyyətlərində mövcud ola bilən komplekslərə uyğundur.
Məsələn, aşağı temperaturda yüksək spinli (paramaqnit), yüksək temperaturda isə aşağı spinli (diamaqnit) olan 1,10-fenantrolinə malik dəmir (II) tiosiyanat kompleksi (M.Marchivie, P. Guionneau, J. A. K. Howard). , G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, c. 124, s. 194). Çoxluğun dəyişməsi atomlararası məsafələrin və koordinasiya mühitinin həndəsəsinin dəyişməsi ilə müşayiət olunur: aşağı spinli kompleks nizamlı oktaedr, yüksək fırlanan kompleks isə təhrif olunmuş kompleksdir. Yüksək fırlanma vəziyyətinə tərs keçid yüksək təzyiqlərin və ya radiasiyanın təsiri altında mümkündür. Hal-hazırda bir neçə onlarla belə sistem məlumdur.
Liqandın σ-donor və π-akseptor xassələri haqqında danışarkən, kompleks birləşmələrə tətbiq olunan molekulyar orbital metodun yanaşmalarından istifadə edərək TCP-dən kənara çıxdıq (1-ci cild). Yada salaq ki, d-orbitalların parçalanması şəkli oktaedral kompleksdə molekulyar orbitalların ümumi sxeminin fraqmentidir, burada t 2g orbitalları qeyri-bağ, e g isə antibond kimi qəbul edilir (Şəkil 1-ci cild). .
Oktaedral kompleksdə π bağı olmayan rabitələrin əmələ gəlməsi metalın s-, p- və d-orbitallarını və hər bir liqanddan bir orbitalı əhatə edir. 15 atom orbitalından 15 molekulyar orbital əmələ gəlir, onlardan altısı (a 1 g, t 1 u, e g (hap qeyd: orbitalların təyinatındakı hərf onların degenerasiya dərəcəsini göstərir: t - üç dəfə degenerasiya, e - ikiqat). degenerasiya, a - qeyri-degenerasiya və simmetriya mərkəzinin olması: g - simmetrik, u - asimmetrik)) σ-bağlama, üç (t 2 g) - bağlanmayan və altı (e g *, t 1 u) *, a 1 g *) σ-boşaltma. Bağlayıcı orbitallar enerji baxımından liqand orbitallarına daha yaxındır, bağlanmayan orbitallar isə əsasən metal atomunda lokallaşdırılır. Kompleksin əmələ gəlməsi zamanı metal orbitalların enerjisi d xy , d xz , d yz (t 2 g) praktiki olaraq dəyişmir.
Liqandda metal orbitallara simmetriya baxımından oxşar olan aşağı enerjili boş orbitalın olması t 2g orbitalların enerjisinin praktiki olaraq məsələn təsir etmədən azalmasına gətirib çıxarır və bununla da Δо artır (Şəkil 1.29. MO fraqmentləri). σ-donor liqand (a) və σ-donor, π-akseptor liqand (b) ilə kobalt(III) kompleksinin diaqramı).
Jahn-Teller effekti. 1937-ci ildə Yang və Teller teoremi sübut etdilər ki, degenerasiyaya uğramış elektron vəziyyətdə olan hər hansı bir qeyri-xətti molekul qeyri-sabitdir və kortəbii olaraq onun simmetriyasını aşağı salan və degenerasiyanın aradan qaldırılmasına səbəb olan təhrifə məruz qalır. Teorem yalnız degenerasiyanın aradan qaldırılması faktını proqnozlaşdırır, lakin onun necə aradan qaldırılacağını göstərmir. Bu teorem əsasında bir sıra komplekslərin oktaedral həndəsəsinin təhrifi izah edilmiş və belə bir təhrifin olması faktının özü də Jahn-Teller effekti adlanmışdır. Bir nümunəyə baxaq. d9 konfiqurasiyalı mis (II) kompleksləri, bir qayda olaraq, müntəzəm oktaedri təmsil etmir, oxlardan biri boyunca uzanır və ya sıxılır (Şəkil 1.30. Mis (II) komplekslərində oktaedral həndəsənin təhrifi). Prolat oktaedr məsələsinə baxaq. Z oxu boyunca yerləşən liqandların çıxarılması orbitalların enerjilərinin dəyişməsi nəticəsində degenerasiyanın aradan qaldırılmasına səbəb olur. Z oxu boyunca yönəlmiş orbitallar (d xz, d yz, d z 2) z komponenti olmayan (d xy, d x 2 -y 2) orbitallarla müqayisədə liqandların orbitalları ilə daha zəif qarşılıqlı təsir göstərir və buna görə də onların enerjisini aşağı salır. Z-komponentinə (d xz, d yz) malik olan eyni simmetriyaya malik bir cüt orbital degenerativ olaraq qalır və artan enerji əldə edir. (Şəkil 1.31. Oktaedr təhrif edildikdə d-orbitalların enerjilərinin dəyişməsi). Jahn-Teller effekti özünü qeyri-bərabər doldurulmuş e g orbitalları, yəni t 2g 3 e g 1 (zəif sahədə d 4 ionuna uyğundur: CrCl 2, K 3 MnF 6) və t 2g konfiqurasiyaları ilə ən güclü şəkildə büruzə verir. 6 e g 3 ( d 9 ionuna uyğundur: demək olar ki, bütün mis (II) kompleksləri) və t 2g 6 e g 1 (güclü sahədə d 7 ionuna uyğundur, nadir, K 3 NiF 6),. Qeyri-bərabər doldurulmuş t 2g orbitalları olan komplekslər üçün əhəmiyyətsiz bir Jahn-Teller effekti xarakterikdir, yəni elektron konfiqurasiyalar üçün t 2g 1 (d 1), t 2g 2 (d 2), t 2g 4 (güclü sahədə d 4) , t 2g 5 (güclü sahədə d 5), t 2g 5 e g 1 (zəif sahədə d 6), t 2g 5 e g 2 (zəif sahədə d 7). Zəif sahədə d 3 və d 5, güclü sahədə d 3 və d 6, d 8 və d 10 konfiqurasiyalı ionlar heç bir halda Jahn-Teller deyil.
Jahn-Teller effekti bir çox mis (II) və manqan (III) komplekslərində rabitə uzunluqlarının bərabərsizliyində və komplekslərin pilləli sabitlik sabitlərinin qeyri-monotonik dəyişməsində özünü göstərir. Məsələn, susuz mis (II) xloriddə mis atomu altı xlor atomu ilə əhatə olunmuşdur, onlardan dördü 0,230 nm, digər ikisi isə ondan 0,295 nm məsafədə yerləşir.
Mis (II) kompleksləri (Cl 2, (C 6 H 5 SO 3) 2 və s.) məlumdur ki, onlar bir neçə kristalloqrafik cəhətdən qeyri-ekvivalent Jahn-Teller ionlarından ibarətdir, hər biri özünəməxsus təhrif tipinə malikdir, bir-birinə çevrilir, dəyişir. metal-liqand məsafəsi o qədər sürətlidir ki, ümumilikdə bütün metal-liqand məsafələri eyni görünür. Bu iş çağırıldı dinamik və ya pulsasiya edən Jahn-Teller effekti(P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214) .
Jahn-Teller effekti isə universal qanun deyil. Hal-hazırda Jahn-Teller konfiqurasiyasına malik mürəkkəb ionlar məlumdur, onlar təhrif edilməmiş oktaedrlərdir: 4-, 3+.
Oktaedraldan başqa simmetriyaya malik sahələrdə parçalanma.
Oktaedrallardan başqa, müxtəlif həndəsə malik komplekslər də məlumdur - kvadrat müstəvi, tetraedral, triqonal-piramidal, kvadrat-piramidal, xətti və s. koordinasiya polihedronunun simmetriyası ilə müəyyən edilir.
Kvadrat-müstəvi kompleksləri koordinat oxlarından biri boyunca yerləşən liqandlar sonsuzluğa qədər çıxarıldıqda səkkizbucaqlı həndəsənin tetraqonal təhrifinin ekstremal halı hesab edilə bilər (şək. 1.27b). Orbitalların təyinatları şəkildə göstərilmişdir. Planar-kvadrat komplekslər d 8 – Ni 2+, Pd 2+, Pt 2+, Au 3+ elektron konfiqurasiyası olan ionlar üçün ən tipikdir. Onların sabitliyi artan Δ ilə kəskin şəkildə artır, yəni 3d seriyasının elementlərindən ağır keçid elementlərinə keçdikdə. Beləliklə, məsələn, palladium, platin və qızılın koordinasiya nömrəsi dörd kvadrat olan demək olar ki, bütün kompleksləri varsa, nikel yalnız yüksək sahəli liqandlarla planar-kvadrat komplekslər əmələ gətirir: 2-, Ni(dmg) 2. Halogenlər kimi aşağı sahəli liqandları olan nikel (II) kompleksləri tetraedral həndəsə malikdir.
Bəzi kvadrat-müstəvi keçid metal kompleksləri, məsələn, platin atomlarının qismən +4 oksidləşmə vəziyyətində olduğu K 2 Br 0.3-də Pt-CN-Pt, məsələn, körpü ligandları ilə bərk formada zəncirlər əmələ gətirir. 5d orbitalların yüksək nüfuzetmə qabiliyyəti onların vahid enerji zolağının formalaşması ilə üst-üstə düşməsini və nəticədə zəncir istiqamətində metal keçiriciliyini təmin edir. Belə molekulyar komplekslər elektrik cərəyanı keçirməyə qadirdir və hazırda intensiv şəkildə öyrənilir.
Tetraedral simmetriya sahəsində d xy , d yz , d xz orbitalları maksimum enerjiyə malikdir, onlara t 2 -orbitallar, minimum enerji isə d x 2 –y 2 və d z 2 orbitalları deyilir, e ilə işarələnirlər. . Daha az sayda liqandların olması və onların müxtəlif düzülüşünə görə tetraedral sahə (şək. 1.32. Tetraedral və oktaedral sahələrdə parçalanmaların müqayisəsi) oktaedraldan 2,25 dəfə zəif olur: .
Əksər tetraedral komplekslər yüksək fırlanmalı olur.(İstifadə - Aşağı spinli tetraedral komplekslərin bir neçə nümunəsi məlumdur, məsələn, Cr(N(Si(CH 3) 3) 2 ) 3 NO (xrom(II), d 4 ; D. C). Bradley, Chem. Ber., 1979, 11, 393);CoL 4, burada L 1-norbornildir (kobalt(IV), d5; E.K: Brune, D.S. Richeson, K.H. Theopold, Chem. Commun., 1986). , 1491)). Tetraedral mühitin kristal sahə ilə maksimum sabitləşməsi d 2 (FeO 4 2–, MnO 4 3–) və d 7 (2–) konfiqurasiyaları ilə əldə edilir. Nisbətən aşağı stabilləşmə enerjisi sayəsində tetraedral komplekslər daha çox zəif sahədə d 0 (TiCl 4, MnO 4 –, CrO 4 2–), d 5 (FeCl 4 –) və d 10 (ZnCl) konfiqurasiyalı ionlardan əmələ gəlir. 4 2–) sıfır ESKP ilə, həmçinin keçid olmayan metal ionları (AlCl 4 –). Oktaedral komplekslərlə müqayisədə tetrahedral komplekslərin əmələ gəlməsinə çox vaxt sterik amil üstünlük verir, məsələn, ion 3-dən daha sabitdir.
Komplekslərin sabitliyini izah etmək üçün TCP-dən istifadə. Irving-Williams seriyası. Kristal sahə nəzəriyyəsi oksidlərin və halidlərin kristal qəfəsinin enerjilərindəki dəyişikliklərin qeyri-monoton xarakterini, komplekslərin sabitlik sabitlərini və s. izah etməyə imkan verir. 3d metalların ikiqat yüklü kationlarının hidratasiya enerjilərinin dəyişmə qaydası ümumiyyətlə yüksək spinli komplekslərdə ESC-də dəyişikliklərin xarakteri ilə üst-üstə düşür (Şəkil 1.33. 3d seriyasının ikiqat yüklü kation metallarının hidratasiya enerjisinin dəyişməsi (a) və yüksək spinli komplekslərdə ESC-nin dəyişməsi (b)). ), kristal sahəsi ilə sabitləşmə nə qədər güclü olarsa, nəmləndirmə də bir o qədər çox olar. Məlumdur ki, su molekulunun zəif sahəli liqand L ilə əvəzlənməsinin sabitləri
2+ + L x– = (2-x)+ + H 2 O
Irving-Williams seriyasına tabe olun: Mn 2+< Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ < Zn 2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Nefeloauxetik təsir göstərir. Atomun liqandlar sahəsinə yerləşdirildiyi zaman d-elektronların qarşılıqlı itələnməsinin zəiflədiyi aşkar edilmişdir. Liqandın metal atomunun d-elektronlarına bu təsiri yunanca νεφελη - bulud və αυξανω - artım sözlərindən nefeloauxetic effekt adlanır. Metal orbitallara təsirini artırmaq üçün düzülmüş liqandlar seriyası, demək olar ki, tamamilə spektrokimyəvi sıraya uyğundur. Nefeloaksetik təsirin səbəbi metalın d-orbitallarının liqandların orbitalları ilə üst-üstə düşməsidir ki, bunun sayəsində d-bulud kosmosda genişlənir. Bu effektin olması ən sadə elektrostatik modelin - liqnadların nöqtə mənfi yüklər olduğunu qəbul edən kristal sahə nəzəriyyəsinin məhdudiyyətlərini aydın şəkildə nümayiş etdirir.
Liqand sahəsi nəzəriyyəsi. Kristal sahə nəzəriyyəsi 1929-cu ildə Bethe tərəfindən işlənib hazırlanmışdır. Hal-hazırda, metal-liqand bağının bəzi kovalentliyi üçün düzəlişlərlə dəyişdirilmiş formada geniş istifadə olunur. Bu nəzəriyyə liqand sahə nəzəriyyəsi adlanır. Kovalent qatqının olması TCP ilə hesablananla müqayisədə metal orbitalların enerjisini dəyişir. Kovalentlik nisbəti, eksperimental dəyərləri hesablanmış dəyərlərlə bərabərləşdirməyə imkan verən düzəliş amillərinin tətbiqi ilə nəzərə alınır.
Komplekslərin rənglənməsi.
d-keçid elementi komplekslərinin rəngi bir d-orbitaldan digərinə elektron keçidləri ilə əlaqələndirilir. Bu, dərsliyin birinci cildində müzakirə olunan Ti 3+ ionunun nümunəsi ilə aydın şəkildə göstərilir. Görünən spektrin mavi və yaşıl hissələrinə uyğun gələn enerjini udmaqla Ti 3+ ionunda olan yeganə d-elektron e g orbitalına keçir (şək. 1.35. 3+ ionunun spektri). İonun rəngi əlavə rənglərlə bağlıdır - qırmızı və bənövşəyi. (Diqqətli oxucu udma zolağının bəzi asimmetriyasını görəcək. Bu, Jahn-Teller effektinin yaratdığı t 2g səviyyəsinin bir qədər parçalanmasının nəticəsidir). Bir-birini tamamlayan rəngləri göstərən və hər bir rəssama yaxşı tanış olan diaqram dərsliyin ikinci vərəqində təqdim olunur. Qarşılıqlı santimetrlərlə ifadə olunan keçid enerjisi (1000 sm –1 = 12 kJ) parçalanma parametrinə Δο uyğun gəlir - bu, ən çox elektron spektrlərdən müəyyən edilir. Dalğa uzunluğu enerji ilə tərs mütənasibdir:
 .
.
Çox sayda elektron olan komplekslər vəziyyətində, spektr şəkli daha da mürəkkəbləşir və onda əlavə zolaqlar görünür. Bunun səbəbi elektronların hansı iki d-orbitalda olmasından asılı olaraq həyəcanlı vəziyyət t 2g 1 e g 1 bir neçə yolla həyata keçirilə bilər. Məsələn, elektronların d xy və d x 2 –y 2 orbitallarını tutduğu bir vəziyyət elektronların x oxu boyunca daha çox itələnməsi səbəbindən enerji baxımından d xy 1 d z 2 1 vəziyyətindən daha yüksək olacaqdır. Ən az enerjiyə malik olan zolağa uyğun gələn enerji Δo parçalanma parametrinə bərabərdir.
Elektron spektrləri daha ətraflı təsvir etmək üçün bəzi anlayışları təqdim etmək lazımdır. Gəlin bir alt səviyyədə elektronların hər hansı düzülüşü mikrodövlət adlandıraq. n elektronun x orbital tutduğu mikrostatların sayı N bərabərdir

Hər bir mikrostate öz spin və bucaq momentum dəyərləri ilə xarakterizə olunur. Eyni enerjilərə malik mikro hallar toplusu adlanır müddət, məsələn, 3 P, 5 D, 1 S. Rəqəmsal indeks çoxluğu göstərir, bu kimi hesablanır:
çoxluq = əsas vəziyyətdə olan qoşalaşmamış elektronların sayı + 1.
Terminlərin adları çoxluq əlaməti ilə oxunur: "üçlük P", "beşlik D", "təklik S". Hərf elektronların tutduğu ayrı-ayrı orbitalların m l bucaq momentlərinin cəminin maksimum dəyərinə bərabər olan atom və ya ionun L ümumi bucaq impulsunu bildirir. Məsələn, Ti 3+ ionunda bir d-elektron var, mikro vəziyyətlərin sayı N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (d-orbital üçün m l = –2, –1, 0, 1, 2 olduğundan elektronların sayı 1-dir, buna görə də maksimum m l cəmi ən böyük qiymətə bərabərdir. m l), çoxluq 1 + 1 = 2. Buna görə də əsas vəziyyət termini (ən aşağı enerji ilə) 2 D-dir. Elektron konfiqurasiyalı ion halında d 2 N = (2´5)!/2!( 2´5 – 2)! = 45, L = 3(F) (d-orbital üçün m l = –2, –1, 0, 1, 2 olduğundan, elektronların sayı 2-dir, buna görə də iki ən böyük dəyərin maksimum cəmi m l-ə bərabərdir), çoxluq 2 + 1 = 3. Nəticə etibarilə, yerin mikrovəziyyətinin müddəti 3 F-dir. d-alt səviyyədə iki elektronun fərqli düzülüşü ilə digər şərtlərlə təsvir edilən vəziyyətlər əldə edilir - 3 P, 1 G , 1 D, 1 S və s. L-nin ədədi dəyərləri ilə əlifba simvolları arasındakı əlaqə aşağıda verilmişdir:
L = 0 1 2 3 4 5 6 7
Eynilə, d-elementlərin digər ionları üçün əsas və həyəcanlı vəziyyətlərin şərtlərini çıxara bilərik (Cədvəl 1.5.). Nəzərə alın ki, d n və d 10-n konfiqurasiyalı ionlar üçün şərtlər eynidir.
Cədvəl. 1.5.
d-elektronların müxtəlif konfiqurasiyaları üçün əsas şərtləri və ən yaxın həyəcanlı vəziyyətləri.
Şərtlər orbitallar kimi oktaedral sahədə bölünür və oxşar hərflərlə işarələnir. D şərtləri d-orbitallar kimi T 2 g və E g komponentlərinə, F şərtləri f-orbitallar kimi T 1 g, T 2 g və A 2 g komponentlərinə bölünür. S və P şərtləri ümumiyyətlə bölünmür. Müxtəlif vəziyyətlər arasında elektron keçid imkanları seçim qaydaları ilə məhdudlaşır. Beləliklə, komplekslərdə yalnız eyni çoxluğa malik dövlətlər arasında keçidlərə icazə verilir. Hər bir belə keçid udma spektrində bir zolağa uyğun gəlir. Nümunə olaraq 3+ kompleksinin elektron spektrini nəzərdən keçirək (şək. 1.36. Kompleks 3+ elektron spektri). Üç lent üç elektron keçidlə bağlıdır: 4 A 2 g ® 4 T 2 g, 4 A 2 g ® 4 T 1 g, 4 A 2 g ® 4 T 1 g (P). Ən aşağı enerji ilə keçid parçalanma parametrinin dəyərinə uyğundur: Δo = 17400 sm–1. Kompleks görünən spektrin qırmızı (17400 sm–1) və mavi (23000 sm–1) hissələrində və yaxın ultrabənövşəyi (37800 sm–1) hissələrində işığı udur, buna görə də bənövşəyi rəngə malikdir.
Laportun qaydasına görə, s-s, p-p, d-d, f-f keçidlərini əhatə edən eyni paritetə malik dövlətlər arasında keçidlər çətin, yaxud spektroskopiyanın dili ilə desək, oktaedral komplekslərdə qadağandır. Qadağan olunmuş keçidlər mümkündür, lakin aşağı intensivliklə baş verir. Buna görə keçid metal duzları yalnız konsentratlı məhlullarda nəzərə çarpan rəngə malikdir. O, ionlarında d-elektronları olmayan permanqanat və ya dikromatın rəngindən dəfələrlə zəifdir.
Laportun qaydası yalnız simmetriya mərkəzi olan komplekslər üçün tətbiq edilir. Oktaedr təhrif edildikdə, simmetriya mərkəzi yox olur, Laport qadağası qaldırılır və rəng görünür. Məsələn, 3+ ion rəngsizdir, lakin dəmir (III) duzlarının məhlulları təhrif olunmuş oktaedral mühitə malik asimmetrik hissəciklərin əmələ gəlməsinə səbəb olan hidroliz səbəbindən çox vaxt sarı-narıncı olur.
Komplekslərin rəngi, bir metal d-orbitaldan digərinə (oktaedral komplekslərdə t 2g-dən eg-ə qədər) d-d keçidlərindən əlavə, daha iki amillə müəyyən edilir: liqand orbitallarından metal orbitallara keçid (onlara yük transferi deyilir). ) və liqand orbitalları daxilində keçidlər. Bu keçidlər Laportun hakimiyyəti altına düşmür və buna görə də yüksək intensivliyə malikdir.
Şarj ötürmə zolağı istənilən birləşmənin elektron spektrində mövcuddur, lakin bəzi hallarda o, spektrin ultrabənövşəyi hissəsindədir və bizim tərəfimizdən rəng kimi qəbul edilmir. Əgər liqand orbitalları ilə metal orbitalların enerjiləri arasındakı fərq azalarsa, yük ötürmə zolağı spektrin görünən hissəsinə düşür. Permanqanat, dikromat, civə sulfid, titan (IV) perokso kompleksləri və boş d-orbitalları olan bir çox digər birləşmələrin intensiv rəngini izah edən yük ötürülməsidir. Bəzi hallarda işığın təsiri altında liqandın orbitallarından metalın orbitallarına yük transferi geri dönməz şəkildə baş verir, yəni kimyəvi proseslə müşayiət olunur. Buna misal olaraq qara və ağ fotoqrafiyanın əsasını təşkil edən gümüş halidlərinin fotokimyəvi parçalanmasını göstərmək olar: Ag + Br – ¾® Ag 0 + Br 0 .
Kalium permanqanatın elektron spektrində elektronların əsasən liqandda lokallaşdırılmış bağlanmayan orbitallardan (a 1, t 2 σ orbitalları və e, t 1, t 2 π orbitalları) e*, t2-yə keçidinə uyğun gələn dörd zolaq müşahidə olunur. '' metal atomunda lokallaşdırılmış orbitalların antibonding orbitalları ((Şəkil 1.37. MnO 4 tetraedral ionunun enerji diaqramı - π bağı ilə. Elektron keçidləri oxlarla göstərilmişdir):
ν 1 , Mn(e*) ¾ O(t 1) 17700 sm –1
ν 2 , Mn(t 2 '') ¾ O(t 1) 29500 sm –1
ν 3 , Mn(e*) ¾ O(t 2) 30300 sm –1
ν 4 , Mn(t 2 '') ¾ O(t 2) 44400 sm –1
Ən aşağı enerjiyə malik zolaq spektrin görünən hissəsinə düşür (λ = 107/17700 = 565 nm), bu da yaşıl işığın udulmasına və qırmızı-qırmızı işığın ötürülməsinə uyğundur.
3. Kompleks birləşmələrin iştirak etdiyi reaksiyaların mexanizmləri.
Kimyəvi proseslərin böyük əksəriyyəti bəzi elementar mərhələlərin ardıcıl zənciri kimi baş verir və reaksiya tənliyi yalnız reaksiyanın əsas son məhsulları haqqında məlumat daşıyır. Başlanğıc maddələrdən məhsullara qədər gedən bu elementar çevrilmə ardıcıllığına mexanizm deyilir. Reaksiyaya girən maddələrdən məhsullara gedən yolun keçdiyi aralıq, adətən qeyri-sabit birləşmələrə ara maddələr deyilir. Hər hansı bir ara məhsulun müəyyən bir ömrü var, adətən son dərəcə qısa, 10 -14 s-ə qədər. Reaksiyanın enerji profili üzrə o, minimuma uyğundur (Şəkil a) (Şəkil 1.38. Reaksiyanın enerji profilləri: (a) aralıq, (b) keçid vəziyyəti.). Bir qayda olaraq, aralıq maddələri reaksiya qarışığında spektral üsullarla aşkar etmək olar və yalnız nadir hallarda onları fərdi formada təcrid etmək olar. Buna görə də, reaksiya mexanizmi haqqında əsas məlumat adətən onun kinetikasının öyrənilməsi - sürət sabitlərinin müəyyən edilməsi və aktivləşmə parametrlərinin (entalpiya, entropiya, həcm) hesablanması yolu ilə əldə edilir. Bu halda mexanizm kinetik məlumatlara uyğun olan model, təkmilləşdirilə, dəyişdirilə, yenidən işlənə bilən modeldir.
Bəzi reaksiyalarda ara maddələr əmələ gəlmir və reaktivlərdən məhsullara keçid ardıcıl olaraq baş verir - atomlardan biri tədricən çıxarılır, digəri isə yaxınlaşır. Bu vəziyyətdə reaksiyanın davam edəcəyi deyilir keçid vəziyyəti və ya aktivləşdirilmiş kompleks. O, reaksiyanın enerji profilində maksimuma uyğundur (şəkil B).
Əlavə: labil və inert komplekslər
Hissəciyin termodinamik sabitliyi onun dissosiasiya reaksiyası üçün Gibbs enerjisinin dəyişməsi və ya bu prosesin sabitlik sabitinin qiyməti ilə müəyyən edilir. Kinetik sabitlik verilmiş hissəciyin digər hissəciklərlə nə qədər tez qarşılıqlı əlaqədə olduğunu və ya çürüməyə məruz qaldığını göstərir. Kimyəvi hissəcik hesab olunur inert, 1 dəqiqədən çox yarımxaricolma dövrü ilə reaksiya verərsə. Daha yüksək sürətlə reaksiya verən hissəciklər deyilir labil. Yadda saxlamaq lazımdır ki, kinetik və termodinamik sabitlik bir-birindən asılı deyildir, yəni eyni maddə yüksək sabitlik sabitinə malik ola bilər və eyni zamanda inert və ya əksinə, labil ola bilər. Bəzi belə nümunələr Cədvəl 1.6-da verilmişdir.
Cədvəl 1.6. Bəzi metalların sianokomplekslərində sabitlik sabitləri və liqandların əvəzlənmə dərəcələri.
Henri Taube oktaedral komplekslərin kinetik sabitliyi ilə oktaedral sahədə mərkəzi ionun elektron konfiqurasiyası arasında əlaqəni göstərmişdir. Taube görə, aşağıdakı komplekslər labildir:
· ən azı bir vakant t 2g orbitala malik olmaq - onlar assosiativ (A, I a) mexanizminə uyğun reaksiyalarda istifadə edə bilərlər və ya
· e g orbitalında ən azı bir elektronun olması - bu, dissosiativ (D, I d) mexanizmi ilə reaksiyaya kömək edir, çünki Elektronun e g orbitalından çıxarılması keçid vəziyyətinin enerjisini azaldır.
Beləliklə, xrom(III) (t 2g 3) oktaedral kompleksləri, dəmirin (II) (t 2g 6) və dəmirin (III) aşağı spinli kompleksləri (t 2g 5), həmçinin 4d-, 5d- kompleksləri. keçid elementləri d-elektronlarının sayı ikidən çox olan inert kimi təsnif edilir.
ƏLAVƏNİN SONU
Qeyri-üzvi reaksiyaların vahid təsnifatı hələ hazırlanmamışdır. Şərti olaraq aşağıdakı sxemi təklif edə bilərik (Şəkil 1.39. Qeyri-üzvi reaksiyaların təsnifatını təsvir edən sxem):
1) liqandların dəyişdirilməsi, əlavə edilməsi və ya aradan qaldırılması reaksiyaları metalın koordinasiya sferasının dəyişməsinə təsir edir;
2) Redoks reaksiyaları metalın elektron konfiqurasiyasının dəyişməsi ilə əlaqələndirilir, lakin onun koordinasiya mühitinə təsir etmir;
3) Koordinasiya olunmuş liqandların reaksiyaları kompleksin koordinasiya sferasını dəyişmədən liqandın dəyişməsini nəzərdə tutur.
Əvəzetmə reaksiyaları. Geniş mənada əvəzetmə reaksiyaları metalın koordinasiya sferasında bəzi liqandların başqaları ilə əvəzlənməsi proseslərini ifadə edir. Bu cür reaksiyalar oksidləşmə vəziyyətinin dəyişməsi ilə və ya dəyişmədən baş verə bilər. Yuxarıdakı təsnifatdan sonra biz bu termini yalnız oksidləşmə dərəcələrində dəyişiklik olmadan baş verən reaksiyalara münasibətdə istifadə edəcəyik.
Qeyri-üzvi kimyada əvəzetmə reaksiyalarının təsnifatı Lenqford və Qrey tərəfindən işlənib hazırlanmışdır. Bu, müəyyən bir mexanizmin təsvirinə deyil, sözdə məhdudlaşdırıcı mexanizmin tərifinə əsaslanır. Əvvəlcə stoxiometrik mexanizm, sonra daxili mexanizm müəyyən edilir. Stokiometrik mexanizm başlanğıc maddələrdən məhsullara keçiddə elementar mərhələlərin ardıcıllığıdır. O, dissosiativ (D), assosiativ (A) və mübadilə (qarşılıqlı mübadilə, I) ola bilər. Dissosiativ və assosiativ proseslər, sanki bir-birinin əksinə olan iki məhdudlaşdırıcı halı təmsil edir. Hər iki proses bir ara məhsulun meydana gəlməsi ilə iki mərhələdə baş verir.
Dissosiativ (D)
Proses iki mərhələlidir, məhdudlaşdırıcı halda konsentrasiyası azalmış ara məhsuldan keçir:
ML 6 + L, + Y ¾® ML 5 Y
Assosiativ (A)
Proses iki mərhələlidir, artan konsentrasiya ilə ara məhsulun meydana gəlməsi ilə xarakterizə olunur:
ML 6 + Y, ¾® ML 5 Y + L
Qarşılıqlı mübadilə (I)
Əksər mübadilə reaksiyaları bu mexanizm vasitəsilə baş verir. Proses bir mərhələlidir və aralığın formalaşması ilə müşayiət olunmur. Keçid vəziyyətində reagent və ayrılan qrup reaksiya mərkəzi ilə əlaqələndirilir, onun ən yaxın koordinasiya sferasına daxil olur və reaksiya zamanı bir qrup digəri ilə əvəzlənir, iki liqandın mübadiləsi baş verir:
ML 6 + Y ML 5 Y + L.
Keçid vəziyyəti ya xarici sfera kompleksidir, ya da yüklü liqandlar vəziyyətində MX 5 L + Y - ion cütüdür.
Daxili mexanizm (a və ya d) molekulyar səviyyədə liqandların əvəzlənməsi prosesini xarakterizə edir. Bu, iki prosesdən hansının - keçid vəziyyətində bir əlaqənin formalaşması və ya qopmasının - məhdudlaşdırıcı olduğunu göstərir. Əgər reaksiya sürəti reaksiya mərkəzi ilə reagent arasında əlaqənin yaranması ilə müəyyən edilirsə, biz assosiativ aktivləşmədən danışırıq. Əks halda, məhdudlaşdırıcı amil reaksiya mərkəzi ilə ayrılan qrup arasındakı əlaqənin pozulması olduqda, proses dissosiativ aktivləşmə ilə davam edir. Stokiometrik mexanizmə müraciət etdikdə, dissosiativ prosesin həmişə dissosiativ aktivləşməyə uyğun gəldiyini və assosiativ prosesin həmişə assosiativ aktivləşməyə uyğun gəldiyini görmək asandır, yəni daxili mexanizm anlayışı yalnız bu halda informativ olur. qarşılıqlı mübadilə mexanizmi - həm dissosiativ (I d), həm də assosiativ (I a) aktivləşmə ilə baş verə bilər. Assosiativ aktivləşdirmə (Ia) ilə qarşılıqlı mübadilə mexanizmi vəziyyətində reaksiya sürəti Y-nin təbiətindən asılıdır. Keçid vəziyyətində metal atomu həm ayrılan qrupla, həm də hücum edən nukleofillə sıx bağlıdır. Buna misal olaraq dietilentriamin (dien) ilə platin kompleksində xlor atomunun brom və yod ilə əvəz edilməsi prosesini göstərmək olar:
Y - ¾¾® + + Cl -
Y = Br, I sürətləri çox dəyişir.
Dissosiativ aktivləşdirmə (I d) ilə qarşılıqlı mübadilə mexanizmi vəziyyətində reaksiya sürəti Y reagentinin xarakterindən asılı deyil. Keçid vəziyyətində olan hücum edən və çıxan qruplar mərkəzi ionla zəif bağlıdır. Bu mexanizm bir çox keçid metallarının, məsələn, nikelin su komplekslərində suyu aminlə əvəz etmək üçün istifadə olunur:
2+ + Y ¾¾® 2+ + H 2 O
Y = NH 3 , py sürətləri yaxındır.
Bir çox metalların komplekslərində əvəzetmə reaksiyalarının mexanizmlərinin öyrənilməsi yalnız ilkin mərhələdədir. Yalnız xrom (III) və kobaltın (III) platin və oktaedral komplekslərinin kvadrat-müstəvi kompleksləri üçün hərtərəfli məlumat əldə edilmişdir. Platin (II) komplekslərində əvəzetmənin assosiativ mexanizmə (A, Ia) uyğun olaraq triqonal bipiramida şəklində aralıq və ya keçid vəziyyəti ilə baş verdiyini qəti şəkildə müəyyən etmək olar. Oktaedral kobalt (III) kompleksləri dissosiativ reaksiya verir (D, I d mexanizmləri). Bu elementlərin kimyasını təsvir edərkən belə reaksiyaların konkret nümunələri nəzərə alınacaqdır.
Redoks reaksiyaları.Əksər redoks prosesləri fərdi elementar mərhələlərin mürəkkəb birləşməsidir, hər biri bir və ya daha az tez-tez iki elektronun ötürülməsini nəzərdə tutur. Məhlullarda daha çox sayda elektronun eyni vaxtda ötürülməsi mümkün deyil.
Tək elektron ötürülməsi iki mexanizmdən biri ilə baş verə bilər: xarici sfera, yəni tunel və ya daxili sfera, körpü ligand vasitəsilə. İntrasfera mexanizmi metallar arasında körpü rolunu oynaya bilən halidlər, hidroksid ionları və karboksil qrupları olan komplekslərdə həyata keçirilir. Məsələn, pentammin xlorokobalt (III) və heksaakvaxrom (II) ionları arasındakı reaksiya. Proses təxminən üç mərhələyə bölünə bilər: körpü xlorid ionu ilə heterometal kompleksin formalaşması, elektron ötürülməsi və körpü kompleksinin parçalanması. Yaranan 2+ ion, qeyri-labil olmaqla, dərhal su kompleksinə çevrilir və inert [(H 2 O) 5 CrCl] 2+ su ilə qarşılıqlı təsir göstərmir:

Sistemdə körpü rolunu oynaya biləcək hissəciklər yoxdursa, proses xarici sferada davam edir:
2+ + 3+ = 3+ + 2+ .
Xüsusilə 6-cı fəsildə müzakirə olunan oksidləşdirici əlavə və reduktiv eliminasiya reaksiyalarını vurğulamaq lazımdır.
Koordinasiya olunmuş liqandların reaksiyaları. Bu reaksiyalar qrupuna metal ionu ilə əlaqələndirilən liqandların modifikasiya prosesləri daxildir. Məsələn, sərbəst diketonlar kimi diketonat kompleksləri nitratlanmış, asilləşdirilmiş və ya halogenləşdirilmiş ola bilər. Koordinasiya olunmuş liqandların reaksiyalarının ən maraqlı və qeyri-adi nümunəsidir şablon sintezi– metal ionunda liqandın “yığılmasının” unikal üsulu. Mis (II) ionlarının iştirakı ilə baş verən ftal turşusundan nitrildən ftalosiyaninlərin sintezi və nikel (II) ionlarının iştirakı ilə baş verən 2-aminobenzaldehiddən makrosiklik Şiff əsasının sintezi misal ola bilər:

Metal olmadıqda, proses fərqli bir yolda davam edir və istənilən məhsul reaksiya qarışığında yalnız kiçik bir miqdarda mövcuddur. Metal ion şablon sintezində matris (“şablon”) kimi fəaliyyət göstərir, bir-biri ilə tarazlıqda olan məhsullardan birini sabitləşdirir və tarazlığı onun əmələ gəlməsinə doğru dəyişir. Məsələn, X + Y ¾® reaksiyasında A və B məhsullarının qarışığı əmələ gəlir, burada daha az enerjiyə malik olan B üstünlük təşkil edir. Metal ionunun iştirakı ilə M ilə kompleks şəklində reaksiya məhsullarında A maddəsi üstünlük təşkil edir (şək. 1.40. Metal ionu olmadıqda X və Y-nin qarşılıqlı təsirinin enerji diaqramı (solda) və onun mövcudluğu (b)).
Suallar və tapşırıqlar
1. Aşağıdakı birləşmələrdən hansı perovskit quruluşa malikdir? BaTiO 3, LiNbO 3, LaCrO 3, FeTiO 3, Na 2 WO 4, CuLa 2 O 4, La 2 MgRuO 6. İon radiuslarının cədvəli Əlavədə verilmişdir. Nəzərə alın ki, mürəkkəb oksid fazalarında B mövqelərində iki müxtəlif metalın kationları ola bilər.
2. TCP-dən istifadə edərək, aşağıdakı şpinellərin düz və ya tərs olacağını müəyyənləşdirin: ZnFe 2 O 4, CoFe 2 O 4, Co 3 O 4, Mn 3 O 4, CuRh 2 O 4.
3. Tiosiyanat ionu SCN - iki donor mərkəzi var - sərt və yumşaq. Kalsium və misin (I) tiosiyanat komplekslərinin hansı quruluşa sahib olacağını təxmin edin. Niyə mis (II) tiosiyanat əldə etmək mümkün deyil?
4. Cr 2+ aqua ionunun spektri (əsas vəziyyət termini 5 D) iki zolağa malikdir (şək. 1.41. Cr 2+ aqua ionunun spektri), baxmayaraq ki, ən yaxın həyəcanlı vəziyyətlərin şərtləri arasında bir belə diapazon yoxdur. eyni çoxluq. Bunu nə izah edir? Bu ion hansı rəngə malikdir?
5. Aşağıdakı Δο qiymətlərindən istifadə edərək, kJ/mol ilə aşağıdakı komplekslər üçün ESC-ni hesablayın:
(a) 2–, Δο = 15000 sm–1,
(b) 2+, Δο = 13000 sm–1,
(c) 2–, Δο (4– üçün)= 21000 sm–1,
19000 sm –1, 1 kJ/mol = 83 sm –1-ə bərabər olan cütləşmə enerjisini götürün. Onların maqnit momentlərini hesablayın (spin komponenti).
6. TCP-dən istifadə edərək, niyə CN – ionunun heksaakvanikel(III) ionu ilə heksasianoferrat(II), heksaakvanikel(II) ionu ilə isə tetrasiyanikelat(II) əmələ gətirmək üçün reaksiyaya girdiyini izah edin.
7. Aşağıda mis(II) su kompleksində suyun ammonyakla ardıcıl əvəzlənməsi üçün reaksiya sabitləri verilmişdir: K 1 = 2´10 4 , K 2 = 4´10 3 , K 3 = 1´10 3 , K 4 = 2´10 2 , K5 = 3´10 –1, K6<< 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. 3d cərgəsi boyunca hərəkət edərkən kationların sərtliyi necə dəyişir? Bu, komplekslərin sabitlik sabitlərinin dəyişmə sırasına uyğundurmu (İrvinq-Uilyams seriyası, şək. 1.34).
9. Hexaquatic dəmir (III) ionunun niyə rəngsiz, dəmir (III) duzlarının məhlullarının isə rəngli olduğunu izah edin.
10. Məhlula tiosiyanat ionunun daxil edilməsinin reaksiya sürətinin dəyişməsinə səbəb olduğu və sürətin praktiki olaraq reaksiya sürətindən asılı olmadığı məlumdursa, 3– + 3– = 4– + 2– reaksiyasının mexanizmini təklif edin. ammonyakın olması. Bu faktlar üçün izahat verin.
Keçid metal ionlarının onları əhatə edən yüklü hissəciklərin elektrik sahəsinin təsiri altında elektron strukturunun dəyişməsi konsepsiyası Bekkerel tərəfindən təklif edilmiş və H.A. Bethe və J. Van Vleck başlanğıcda XX V. Bu anlayışlar kompleks birləşmələrin elektron quruluşunun və xassələrinin təsvirinə yalnız ortada tətbiq edilmişdir XX əsr H.Hartman tərəfindən və model “kristal sahə nəzəriyyəsi” (CFT) adlanırdı.
Keçid kompleksləri üçün TCH-nin əsas müddəaları d metallar Şek. 24):
1. - Kompleks mürəkkəbləşdiricinin liqandlarla elektrostatik təsirinə görə mövcuddur və sabitdir.
2. - Liqandlar elektron strukturları nəzərə alınmadan nöqtə yükləri və ya dipollar kimi qəbul edilir.
3. - Liqandların elektrik sahəsinin təsiri altında valentlik beş qat degenerasiya olunur ( n -1) d orbitallar liqand mühitinin simmetriyasından asılı olaraq bölünür.
4. - Metal valent elektronlarının parçalanmalar arasında paylanması ( n -1) d orbitallar spin cütləşmə enerjisi ilə parçalanma enerjisinin nisbətindən asılıdır.
Məsələn, beş qat degenerasiyanın enerjisinin dəyişməsini nəzərdən keçirək ( n -1) d mərkəzi metal ionunun orbitalları M n+ , koordinatların mərkəzində, mənfi yüklü liqandların oktaedral sahəsinin təsiri altında yerləşir [ ML 6] z , koordinat oxlarında yerləşir (şək. 25). Mənfi yükün metal ətrafında vahid paylanması (sferik simmetrik elektrik sahəsi) ilə metalın valent elektronlarının mənfi yüklü liqandlardan itələnməsi nəticəsində bütün beşin enerjisi d orbitallar sərbəst M ilə müqayisədə E 0 miqdarında artacaq n+ ion. Çünki d orbitallar müxtəlif fəza oriyentasiyalarına malikdirlər, sonra koordinat oxlarında yerləşən liqandlarda mənfi yüklərin konsentrasiyası ilə onların enerjisinin artması fərqlənir. Enerji Gücləndirilməsi d z 2 və d x 2- y 2 koordinat oxlarında liqandlara doğru yönəlmiş orbitallar daha çox enerji artımına malikdir dxy, dxz və dyz koordinat oxları arasında istiqamətlənmiş orbitallar.
Parçalanma enerjisibeş qat degenerasiya ( n -1) orbitallar ikiqat degenerasiya olunur d x 2- y 2, z 2 orbitallar və üçqat degenerasiya d xy, xz, yz orbitallar adlanır (şək. 26) kristal sahəsinin parçalanması parametri. Parçalanmanın enerjisindən bəri d ligandların oktaedral sahəsində orbitalları sferik simmetrik elektrik sahəsi ilə müqayisədə dəyişmir, onda ikisinin enerjisinin artması d x 2- y 2, z 2 orbitallar 0,6-da baş verirD 0 və üç enerjinin azalması d xy , xz , yz orbitalları 0,4 D 0 .
Liqandların elektrik sahəsinin təsiri altında parçalanan metal orbitalların degenerasiya dərəcəsini və simmetriyasını göstərmək üçün xüsusi işarələrdən istifadə olunur. Simmetriya mərkəzinə və koordinat oxları ətrafında fırlanmaya görə üçqat degenerasiya və simmetrik d xy , xz , yz t 2 g ", eyni zamanda ikiqat degenerasiya və simmetriya mərkəzinə nisbətən simmetrikdir d x 2- y 2, z 2 orbitallar simvolu ilə təyin olunur " e g " Beləliklə, ligandların oktaedral elektrik sahəsinin təsiri altında beşqat degenerasiya ( n -1) d Kompleksləşdirici maddənin orbitalları müxtəlif enerjili üç və ikiqat degenerasiya olunmuş orbitallara bölünür. t 2 g və e g orbitalları.
Beş qat degenerasiyanın enerjisinin dəyişməsinə bənzər bir fikir ( n -1) d liqandların tetraedral mühitində sərbəst metal ionunun orbitalları [ ML 4 ]z kompleksləri göstərir (şək. 27) onların da ikiqat (e) və üçqat ( t ) degenerasiya orbitalları, lakin əks enerji mövqeyi ilə. alt yazı " g "e" və "təyin edildikdə t » tetraedral kompleksin simmetriya mərkəzi olmadığı üçün orbitallar göstərilmir. Oktaedral komplekslə müqayisədə tetrahedral kompleksin liqandlarının sayının azalması kristal sahənin parçalanma parametrinin təbii azalmasına səbəb olur:D T = 4/9 D HAQQINDA.
Metalın ligand mühitinin simmetriyasının azaldılması, məsələn, oktaedralın tetraqonal təhrifi [ ML 6] z metal-liqand bağlarının eksenel liqandlarla uzadılması ilə əlaqəli komplekslər [ ML 4 X 2 ] z və müstəvi kvadratın məhdudlaşdırıcı halda formalaşması [ ML 4 ]z komplekslər, valentliyin əlavə parçalanmasına gətirib çıxarır (Şəkil 28) n -1) d metal orbitallar.
Bölmənin doldurulması ( n -1) d metal orbitallar Pauli prinsiplərinə və minimum enerjiyə uyğun olaraq baş verir. ilə oktaedral komplekslər üçün d 1 , d 2 və d 3 metalın elektron konfiqurasiyası, Hund qaydasına uyğun olaraq valentlik elektronları doldurur t 2 g aparan paralel spinli orbitallar t 2 g 1, t 2 g 2 və t 2 g 3 komplekslərin elektron quruluşu.
d 4 olan metallar üçün elektron konfiqurasiya, üç elektron da doldurulur t 2 g paralel spinli orbitallar. Dördüncü elektronun populyasiyası populyasiya zamanı spin cütləşmə enerjisinin (E sp.-sp.) dəyəri üçün enerji xərclərindən asılıdır. t 2 g antiparalel spinli və Hund qaydasını pozan və ya kristal sahəsi ilə parçalanma enerjisini aşan orbitallarD o qeydiyyat zamanı məsələn Hund qaydasına uyğun olaraq paralel fırlanan orbitallar. Birinci halda, ilə bir kompleks əmələ gəlir t 2 g 4 elektron quruluş və sərbəst metalla müqayisədə azaldılmış fırlanma çoxluğu 2 S +1 = 3 (S - ümumi spin), çağırılır aşağı fırlanma. Hund qaydası yerinə yetirildikdə və dördüncü elektron yerləşdikdə e g orbitallarla kompleks əmələ gəlir t 2 g 3 e g 1 elektron quruluş və sərbəst metal kimi fırlanma multiplet 2 S +1 = 5. Belə komplekslər adlanır yüksək fırlanma.
Eynilə, valentlik paylanarkən d5, d6 və d7 metal elektronlar t 2 g və e g E sp.-sp nisbətindən asılı olaraq oktadr komplekslərinin orbitalları. VəD O İki növ kompleksin meydana gəlməsi mümkündür:
E sp.-sp. > D O metalın elektron quruluşuna malik yüksək spinli komplekslər əmələ gəlir t 2 g 3 e g 2 , t 2 g 4 e g 2 , t 2 g 5 e g 2 Hund qaydasına və sərbəst metal kimi spin çoxluğuna görə - 2 S +1 = 6, 5, 4;
E sp.-sp.< D O metalın elektron strukturu ilə aşağı spinli komplekslər əmələ gəlir t 2 g 5 e g 0 , t 2 g 6 e g 0 , t 2 g 6 e g 1 və sərbəst metal 2 ilə müqayisədə daha aşağı fırlanma çoxluğu S +1 = 2, 1, 2.
ilə metal kompleksləri d 8, d 9 və d 10 elektron konfiqurasiya bir növ elektron paylanması ilə xarakterizə olunur - t 2 g 6 e g 2 , t 2 g 6 e g 3 , t 2 g 6 e g 4 sərbəst metala bənzər fırlanma çoxluğu ilə: 2 S +1 = 3, 2 və 0.
Beləliklə, parametrD, parçalanmasını xarakterizə edən ( n -1) d liqandların elektrik sahəsinin təsiri altında metal orbitalların sərbəst metal ionu ilə müqayisədə komplekslərin xassələrinin dəyişməsinin əsas xüsusiyyətlərindən biridir. Parametr dəyəridirDmetalın bir sıra elektron konfiqurasiyaları üçün split orbitallar üzərində elektronların müxtəlif paylanması və müxtəlif xassələri olan yüksək və ya aşağı spinli komplekslərin əmələ gəlməsinin mümkünlüyünü müəyyən edir.
Kristal sahəsinin parçalanması parametrinin dəyəriDKompleksləşdiricinin metalının təbiətindən, onu əhatə edən liqandlardan və kompleks əmələ gətirən maddənin ətrafındakı fəza mövqeyindən asılıdır:
1. Artan parametrə görə liqandlarDeyni metal və oxşar həndəsi strukturun kompleksləri üçün sözdə spektrokimyəvi sıralarda yerləşir: mən -< Br - < Cl - < F - < OH - < C 2 O 4 2- ~ H 2 O < NCS - < NH 3 ~ En < NO 2 - < CN - < CO . Sıranın əvvəlində "zəif sahə" liqandları var - halid ionları, hidroksid və oksalat ionları, əsasən yüksək spinli komplekslər meydana gətirən su. Seriyanın sağ tərəfindəki liqandlar: karbon monoksit, siyanid və nitrit ionları “yüksək sahə” liqandları adlanır və adətən aşağı spinli komplekslərin əmələ gəlməsi ilə xarakterizə olunur. Seriyanın ortasındakı liqandlar üçün - tiosiyanat ionu, ammonyak, etilendiamin, metalın təbiətindən asılı olaraq, yüksək və ya aşağı spinli komplekslər əmələ gəlir.
2. Liqandların elektrik sahəsinin səmərəliliyinin artırılması d 3-cü cərgədə ölçülərini artıraraq metal orbitallar d<< 4 d < 5 d , eləcə də metalın oksidləşmə dərəcəsinin artması parametrin artmasına səbəb olurD seriyada: Mn(II)< Ni (II ) < Co (II ) < Fe (II ) < V (II ) < Fe (III ) < Co (III ) < Mn (IV ) < Mo (III ) < Rh (III ) < Ru (III ) < Pd (IV ) < Ir (III ) < Pt (IV ).
3. Parametr Dtetraedral komplekslər üçün parametrin yalnız 4/9 hissəsidirDoktaedral komplekslər.
“Ağır” komplekslər 4 d və 5 d metallar, demək olar ki, ligandların təbiətindən asılı olmayaraq, əsasən aşağı spinli komplekslər əmələ gətirir, aşağı və ya yüksək spinli komplekslərin əmələ gəlməsi isə "yüngül" 3 d metallar əsasən liqand sahəsinin gücü ilə müəyyən edilir.
MMS-dən fərqli olaraq, kristal sahə nəzəriyyəsi müxtəlif ligand mühitləri ilə eyni metal ionunun komplekslərinin maqnit xassələrindəki fərqi əsaslandırmaq üçün, məsələn, diamaqnit [ Fe(CN ) 6 ] 4- və paramaqnit [ Fe(H2O ) 6 ] 2+ onların intraorbital hipotezindən istifadə etmir ( d 2 sp 3 hibridləşmə) və xarici orbital ( sp 3 d 2 hibridləşmə) quruluşu. Maqnit xassələrindəki fərq 6 valentli elektronların paylanmasının aşağı və yüksək spinli təbiəti ilə müəyyən edilir. Fe(II ) bölünməklə t 2 g və e g orbitallar (şək. 29). Güclü və zəif sahə liqandları olan sianid ionları və su molekulları əmələ gəlir Fe(II ) ilə aşağı və yüksək spinli komplekslər t 2 g 6 e g 0 və t 2 g 4 e g 2 diamaqnetizmi təyin edən elektronların paylanması [ Fe(CN ) 6 ] 4- və paramaqnetizm [ Fe(H2O ) 6 ] 2+ kompleksləri.
Beşqat degenerasiyanın bölünməsi ( n -1) d komplekslərdə metal orbitallar və parametrlərin dəyişməsiDliqandların xarakterindən asılı olaraq həm bərk halda, həm də məhlullarda komplekslərin xarakterik rəngini müəyyən edir. Kompleks spektrin (400-750) nm görünən bölgəsində elektromaqnit şüalanmasını udduqda, kvantının enerjisi E olan dəyərinə bərabərdir D, elektron köçürmə -dən baş verir t 2 g, e g orbitallar. Məhz spektrin görünən bölgəsinin udulmamış elektromaqnit şüalanmasıdır ki, görünən şüalanmanın əsas və ikinci dərəcəli rənglərini göstərən “Nyutonun rəng dairəsi”nə (şəkil 30) uyğun olaraq kompleksin rəngini müəyyən edir.
Aquacomplex titan ( III) [Ti (H 2 O) 6] 3+ c t 2 g 1 e g 0 elektronun daha yüksək enerjiyə keçidinə uyğun gələn foto həyəcanlanma nəticəsində elektron paylama məsələn, orbitallar:
3+ (t 2g 1 e g 0) + hn= * 3+ (t 2g 0 e g 1)
spektrin sarı bölgəsində işıq kvantlarını udur, bu da onun bənövşəyi rənginə səbəb olur. Spektrokimyəvi sıradakı liqandın vəziyyətinə uyğun olaraq metal ionunun liqand mühitinin dəyişməsi parametrin dəyişməsinə səbəb olur.Dvə bunun nəticəsi olaraq, kompleks tərəfindən udulmuş kvantların enerjisi və dalğa uzunluğunun dəyişməsinə və kompleksin xarakterik rənginə - məsələn, silsilədə [ CuCl 4 ] 2- , [ Cu (H 2 O ) 4 ] 2+ , [ Cu (NH 3) ) 4 ] 2+ komplekslərin rəngi yaşıldan göyə və bənövşəyə dəyişir.
Kristal sahəsində parçalanma enerjisi ilə yanaşıD, TCH-də də mühüm rol oynayır kristal sahəsində sabitləşmə enerjisi(ESKP) - elektronları kompleksdə parçalananlar arasında paylayarkən enerji qazanması ( n -1) d beş qat degenerasiya enerjisi ilə müqayisədə metal orbitallar ( n -1) d ekvivalent sferik elektrik sahəsində metal orbitallar (şək. 31, 32).
Oktadral və tetraedral komplekslərin ESCP.|
Mn+ |
Oktaedral komplekslər |
Tetraedral komplekslər |
|
|
Aşağı spin |
Yüksək spin |
Yüksək spin |
|
|
0.4 D o |
0.6 D T |
||
|
0.8 D o |
1.2 D T |
||
|
1.2 D o |
0.8 D T |
||
|
d 4 |
1.6 D o |
0.6 D o |
0.4 D T |
|
d 5 |
2.0 D o |
0 D o |
0 D T |
|
d 6 |
2.4 D o |
0.4 D o |
0.6 D T |
|
d 7 |
1.8 D o |
0.8 D o |
1.2 D T |
|
d 8 |
1.2 D o |
0.8 D T |
|
|
d 9 |
0.6 D o |
0.4 D T |
|
|
d 10 |
0 D o |
||
Kompleksin EXP dəyərinin təxmini bölmə diaqramları əsasında əldə edilir ( n -1) d elektronlar parçalandıqda sferik elektrik sahəsi ilə müqayisədə sistemin enerjisində azalma və ya artım göstərən liqandların elektrik sahəsindəki metal orbitallar ( n -1) d orbitallar. Oktaedral üçün [ ML 6] z kompleksləri (Şəkil. 32) hər bir elektron əhali t 2 g orbitallar sistem enerjisinin 0,4 artmasına səbəb olurD oh, qeydiyyat məsələn enerji xərcləri tələb edir 0,6D O . tetraedral üçün [ ML 4 ]z əks enerji mövqeləri olan komplekslər e və t metal orbitalları - hər bir elektronun parçalanma ilə işğalı e və t orbitallar sistemin enerjisinin 0,6 azalması və artması ilə müşayiət olunurD t və 0,4 D T .
Komplekslərin termodinamik sabitliyinin əksi olaraq, onların ESCR dəyərlərinin təxminləri yüksək spinli heksaflorid kompleksləri üçün kristal şəbəkənin enerjisindəki dəyişikliklərə dair eksperimental məlumatlara uyğundur 3 d metallar (şək. 33).
ESC dəyərləri bizə ən çox seçilən koordinasiya izomerini təyin etməyə imkan verir (Şəkil 34), məsələn [ Cu (NH 3 ) 6 ][ NiCl 4 ] və ya [ Ni (NH 3 ) 6 ][ CuCl 4 ]. Bunun üçün izomerlərin kompleks kation və anionu üçün ESC fərqini hesablayın. ESCR dəyəri [ Cu (NH 3 ) 6 ] 2+ və [NiCl 4 ] 2- 0,6-dır D o və 0,8 D T müvafiq olaraq. Bunu nəzərə alaraqD t = 4/9 D o , ESCP dəyərləri arasındakı fərq [ Cu (NH 3 ) 6 ] 2+ və [NiCl 4 ] 2- 19/45 olacaqD o . Eynilə, ESKP dəyərləri [ Ni (NH 3 ) 6 ] 2+ və [CuCl 4 ] 2- 1,2-dir D o və 0,4 D T , və aralarındakı fərq 28/45-dirD o . Böyük fərq ESCP kompleks kation [ Ni (NH 3 ) 6 ] 2+ və anion [CuCl 4 ] 2- [ ilə müqayisədə Cu (NH 3 ) 6 ] 2+ və [NiCl 4 ] 2- tərkibinin izomerinin daha üstünlük təşkil edən formalaşmasını göstərir [ Ni (NH 3 ) 6 ][ CuCl 4 ].
Metalın elektron strukturunun komplekslərin termodinamik sabitliyinə təsirinin maqnit və optik xüsusiyyətləri ilə yanaşı, TKP elektronların bölünmə üzərində qeyri-bərabər paylanması ilə komplekslərin həndəsi strukturunun təhrifini proqnozlaşdırır ( n -1) d metal orbitallar (şək. 35). Normal oktaedral quruluşdan fərqli olaraq [ Co (CN) 6 ] 3- s t 2 g 6 e g 0 elektron paylama, oxşar kompleksin tetraqonal təhrifi [ Cu (CN) 6 ] 4- s t 2 g 6 e g 3 2 qat degenerasiyada 3 elektrondan ibarət elektron paylama e g orbitallar, oktaedralın kvadrat-planar kompleksə effektiv çevrilməsinə səbəb olur:
4- = 2- + 2CN - .
Yuxarıda göstərilənlərin hamısı göstərir ki, TCT-nin komplekslərin fiziki-kimyəvi xassələrini izah etmək və proqnozlaşdırmaq üçün nisbi sadəliyi və geniş imkanları kompleks birləşmələrdə kimyəvi bağları təsvir etmək üçün bu modelin böyük populyarlığını müəyyənləşdirir. Eyni zamanda, mürəkkəb əmələ gəlmə zamanı metalın elektron strukturunda dəyişikliklərə diqqət yetirərək, TCP liqandların elektron strukturunu nəzərə almır, onları nöqtə mənfi yüklər və ya dipollar kimi hesab edir. Bu, komplekslərin elektron strukturunu təsvir edərkən TCP-nin bir sıra məhdudiyyətlərinə gətirib çıxarır. Məsələn, TCP çərçivəsində bir sıra liqandların və metalların spektrokimyəvi sıradakı vəziyyətini izah etmək çətindir ki, bu da müəyyən dərəcədə kovalentlik və çoxsaylı metal-liqand bağlarının əmələ gəlməsi ehtimalı ilə bağlıdır. Molekulyar orbitalların daha mürəkkəb və daha az vizual metodundan istifadə edərək kompleks birləşmələrin elektron strukturunu nəzərdən keçirərkən bu məhdudiyyətlər aradan qaldırılır.
Valentlik əlaqə nəzəriyyəsi kompleks birləşmələrdə kimyəvi bağların təbiətini təqribən izah etmək üçün istifadə edilən kvant mexaniki nəzəriyyələrindən birincisi idi. Onun tətbiqi ideyasına əsaslanırdı donor-akseptor mexanizmi liqand və kompleksləşdirici agent arasında kovalent bağların əmələ gəlməsi. liqand sayır donor hissəcik, bir cüt elektron ötürməyə qadirdir qəbul edən – kompleksləşdirici agent bağların formalaşması üçün enerji səviyyələrinin sərbəst kvant hüceyrələrini (atom orbitallarını) təmin edən.
Kompleksləşdirici maddə ilə liqandlar arasında kovalent bağların əmələ gəlməsi üçün boş s-, səh- və ya d-kompleksləşdirici maddənin atom orbitalları keçdi hibridləşmə müəyyən bir növ. Hibrid orbitallar kosmosda müəyyən bir mövqe tutur və onların sayı uyğun gəlir koordinasiya nömrəsi kompleksləşdirici agent.
Bu tez-tez olur qoşalaşmamış elektronları birləşdirir kompleksləşdirici agent cütlərə bölünür, bu da müəyyən sayda kvant hüceyrələrinin - atom orbitallarının sərbəst buraxılmasına imkan verir, sonra hibridləşmədə və kimyəvi bağların formalaşmasında iştirak edir.
Liqandların tək elektron cütləri kompleksləşdiricinin hibrid orbitalları ilə qarşılıqlı əlaqədə olur və üst-üstə düşmək nüvələrarası məkanda artan elektron sıxlığının görünüşü ilə kompleksləşdirici agentin və ligandın müvafiq orbitalları. Kompleksləşdiricinin elektron cütləri, öz növbəsində, liqandın boş atom orbitalları ilə qarşılıqlı təsir göstərir, dativ mexanizm vasitəsilə əlaqənin gücləndirilməsi. Beləliklə, kompleks birləşmələrdə kimyəvi birləşmə adi haldır kovalent kifayət qədər əlaqə davamlı Və enerji baxımından əlverişlidir.
Kompleksləşdirici agentin hibrid orbitallarında yerləşən elektron cütləri kosmosda onların qarşılıqlı itələnməsinin minimal olduğu bir mövqe tutmağa meyllidirlər. Bu gətirib çıxarır strukturu mürəkkəb ionlar və molekullardan müəyyən bir asılılıq içində olduğu görünür hibridləşmə növü.
Bəzi komplekslərin əmələ gəlməsini valentlik bağları nəzəriyyəsi nöqteyi-nəzərindən nəzərdən keçirək. Hər şeydən əvvəl qeyd edirik ki, kompleksləşdiricilərin atomlarının valent orbitalları enerji baxımından yaxındır:
E (n- 1)d » E ns » E n.p. » E nd
|
Hibridləşmə növü |
Kompleksin həndəsəsi |
||
|
xətti |
-
|
||
|
üçbucaqlı |
- |
||
|
tetraedr |
2-
|
||
|
2-
|
|||
|
sp 3 d(z 2) |
triqonal bipiramida |
||
|
sp 3 d(x 2 - y 2) |
kvadrat piramida |
3-
|
|
|
sp 3 d 2 , |
3+ |
||
|
sp 3 d 3 |
beşbucaqlı bipiramida |
4-
|
Məsələn, 2+ kationa kompleksləşdirici sink (II) daxildir. Bu şərti ionun elektron qabığı 3 formuluna malikdir d 10 4s 0 4səh 0 və şərti olaraq aşağıdakı kimi təsvir edilə bilər:
Boş 4 s- və 4 səh-sink(II) atomunun orbitalları dörd təşkil edir sp Tetraedrin təpələrinə doğru yönəlmiş 3-hibrid orbitallar.
Hər bir ammonyak molekulunun azot atomunda tək elektron cütü var. Tərkibində tək elektron cütləri olan azot atomlarının orbitalları üst-üstə düşür sp Sinkin (II) 3-hibrid orbitalları, tetraammin sinkin (II) 2+ tetraedral kompleks katyonunu təşkil edir:
2+ ionunun qoşalaşmamış elektronları olmadığı üçün nümayiş etdirir diamaqnit xassələri.
Tetraxloromanganat (II) ion 2- hər 3-də beş qoşalaşmamış elektron ehtiva edir d-orbitallar və boş 4 s- və 4 səh-orbitallar. Boş orbitallar əmələ gəlir spüst-üstə düşən 3-hibrid orbitallar səh-xlorid ionlarının atom orbitalları: 
Beləliklə alınan tetraedral ion 2-dir paramaqnit, çünki beş qoşalaşmamış elektron ehtiva edir.
Ənənəvi proqnoz alqoritmindən istifadə atom orbitallarının hibridləşməsinin növü valentlik bağı metodu çərçivəsində müəyyən etmək olar komplekslərin həndəsəsi müxtəlif tərkibli. Bunun üçün ilk növbədə valentlik səviyyəsinin elektron formulunu yazmaq və elektronların kvant hüceyrələri üzərində paylanması diaqramını qurmaq lazımdır. Məsələn, neytral nikel atomu üçün:

Keçid 4 s-3 üçün elektronlar d-alt səviyyəli çevrilmələr paramaqnit Ni atom 0 düym diamaqnit hissəcik Ni*: 
Yaranan boş orbitallar hibridləşməyə məruz qalır və tetraedral konfiqurasiya yaradır. Belə tikilib tetraedral diamaqnitəhəmiyyətli sabitlik ilə xarakterizə olan tetrakarbonilnikel kompleksi (CN = 4).
Kompleksləşdirici maddə elektron konfiqurasiyalı nikel(II) olarsa 3 d 8 4s 0 4səh 0, sonra elektronları 4-dən köçürmək lazımdır s-hibridləşmə yoxa çıxmazdan əvvəl alt səviyyə, çünki 4 nömrəli koordinasiyanı həyata keçirmək üçün kifayət qədər boş orbital var: 
Bu struktur qeyri-sabitdir paramaqnit tetrabromonikolat(II)-ion 2- kompleksi. Ancaq iki elektron birləşdirildikdə 3 d-alt səviyyənin cütə çevrilməsi və bu alt səviyyənin kvant hüceyrələrindən birinin boş hüceyrəyə çevrilməsi həm hibridləşmənin növünü, həm də yaranan kompleksin xüsusiyyətlərini dəyişir: 
Hibridləşmə növü dsp 2 və tövlənin əmələ gəlməsi ilə kompleksin müstəvi kvadrat forması həyata keçirilir diamaqnit kompleks tetrasiyanikolat(II)-ion 2- (CN = 4): 
Sianid kompleksinin sintezi artıq ligand şəraitində aparılarsa, 5 koordinasiya nömrəsi həyata keçirilə bilər: 
Stabil diamaqnit pentacyanoniccolate(II)-ion 3- kompleksi kvadrat piramida formasına malikdir: 
Oktahedral nikel(II) 2+ kompleksi olsa da paramaqnit, lakin olduqca sabitdir. Onun təhsili var sp 3 d 2 -nikel atom orbitallarının hibridləşməsi: 
Əgər xarici atom orbitalları d-alt səviyyəli, mürəkkəb, bir qayda olaraq, xeyli dərəcədə paramaqnit və çağırılır xarici orbital və ya yüksək fırlanma. Belə komplekslərin quruluşu hibridləşmə növünə uyğun ola bilər, məsələn, sp 3 d 2 .
Belə komplekslər, onların əmələ gəlməsi zamanı xarici atom orbitallarının iştirakı ilə hibridləşmə baş verir. d-alt səviyyələr deyilir intraorbital və ya aşağı fırlanma və bir qayda olaraq diamaqnit və ya zəif paramaqnit(kompleksləşdiricinin bütün və ya demək olar ki, bütün elektronları qoşalaşır və hibridləşmə növü, məs. d 2 sp 3 və ya dsp 2).
Dəmir (II) komplekslərini tədqiq edərkən həm xarici orbital, həm də intraorbital komplekslər aşkar edilir.


Aşağıdakı diaqram onların necə formalaşdığını göstərir paramaqnit yüksək fırlanma heksafluoroferrat(II)-ion 4- və diamaqnit aşağı fırlanma heksasiyanoferrat (II) ion 4-.
Valentlik bağları nəzəriyyəsinin özü hər bir konkret halda hansı tip kompleksin əmələ gəlməsi sualına cavab vermir, çünki bu üsul liqandın təbiətinin təsirini nəzərə almır. Buna görə də, valentlik bağı metodu mütləq kompleksin maqnit xassələri haqqında məlumatlar və ya liqandın əmələ gələn kompleksin təbiətinə təsiri haqqında məlumatlarla tamamlanmalıdır.
.Kristal sahə nəzəriyyəsi 20-ci əsrin 40-cı illərində valentlik bağları nəzəriyyəsini əvəz etdi. Təmiz formada, hazırda istifadə edilmir, çünki o, kompleks birləşmələrdə kovalent bağların əmələ gəlməsini izah edə bilmir və ligandların həqiqi vəziyyətini (məsələn, onların faktiki ölçülərini) nəzərə almır, hətta qarşılıqlı təsirlər yaxın olduqda belə. sırf elektrostatik.
Artıq 50-ci illərin ortalarında sadələşdirilmiş kristal sahə nəzəriyyəsi təkmilləşdirilmiş nəzəriyyə ilə əvəz edilmişdir. liqand sahəsi nəzəriyyəsi, kompleksləşdirici maddə ilə liqand arasındakı kimyəvi bağların kovalent xarakterini nəzərə alaraq.
Bununla belə, kompleks birləşmələrin əmələ gəlməsini izah etmək üçün ən ümumi yanaşma verilir molekulyar orbital nəzəriyyə(MO), hazırda bütün digərlərindən üstündür. Molekulyar orbital metod üst-üstə düşən atom orbitalları olmadıqda həm sırf elektrostatik qarşılıqlı əlaqəni, həm də üst-üstə düşmənin aralıq dərəcələrinin bütün dəstini təmin edir.
Əsas anlayışlara nəzər salaq kristal sahə nəzəriyyəsi, valentlik bağları nəzəriyyəsi kimi, böyük sadəliyi və aydınlığı ilə mürəkkəb birləşmələrdə kimyəvi bağların keyfiyyətcə təsviri üçün əhəmiyyətini hələ də qoruyub saxlayır.
Kristal sahə nəzəriyyəsində kompleksləşdirici maddə ilə liqand arasındakı kimyəvi əlaqə nəzərdən keçirilir elektrostatik. Bu nəzəriyyəyə görə, liqandlar müntəzəm çoxüzlülərin təpələrində kompleksləşdirici maddənin ətrafında yerləşir ( çoxüzlü) kimi nöqtə ödənişləri. Nəzəriyyə liqandın faktiki həcmini nəzərə almır.
Liqandlar, nöqtə yükləri kimi, kompleksləşdirici agentin ətrafında yaradırlar elektrostatik sahə("kristal sahəsi", mürəkkəb birləşmənin kristalını nəzərə alsaq, və ya liqand sahəsi), burada kompleksləşdirici agentin enerji səviyyələri və hər şeydən əvvəl, d- alt səviyyələr parçalanırlar və onların enerjisi dəyişir. Parçalanmanın təbiəti, yeni enerji səviyyələrinin enerjisindən asılıdır simmetriya liqandların düzülüşü (oktaedral, tetraedral və ya digər kristal sahə). H 2 O, NH 3, CO və digər molekullar liqandlar kimi əlaqələndirildikdə, onlar dipollar, kompleksləşdirici agentə qarşı mənfi yüklə istiqamətlənmişdir.
Liqandların oktaedral düzülüşünə (məsələn, 3- və ya 3+) baxaq. Oktaedrin mərkəzində elektronları olan kompleksləşən M(+n) atomu var d-atomik orbitallar və onun təpələrində nöqtə mənfi yüklər şəklində liqandlar var (məsələn, F - ionları və ya NH 3 kimi qütb molekulları). Liqandlarla əlaqəli olmayan şərti M(+n) ionunda bütün beşin enerjiləri d-AO eynidir (yəni atom orbitalları degenerasiya etmək).
Lakin liqandların oktaedral sahəsində d-Kompleksləşdirici agentin AO-larına düşür qeyri-bərabər mövqe. Atom orbitalları d(z 2) və d(x 2 -
y 2), koordinat oxları boyunca uzanır, liqandlara ən yaxın gəlir. Bu orbitallarla oktaedrin təpələrində yerləşən liqandlar arasında əhəmiyyətli fərqlər yaranır. itələyici qüvvələr, orbital enerjinin artmasına səbəb olur. Başqa sözlə, bu atom orbitalları tabedir liqand sahəsinə maksimum məruz qalma. Güclü sıxılmış yay bu cür qarşılıqlı əlaqənin fiziki modeli kimi xidmət edə bilər. 

Digər üç d-AO - d(xy), d(xz) Və d(yz), koordinat oxları arasında və liqandlar arasında yerləşir, onlardan daha çox məsafədədir. Belələrinin qarşılıqlı təsiri d-Liqandlarla AO minimaldır və buna görə də enerjidir d(xy), d(xz) Və d(yz)-AO orijinalla müqayisədə azalır. 

Beləliklə, beş qat degenerasiya d-AO kompleksləşdirici agent, daxil olur oktaedral liqand sahəsi, məruz parçalanma yeni orbitalların iki qrupuna - orbitalların üçqat degenerasiyası aşağı enerji ilə, d(xy), d(xz) Və d(yz), Və orbitalların ikiqat degenerasiyası daha yüksək enerji ilə d(z 2) və d(x 2 -
y 2). Bu yeni qruplar d- ilə orbitallar aşağı Və daha yüksək enerji işarələmək d e və d g: 
Enerji fərqi iki yeni alt səviyyə d e və d g adını aldı bölmə parametri D0:
E 2 – E 1 = D0
İki yeni yer enerji alt səviyyələri d e və d g orijinala nisbətən ( d-AO) enerji diaqramında asimmetrik:
(E 2 – E 0) > (E 0 – E 1).
Kvant mexaniki nəzəriyyəsi bunu tələb edir yeni enerji səviyyələri tamamilə elektronlarla doldurulduqda, ümumi enerji dəyişməz olaraq qalır, yəni. qalmalıdır bərabərdir E 0 .
Başqa sözlə, bərabərlik təmin edilməlidir
4(E 2 – E 0) = 6(E 0 – E 1),
burada 4 və 6 - maksimum başına elektronların sayı d g - və d e -AO. Bu bərabərlikdən belə nəticə çıxır
(E 2 – E 0) / (E 0 – E 1) = 3/2 və
(E 2 – E 1) / (E 0 – E 1 >) = 5/2 və ya
D0/( E 0 – E 1) = 5/2, buradan ( E 0 – E 1) = 2/5 ´ D 0 >. Mümkün olan maksimum altı elektrondan hər bir elektronun yerləşdirilməsi d e-orbitalların səbəbləri azalma (uduşlar) enerji 2/5 D 0 ilə. Əksinə, dördündən hər bir elektronun yerləşdirilməsi mümkündür d g orbitalları səbəb olur artırmaq (dəyəri) enerji 3/5 D 0 ilə. Elektronlarla doludursa d e - və d g -orbitallar tamamilə, onda yox qalib enerji olmayacaq(elə bilməyəcəyi kimi əlavə enerji istehlakı): 4 ´ 3/5 ´ D 0 - 6 ´ 2/5 ´ D 0 = 0. Amma orijinal olsa d-AO yalnız məskunlaşmışdır qismən və 1-dən 6-a qədər elektron ehtiva edir və bu elektronlar yalnız yerləşdirilir d e -AO, onda alırıq əhəmiyyətli enerji qazancı. Hər bir liqandın spesifikliyi bu liqandın yaratdığı sahəyə təsir göstərir - güclü və ya zəif. Necə daha güclü sahə dan liqandlar daha çox məna bölmə parametri D0. Parçalanma parametrinin öyrənilməsi adətən əsaslanır spektroskopik tədqiqat. Dalğa uzunluqları udma zolaqları kompleksləri l kristal vəziyyətində və ya məhlulda elektronların keçidi ilə əlaqədardır d e - açıq d ilə əlaqəli g-AO bölmə parametri D 0 aşağıdakı kimi: n = 1/l; D Plank sabiti haradadır h 6,626 ´ 10 - 34 J. s-ə bərabər; Bölmə parametri, ligand növündən əlavə, asılıdır oksidləşmə dərəcəsinə görə Və təbiət kompleksləşdirici agent. At nüvə yükünün artması kompleks əmələ gətirən atomun D 0 da artır. Hexaamminiridium(III) 3+, hexaamminiridium(III) 3+ və hexaamminiridium(III) 3+ kationları ( Z= 27, 45 və 77) 22900, 34100 və 41000 sm -1-ə bərabər parçalanma parametrləri ilə xarakterizə olunur. D0-nın liqandların təbiətindən asılılığı daha müxtəlifdir. Çoxsaylı kompleks birləşmələrin tədqiqi nəticəsində məlum olmuşdur ki, onların adi oksidləşmə vəziyyətlərində yerləşən kompleksləşən metalların parçalanma parametrlərini artırmaq qabiliyyətinə görə, ən çox yayılmış liqandları aşağıdakı kimi təşkil etmək olar. spektrokimyəvi seriyalar, bunun boyunca D 0 dəyəri monoton şəkildə artır: Beləliklə, kompleksləşdirici maddə ətrafında ən güclü elektrostatik sahə və ən güclü parçalanma d-AO NO 2 - liqandlar tərəfindən törədilir, CN -
və CO. Elektronların üzərində paylanmasını nəzərdən keçirək d e - və d liqandların oktaedral sahəsində g-orbitalları. Kontrol d e - və d g-orbitallara tam uyğun olaraq baş verir Hund qaydası Və Pauli prinsipi. Bu halda, parçalanma parametrinin dəyərindən asılı olmayaraq, ilk üç elektron kvant hüceyrələri tərəfindən tutulur. d e-alt səviyyə: Əgər başına elektronların sayı d- kompleksləşdirici agentin üçdən çox alt səviyyəsi var; onları bölünmüş alt səviyyələrə yerləşdirmək üçün iki imkan var. Parçalanma parametrinin aşağı qiymətində (liqandların zəif sahəsi) elektronlar enerji maneəsini aşırlar. d e - və d g-orbitallar; dördüncü və sonra beşinci elektronlar kvant hüceyrələrini doldurur d g-alt səviyyə. Güclü liqand sahəsi və yüksək D0 dəyəri ilə populyasiya dördüncü və beşinci elektronlarla məskunlaşır. d g-alt səviyyə istisnadır; doldurulması davam edir d e-orbitallar. At zəif sahə liqandları kvant hüceyrələrini 4 və ya 5 elektronla doldurmaq paralel spinlər, beləliklə, ortaya çıxan kompleks güclü olur paramaqnit. Güclü ligand sahəsindəüzərində bir və sonra iki elektron cütü əmələ gəlir d e -alt səviyyə, belə ki paramaqnetizm kompleksin daha zəif olduğu ortaya çıxır. Zəif sahə vəziyyətində altıncı, yeddinci və səkkizinci elektronlar geri qayıdırlar d e -alt səviyyə, konfiqurasiyaları elektron cütlərinə tamamlayır (bir halda d 6, iki - d 7 və üç - d 8): Güclü liqand sahəsi vəziyyətində altıncı elektron məskunlaşır d e -AO, aparan diamaqnetizm kompleks, bundan sonra yeddinci və səkkizinci elektronlar gedir d g-alt səviyyə: Aydındır ki, səkkiz elektron konfiqurasiya ilə struktur fərqləri liqandlarla komplekslər arasında zəif Və güclü sahələr yox olur. Doqquzuncu və onuncu elektron tərəfindən orbitalların işğalı hər iki növ komplekslər üçün də fərqlənmir: 3+ və 3- oktaedral kompleks ionlarının elektron quruluşunun nəzərdən keçirilməsinə qayıdaq. Yerləşdiyi yerə görə spektrokimyəvi seriyalar, ammonyak NH 3 liqandlardan biridir güclü sahə
, və ftorid ionu F - – zəif sahə
. Nəticədə, bu komplekslərdə atom orbitallarının elektronlar tərəfindən tutulması aşağıdakı sxemə uyğun olaraq baş verəcəkdir: 3-anionda F - liqandları zəif kristal sahəsi (D 0 = 13000 sm - 1) yaradır və orijinal 3-ün bütün elektronları. d 6 -SC-də yerləşir d e - və d g orbitalları heç bir qoşalaşmadan. Kompleks iondur yüksək fırlanma və dörd qoşalaşmamış elektron ehtiva edir, buna görə də paramaqnit. 3+ ionunda NH 3 liqandları güclü kristal sahə yaradır (D 0 = 22900 sm - 1), hamısı 3 d 6 -elektronlar daha çox enerji baxımından əlverişli yerlərə yerləşdirilir d e-orbitallar. Elektronların ötürülməsi d e - açıq d g-orbitallar qeyri-mümkünçünki həm də yüksək enerji maneəsi. Buna görə də, bu kompleks kation aşağı spin, onun tərkibində qoşalaşmamış elektronlar yoxdur və diamaqnit. Oxşar şəkildə, 2+ və 4- ionları üçün oktaedral sahədə elektronların orbitallar üzərində paylanması sxemləri təqdim edilə bilər: H 2 O liqandları zəif sahə yaradır; arasında elektron mübadiləsi d e - və d g-orbitalları heç bir çətinlik yaratmır və buna görə də kompleks ionunda qoşalaşmamış elektronların sayı şərti Fe + II ionunda olduğu kimidir. Nəticə su kompleksidir yüksək fırlanma, paramaqnit. Kristal vəziyyətində və sulu məhlulda olan bir çox mürəkkəb birləşmələr parlaq rəngdədir. Beləliklə, tərkibində 2+ kation olan sulu məhlul intensiv mavi rəngə boyanır, 3+ kation məhlula bənövşəyi, 2+ kation isə qırmızı rəng verir. Kristal sahə nəzəriyyəsi mürəkkəb birləşmələrdə bu və ya digər rəngin görünüşünü izah etməyə imkan verir. İşıq bir maddənin məhlulundan və ya kristal nümunəsindən keçərsə spektrin görünən hissəsidir, onda, prinsipcə, nümunənin fiziki davranışı üçün üç variant mümkündür: işığın udulması yoxdur istənilən dalğa uzunluğu (maddə nümunəsi rəngsiz, baxmayaraq ki, spektrin ultrabənövşəyi bölgəsində udma zolaqları ola bilər); tam işığın udulması bütün dalğa boyu diapazonunda (nümunə görünəcək qara); nəhayət, işığın udulması yalnız müəyyən dalğa uzunluğu(sonra nümunə olacaq udulmuş rəngi tamamlayır spektrin dar hissəsi). Beləliklə, məhlulun və ya kristalların rəngi müəyyən edilir udma zolaqlarının tezliyi görünən işıq: İşıq kvantlarının komplekslər tərəfindən udulması (məsələn, oktaedral quruluşa malik olanlar) işığın üzərində yerləşən elektronlarla qarşılıqlı təsiri ilə izah olunur. d e -alt səviyyə, onların boş orbitallara keçidi ilə müşayiət olunur d g-alt səviyyə. Məsələn, hexaaquatitanium(III) 3+ kationları olan sulu məhluldan işığı keçirərkən spektrin sarı-yaşıl bölgəsində (20300 sm - 1, l » 500 nm) işığın udulma zolağı aşkar edilir. Bu, mürəkkəbləşdirici agentin tək elektronunun keçidi ilə əlaqədardır d e-AO aktivdir d g-alt səviyyə: Buna görə də, 3+ olan bir həll bənövşəyi rəng əldə edir (udulmuş sarı-yaşıldan əlavə). Vanadium duzunun Cl 3 məhlulu yaşıl rəngdədir. Bu, həmçinin işıq şüasının enerjisinin bir hissəsini udduqları zaman elektronların müvafiq keçidləri ilə bağlıdır. Vanadiumun (III) elektron konfiqurasiyası ilə əsas vəziyyətdə 3 d 2, iki qoşalaşmamış elektron işğal edilir d e-alt səviyyə: Yalnız var iki elektronun keçidi üçün iki variant haqqında d g -alt səviyyə: ya hər ikisi elektronlar işğal edilir d g -AO, və ya yalnız bir onlardan. Ümumi spinin azalması ilə əlaqəli hər hansı digər elektron keçidləri qadağandır. Kompleksləşdirici agentin elektron konfiqurasiyası varsa d 0 və ya d 10 sonra elektron keçidləri ilə d e - açıq d g -alt səviyyə və ya əksinə qeyri-mümkün ya ona görə elektronların olmaması, ya ona görə boş orbitalların olmaması. Buna görə də komplekslərin Sc(III), Cu(I), Zn(II), Cd(II) və s. kimi kompleksləşdiriciləri olan məhlulları spektrin görünən hissəsində enerji udmur və görünür. rəngsiz: İşığın udulmasının seçiciliyi təkcə ondan asılı deyil kompleksləşdirici agent Və onun oksidləşmə vəziyyəti, həm də ondan liqandların növü. Kompleks birləşmədə spektrokimyəvi silsilənin sol tərəfindəki liqandları yaradan liqandlarla əvəz edərkən güclü elektrostatik sahə müşahidə olunur artırmaqötürülən işıqdan elektronlar tərəfindən udulmuş enerjinin bir hissəsi və nəticədə, azalma müvafiq udma zolağının dalğa uzunluğu. Beləliklə, tərkibində tetraaquacopper(II) 2+ kationları olan sulu məhlul mavi, tetraamminecopper(II) 2+ sulfat məhlulu isə intensiv mavi rəngdədir. ________________________ Təkrarlayın: >>> Tətbiqlər
Enerji qazanması səbəbiylə prioritet həll elektronlar d e-atom orbitalları adlanır liqand sahəsi ilə kompleksin sabitləşmə enerjisi.
işıq sürəti ilə
= 3 ´ 10 10 sm/s.
Vahid D 0 n dalğa nömrəsi ilə eynidir: sm - 1, bu təxminən 12 J/mol-a uyğundur.
Eyni dövrün və eyni oksidləşmə vəziyyətində olan, eyni liqandlara malik kompleksləşdirici maddələri ehtiva edən kompleks birləşmələrdə parçalanma parametri təxminən eyni olur. Kompleksləşdirici maddənin oksidləşmə dərəcəsinin artması ilə D 0 dəyəri artır. Beləliklə, 2+ və 2+ aqua kompleksləri üçün parçalanma parametrinin dəyəri müvafiq olaraq 7800 və 10400 sm - 1, 3+ və 3+ üçün - 13700 və 21000 sm - 1-dir.
I-Br - Cl - » NCS - NO 3 - F -OH - H2O » H - NH 3 NO 2 -CN - "YOX" CO. 









Əksinə, CN - liqandlar əhəmiyyətli parçalanmaya səbəb olur d-AO, 33000 sm təşkil edir - 1. Bu o deməkdir ki, güclü var bütün elektronları ayırmaq meyli haqqında d e-orbitallar. Enerji qazancı, belə bir orbital populyasiyası ilə əldə edilən elektron cütləşməsi səbəbindən enerji xərclərindən qat-qat çoxdur.


Artıq enerji almış elektronların göstərilən keçidləri uyğun gəlir udma bandı hexaaquavanadium (III) xlorid məhlulunun udma spektrində təxminən 400 nm. Spektrin bənövşəyi-bənövşəyi bölgəsinin udulması məhlula əlavə rəng verir - parlaq yaşıl.

Con Van Vleck isə liqandlarla əhatə olunmuş keçid metalı kationlarının aşağı vəziyyətlərini - həm anionlar, həm də neytral molekulları təsvir edir. Kristal sahə nəzəriyyəsi daha sonra koordinasiya birləşmələrində metal-liqand bağının qismən kovalentliyini nəzərə alan daha ümumi nəzəriyyəyə (delokalizasiya edilmiş) molekulyar orbital nəzəriyyə ilə birləşdirildi [və təmizləndi].
Kristal sahə nəzəriyyəsi kristalların və kompleks birləşmələrin optik udma spektrlərini və elektron paramaqnit rezonans spektrlərini, həmçinin keçid metal komplekslərinin məhlullarında hidratasiya və sabitlik entalpiyalarını proqnozlaşdırmağa və ya şərh etməyə imkan verir.
Kristal sahə nəzəriyyəsinin icmalı[ | ]
TCP-yə görə, keçid metalı ilə liqandlar arasındakı qarşılıqlı təsir müsbət yüklü metal kation ilə liqandın bağlanmayan orbitallarında elektronların mənfi yükü arasındakı cazibədən yaranır. Nəzəriyyə beş degenerativ enerjinin dəyişməsini hesab edir d-liqandların nöqtə yükləri ilə əhatə olunmuş orbitallar. Liqand metal ionuna yaxınlaşdıqca liqandın elektronları bəzilərinə yaxınlaşır d-orbitallar digərlərinə nisbətən degenerasiya itkisinə səbəb olur. Elektronlar d-orbitallar və liqandlar eyni işarəli yüklər kimi bir-birini itələyirlər. Beləliklə, onların enerjisi d-ligandlara daha yaxın olan elektronlar daha uzaqda olanlardan daha yüksək olur, bu da enerji səviyyələrinin parçalanmasına səbəb olur. d-orbitallar.
Aşağıdakı amillər bölünməyə təsir göstərir:
- Metal ionunun təbiəti.
- Metalın oksidləşmə dərəcəsi. Oksidləşmə vəziyyəti nə qədər yüksəkdirsə, parçalanma enerjisi də bir o qədər yüksəkdir.
- Metal ionu ətrafında liqandların düzülüşü.
- Metal ionunu əhatə edən liqandların təbiəti. Liqandların təsiri nə qədər güclü olarsa, yüksək və aşağı enerji səviyyələri arasındakı fərq bir o qədər çox olar.
Ən çox yayılmış ligand koordinasiya növüdür oktaedral, burada altı liqand metal ionunun ətrafında oktaedral simmetriyanın kristal sahəsi yaradır. Xarici qabıqda bir elektron olan metal ionunun oktaedral mühitində d-orbitallar enerji səviyyələrində Δ okt () fərqi ilə iki qrupa bölünür. parçalanma enerjisi), orbitalların enerjisi isə dxy, dxz Və d yz-dən aşağı olacaq d z 2 və d x 2 -y 2, çünki birinci qrupun orbitalları liqandlardan daha uzaqda yerləşir və daha az itələnir. Aşağı enerjili üç orbital kimi təyin edilmişdir t 2g, və iki yüksək - kimi e g.
Növbəti ən çox yayılmışlar tetraedral dörd liqandın metal ionunun ətrafında tetraedr əmələ gətirdiyi komplekslər. Bu halda d-orbitallar da enerji səviyyələrində Δ tetr fərqi ilə iki qrupa bölünür. Oktaedral koordinasiyadan fərqli olaraq, orbitalların enerjisi aşağı olacaq d z 2 və d x 2 -y 2 və yüksək - d xy , d xz Və d yz. Bundan əlavə, ligandların elektronları birbaşa istiqamətdə olmadığı üçün d-orbitallarda parçalanma enerjisi oktaedral koordinasiya ilə müqayisədə daha az olacaq. TCP istifadə edərək siz də təsvir edə bilərsiniz plano-kvadrat və komplekslərin digər həndəsələri.
İki və ya daha çox orbital qrupu arasında enerji səviyyələrinin Δ fərqi də liqandların təbiətindən asılıdır. Bəzi ligandlar digərlərinə nisbətən daha az parçalanmaya səbəb olur, bunun səbəbləri izah olunur. Spektrokimyəvi seriyalar- Δ artan qaydada sıralanmış liqandların eksperimental olaraq əldə edilmiş siyahısı:
Metalın oksidləşmə vəziyyəti də Δ-ya təsir göstərir. Daha yüksək oksidləşmə vəziyyəti olan bir metal daha böyük yük fərqinə görə liqandları daha yaxına çəkir. Metal ionuna daha yaxın olan ligandlar daha çox parçalanmaya səbəb olur.
Aşağı və yüksək spinli komplekslər[ | ]
Böyük parçalanmaya səbəb olan ligandlar d CN− və CO kimi səviyyələrə liqandlar deyilir güclü sahə. Belə liqandlarla komplekslərdə elektronların yüksək enerjili orbitalları tutması əlverişsizdir. Nəticədə, yüksək enerjili orbitallar dolmağa başlamazdan əvvəl aşağı enerjili orbitallar tamamilə doldurulur. Belə komplekslər adlanır aşağı fırlanma. Məsələn, NO 2 - böyük parçalanma əmələ gətirən yüksək sahəli liqanddır. Hamısı 5 d-oktaedral ionun elektronları 3− aşağı səviyyədə yerləşəcək t 2g .
Bunun əksinə olaraq, I- və Br- kimi kiçik parçalanmaya səbəb olan liqandlara liqandlar deyilir. zəif sahə. Bu halda elektronları yüksək enerjili orbitallara yerləşdirmək, iki elektronu eyni aşağı enerjili orbitalda yerləşdirməkdən daha asandır, çünki eyni orbitalda olan iki elektron bir-birini itələyir və ikinci elektronun orbitalda yerləşdirilməsinin enerji xərci belədir. Δ-dən yüksəkdir. Beləliklə, beşin hər birində qoşalaşmış elektronlar görünməzdən əvvəl d-orbitallar Hund qaydasına uyğun olaraq hər dəfə bir elektron yerləşdirilməlidir. Belə komplekslər adlanır yüksək fırlanma. Məsələn, Br− zəif sahəli liqanddır və az parçalanmaya səbəb olur. Hamısı 5 d-5-ə malik olan 3− ionunun orbitalları d-elektronlar bir elektron tərəfindən tutulacaq.
Tetraedral komplekslər üçün parçalanma enerjisi Δ tetr təxminən 4/9Δ okt-a bərabərdir (eyni metal və liqandlar üçün). Nəticədə, enerji səviyyələrində fərq d-orbitallar adətən elektron cütləşmə enerjisindən aşağı olur və tetraedral komplekslər adətən yüksək spinlidir.
Paylanma diaqramları d-elektronlar koordinasiya birləşmələrinin maqnit xassələrini proqnozlaşdırmağa imkan verir. Qoşalaşmamış elektronları olan komplekslər paramaqnitdir və maqnit sahəsi tərəfindən cəlb olunur, olmayan komplekslər isə diamaqnitdir və zəif dəf edir.
Kristal sahənin sabitləşmə enerjisi[ | ]
Kristal sahənin sabitləşmə enerjisi (CFE) orbitalların orta enerjisinə nisbətən keçid metal ionunun elektron konfiqurasiyasının enerjisidir. Stabilləşmə, ligand sahəsində bəzi orbitalların enerji səviyyəsinin bütün beşinin olduğu hipotetik sferik sahədən daha aşağı olması səbəbindən baş verir. d-orbitallar eyni itələyici qüvvəyə malikdir və hamısı d-orbitallar degenerasiya olunur. Məsələn, oktaedral halda səviyyə t 2g sferik sahədə orta səviyyədən aşağıdır. Nəticə etibarilə, əgər bu orbitallarda elektronlar varsa, onda metal ionu sferik sahəyə nisbətən liqand sahəsində daha sabitdir. Əksinə, orbitalların enerji səviyyəsi e g orta səviyyədən yuxarıdır və onların tərkibindəki elektronlar sabitləşməni azaldır.
Oktaedral sahə ilə sabitləşmə enerjisi
Oktaedral sahədə üç orbital var t 2g orta enerji səviyyəsinə nisbətən 2/5 Δ oktava və iki orbital ilə sabitləşdi e g 3/5 Δ oktyabrda sabitliyi pozdu. Yuxarıda iki elektron konfiqurasiyanın nümunələri var idi d 5 . Birinci misalda beş elektronu olan aşağı spinli 3− kompleksi var t 2g. Onun ESP 5 × 2 / 5 Δ okt = 2Δ oktyabrdır. İkinci misalda yüksək spinli kompleks 3− ESKP (3 × 2 / 5 Δ okt) − (2 × 3 / 5 Δ okt) = 0. Bu halda aşağı səviyyəli orbitallarda elektronların stabilləşdirici təsiri yüksək səviyyəli orbitallarda elektronların sabitsizləşdirici təsiri ilə neytrallaşdırılır.
Kristal sahə ilə d səviyyəli parçalanma diaqramları[ | ]
| oktaedral | beşbucaqlı-bipiramidal | kvadrat-antiprizmatik |
|---|---|---|
Kristal sahə nəzəriyyəsi 20-ci əsrin 40-cı illərində valentlik bağları nəzəriyyəsini əvəz etdi. Təmiz formada, hazırda istifadə edilmir, çünki o, kompleks birləşmələrdə kovalent bağların əmələ gəlməsini izah edə bilmir və ligandların həqiqi vəziyyətini (məsələn, onların faktiki ölçülərini) nəzərə almır, hətta qarşılıqlı təsirlər yaxın olduqda belə. sırf elektrostatik.
Artıq 50-ci illərin ortalarında sadələşdirilmiş kristal sahə nəzəriyyəsi təkmilləşdirilmiş nəzəriyyə ilə əvəz edilmişdir. liqand sahəsi nəzəriyyəsi, kompleksləşdirici maddə ilə liqand arasındakı kimyəvi bağların kovalent xarakterini nəzərə alaraq.
Bununla belə, kompleks birləşmələrin əmələ gəlməsini izah etmək üçün ən ümumi yanaşma verilir molekulyar orbital nəzəriyyə(MO), hazırda bütün digərlərindən üstündür. Molekulyar orbital metod üst-üstə düşən atom orbitalları olmadıqda həm sırf elektrostatik qarşılıqlı əlaqəni, həm də üst-üstə düşmənin aralıq dərəcələrinin bütün dəstini təmin edir.
Əsas anlayışlara nəzər salaq kristal sahə nəzəriyyəsi, valentlik bağları nəzəriyyəsi kimi, böyük sadəliyi və aydınlığı ilə mürəkkəb birləşmələrdə kimyəvi bağların keyfiyyətcə təsviri üçün əhəmiyyətini hələ də qoruyub saxlayır.
Kristal sahə nəzəriyyəsində kompleksləşdirici maddə ilə liqand arasındakı kimyəvi əlaqə nəzərdən keçirilir elektrostatik. Bu nəzəriyyəyə görə, liqandlar müntəzəm çoxüzlülərin təpələrində kompleksləşdirici maddənin ətrafında yerləşir ( çoxüzlü) kimi nöqtə ödənişləri. Nəzəriyyə liqandın faktiki həcmini nəzərə almır.
Liqandlar, nöqtə yükləri kimi, kompleksləşdirici agentin ətrafında yaradırlar elektrostatik sahə("kristal sahəsi", mürəkkəb birləşmənin kristalını nəzərə alsaq, və ya liqand sahəsi), burada kompleksləşdirici agentin enerji səviyyələri və hər şeydən əvvəl, d- alt səviyyələr parçalanırlar və onların enerjisi dəyişir. Parçalanmanın təbiəti, yeni enerji səviyyələrinin enerjisindən asılıdır simmetriya liqandların düzülüşü (oktaedral, tetraedral və ya digər kristal sahə). H 2 O, NH 3, CO və digər molekullar liqandlar kimi əlaqələndirildikdə, onlar dipollar, kompleksləşdirici agentə qarşı mənfi yüklə istiqamətlənmişdir.
Liqandların oktaedral düzülüşünə nəzər salaq (məsələn, -3 və ya 3+). Oktaedrin mərkəzində elektronları olan kompleksləşmə ionu M(+ n) var d-atomik orbitallar və onun təpələrində nöqtə mənfi yüklər şəklində liqandlar var (məsələn, F - ionları və ya NH 3 kimi qütb molekulları). Liqandlarla əlaqəli olmayan şərti M(+ n) ionunda bütün beşin enerjiləri d-AO eynidir (yəni atom orbitalları degenerasiya etmək).
Lakin liqandların oktaedral sahəsində d-Kompleksləşdirici agentin AO-larına düşür qeyri-bərabər mövqe. Atom orbitalları d(z 2) və d(x 2 -y 2), koordinat oxları boyunca uzanır, liqandlara ən yaxın gəlir. Bu orbitallarla oktaedrin təpələrində yerləşən liqandlar arasında əhəmiyyətli fərqlər yaranır. itələyici qüvvələr, orbital enerjinin artmasına səbəb olur. Başqa sözlə, bu atom orbitalları tabedir liqand sahəsinə maksimum məruz qalma. Güclü sıxılmış yay bu cür qarşılıqlı əlaqənin fiziki modeli kimi xidmət edə bilər.
Digər üç d-AO - d(xy), d(xz) Və d(yz), koordinat oxları arasında və liqandlar arasında yerləşir, onlardan daha çox məsafədədir. Belələrinin qarşılıqlı təsiri d-Liqandlarla AO minimaldır və buna görə də enerjidir d(xy), d(xz) Və d(yz)-AO orijinalla müqayisədə azalır.
Beləliklə, beş qat degenerasiya d-AO kompleksləşdirici agent, daxil olur oktaedral liqand sahəsi, məruz parçalanma yeni orbitalların iki qrupuna - orbitalların üçqat degenerasiyası aşağı enerji ilə, d(xy), d(xz) Və d(yz), Və orbitalların ikiqat degenerasiyası daha yüksək enerji ilə d(z 2) və d(x 2 -y 2). Bu yeni qruplar d- ilə orbitallar aşağı Və daha yüksək enerji işarələmək dε və dγ:
d(z 2) və d(x 2 -y 2)
d(xy), d(xz),d(yz)
Enerji fərqi iki yeni alt səviyyə dε və dγ adlandırıldı bölmə parametri Δ 0:
E 2 – E 1 = Δ 0 ≈ 0
İki yeni yer enerji alt səviyyələri dε və dγ orijinala nisbətən ( d-AO) enerji diaqramında asimmetrik:
(E 2 – E 0) > (E 0 – E 1).
Kvant mexaniki nəzəriyyəsi bunu tələb edir yeni enerji səviyyələri tamamilə elektronlarla doldurulduqda, ümumi enerji dəyişməz olaraq qalır, yəni. qalmalıdır bərabərdir E 0 .
Başqa sözlə, bərabərlik təmin edilməlidir
4(E 2 – E 0) = 6(E 0 – E 1),
burada 4 və 6 - maksimum başına elektronların sayı dγ- və dε-AO. Bu bərabərlikdən belə nəticə çıxır
(E 2 – E 0) / (E 0 – E 1) = 3/2 və
(E 2 – E 1) / (E 0 – E 1) = 5/2 və ya
Δ 0 / ( E 0 – E 1) = 5/2, buradan ( E 0 – E 1) = 2/5Δ 0 .
Mümkün olan maksimum altı elektrondan hər bir elektronun yerləşdirilməsi dε orbitallar səbəb olur azalma (uduşlar) enerji 2/5 Δ 0 ilə.
Əksinə, dördündən hər bir elektronun yerləşdirilməsi mümkündür dγ orbitalları səbəb olur artırmaq (dəyəri) enerji 3/5 Δ 0 ilə.
Elektronlarla doludursa dε- və dγ-orbitalları tamamilə, onda yox qalib enerji olmayacaq(elə bilməyəcəyi kimi əlavə enerji istehlakı).
Amma orijinal olsa d-AO yalnız məskunlaşmışdır qismən və 1-dən 6-a qədər elektron ehtiva edir və bu elektronlar yalnız yerləşdirilir dε-AO, onda alırıq əhəmiyyətli enerji qazancı.
Enerji qazanması səbəbiylə prioritet həll elektronlar dε-atom orbitalları deyilir liqand sahəsi ilə kompleksin sabitləşmə enerjisi.
Hər bir liqandın spesifikliyi bu liqandın yaratdığı sahəyə təsir göstərir - güclü və ya zəif. Necə daha güclü sahə dan liqandlar daha çox məna bölmə parametri Δ 0 .
Parçalanma parametrinin öyrənilməsi adətən əsaslanır spektroskopik tədqiqat. Dalğa uzunluqları udma zolaqları elektronların ötürülməsi səbəbindən kristal vəziyyətində və ya məhlulda olan komplekslər dε- açıq d ilə əlaqəli γ-AO bölmə parametriΔ 0 aşağıdakı kimi:
λ = c / ν; Δ 0 = E 2 – E 1 = h ν = h · ( c / λ),
Plank sabiti haradadır h 6,6260693 ∙ 10 -34 J s-ə bərabər;
işıq sürəti ilə
= 3 · 10 10 sm/s.
VahidΔ 0 dalğa nömrəsi ilə eynidir: sm -1, təxminən 12 J/mol-a uyğundur. Bölmə parametri, ligand növündən əlavə, asılıdır oksidləşmə dərəcəsinə görə Və təbiət kompleksləşdirici agent.
Eyni dövrün və eyni oksidləşmə vəziyyətində olan, eyni liqandlara malik kompleksləşdirici maddələri ehtiva edən kompleks birləşmələrdə parçalanma parametri təxminən eyni olur. Kompleksləşdirici maddənin oksidləşmə dərəcəsinin artması ilə Δ 0 dəyəri artır. Beləliklə, 2+ və 2+ aqua kompleksləri üçün parçalanma parametrinin dəyəri müvafiq olaraq 7800 və 10400 sm -1, 3+ və +3 üçün isə 13700 və 21000 sm -1 təşkil edir. At nüvə yükünün artması kompleks əmələ gətirən atomun Δ 0 da artır. Hexaamminiridium(III) 3+, hexaamminiridium(III) 3+ və hexaamminiridium(III) 3+ kationları ( Z= 27, 45 və 77) 22900, 34100 və 41000 sm -1-ə bərabər parçalanma parametrləri ilə xarakterizə olunur.
Δ 0-nın liqandların təbiətindən asılılığı daha müxtəlifdir. Çoxsaylı kompleks birləşmələrin tədqiqi nəticəsində məlum olmuşdur ki, onların adi oksidləşmə vəziyyətlərində yerləşən kompleksləşən metalların parçalanma parametrlərini artırmaq qabiliyyətinə görə, ən çox yayılmış liqandları aşağıdakı kimi təşkil etmək olar. spektrokimyəvi seriyalar, bunun boyunca Δ 0 dəyəri monoton şəkildə artır:
I > Br > Cl > NCS - ≈ NO 3 - > F - > OH - > H 2 O > H - > NH 3 > NO 2 - > CN - > NO > CO.
Beləliklə, kompleksləşdirici maddə ətrafında ən güclü elektrostatik sahə və ən güclü parçalanma d-AO CN-, NO və CO liqandları tərəfindən törədilir. Elektronların üzərində paylanmasını nəzərdən keçirək dε- və d ligandların oktaedral sahəsində γ-orbitallar. Kontrol dε- və dγ-orbitallara tam uyğun olaraq baş verir Hund qaydası Və Pauli prinsipi. Bu halda, parçalanma parametrinin dəyərindən asılı olmayaraq, ilk üç elektron kvant hüceyrələri tərəfindən tutulur. dε-alt səviyyə:
![]() dε
dε
Əgər başına elektronların sayı d- kompleksləşdirici agentin üçdən çox alt səviyyəsi var; onları bölünmüş alt səviyyələrə yerləşdirmək üçün iki imkan var. Parçalanma parametrinin aşağı qiymətində (liqandların zəif sahəsi) elektronlar enerji maneəsini aşırlar. dε- və dγ-orbitallar; dördüncü və sonra beşinci elektronlar kvant hüceyrələrini doldurur dγ-alt səviyyə.
![]() dε
dε
Güclü ligand sahəsi və yüksək Δ 0 dəyəri ilə dördüncü və beşinci elektronların əhalisi dγ-alt səviyyə istisna edilir; doldurulması davam edir dε-orbitallar.
![]() dε
dε
At zəif sahə liqandları kvant hüceyrələrini 4 və ya 5 elektronla doldurmaq paralel spinlər, beləliklə, ortaya çıxan kompleks güclü olur paramaqnit. Güclü ligand sahəsindəüzərində bir və sonra iki elektron cütü əmələ gəlir dε-alt səviyyə, yəni paramaqnetizm kompleksin daha zəif olduğu ortaya çıxır. Zəif sahə vəziyyətində altıncı, yeddinci və səkkizinci elektronlar geri qayıdırlar dγ-alt səviyyə, konfiqurasiyaları elektron cütlərinə tamamlayır (bir halda d 6, iki - d 7 və üç - d 8):
![]() dε
dε
Güclü liqand sahəsi vəziyyətində altıncı elektron məskunlaşır dε-AO, aparan diamaqnetizm kompleks, bundan sonra yeddinci və səkkizinci elektronlar gedir dγ-alt səviyyə:
![]() dε
dε
Aydındır ki, səkkiz elektron konfiqurasiya ilə struktur fərqləri liqandlarla komplekslər arasında zəif Və güclü sahələr yox olur. Doqquzuncu və onuncu elektron tərəfindən orbitalların işğalı hər iki növ komplekslər üçün də fərqlənmir:
![]() dε
dε
Oktaedral kompleks ionlarının 3+ və -3 elektron quruluşunun nəzərdən keçirilməsinə qayıdaq. Yerləşdiyi yerə görə spektrokimyəvi seriyalar, ammonyak NH 3 liqandlardan biridir güclü sahə, və ftorid ionu F - – zəif sahə. -3 anionunda F - liqandları zəif kristal sahəsi (Δ 0 = 13000 sm -1) yaradır və orijinal 3-ün bütün elektronları d 6 -SC-də yerləşir dε- və d heç bir qoşalaşma olmadan γ orbitalları. Kompleks iondur yüksək fırlanma və dörd qoşalaşmamış elektron ehtiva edir, buna görə də paramaqnit:

3+ ionunda NH 3 liqandları güclü kristal sahə yaradır (Δ 0 = 22900 sm -1), hamısı 3 d 6 -elektronlar daha çox enerji baxımından əlverişli yerlərə yerləşdirilir dε-orbitallar. Elektronların ötürülməsi dε- açıq dγ orbitalları qeyri-mümkünçünki həm də yüksək enerji maneəsi. Buna görə də, bu kompleks kation aşağı spin, onun tərkibində qoşalaşmamış elektronlar yoxdur və diamaqnit:

Eyni şəkildə, 2+ və -4 ionları üçün oktaedral sahədə elektronların orbitallar üzərində paylanması sxemləri təqdim edilə bilər:


H 2 O liqandları zəif sahə yaradır; arasında elektron mübadiləsi dε- və dγ-orbitallar heç bir çətinlik yaratmır və buna görə də kompleks ionda qoşalaşmamış elektronların sayı şərti Fe + II ionunda olduğu kimidir. Nəticə su kompleksidir yüksək fırlanma, paramaqnit.
Əksinə, CN - liqandlar əhəmiyyətli parçalanmaya səbəb olur d-AO, 33000 sm -1 təşkil edir. Bu o deməkdir ki, güclü var bütün elektronları ayırmaq meyli haqqında dε-orbitallar. Enerji qazancı, belə bir orbital populyasiyası ilə əldə edilən elektron cütləşməsi səbəbindən enerji xərclərindən qat-qat çoxdur.
Valentlik bağı metodu nöqteyi-nəzərindən akvakompleksdə əlaqə əmələ gətirən valent orbitalların hibridləşməsi daxildir. d-AO xarici alt səviyyəsi (4 sp 3 d 2) və aşağı fırlanmada - d-SC daxili alt səviyyə (3 d 2 4sp 3).
Beləliklə, zəif sahəli liqandları olan yüksək spinli komplekslərdə hibridləşmə iştirakı ilə baş verir. d-Xarici alt səviyyənin AO və yüksək sahəli liqandlarla aşağı spinli - d- daxili alt səviyyəli ASC. Kompleksdəki qoşalaşmamış elektronların sayı elektron paramaqnit rezonansı (EPR) ilə müəyyən edilə bilər. EPR spektrometrləri adlanan bu metodun alətlərindən istifadə etməklə paramaqnit maddələr tədqiq edilir.
Kristal sahə nəzəriyyəsi mürəkkəb birləşmələrdə bu və ya digər rəngin görünüşünü izah etməyə imkan verir. Mürəkkəb birləşmələr arasında kristal vəziyyətdə və sulu məhlulda əhəmiyyətli sayda parlaq rəngləri ilə fərqlənir. Beləliklə, tərkibində 2+ kation olan sulu məhlul intensiv mavi rəngə boyanır, 3+ kation məhlula bənövşəyi, 2+ kation isə qırmızı rəng verir. İşıq bir maddənin məhlulundan və ya kristal nümunəsindən keçərsə spektrin görünən hissəsidir, onda, prinsipcə, nümunənin fiziki davranışı üçün üç variant mümkündür: işığın udulması yoxdur istənilən dalğa uzunluğu (maddə nümunəsi rəngsiz, baxmayaraq ki, spektrin ultrabənövşəyi bölgəsində udma zolaqları ola bilər); tam işığın udulması bütün dalğa boyu diapazonunda (nümunə görünəcək qara); nəhayət, işığın udulması yalnız müəyyən dalğa uzunluğu(sonra nümunə olacaq udulmuş rəngi tamamlayır spektrin dar hissəsi).

Beləliklə, məhlulun və ya kristalların rəngi müəyyən edilir udma zolaqlarının tezliyi görünən işıq. İşıq kvantlarının komplekslər tərəfindən udulması (məsələn, oktaedral quruluşa malik olanlar) işığın üzərində yerləşən elektronlarla qarşılıqlı təsiri ilə izah olunur. dε-alt səviyyə, onların boş orbitallara keçidi ilə müşayiət olunur dγ-alt səviyyə. Məsələn, hexaaquatitanium(III) 3+ kationları olan sulu məhluldan işığı keçirərkən spektrin sarı-yaşıl bölgəsində (20300 sm -1, λ=500 nm) işığın udma zolağı aşkar edilir. Bu, mürəkkəbləşdirici agentin tək elektronunun keçidi ilə əlaqədardır dε-AO aktivdir dγ-alt səviyyə:

Buna görə də, 3+ olan bir həll bənövşəyi rəng əldə edir (udulmuş sarı-yaşıldan əlavə). Vanadium duzunun Cl 3 məhlulu yaşıl rəngdədir. Bu, həmçinin işıq şüasının enerjisinin bir hissəsini udduqları zaman elektronların müvafiq keçidləri ilə bağlıdır. Vanadiumun (III) elektron konfiqurasiyası ilə əsas vəziyyətdə 3 d 2, iki qoşalaşmamış elektron işğal edilir dε-alt səviyyə:

Yalnız var iki elektronun keçidi üçün iki variant haqqında dγ-alt səviyyə: ya hər ikisi elektronlar işğal edilir dγ-AO və ya yalnız bir onlardan. Ümumi spinin azalması ilə əlaqəli hər hansı digər elektron keçidləri qadağandır.
Artıq enerji almış elektronların göstərilən keçidləri uyğun gəlir udma bandı hexaaquavanadium (III) xlorid məhlulunun udma spektrində təxminən 400 nm. Spektrin bənövşəyi-bənövşəyi bölgəsinin udulması məhlula əlavə rəng verir - parlaq yaşıl. Kompleksləşdirici agentin elektron konfiqurasiyası varsa d 0 və ya d 10 sonra elektron keçidləri ilə dε- açıq dγ-alt səviyyə və ya əksinə qeyri-mümkün ya ona görə elektronların olmaması, ya ona görə boş orbitalların olmaması. Buna görə komplekslərin Sc(III) kimi kompleksləşdirici maddələrlə məhlulları (3 d 0), Cu(I) (3 d 10), Zn(II) (3 d 10), Cd(II) (4 d 10) və s., spektrin görünən hissəsində enerji udmur və görünür rəngsiz. İşığın udulmasının seçiciliyi təkcə ondan asılı deyil kompleksləşdirici agent Və onun oksidləşmə vəziyyəti, həm də ondan liqandların növü. Kompleks birləşmədə spektrokimyəvi silsilənin sol tərəfindəki liqandları yaradan liqandlarla əvəz edərkən güclü elektrostatik sahə müşahidə olunur artırmaqötürülən işıqdan elektronlar tərəfindən udulmuş enerjinin bir hissəsi və nəticədə, azalma müvafiq udma zolağının dalğa uzunluğu. Beləliklə, tərkibində tetraaquacopper(II) 2+ kationları olan sulu məhlul mavi, tetraamminecopper(II) 2+ sulfat məhlulu isə intensiv mavi rəngdədir.
Əlaqədar məlumat.