Državna farmakopeja xiii. Određivanje glavnih grupa biološki aktivnih supstanci. Provjera autentičnosti cijelih listova
Lijekovi su specifičan proizvodni proizvod čiji kvalitet potrošač ne može samostalno ocijeniti. Garantovanje kvaliteta i lekova proizvedenih u Rusiji i uvoza iz inostranstva jedan je od glavnih zadataka države u oblasti zaštite javnog zdravlja. Najvažniji zadaci uključuju ne samo zasićenje domaćeg farmaceutskog tržišta ovim lijekovima, već i izlazak na međunarodno farmaceutsko tržište, što se može postići osiguravanjem da domaći lijekovi budu u skladu sa zahtjevima svjetskih standarda, napomenula je ministarka Veronika Skvortsova u uvodnom obraćanju publikaciju.
Novo izdanje Državne farmakopeje, XIII izdanje, rješava ove strateške probleme.
Prva farmakopeja, objavljena 1765. godine, bila je na latinskom jeziku i trebala je osigurati kvalitet lijekova koje koriste kirurzi u vojnim bolnicama. U narednim godinama, decenijama i vekovima, domaća farmakopeja je više puta iznova objavljivana, ažurirajući svoj sadržaj u skladu sa stanjem i stepenom razvoja farmaceutske industrije i sistema kontrole i licenciranja kako u našoj zemlji tako i u inostranstvu, rekao je direktor Departmana. Državne regulacije cirkulacije lijekova u njegovom uvodu sredstva Arsalan Tsyndymeev.
Državna farmakopeja XIII izdanja uključivala je 229 općih farmakopejskih članaka i 179 farmakopejskih članaka.
Prvi put se u Državnu farmakopeju XIII izdanja uvodi 99 općih farmakopejskih članaka, uključujući 30 o metodama analize, 5 o oblicima doziranja i 12 o metodama za određivanje farmaceutskih i tehnoloških parametara doznih oblika. Osim toga, 2 opća farmakopejska članka - o ljekovitim biljnim sirovinama i 3 - o metodama njihove analize, 7 - o grupama imunobioloških lijekova i 31 - o metodama njihovog ispitivanja, 3 - o grupama lijekova iz krvi i krvne plazme ljudi i životinje, 9 - o metodama analize lijekova dobijenih iz krvi i krvne plazme ljudi i životinja.
Glavni cilj Državne farmakopeje Ruske Federacije je standardizacija kvaliteta lijekova u prometu na domaćem farmaceutskom tržištu, napominje Elena Sakanyan, direktorica Centra za farmakopeju i međunarodnu saradnju Federalne državne budžetske institucije “NTsESMP”.
Pravovremeno objavljivanje Državne farmakopeje Ruske Federacije, koja bi se, u skladu sa Federalnim zakonom „o prometu lijekova“ trebala provoditi ne više od 1 puta u 5 godina, bit će ključ za rješavanje problema. obezbjeđivanja kvalitetne medicinske zaštite stanovništvu naše zemlje.
Naredba Ministarstva zdravlja Ruske Federacije od 29. oktobra 2015. broj 771 predviđa uvođenje na snagu opštih farmakopejskih monografija i farmakopejskih monografija uključenih u Državnu farmakopeju XIII izdanja od 1. januara 2016. godine.
Utvrđeno je da opšte farmakopejske monografije i farmakopejske monografije odobrene ovom naredbom, opšte farmakopejske monografije i farmakopejske monografije odobrene naredbom Ministarstva zdravlja Ruske Federacije od 21. novembra 2014. br. 768 „O odobrenju opšte farmakopejske monografije i farmakopejske monografije” čine publikacije Državne farmakopeje XIII.
Utvrdili da:
regulatornu dokumentaciju za registrirane lijekove za medicinsku upotrebu, kao i za lijekove za medicinsku upotrebu, čije se prijave za državnu registraciju podnose Ministarstvu zdravlja Ruske Federacije prije stupanja na snagu farmakopejskih monografija odobrenih ovom naredbom , uskladiće se sa ovim farmakopejskim monografijama do 1. januara 2018. godine;
regulatornu dokumentaciju za registrovane lekove za medicinsku upotrebu, kao i za lekove za medicinsku upotrebu, čije se prijave za državnu registraciju podnose Ministarstvu zdravlja Ruske Federacije pre stupanja na snagu opštih farmakopejskih monografija odobrenih ovim naredbe, uskladiće se sa ovim člancima iz opštih farmakopejskih monografija do 1. januara 2019. godine.
Novu Državnu farmakopeju možete pronaći na sljedećoj e-mail adresi:
Opće farmakopejske monografije i farmakopejske monografije Državne farmakopeje Ruske Federacije
XIII izdanje
V.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, N.D. Bunyatyan
Federalna državna budžetska institucija "Naučni centar za ekspertizu medicinskih proizvoda" Ministarstva zdravlja Ruske Federacije, 127051, Moskva, Rusija
Sažetak: Državna farmakopeja Ruske Federacije je skup općih farmakopejskih članaka i farmakopejskih članaka i podliježe ponovnom izdavanju najmanje jednom u 5 godina. Sljedeće izdanje Državne farmakopeje Ruske Federacije, planirano za objavljivanje 2015. godine, uključivat će i opće farmakopejske monografije i farmakopejske monografije koje su prvi put razvijene u praksi domaće, a u nekim slučajevima i globalne farmakopejske analize, kao i članke koje su ažurirane i revidirane verzije općih farmakopejskih monografija i farmakopejskih monografija. Uvođenjem općih farmakopejskih monografija i farmakopejskih monografija ovog izdanja Državne farmakopeje Ruske Federacije značajno će se povećati nivo domaće farmakopejske analize i osigurati njena usklađenost sa zahtjevima svjetskih standarda.
Ključne riječi: državna farmakopeja; opća farmakopejska monografija; farmakopejska monografija; kvalitet lijekova; farmakopejska analiza.
Bibliografski opis: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Opći farmakopejski članci i farmakopejski članci Državne farmakopeje Ruske Federacije XIII izdanje. Glasnik Naučnog centra za vještačenje medicinskih proizvoda 2015; (2): 54-58.
OPĆE MONOGRAFIJE I FARMAKOPEJSKE MONOGRAFIJE DRŽAVNE FARMAKOPEJE RUSKE Federacije, XIII izdanje v.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, N.D. Bunyatyan
Federalna državna budžetska institucija "Naučni centar za stručno ocjenjivanje lijekova" Ministarstva zdravlja Ruske Federacije, 127051, Moskva, Rusija
Sažetak: Državna farmakopeja Ruske Federacije je zbirka općih monografija i farmakopejskih monografija. Trebalo bi se reizdati najmanje jednom u 5 godina. Sljedeće planirano izdanje Državne farmakopeje Ruske Federacije planirano je za objavljivanje 2015. godine. Ono će uključivati kako prvo razvijene nacionalne i, u nekim slučajevima, globalne farmakopejske analize opće i farmakopejske monografije, te ažurirane revidirane opće i farmakopejske monografije. Implementacijom općih i farmakopejskih monografija navedenog izdanja Državne farmakopeje Ruske Federacije značajno će se podići nivo nacionalne farmakopejske analize i osigurati njena usklađenost sa međunarodnim standardima.
Ključne riječi: Državna farmakopeja; opća monografija; farmakopejska monografija; kvaliteta lijeka; farmakopejska analiza.
Bibliografski opis: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Opće monografije i farmakopejske monografije Državne farmakopeje Ruske Federacije, XIII izdanje. Bilten Naučnog centra za stručno ocjenjivanje lijekova 2015; (2): 54-58.
Glavni cilj Državne farmakopeje Ruske Federacije (SF RF) je standardizacija kvaliteta lijekova u prometu na domaćem farmaceutskom tržištu.
Trenutno djeluju Državni fond X izdanja (1968), Državni fond XI izdanja (1. dio - 1987, dio 2 - 1989), kao i Državni fond XII izdanja (1 dio - 2007). teritoriju Ruske Federacije. Navedeni datumi objavljivanja ovih publikacija Globalnog fonda ukazuju na to da nisu u skladu sa zahtjevima važećeg Federalnog zakona od 12. aprila 2010. „O prometu lijekova“ br. 61-FZ u vezi sa vremenom ponovnog izdavanja Državna farmakopeja.
Unatoč tome, opće farmakopejske monografije (GPM) i farmakopejske monografije (PS) uključene u izdanja Državne farmakopeje X-X11 nisu otkazane. Neki od njih trebaju reviziju, neki od članaka su već izgubili na važnosti zbog nedostatka potražnje. To uključuje GPM kao što su „Biološka metoda za određivanje aktivnosti 0,1% rastvora adrenalin hidrohlorida“, „Biološka ispitivanja
cija novarsenola i miarsenola“, „Određivanje stepena beline lekova u prahu“ i dr. Takođe je potrebno ukinuti FS za lijekove povučene iz prometa. Osim toga, potrebno je revidirati farmaceutske supstance koje su odobrene u periodu između objavljivanja farmakopeja, prema kojima pojedina preduzeća proizvode lijekove i prate njihov kvalitet, jer se metode farmakopejske analize stalno usavršavaju.
Trenutno je pripremljeno 229 OFS i 179 FS za uključivanje u sljedeće XIII izdanje Državnog fonda Ruske Federacije. Mogu se podijeliti u odgovarajuće dijelove.
Odjeljak „Opšti farmakopejski članci“ sadrži: članke o općim metodama, Opće farmakopejske monografije o metodama analize, reagensima, oblicima doziranja i metodama njihove analize; ljekovite biljne sirovine i metode za ocjenjivanje njihovog kvaliteta; grupe imunobioloških lijekova i metode njihove analize; medicinski proizvodi iz ljudske i životinjske krvi i krvne plazme i analitičke metode koje se koriste za procjenu njihovog kvaliteta; radiofarmaceutika.
Farmakopejske monografije su predstavljene u odjeljcima “Farmaceutske supstance” i “Lijekovi”. Odeljak „Farmaceutske supstance“ predstavljen je farmakopejskim člancima o farmaceutskim supstancama sintetičkog ili mineralnog porekla, koje se koriste kao aktivne i/ili pomoćne supstance. Osim toga, kao poseban pododjeljak prikazane su farmakopejske monografije za ljekovite biljne sirovine koje se koriste u farmaceutskoj proizvodnji, uključujući i ljekovite biljne preparate. Odjeljak „Lijekovi“ sastoji se od dva pododjeljka: imunobiološki lijekovi i lijekovi dobiveni iz ljudske krvi i plazme.
Prilozi Državnom fondu Ruske Federacije, XIII izdanje, prikazani su sa referentnim tabelama: tabela atomskih masa, alkoholno-holometrijske tabele, tabela izotoničnih ekvivalenata lekovitih supstanci za natrijum hlorid, tabela broja kapi u 1 g i 1 ml i masu 1 kapi tečnog lijeka na temperaturi od 20°C pomoću standardnog mjernog kapljičara, crteže IR spektra standardnih uzoraka farmaceutskih supstanci.
Od ovog broja, po prvi put za Državnu farmakopeju Ruske Federacije, XIII izdanje, razvijene su i preporučene za odobrenje 102 monografije opšte farmakopeje, uključujući 30 monografija opšte farmakopeje za metode analize, 5 monografija opšte farmakopeje, monografija za doktore i 12 monografija Opće farmakopeje za metode za određivanje farmaceutskih i tehnoloških parametara doznih oblika, 2 monografije Opće farmakopeje za ljekovite biljne sirovine i 3 monografije Opće farmakopeje za metode njene analize, 7 Opšta farmakopeja monografija za imunobiološke grupe3 Monografija Opće farmakopeje za njihove metode ispitivanja, 3 Monografija Opće farmakopeje za grupe lijekova iz ljudske i životinjske krvi i plazme, 9 Monografija Opće farmakopeje za metode analize lijekova dobijenih iz krvi i plazme krvi ljudi i životinja.
Osim toga, za uključivanje u Državnu farmakopeju Ruske Federacije XIII izdanja, po prvi put je pripremljeno 17 farmakopejskih članaka, uključujući 4 FS za farmaceutske supstance, 4 FS za ljekovite biljne sirovine, 5 FS za imunobiološke lijekove i 4 FS za lijekove iz ljudske krvi i krvne plazme .
Određeni broj općih farmaceutskih supstanci prethodno predstavljenih u Državnoj farmakopeji SSSR-a u X i XI izdanju (Državna farmakopeja SSSR-a X izdanje, SSSR Državna farmakopeja XI izdanje) isključeni su iz prakse moderne farmakopejske analize kao nezatražene. Ostale aktuelne OFS i FS Državna farmakopeja SSSR X izdanje, Državna farmakopeja SSSR XI izdanje (broj 1, 2) i Državna farmakopeja Ruske Federacije XII izdanje (SF Državna farmakopeja Ruske Federacije XII izdanje) su revidirane i dopunjena materijalima uzimajući u obzir savremene zahtjeve, naučna i praktična dostignuća u oblasti farmakopejske analize.
Monografija Opće farmakopeje „Pravila za upotrebu farmakopejskih monografija” dopunjena je odjeljcima „Vlažnost” i „Skladištenje”. Osim toga, unesena su odgovarajuća pojašnjenja u odjeljcima „Opis“, „Masa“, „Zapremina“, „Temperatura“, „Tačno vaganje“, „Rastvarači“, „Indikatori“, „Granice sadržaja“, „Filtracija“.
OFS “Uzorkovanje” uključuje definicije pojmova, opšte odredbe, a dodat je i odjeljak “Pravila uzorkovanja”. Uvedene su i nove rubrike: „Uzorkovanje iz rasutih lijekova i materijala
ribolov“, „Uzorkovanje lijekova u potrošačkoj ambalaži“, „Pakovanje, označavanje, skladištenje odabranih uzoraka“, „Zahtjevi za prostorije, opremu i osoblje za uzorkovanje“.
OFS “Analiza sita” je razvijen da zameni OFS GF XI izdanje “Određivanje mlevenja prahova i sita” i ukazuje na svrhu analize sita, uslove i metode za njenu implementaciju, klasifikaciju tipičnih veličina sita u skladu sa zahtevima sveta. standardima.
Novo izdanje monografije Opšte farmakopeje „Sterilizacija“ sadrži savremene aktuelne metode i uslove sterilizacije farmaceutskih supstanci, lekova, ekscipijenata i dr., kriterijum za stepen sterilizacije i opis bioloških pokazatelja sterilizacije.
U skladu sa dodatnim podacima o toksičnosti, pojašnjenja su u Monografiji Opće farmakopeje „Rezidualni organski rastvarači“ i dodane su informacije o rastvaračima s nedovoljno potkrijepljenom toksičnošću.
U Monografiji Opće farmakopeje “Radiofarmaceutika” proširen je odjeljak “Lista indikatora kvaliteta koje radiofarmaceutici industrijske proizvodnje i ekstemporane proizvodnje moraju ispunjavati”, a odjeljak “Poluživot” dopunjen je jednadžbom za vrijeme poluraspada. krivulja.
Monografija Opće farmakopeje “Farmaceutske supstance” unela je značajne dopune u odeljak koji karakteriše zahteve za kvalitet farmaceutskih supstanci (na primer, “Rezidualni organski rastvarači”, “Bakterijski endotoksini ili pirogenost” itd.). Daje se uređena definicija pojma „farmaceutska supstanca“. Monografija Opće farmakopeje dopunjena je odjeljcima o metodama biološke analize: “Abnormalna toksičnost” i “Histaminske i/ili depresorske supstance”. Uključuje tabele kao što su “Granice za kontrolu, identifikaciju i kvalifikaciju srodnih nečistoća za farmaceutske supstance”, “Granice za kontrolu, identifikaciju i kvalifikaciju srodnih nečistoća u peptidima dobijenim sintetički” i “Kriterijumi za standardizaciju dozvoljenog sadržaja teških metala”.
Monografija Opće farmakopeje „Rok trajanja lijekova” dopunjena je odjeljkom „Testovi stabilnosti metodom „ubrzanog starenja”.
U Monografiju Opće farmakopeje “Opšte reakcije na autentičnost” dodatno je uveden odjeljak “Aluminij”, au Monografiji Opće farmakopeje “Način sagorijevanja u tikvici s kisikom” dodat je odjeljak “Selen”.
Nastavlja se opis ispitivanja čistoće i dozvoljenih granica nečistoća u lijekovima. Tako su po prvi put predstavljene metode za određivanje nečistoća aluminijuma, fosfata, žive i selena. Metode za određivanje nečistoća amonijuma, kalcijuma, arsena, sulfata, hlorida i cinka i regulatorni zahtevi za njihov sadržaj usklađeni su sa zahtevima svetskih standarda. Monografija Opće farmakopeje “Teški metali” dodatno navodi metode za kvantitativno određivanje pojedinačnih jona, a monografija Opće farmakopeje “Gvožđe” sadrži pojašnjenja u vezi sa koncentracijom reagensa.
Određivanje fluora u lijekovima preporučuje se provoditi trima metodama: titrimetrijskom, spektrofotometrijskom i ionometrijskom.
Pored određivanja saponifikacionog broja, kiselinskog, etarskog i jodnog broja, XIII izdanje Državne farmakopeje Ruske Federacije uključuje opšte farmakološke monografije posvećene određivanju peroksidnog, hidroksilnog i anizidinskog broja. Za razliku od peroksidne vrijednosti, anizidinski broj karakterizira sadržaj sekundarnih produkata oksidacije (aldehida, ketona) u ispitivanoj farmaceutskoj supstanci i/ili lijeku i na taj način daje potpunu sliku o kvaliteti lijeka koji se analizira.
Monografija Opće farmakopeje “Određivanje proteina” je značajno revidirana: promijenjena je struktura članka, pojašnjeno je određivanje interferirajućih supstanci, proširen je opis spektrofotometrijskih i kolorimetrijskih metoda za određivanje proteina, a Uvedena je fluorimetrijska metoda za određivanje proteina pomoću o-ftalaldehida. Metoda kao što je određivanje proteina Nesslerovim reagensom je isključena – ova metoda je uključena u posebnu Monografiju Opće farmakopeje „Određivanje proteinskog dušika Nesslerovim reagensom uz preliminarnu precipitaciju proteinskog materijala u imunobiološkim lijekovima“.
Za karakterizaciju glavnog pokazatelja kvalitete antacidnih lijekova, 13. izdanje Državne farmakopeje Ruske Federacije po prvi put je uključilo Monografiju Opće farmakopeje „Određivanje sposobnosti neutralizacije kiseline“.
Moderne spektroskopske metode za proučavanje strukture i kvaliteta lijekova su Raman spektrometrija, rendgenska fluorescentna spektrometrija, bliska infracrvena spektrometrija, infracrvena spektrometrija, ultraljubičasta i vidljiva spektrofotometrija, atomska emisiona spektrometrija, fluorimetrija, nuklearna magnetnozonska spektrometrija itd. Uzimajući u obzir savremene mogućnosti spektroskopskih metoda, prvi su razvijeni OFS kao što su „Ramanova spektrometrija“, „Fluorescentna rendgenska spektrometrija“, „Masena spektrometrija“ i „Bliska infracrvena spektrometrija“.
Potreba za uvođenjem OFS-a „Polimorfizam“ i „Kristalnost“ proizilazi iz važnosti procjene polimorfizma i stepena kristalnosti odnosno sadržaja amorfne frakcije u farmaceutskim supstancama, što naknadno određuje terapijski učinak lijekova i značajno utiče na parametre. njihove bioraspoloživosti.
Monografija Opće farmakopeje “Atomska emisiona spektrometrija i atomska apsorpciona spektrometrija” XII izdanja Državne farmakopeje (1. dio) podijeljena je na dvije monografije Opće farmakopeje: “Atomska emisiona spektrometrija” i “Atomska emisiona spektrometrija” i “Atomska apsorpciona spektrometrija”. Sljedeće izdanje Državnog fonda Ruske Federacije predstavit će revidiranu i proširenu verziju Opće farmakopejske monografije „Atomska emisiona spektrometrija“.
U novom izdanju monografije Opće farmakopeje „Fluorimetrija“ izmijenjen je tekst definicije metode u pravcu veće sažetosti i svestranosti, date su farmaceutske supstance za koje je ova metoda određivanja dostupna, opisani su izvori uzbudljivog zračenja, dat je koncept Stokesovog pomaka sa kratkim obrazloženjem uzroka ove pojave, grupe jedinjenja sa fluorescentnim svojstvima-
Dodali smo listu faktora koji utiču na intenzitet fluorescencije.
Državna farmakopeja po prvi put uključuje opće farmakopejske članke “Optička mikroskopija” i “Određivanje raspodjele veličine čestica difrakcijom laserskog svjetla”. Za razliku od mikroskopske metode, metoda za proučavanje dispergiranih sistema zasnovana na laserskom raspršenju svjetlosti omogućava procjenu svih čestica, nedestruktivna je i omogućava mjerenje veličina čestica u rasponu od 0,1 μm do 3 mm, za razliku od optičke mikroskopije. , koji se koristi za karakterizaciju čestica veličine od 1 mikrona ili više.
Dva odvojena članka posvećena su gubitku težine tokom sušenja i određivanju vode. Pored polumikrometode K. Fischera, opisana je i kulometrijska metoda (mikrometoda) koja omogućava kvantificiranje mikrokoličina vode u lijekovima.
U Monografiji Opće farmakopeje “Viskozitet” izmijenjena je definicija za nenjutnove tekućine i okarakterisani su uslovi za određivanje viskoziteta na rotacionom viskozimetru. Sljedeći pododjeljci su dodani kao novi: “Viskozimetri sa koncentričnim cilindrom (apsolutni viskozimetri)”, “Viskozimetri sa sistemom konus-ravni (apsolutni viskozimetri)” i “Viskozimetri sa vretenom (relativni viskozimetri)”.
Razvoj OFS “Električna provodljivost” uzrokovan je potrebom da se ovaj indikator kvaliteta i način njegovog određivanja uključi u FS “Prečišćena voda” i “Voda za injekcije”.
Alternativa ili dodatna metoda hromatografskog ispitivanja je metoda elektroforeze. Prilikom revizije monografije Opće farmakopeje „Elektroforeza“ posebna pažnja je posvećena opisu najraširenije metode u farmaceutskoj analizi elektroforeze proteina u poliakrilamidnom gelu sa natrijum dodecil sulfatom. U poređenju s tradicionalnom elektroforezom, uvođenje kapilarne elektroforeze omogućilo je automatsku kvantifikaciju ne samo velikih nabijenih molekula ili mikročestica, već i kationa, anjona i neutralnih spojeva.
Metoda elektroforeze u poliakrilamidnom gelu se široko koristi u odvajanju različitih proteina i procjeni njihove molekularne težine. Promjenom koncentracije poliakrilamida u gelu, možete kontrolirati raspon molekulskih težina izdvojenih proteina, što je vrlo pogodno za dobivanje preciznih rezultata. Frakcionisanje proteinskih molekula ovom metodom se široko koristi za kontrolu kvaliteta proteinskih lekova.
Po prvi put se u praksu domaće farmakopejske analize uvodi automatska elementarna analiza, koja omogućava značajno pojednostavljenje analize organskih spojeva koji sadrže dušik, sumpor, hlor, brom, kiseonik i druge elemente. Određivanje se zasniva na visokotemperaturnoj oksidativnoj razgradnji ispitivanih supstanci i naknadnom selektivnom određivanju produkata raspadanja koji odgovaraju ovim elementima pomoću plinske hromatografije. Jedna od prednosti automatske elementarne analize je mogućnost korištenja jednog standardnog uzorka sa poznatim sadržajem elementa koji se utvrđuje za procjenu kvaliteta različitih lijekova za ovaj element.
Određivanje adsorpcijske aktivnosti enterosorbenata je specifičan pokazatelj kvaliteta ove klase lijekova. Adsorpciona aktivnost se koristi za karakterizaciju apsorpcionog kapaciteta enterosorbenata, a metode za njegovo određivanje su prikazane u ovoj Monografiji Opće farmakopeje.
Članci koji opisuju biološke metode za kontrolu kvaliteta lijekova uključeni u XIII izdanje Državnog fonda Ruske Federacije odgovaraju savremenom pristupu biološkom ispitivanju. Monografija Opće farmakopeje “Bakterijski endotoksini” po prvi put uvodi opis fotometrijskih metoda za određivanje bakterijskih endotoksina: turbidimetrijskih i hromogenih.
Iz monografije Opće farmakopeje „Biološke metode za procjenu aktivnosti ljekovitih biljnih sirovina i ljekovitih preparata koji sadrže srčane glikozide“, prilikom njene revizije, isključena je metoda biološke procjene sadržaja srčanih glikozida koja je provedena na mačkama.
Monografija Opće farmakopeje „Mikrobiološka čistoća” značajno je poboljšana i dopunjena novim dijelovima, uključujući i one koji se odnose na zahtjeve za imunobiološke lijekove.
Revizija monografije Opšte farmakopeje „Utvrđivanje efikasnosti antimikrobnih konzervansa“ omogućila je da se u nju unesu odgovarajući dodaci i pojašnjenja u pogledu kategorija lijekova koji sadrže konzervanse i kriterija za ocjenu efikasnosti antimikrobnih konzervansa u lijekovima.
Revizija monografije Opće farmakopeje „Reagensi. Indikatori“ doveli su do značajnog povećanja liste reagensa i indikatora koji se koriste u farmakopejskoj analizi. Hemijski nazivi reagensa i indikatora dati su u skladu sa zahtjevima Međunarodne unije za čistu i primijenjenu hemiju (IUPAC). Navedeni su CAS (Chemical Abstracts Service) registarski brojevi hemijskih supstanci uključenih u registar Chemical Abstracts Service. Učinjena su pojašnjenja i dopune hemijskih formula i fizičkih parametara reagensa i indikatora.
Prilikom revizije Opće farmakopeje, “Statistička obrada rezultata hemijskih eksperimenata i bioloških ispitivanja” podijeljena je na dvije Opće farmakopeje: “Statistička obrada rezultata hemijskog eksperimenta” i “Statistička obrada rezultata određivanja specifične farmakološke aktivnosti droga biološkim metodama.”
Po prvi put, XIII izdanje Državnog fonda Ruske Federacije razvilo je i uključilo takve opće farmaceutske supstance kao što su „Oblici doziranja“, „Oblici doziranja za inhalacije“, „Transdermalni flasteri“, „Otopine“ i „Rezano prešane granule ”.
Monografija Opšte farmakopeje “Dozni oblici” sadrži osnovne pojmove i definicije, klasifikaciju doznih oblika, opšte zahtjeve za proizvodnju/proizvodnju, ocjenu kvaliteta, pakovanje, označavanje i skladištenje lijekova u odgovarajućim doznim oblicima. Ova monografija Opće farmakopeje sadrži pokazatelje kvaliteta koji su obavezni za ocjenu kvaliteta lijeka u bilo kojem obliku doze, kao i pokazatelje kvaliteta koji karakterišu karakteristike proizvodnje/proizvodnje lijeka i njegovih aktivnih i pomoćnih supstanci.
17 Monografija Opće farmakopeje za oblike doziranja uvedena je kako bi se zamijenili odgovarajući članci Državnog fonda SSSR-a, XI izdanje, sa dodacima i promjenama u njima.
Većina monografija Opće farmakopeje za metode za procjenu farmaceutskih i tehnoloških pokazatelja kvaliteta doznih oblika po prvi put je uključena u 13. izdanje Državne farmakopeje Ruske Federacije. Razvijeni su zasebni OFS za metode analize prethodno opisane u člancima Državne farmakopeje XI za dozne oblike (metode za određivanje ekstrahiranog volumena doznih oblika za parenteralnu upotrebu, abrazija tableta, vrijeme potpune deformacije čepića na bazi lipofila, dezintegracija tablete i kapsule).
Po prvi put razvijen i uključen u Državni fond Ruske Federacije u XIII izdanju Opće monografije farmakopeje za takve metode za određivanje farmaceutskih i tehnoloških pokazatelja kvalitete doznih oblika kao što su „Vidljive mehaničke inkluzije u oblicima doziranja za parenteralnu i oftalmologiju oblici doziranja”, „Nevidljive mehaničke inkluzije u doznim oblicima za parenteralnu upotrebu”, „Masa (zapremina) sadržaja pakovanja”, „Ujednačenost doziranja”, „Ujednačenost mase doznih oblika”, „Snaga na drobljenje tablete”, “Raspad supozitorija i vaginalnih tableta”, “Rastapanje za lipofilne supozitorije”, “Stepen tečljivosti praškova”, “Rastapanje za transdermalne flastere”.
Pododjeljak “Sirovine ljekovitog bilja i metode njihove analize” obuhvata 23 Opšte farmakopeje i 55 FS. Zahtjevi za uzorkovanje, skladištenje, pakovanje, označavanje i transport ljekovitih biljnih sirovina i ljekovitih biljnih preparata prikazani su u pododjeljku „Opći članci“ u Monografiji Opće farmakopeje „Uzorkovanje ljekovitih biljnih sirovina i ljekovitih biljnih preparata“, Monografija Opće farmakopeje “Skladištenje ljekovitih biljnih sirovina i ljekovitih biljnih preparata” i Monografija Opće farmakopeje “Pakovanje, označavanje i transport ljekovitih biljnih sirovina i ljekovitih biljnih preparata”.
Opći zahtjevi za ljekovite biljne sirovine navedeni su u Monografiji Opće farmakopeje “Sirovine ljekovitog bilja”. 12 OFS je posvećeno metodama analize ljekovitog biljnog materijala i ljekovitih biljnih preparata. 8 Monografije Opšte farmakopeje opisuju zahtjeve za metode analize ljekovitog biljnog materijala u zavisnosti od morfoloških grupa: cvjetovi, plodovi, sjemenke, pupoljci, bilje, listovi, kora i podzemni organi. U ovom odeljku su predstavljene i 2 monografije Opšte farmakopeje za lekove biljnog porekla: Monografija Opšte farmakopeje „Bilna masna ulja“ i „Eterična ulja“.
Monografija Opće farmakopeje "Sirovine ljekovitog bilja" razvijena je i prvi put uključena u Državni fond Ruske Federacije. Ovaj članak daje klasifikaciju ljekovitih biljnih sirovina u zavisnosti od morfoloških grupa, mljevenja, sadržaja jedne ili druge grupe biološki aktivnih supstanci, daje glavne pokazatelje kvaliteta ljekovitih biljnih sirovina i opći zahtjevi za skladištenje i pakovanje.
Od 12 monografija Opće farmakopeje za metode analize ljekovitih biljnih sirovina, 3 monografije Opće farmakopeje su po prvi put uključene u Državni fond Ruske Federacije u XIII izdanju, 9 monografija Opće farmakopeje je revidirano i uvedeno umjesto članci Državnog fonda SSSR-a u XI izdanju. Prvi put uključena u praksu domaće farmakopejske analize: Opća farmakopejska monografija „Određivanje sadržaja teških metala i arsena u ljekovitim biljnim sirovinama i ljekovitom bilju”
ljekoviti preparati", Monografija Opće farmakopeje "Određivanje sadržaja rezidualnih pesticida u ljekovitim biljnim sirovinama i ljekovitim biljnim preparatima", Monografija Opće farmakopeje "Određivanje koeficijenta upijanja vode i koeficijenta potrošnje ljekovitih biljnih sirovina".
XIII izdanje Državnog fonda Ruske Federacije uključuje nove vrste ljekovitih biljnih sirovina odobrenih za medicinsku upotrebu, kao što su suhi plodovi aronije, listovi ginkgo bilobe, trava slatke djeteline i pupoljci topole. Struktura farmakopejskih monografija za ljekovite biljne sirovine usklađena je sa zahtjevima svjetskih farmakopejskih standarda za ljekovite biljne sirovine.
Pododjeljak „Grupe imunobioloških lijekova i metode njihove analize” obuhvata 43 monografije Opće farmakopeje i 48 FS za imunobiološke lijekove.
IMP uključuju vakcine, toksoide, serume i alergene.
Po prvi put, praksa domaće farmakopejske analize uvela je OFS za pojedine grupe ILP-a, kao što su „Liječenje i profilaktički bakteriofagi“, „Pro-biotici“, „Probiotici koji sadrže bifid“, „Probiotici koji sadrže Colax“, „Laktoza -sadrže probiotike”, „Probiotici koji sadrže spore” i „Lijekovi dobiveni metodama rekombinantne DNK”.
Od 48 FS za IMP uključenih u XIII izdanje Državnog fonda Ruske Federacije, 5 FS je po prvi put razvijeno u praksi domaće farmakopejske analize: „Vakcina protiv dizenterije protiv lipopolisaharida Shigella Sonne“, „Živa kultivisana vakcina protiv rubeole “, “Inaktivirana vakcina protiv velikih boginja”, “Imunoglobulin protiv velikih boginja” FS “Pyrogenal, rektalne supozitorije” razvijen je po prvi put u praksi domaće i svjetske farmaceutske analize.
Lijekovi iz krvi i krvne plazme ljudi i životinja zastupljeni su sa 13 OFS i 8 FS.
Lijekovi iz ljudske krvi i krvne plazme uključuju preparate humanog albumina
ka, preparati humanog imunoglobulina i preparati faktora zgrušavanja krvi koji sadrže jedan od faktora koagulacije krvi ili njihovu kombinaciju.
12 Monografije Opće farmakopeje za lijekove iz ljudske i životinjske krvi i krvne plazme prvi put su predstavljene u XIII izdanju Državne farmakopeje Ruske Federacije.
Farmakopejske monografije za farmaceutske supstance sintetičkog i mineralnog porekla sadrže hemijske nazive lekovitih supstanci u skladu sa zahtevima Međunarodne unije za čistu i primenjenu hemiju (IUP), pokazatelje kvaliteta, njihove standardizovane vrednosti i odgovarajuće metode za analizu ovih pokazatelja. .
Metoda infracrvene spektrometrije, koja daje najpouzdaniji rezultat, smatra se glavnom metodom identifikacije. Za niz supstanci, 13. izdanje Dodatka Državnom fondu Ruske Federacije sadrži crteže IR spektra standardnih uzoraka ovih farmaceutskih supstanci.
Za kvantitativno određivanje prednost se daje klasičnim titrimetrijskim metodama analize. Uz to, široko se koriste savremene metode fizičke i hemijske analize, kao što su spektroskopija u ultraljubičastom području, gasna i tečna hromatografija visokih performansi, koje podrazumevaju upotrebu standardnih uzoraka. Sadržaj aktivne tvari je dat u suhim (ako se utvrđuje gubitak težine pri sušenju), bezvodnim (ako je određena voda) ili bezvodnim tvarima koje ne sadrže zaostale organske rastvarače.
Dakle, stupanje na snagu Opće farmakopejske monografije i FS pripremljenog za sljedeće, XIII izdanje Državnog fonda Ruske Federacije ne samo da će poništiti ili zamijeniti zastarjele članke Državnog fonda Ruske Federacije prethodnih izdanja, već takođe će obezbijediti da nivo domaće farmakopejske analize bude u skladu sa zahtjevima svjetskih standarda.
književnost
1. Državna farmakopeja SSSR-a. 10th ed. M.: Medicina; 1968.
2. Državna farmakopeja SSSR-a. 11th ed. Vol. 1. M.: Medicina; 1987.
3. Državna farmakopeja SSSR-a. 11th ed. Vol. 2. M.: Medicina; 1989.
4. Državna farmakopeja Ruske Federacije. 12th ed. Dio 1. M.: Naučni centar za ekspertizu medicinskih proizvoda; 2007.
Federalna državna budžetska ustanova "Naučni centar za ekspertizu medicinskih proizvoda" Ministarstva zdravlja Ruske Federacije. Ruska Federacija, 127051, Moskva, Petrovski bulevar, 8.
Merkulov Vadim Anatolijevič. Prvi zamjenik generalnog direktora, dr. med. nauke, profesor.
Sakanyan Elena Ivanovna. Direktor Centra za farmakopeju i međunarodnu saradnju, dr. Pharm. nauke, profesor.
Shemeryankina Tatyana Borisovna. Šef Odjela za državnu farmakopeju i farmakopejsku analizu, dr. sc. pharm. Sci. Mochikina Olga Aleksejevna. Istraživač na Odsjeku za državnu farmakopeju i farmakopejsku analizu.
Bunyatyan Natalya Dmitrievna. Zamjenik generalnog direktora za istraživanje, dr. Pharm. nauke, profesor.
1. Državna farmakopeja SSSR-a. 10th ed. Moskva: Medicina; 1968 (na ruskom).
2. Državna farmakopeja SSSR-a. 11th ed. V. 1. Moskva: Medicina; 1987 (na ruskom).
3. Državna farmakopeja SSSR-a. 11th ed. V. 2. Moskva: Medicina; 1989 (na ruskom).
4. Državna farmakopeja Ruske Federacije. 12 th ed. V. 1. Moskva: Federalna državna budžetska ustanova „Naučni centar za stručno ocjenjivanje lijekova” Ministarstva zdravlja Ruske Federacije; 2007 (na ruskom).
Federalna državna budžetska ustanova "Naučni centar za stručno ocjenjivanje lijekova" Ministarstva zdravlja Ruske Federacije, Petrovski bulevar 8, Moskva, 127051, Ruska Federacija.
Merkulov V.A. Prvi zamjenik generalnog direktora. Doktor medicinskih nauka, prof. Sakanyan EI. Direktor Centra za farmakopeju i međunarodnu saradnju. Doktor farmaceutskih nauka, prof.
Shemeryankina TB. Šef Odjela za državnu farmakopeju i analizu farmakopeje. Kandidat farmaceutskih nauka.
Mochikina O.A. Istraživač Odjela za državnu farmakopeju i farmakopejske analize.
Bunyatyan ND. Zamjenik generalnog direktora za naučni rad. Doktor farmaceutskih nauka, prof.
MINISTARSTVO ZDRAVLJA RUJSKE FEDERACIJE
FARMAKOPEJSKI ČLANAK
GinsengprisutankorijenjeFS.2.5.0013.15
Panacis ginseng radices U zamjenu za Globalni fondXI, vol. 2, čl. 66
Sakupljeno krajem avgusta - početkom septembra i osušeno korenje divlje i kultivisane višegodišnje zeljaste biljke pravog ginsenga - Panax ginseng C. A. Mey, sem. Araliaceae – Araliaceae.
AUTENTIČNOST
Vanjski znakovi. Cijele sirovine. Korijenje do 25 cm dugo, debljine 0,7-2,5 cm, sa 2-5 velikih grana, rjeđe bez njih. Korijenje je ukorijenjeno, uzdužno, rjeđe spiralno naborano, lomljivo, s ravnomjernim lomom. “Tijelo” korijena je zadebljano, gotovo cilindrično, sa jasno izraženim prstenastim zadebljanjima na vrhu. U gornjem dijelu korijena nalazi se suženi poprečno naborani rizom - "vrat". Rizom je kratak s nekoliko ožiljaka od otpalih stabljika; na vrhu formira „glavu“, koja je prošireni ostatak stabljike i apikalni pupoljak (ponekad 2–3). Jedan ili više adventivnih korijena ponekad se protežu od "vrata". "Vrat" i "glava" možda nedostaju. Boja korijena na površini i na rezu je žućkastobijela, na svježem lomu je bijela. Miris je specifičan. Okus vodenog ekstrakta je sladak, opor, zatim ljuto-gorak.
Drobljene sirovine. Prilikom pregleda usitnjenih sirovina pod lupom (10×) ili stereomikroskopom (16×), vidljivi su komadi korijena različitih oblika koji prolaze kroz sito sa rupama od 7 mm. Boja na površini i na lomu je žućkasto-bijela. Miris je specifičan. Okus vodenog ekstrakta je sladak, opor, zatim ljuto-gorak.
Puder. Prilikom pregleda praha pod lupom (10×) ili stereomikroskopom (16×), vidljiva je mješavina zdrobljenih čestica korijena različitih oblika žućkasto-bijele boje koje prolaze kroz sito s rupama od 2 mm. Miris je specifičan. Okus vodenog ekstrakta je sladak, opor, zatim ljuto-gorak.
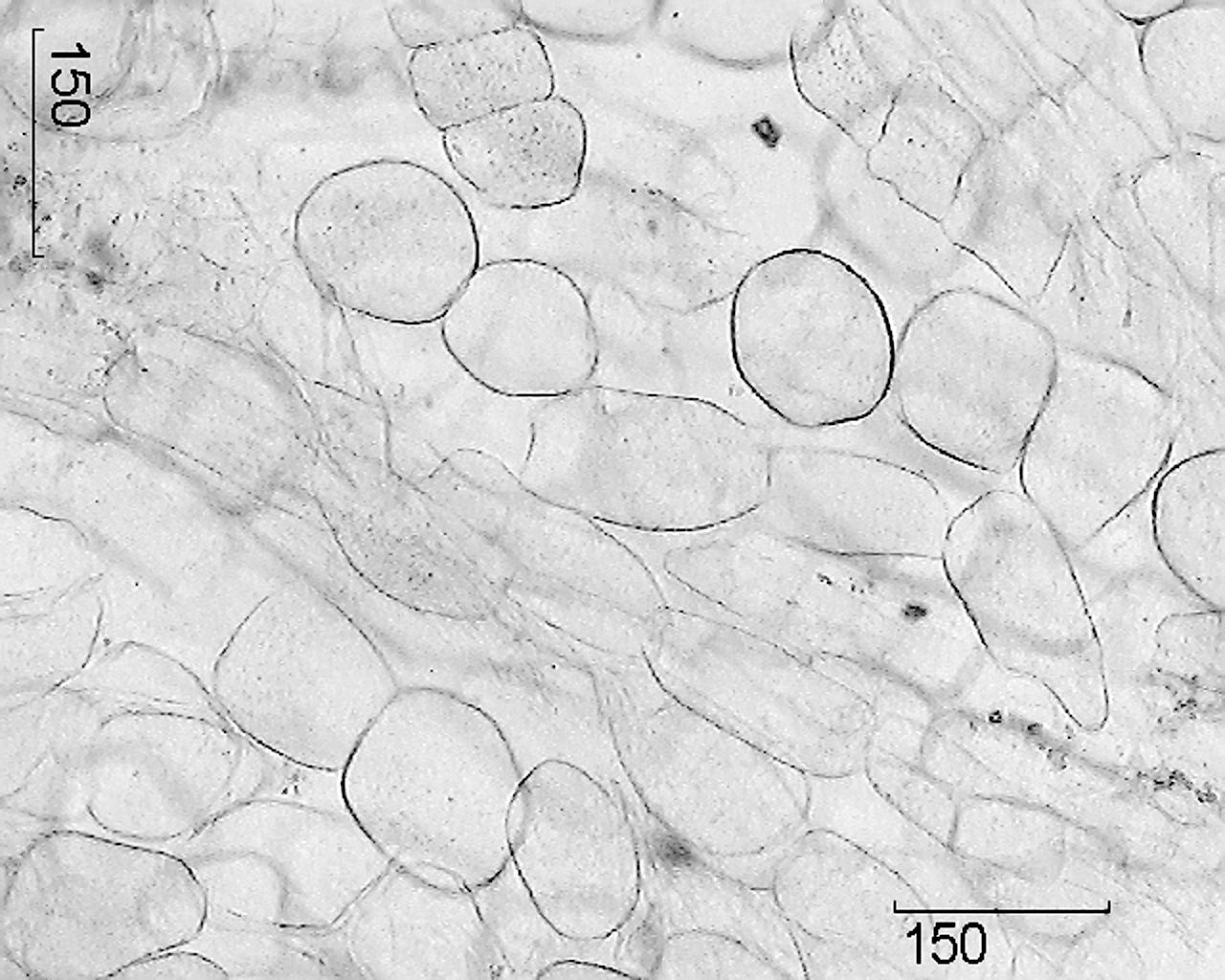
Mikroskopski znaci. Cijele sirovine. Poprečni presjek glavnog korijena otkriva uski sloj svijetlosmeđeg čepa, široku koru, jasnu liniju kambija i drvo.
Glavni korijen je prekriven peridermom, čije su stanice tankih stijenki i lignificirane, nesuberizirane. Floem i ksilem su odvojeni kambijalnom zonom, koja se proteže otprilike kroz sredinu polumjera korijena i
ponekad se ne vidi. Do periferije se od primarnog ksilema protežu krupnoćelijski primarni radijalni zraci tkiva parenhima, između kojih se nalazi sekundarni ksilem, ispresijecan brojnim sekundarnim radijalnim zracima glavnog parenhima. Ksilem se sastoji od ćelija parenhima tankih stijenki koje sadrže škrobna zrna. Žile medularnih zraka imaju zadebljane, lignificirane stijenke i nalaze se pojedinačno ili skupljene u grupama od 3-6. Ćelije koje sadrže žute pigmente povremeno se nalaze u drvenom parenhimu. U središtu korijena nalaze se nejasno prepoznatljivi ostaci primarnog ksilema u obliku 2 zraka. Floem se sastoji uglavnom od sitnoćelijskih elemenata, sadrži jasno vidljive šizogene posude koje sadrže kapljice sekreta od svijetložute do crveno-smeđe. Zrna škroba su mala, okrugla, jednostavna. Pojedinačne ćelije parenhima sadrže druze kalcijum oksalata. Vanjski dio sekundarnog korteksa omeđen je zonom od nekoliko (4-6) redova velikih tangencijalno izduženih parenhimskih stanica feloderma, okruglog ili ovalnog oblika, sa blago zadebljanom ljuskom.
|
|
||
|
|
|
|
|
|
|
|
Slika – Pravi korijeni ginsenga.
1 – fragment poprečnog presjeka glavnog korijena (100×); 2 – fragment plute (400×); 3 – fragment poprečnog presjeka adventivnog korijena: a – ksilemske posude, b – škrobna zrna (400×); 4 – fragment poprečnog presjeka glavnog korijena sa sekretornim kanalom: a – ćelije obloge kanala, b – šupljina kanala (400×); 5 – fragment parenhima medularnih zraka: a – drusen kalcijum oksalata, b – škrobna zrna (400×); 6 – ćelije parenhima medularnog zraka (100×).
Na poprečnom presjeku adventivnog korijena, u sredini, zraka žila primarnog ksilema je ostatak diarhičnog vaskularnog snopa u primarnoj strukturi. Dva sektora sekundarnog ksilema odvojena su radijalnim zracima glavnog parenhima. Stanice parenhima su okrugle ili ovalne, djelomično ili potpuno ispunjene škrobnim zrncima. Pluta se sastoji od 5-7 slojeva pravougaonih ćelija tankih stijenki, slabo lignificiranih.
Drobljene sirovine. Prilikom pregleda presovanog uzorka treba da budu vidljivi fragmenti poprečnih i uzdužnih presjeka glavnog i pomoćnog korijena.
Fragmenti glavnog korijena predstavljeni su ksilemskim zrakama i žilama, koji ispunjavaju ćelije parenhima medularnih zraka škrobnim zrncima, šupljine kanala i stanica sluznice, ćelije parenhima s pigmentima i ćelije kambija.
Fragmenti adventivnog korijena predstavljeni su čepnim ćelijama, parenhimom sa škrobnim zrncima, posudama, primarnim i sekundarnim korteksom, žilama, medularnim zracima.
Puder. Prilikom pregleda mikroslajda vidljivi su fragmenti epiderme, plute, drveta, parenhima, kao i druze kalcijum oksalata.
Određivanje glavnih grupa biološki aktivnih supstanci
Tankoslojna hromatografija
Na početnu liniju analitičke hromatografske ploče sa slojem silika gela sa fluorescentnim indikatorom dimenzija 10 × 15 cm na aluminijumsku podlogu, nanijeti 20 μl ispitnog rastvora (pogledati odeljak „Kvantitativno određivanje“, priprema rastvora A test rastvor) i 50 μl standardnog rastvora uzorka (SS) panaksozida Rg 1 (videti odeljak „Kvantitativno određivanje“ priprema rastvora A CO panaksozida Rg 1). Ploča sa nanesenim uzorcima se suši na vazduhu, stavlja u komoru, prethodno zasićenu najmanje 2 sata smešom rastvarača hloroform - metanol - voda (26:14:3), i hromatografiše uzlaznom metodom. Kada front rastvarača prođe oko 80-90% dužine ploče od startne linije, uklanja se iz komore, suši dok se ne uklone tragovi rastvarača, tretira se fosfovolframnom kiselinom sa 20% rastvorom alkohola i zagreva u peći na 100–105 °C 3 minute, nakon čega se gleda na dnevnom svjetlu.
Kromatogram ispitne otopine treba pokazati najmanje 6 adsorpcionih zona od svijetlo ružičaste do tamno ružičaste; dominantna zona je na nivou zone u hromatogramu CO rastvora panaksozida Rg 1 ; detekcija drugih adsorpcionih zona je dozvoljena.
Kada se kap koncentrirane sumporne kiseline nanese na prah korijena ginsenga nakon 1-2 minute, pojavljuje se cigla-crvena boja koja prelazi u crveno-ljubičastu, a zatim ljubičastu (panaksozidi).
Testovi
Vlažnost. Cijele sirovine drobljene sirovine, puder – ne više od 13%.
Obični pepeo. Cijele sirovine drobljene sirovine, puder – ne više od 5%.
Pepeo, nerastvorljiv u hlorovodoničkoj kiselini. Cijele sirovine drobljene sirovine, puder – ne više od 2%.
Mljevenje sirovina.Cijele sirovine:čestice koje prolaze kroz sito sa rupama od 3 mm - ne više od 5%. Drobljene sirovine:čestice koje ne prolaze kroz sito s rupama od 7 mm - ne više od 5%; čestice koje prolaze kroz sito sa rupama od 0,5 mm - ne više od 5%. puder:čestice koje ne prolaze kroz sito s rupama od 2 mm - ne više od 5%; čestice koje prolaze kroz sito sa rupama od 0,18 mm - ne više od 5%.
Strana materija
Korijeni su potamnjeli s površine . Cijele sirovine drobljene sirovine – ne više od 3%.
Organska nečistoća. Cijele sirovine drobljene sirovine – ne više od 0,5%.
Mineralna nečistoća . Cijele sirovine, drobljene sirovine, puder – ne više od 1%.
Teški metali. U skladu sa zahtjevima Monografije Opće farmakopeje “Određivanje sadržaja teških metala i arsena u ljekovitom biljnom materijalu i ljekovitim biljnim preparatima.”
Radionuklidi. U skladu sa zahtjevima monografije Opće farmakopeje “Određivanje sadržaja radionuklida u ljekovitom biljnom materijalu i ljekovitim biljnim preparatima.”
Ostaci pesticida. U skladu sa zahtjevima Monografije Opće farmakopeje “Određivanje sadržaja rezidualnih pesticida u ljekovitom biljnom materijalu i ljekovitim biljnim preparatima.”
Mikrobiološka čistoća. U skladu sa zahtjevima Monografije Opće farmakopeje “Mikrobiološka čistoća”.
kvantitacija. Cijele sirovine drobljene sirovine, prah: količina panaksozida u odnosu na panaksozid Rg 1 - ne manje od 2%; ekstraktivne supstance ekstrahovane sa 70% alkohola - najmanje 20%.
(“Državna farmakopeja Ruske Federacije. XIII izdanje. Tom I”)
Ovaj opšti farmakopejski član utvrđuje opšte uslove za skladištenje farmaceutskih supstanci, pomoćnih supstanci i lekova i primenjuje se na sve organizacije u kojima se odvija skladištenje lekova, uzimajući u obzir vrstu delatnosti organizacije.
Skladištenje ljekovitih biljnih sirovina i ljekovitih biljnih preparata vrši se u skladu sa Monografijom Opće farmakopeje „Skladištenje ljekovitih biljnih sirovina i ljekovitih biljnih preparata“.
Skladištenje- postupak čuvanja lijekova do upotrebe u utvrđenom roku trajanja, koji je sastavni dio prometa lijekova.
Opšti zahtjevi za skladišne objekte
lijekove i organizaciju njihovog skladištenja
Skladištenje lijekova mora se vršiti u prostorijama namijenjenim za ove namjene. Dizajn, sastav, dimenzije skladišnih prostora, njihov rad i oprema moraju osigurati odgovarajuće uslove skladištenja za različite grupe lijekova.
Kompleks skladišnih objekata treba da uključuje:
- prijemna prostorija (prostor) namijenjena za raspakivanje i prijem paketa lijekova i njihov preliminarni pregled;
- prostorija (zona) za uzorkovanje medicinskih proizvoda u skladu sa zahtevima Monografije Opšte farmakopeje “Uzorkovanje”;
- prostorija (zona) za karantensko skladištenje lijekova;
- prostori za lijekove koji zahtijevaju posebne uslove skladištenja;
- prostorija (prostor) za skladištenje odbijenih, vraćenih, opozvanih i/ili lijekova kojima je istekao rok trajanja Navedeni lijekovi i mjesta za njihovo skladištenje moraju biti jasno označeni.
Skladišni prostor je raspoređen u zajedničku ostavu u nedostatku posebne izolirane prostorije.
Završna obrada prostorija za skladištenje lijekova mora ispunjavati važeće sanitarno-higijenske zahtjeve, unutrašnje površine zidova i plafona moraju biti glatke, omogućavajući mokro čišćenje.
U svakoj skladišnoj prostoriji potrebno je održavati klimatske uslove, poštujući temperaturu i vlažnost utvrđenu farmakopejskom monografijom ili regulatornom dokumentacijom za lijekove.
Potrebna izmjena zraka u skladišnim prostorijama se stvara pomoću klima uređaja, dovodne i odsisne ventilacije ili druge opreme. Prirodna i umjetna rasvjeta u skladišnim prostorijama mora osigurati tačnu i sigurnu provedbu svih operacija koje se izvode u prostoriji. Po potrebi treba obezbijediti zaštitu lijekova od sunčevog zračenja.
Prostorije za skladištenje lijekova moraju biti opremljene potrebnim brojem propisno ovjerenih mjernih instrumenata (termometara, higrometara, psihrometara i dr.) za praćenje i snimanje temperature i vlažnosti, koje se vrši najmanje jednom dnevno.
Mjerni instrumenti se postavljaju na udaljenosti od najmanje 3 metra od vrata, prozora i uređaja za grijanje na mjestu dostupnom za očitavanje očitavanja, na visini od 1,5-1,7 metara od poda. Istovremeno, preporučuje se postavljanje na mjestima gdje postoji najveća vjerovatnoća fluktuacija temperature i vlažnosti ili se najčešće uočavaju odstupanja od traženih parametara.
Evidencija o registraciji mora pokazati temperaturne i vlažne uslove utvrđene za prostorije i, ako nisu u skladu, korektivne radnje.
Skladišni prostori moraju biti opremljeni dovoljnim brojem ormara, sefova, regala, skladišnih jedinica i paleta. Oprema mora biti u dobrom stanju i čista.
Police, ormari i druga oprema moraju biti postavljeni tako da se osigura pristup lijekovima, slobodan prolaz osoblja i, po potrebi, pristupačnost utovara i istovara, kao i pristupačnost opremi, zidovima i podovima prostorije. za čišćenje.
U prostorijama za skladištenje lijekova moraju se održavati odgovarajući sanitarni uslovi. Učestalost i metode čišćenja prostorija moraju biti u skladu sa zahtjevima regulatornih dokumenata. Sredstva za sanitarnu dezinfekciju koja se koriste moraju biti bezbedna; rizik od kontaminacije uskladištenih lekova ovim proizvodima mora biti eliminisan.
Potrebno je izraditi posebne upute za čišćenje prosutih ili rasutih lijekova kako bi se osigurala potpuna eliminacija i spriječila kontaminacija drugih lijekova.
Prilikom obavljanja poslova u prostorijama za skladištenje lijekova, zaposleni moraju nositi posebnu odjeću i obuću i pridržavati se pravila lične higijene.
U skladišne prostorije, lijekovi se stavljaju u skladu s uvjetima skladištenja navedenim u farmakopejskoj monografiji ili regulatornoj dokumentaciji za lijekove, uzimajući u obzir njihova fizičko-hemijska i štetna svojstva, farmakološka i toksikološka dejstva, vrstu doznog oblika lijeka i način njegove upotrebe, agregatno stanje lijeka. Prilikom upotrebe računarske tehnologije dozvoljeno je postavljanje lijekova po abecednom redu, po šiframa.
Stalci, ormarići i police namijenjeni za odlaganje lijekova moraju biti označeni. Takođe je neophodno identifikovati uskladištene lekove pomoću regal kartice, ili, kada se koristi kompjuterska tehnologija, korišćenjem kodova i elektronskih uređaja.
Kada se istovar i utovar izvode ručno, visina slaganja lijekova ne smije biti veća od 1,5 metara. Prilikom upotrebe mehanizovanih uređaja tokom operacija istovara i utovara, lekove treba skladištiti u nekoliko slojeva. Istovremeno, ukupna visina postavljanja lijekova na police ne bi trebala prelaziti mogućnosti mehanizama za utovar i istovar.
Lijekovi u skladišnim prostorijama moraju biti smješteni u ormare, police, police, palete i sl. Nije dozvoljeno postavljanje lijekova na pod bez palete.
Palete se mogu postaviti na pod u jednom redu ili na regale u više nivoa, u zavisnosti od visine regala. Nije dozvoljeno postavljanje paleta sa lekovima u više redova po visini bez upotrebe regala.
Prilikom stvaranja uslova skladištenja određenog lijeka potrebno je voditi se zahtjevima navedenim u farmakopejskoj monografiji ili regulatornoj dokumentaciji za ovaj lijek, koje utvrđuje proizvođač (proizvođač) lijeka na osnovu rezultata stabilnosti. studija u skladu sa Monografijom Opće farmakopeje “Rok trajanja lijekova”.
Lijekovi se čuvaju u ambalaži (potrošačkoj, grupnoj) koja ispunjava zahtjeve regulatorne dokumentacije za ovaj lijek.
Lijekovi se čuvaju na relativnoj vlažnosti zraka ne većoj od 60%+/-5% u zavisnosti od relevantne klimatske zone (I, II, III, IVA, IVB), osim ako su posebni uslovi skladištenja propisani regulatornom dokumentacijom.
Lijekove treba čuvati kako bi se spriječila kontaminacija, miješanje i unakrsna kontaminacija. Neophodno je izbjegavati strane mirise u skladišnim prostorima.
U organizaciji mora biti implementiran sistem evidentiranja lijekova sa ograničenim rokom trajanja. Ako se u skladištu nalazi nekoliko serija istog naziva lijeka, tada treba prvo uzeti za upotrebu lijek čiji rok trajanja ističe ranije od ostalih.
Odbačeni lekovi moraju biti identifikovani i uskladišteni u odgovarajućoj prostoriji (prostoru) pod uslovima koji ne dozvoljavaju njihovu neovlašćenu upotrebu.
Karakteristike skladištenja određenih grupa lijekova
Lijekove opasnih svojstava (zapaljivi, eksplozivni, radiofarmaceutski, kaustični, korozivni, komprimirani i tečni plinovi itd.) treba čuvati u posebno dizajniranim prostorijama opremljenim dodatnom sigurnosnom i sigurnosnom opremom.
Prilikom skladištenja potrebno je osigurati bezbjednost i deklarisani kvalitet lijekova, spriječiti mogućnost da lijekovi ispolje svoja opasna svojstva i stvoriti bezbedne uslove za rad zaposlenih sa takvim lekovima.
Prilikom uređenja prostorija i organiziranja skladištenja opasnih lijekova potrebno je voditi se zahtjevima saveznih zakona i regulatornih pravnih akata Ruske Federacije.
Skladištenje opojnih i psihotropnih lijekova mora se vršiti u skladu sa saveznim zakonima i propisima Ruske Federacije.
Prilikom skladištenja lijekova koji zahtijevaju zaštitu od uticaja faktora okoline (svjetlo, temperatura, atmosferski sastav zraka i sl.), potrebno je osigurati režim skladištenja naveden u farmakopejskoj monografiji ili regulatornoj dokumentaciji. Odstupanja od propisanih uslova dozvoljena su jednom samo na kraći period (ne duže od 24 sata), osim ako posebni uslovi, na primer, trajno skladištenje na hladnom mestu, nisu posebno navedeni.
Lijekovi koji pod utjecajem svjetlosne energije mogu promijeniti svoja svojstva (oksidirati, reducirati, razgraditi, promijeniti boju itd.) foto- ili svjetlosno osjetljivi; lijekovi koji su otporni na svjetlost su fotostabilni. Utjecaj svjetlosne energije može se manifestirati u izlaganju direktnoj sunčevoj svjetlosti, raspršenoj svjetlosti u vidljivom dijelu svjetlosnog spektra i zračenju u ultraljubičastom području.
Označavanje fotoosjetljivih lijekova obično sadrži instrukciju: „Čuvajte na mjestu zaštićenom od svjetlosti“. Lijekove koji zahtijevaju zaštitu od svjetlosti treba čuvati u prostorijama ili posebno opremljenim prostorima koji pružaju zaštitu od prirodnog i umjetnog svjetla.
Farmaceutske tvari koje zahtijevaju zaštitu od svjetlosti treba čuvati ili u ambalaži napravljenoj od materijala za zaštitu od svjetlosti ili u mračnoj prostoriji ili ormariću. Ako se staklene posude za lijekove koriste za pakovanje farmaceutskih supstanci koje su posebno osjetljive na svjetlost, posuda mora biti pokrivena crnim svjetlootpornim papirom.
Fotoosetljivi lekovi treba da budu upakovani u sekundarnu (potrošačku) ambalažu koja štiti svetlost i/ili da se čuvaju na mestu zaštićenom od svetlosti.
Lijekovi koji u kontaktu s vodom, vlagom mogu oslobađati plinove itd., osjetljivi su na vlagu. Označavanje lijekova osjetljivih na vlagu obično sadrži uputu: „Čuvati na suhom mjestu“.
Prilikom skladištenja takvih lijekova potrebno je osigurati da relativna vlažnost ne prelazi 50% na sobnoj temperaturi (u normalnim uslovima skladištenja) ili ekvivalentni pritisak pare na drugoj temperaturi. Ispunjavanjem zahtjeva obezbjeđuje se i skladištenje lijeka osjetljivog na vlagu u nepropusnoj (vodootpornoj) potrošačkoj ambalaži koja obezbjeđuje propisanu zaštitu i poštovanje uslova skladištenja tokom prometa lijeka.
Za održavanje niskog sadržaja vlage tokom skladištenja lijekova u propisanim slučajevima koriste se sredstva za sušenje, pod uslovom da se izbjegne njihov direktan kontakt sa lijekom.
Lijekovi sa higroskopnim svojstvima moraju se skladištiti na relativnoj vlažnosti ne većoj od 50% u ambalaži, koja je staklena posuda za lijekove, hermetički zatvorena, ili u ambalaži s dodatnom zaštitom, na primjer, u plastičnoj foliji, u skladu sa zahtjeve farmakopejske monografije ili regulatorne dokumentacije.
Neke grupe lijekova mijenjaju svoja svojstva pod utjecajem atmosferskih plinova, poput kisika ili ugljičnog dioksida. Kako bi se osigurala zaštita lijekova od djelovanja plinova, preporučuje se čuvanje lijekova u hermetički zatvorenoj ambalaži od materijala nepropusnih za plinove. Ako je moguće, ambalažu treba napuniti do vrha i dobro zatvoriti.
Lijekovi koji su zapravo hlapljivi lijekovi ili lijekovi koji sadrže hlapljiv rastvarač; otopine i mješavine isparljivih tvari; Lijekovi koji se raspadaju sa stvaranjem isparljivih proizvoda zahtijevaju uvjete skladištenja koji ih štite od isparavanja i isušivanja. Preporučljivo je čuvati lijekove na hladnom mjestu, u hermetički zatvorenoj ambalaži od materijala nepropusnih za isparljive tvari, ili u primarnoj i sekundarnoj (potrošačkoj) ambalaži u skladu sa zahtjevima navedenim u farmakopejskoj monografiji ili regulatornoj dokumentaciji.
Lijekovi, koji su farmaceutske tvari koje sadrže vodu kristalizacije (kristal hidrati), pokazuju svojstva higroskopnih tvari. Preporučuje se skladištenje kristalnih hidrata u hermetički zatvorenoj ambalaži u skladu sa zahtjevima navedenim u farmakopejskoj monografiji ili regulatornoj dokumentaciji. U pravilu se kristalni hidrati čuvaju na temperaturama od 8 do 15°C i relativnoj vlažnosti zraka ne većoj od 60%.
Lijekovi koji mijenjaju svojstva pod utjecajem temperature okoline su termoosjetljivi. Lijekovi mogu promijeniti svoja svojstva kada su izloženi sobnoj temperaturi ili višoj (ljekovi otporni na toplinu) ili kada su izloženi niskim temperaturama, uključujući smrzavanje.
Prilikom skladištenja lijekova osjetljivih na toplinu potrebno je osigurati temperaturni režim reguliran zahtjevima farmakopejske monografije ili regulatorne dokumentacije naznačene na primarnom i/ili sekundarnom (potrošačkom) pakovanju lijeka.
Toplotno labilne lijekove treba čuvati u posebno opremljenim prostorijama (hladnjacima) ili u skladištima opremljenim dovoljnim brojem rashladnih vitrina i frižidera. Za skladištenje termolabilnih lijekova treba koristiti farmaceutske hladnjake ili frižidere za krv i krvne proizvode.
Odgovarajući kvalitet imunobioloških lijekova, sigurnost i djelotvornost njihove upotrebe osigurava sistem „hladnog lanca“, koji se mora implementirati na sva četiri nivoa.
Rezolucija Glavnog državnog sanitarnog doktora Ruske Federacije br. 15 od 10. aprila 2002. „O implementaciji sanitarnih i epidemioloških pravila SP 3.3.2.1120-02″
Frižideri (komorice, ormarići) moraju biti podešeni na temperaturu koja odgovara temperaturnim uslovima za čuvanje lijekova koji se u njima nalaze. Imunobiološke lijekove treba čuvati na temperaturi koja ne prelazi 8 °C. Svako pakovanje imunobiološkog leka u frižideru mora imati pristup ohlađenom vazduhu. Imunobiološke lekove ne treba čuvati zajedno u frižideru sa drugim lekovima.
Za praćenje temperaturnih uslova skladištenja termolabilnih lekova, svi frižideri (komore, ormari) moraju biti opremljeni termometrima. Kontinuirano praćenje temperaturnog režima provodi se pomoću termografa i temperaturnih registratora, čija se očitanja bilježe najmanje dva puta dnevno.
Temperaturni režim na policama frižidera je drugačiji: temperatura je niža u blizini pregrade za zamrzavanje, viša u blizini panela vrata koja se otvaraju.
Obezbeđivanje hladnog mesta podrazumeva čuvanje lekova u frižideru na temperaturi od 2 do 8°C, izbegavajući smrzavanje. Hladno skladištenje podrazumeva čuvanje lekova na temperaturi od 8 do 15 °C. U tom slučaju dozvoljeno je čuvanje lijekova u hladnjaku, osim lijekova koji, kada se čuvaju na temperaturi hladnjaka ispod 8°C, mogu promijeniti svoje fizičko-hemijske karakteristike, na primjer tinkture, tečni ekstrakti itd.
Čuvanje na sobnoj temperaturi podrazumeva temperaturni opseg od 15 do 25 °C ili, zavisno od klimatskih uslova, do 30 °C. Čuvanje u zamrzivaču obezbeđuje temperaturu lekova od -5 do -18 °C. Za skladištenje u dubokom zamrzavanju potrebna je temperatura ispod -18 °C.
Preporučljivo je staviti lijekove u prostore i na police frižidera koji odgovaraju njihovim temperaturnim uvjetima skladištenja. Nije dozvoljeno odlaganje imunobioloških lijekova na panelu vrata frižidera.
U skladišnim prostorijama potrebno je obezbijediti uslove skladištenja za lijekove koji zahtijevaju zaštitu od izlaganja niskim temperaturama, za koje je farmakopejska monografija ili regulatorna dokumentacija propisana niža temperaturna granica čuvanja.
Nije dozvoljeno zamrzavanje lijekova koji imaju odgovarajuće zahtjeve u farmakopejskoj monografiji ili regulatornoj dokumentaciji i naznačeni su na primarnom ili sekundarnom pakovanju, uključujući inzulinske preparate, adsorbovane imunobiološke preparate i dr.
Nije dozvoljeno zamrzavanje lijekova koji se nalaze u ambalaži koja se smrzavanjem može uništiti, na primjer lijekovi u ampulama, staklenim bocama i sl.
Definicije koje se koriste u farmakopeji koje karakterišu temperaturne uslove za skladištenje lekova date su u tabeli.
Potrebno je osigurati poštivanje uslova skladištenja lijekova i očuvanje njihovog integriteta tokom transporta.
Za lijekove koji su posebno osjetljivi na promjene temperature (vakcine, serumi i drugi imunobiološki lijekovi, inzulinski lijekovi i dr.), prilikom transporta mora se poštovati temperaturni režim propisan farmakopejskom monografijom ili regulatornom dokumentacijom.
Definicije koje karakteriziraju načine skladištenja lijekova