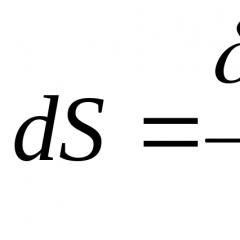Karakteristike i hemija. Silicijum metal. Pogledajte šta je "silicijum" u drugim rečnicima
Silicijum (Si) je nemetal koji zauzima 2. mesto posle kiseonika po rezervama i prisutnosti na Zemlji (25,8% u Zemljinoj kori). Praktično se nikada ne nalazi u svom čistom obliku, uglavnom je prisutan na planeti u obliku jedinjenja.
Karakteristike silicijuma
Fizička svojstva

Silicijum je krhak, svijetlo siv materijal s metalnom nijansom ili smeđi praškasti materijal. Struktura kristala silicijuma je slična dijamantu, ali zbog razlika u dužini veze između atoma, tvrdoća dijamanta je mnogo veća.
Silicijum je nemetal dostupan za elektromagnetno zračenje. Zbog nekih kvaliteta nalazi se u sredini između nemetala i metala:
Kada se temperatura poveća na 800 °C, postaje fleksibilna i plastična;
Kada se zagrije na 1417 °C topi se;
Počinje ključati na temperaturama iznad 2600 °C;
Mijenja gustinu pri visokom pritisku;
Ima svojstvo magnetiziranja u suprotnom smjeru od vanjskog magnetno polje(dijamagnet).
Silicijum je poluprovodnik, a nečistoće koje se nalaze u njegovim legurama određuju električne karakteristike budućih jedinjenja.
Hemijska svojstva

Kada se zagrije, Si reagira s kisikom, bromom, jodom, dušikom, hlorom i raznim metalima. Kombinacijom sa ugljenikom dobijaju se tvrde legure sa termičkom i hemijskom otpornošću.
Silicijum ni na koji način ne reaguje sa vodonikom, pa se sve moguće mešavine sa njim dobijaju na drugačiji način.
U normalnim uslovima slabo reaguje sa svim supstancama osim gasa fluora. Sa njim se formira silicijum tetrafluorid SiF4. Ova neaktivnost se objašnjava činjenicom da se, uslijed reakcije s kisikom, vodom, njenom parom i zrakom, na površini nemetala stvara film silicijum dioksida koji ga obavija. Zbog toga je hemijski efekat spor i beznačajan.
Za uklanjanje ovog sloja koristite mješavinu fluorovodonika i azotne kiseline ili vodene otopine alkalija. Neke posebne tekućine za to zahtijevaju dodavanje kromnog anhidrida i drugih tvari.
Pronalaženje silicijuma u prirodi

Silicijum je važan za Zemlju kao što je ugljenik za biljke i životinje. Njegova kora je skoro polovina kiseonika, a ako tome dodate silicijum, dobijate 80% mase. Ova veza je veoma važna za kretanje hemijski elementi.
75% litosfere sadrži različite soli silicijumskih kiselina i minerala (pijesak, kvarciti, kremen, liskun, feldspat, itd.). Tokom formiranja magme i raznih magmatskih stijena, Si se akumulira u granitima i ultramafičnim stijenama (plutonskim i vulkanskim).
U ljudskom tijelu postoji 1 g silicijuma. Najviše se nalazi u kostima, tetivama, koži i kosi, limfnim čvorovima, aorti i traheji. Učestvuje u rastu vezivnog i koštanog tkiva, a takođe održava elastičnost krvnih sudova.
Dnevna stopa unosa za odraslu osobu je 5 - 20 mg. Višak uzrokuje silikozu.
Primjena silicija u industriji

Ovaj nemetal poznat je čovjeku još od kamenog doba i danas je u širokoj upotrebi.
primjena:
Dobro je redukciono sredstvo, pa se koristi u metalurgiji za proizvodnju metala.
Pod određenim uslovima silicijum može provoditi električnu energiju, zbog čega se koristi u elektronici.
Silicijum oksid se koristi u proizvodnji stakla i silikatnih materijala.
Za proizvodnju poluvodičkih uređaja koriste se posebne legure.
Sa svim, kako kažu, posljedicama koje su uslijedile. Očigledno, vrijedno je razmotriti sa ove tačke gledišta silicijum je prilično običan i prilično neobičan element.
Prirodna jedinjenja silicijuma
„Pokazuju mi“, pisao je akademik A. E. Fersman u jednoj od svojih popularnih knjiga, „veliki izbor predmeta: prozirnu kuglu koja blista na suncu čistoćom hladne izvorske vode, prelep, šareni ahat, blistavu igru višestrukih -opal u boji, čisti pijesak na obali mora, kao dud tanak konac od topljenog kvarca ili jela otporna na toplinu napravljena od njega, lijepo izrezane gomile gorskog kristala, misteriozni dizajn fantastičnog jaspisa, okamenjeno drvo pretvoreno u kamen, grubo obrađen vrh strelice drevni čovek... sve je to jedno te isto hemijsko jedinjenje elemenata silicijum i kiseonik.”
Koliko god ova lista bila raznolika, ona, naravno, ne iscrpljuje raznolikost prirodnih spojeva silicija. Počnimo, međutim, sa pomenutim. "Grubo obrađen vrh strijele drevnog čovjeka" napravljen je od kremena. Šta je kremen? Savremeni čovjek je vidio ove vrhove strijela, kao i kremenjače, možda samo unutra istorijski muzej. „Kremeni“ umetnuti u pušačke upaljače nisu nimalo slični ni izgledu ni sastavu tim kremenima. Međutim, mnogi od nas u djetinjstvu su stvarali varnice udarajući kamenčiće o kamenčiće, a najvjerovatnije smo tada imali prave kremene u rukama.
Dakle, šta je kremen? Hemičar će na ovo pitanje odgovoriti doslovno prema Fersmanu: silicijum dioksid, silicijum dioksid. Možda će dodati da je silicijum silicijum amorfan, za razliku od kristalnog silicijum-dioksida kvarcnog peska i gorskog kristala, i da neki hemičari smatraju da je silicijum kristalni hidrat mSiO 2 -nH 2 O.
Geolog će na isto pitanje odgovoriti drugačije, ali i na općenito svakodnevni način: mineralna formacija, rasprostranjena i malo interesantna, slojevi i „kvržice“ kremena obično leže među naslagama krečnjaka i krede...
I samo će humanistički istoričar odgovoriti, mora se odazvati, oduševljeno kremenom, jer je kremen – neupadljiv i ne baš izdržljiv kamen – jednom prilikom pomogao čovjeku da postane čovjek. Kameno doba je doba kremenog oruđa. Razlog za to nije samo i ne toliko rasprostranjenost i dostupnost kremena, već njegova sposobnost da formira oštre rezne ivice kada se usitnjavaju.
Okrenimo se sada kristalnim analozima kremena: „lepo isečene gomile gorskog kristala“, „čist pesak na obali mora“... Razlika između njih je mala, u suštini samo u veličini i nečistoćama. Čisti pijesak je čisti kristalni silicijum dioksid. Čisti gorski kristal je isti. I što je takođe veoma važno, obe ove supstance su polimeri, neorganski polimeri.
Jedan od prvih koji je predložio polimernu strukturu silicijum dioksida bio je Dmitrij Ivanovič Mendeljejev. Upravo tom okolnošću je objasnio neisparljivost i vatrostalnost supstanci sastava SiO 2 ili, tačnije, (SiO 2)n. Rendgenske strukturne studije naših dana potvrdile su tačnost ove pretpostavke. Utvrđeno je da je kristalni silicijum trodimenzionalni mrežni polimer. Lanac silicijum-kiseonika tetraedara je veoma jak, veza između silicija i kiseonika je mnogo jača od, na primer, veze između atoma ugljika u lancima organskih polimera. Silicijum-kiseonički lanci takođe imaju dovoljno fleksibilnosti, ali u svetu minerala formiraju krute pleksuse u obliku prostornih rešetki i mreža, koje su krhke i nepopustljive prilikom mehaničke obrade. Da bi silicijum-kiseonički lanci ostali fleksibilni i elastični, moraju biti izolovani jedan od drugog, okruženi drugim atomima ili grupama atoma. To su učinili hemičari koji su sintetizirali sada brojne organosilicijumske polimere, o čemu će biti riječi u nastavku. Međutim, priroda je također pružila odličan primjer vlaknastog polimernog spoja kisika i silicija - to je azbest.
Danas je vrlo teško odgovoriti na dječje pitanje koja je od varijanti kristalnog silicijum dioksida - pijesak ili kameni kristal - važnija za savremeni čovek. Ako uzmemo u obzir samo prirodni kameni kristal, čije su rezerve gotovo iscrpljene, onda je odgovor jasan: naravno, pijesak. Od kvarcnog pijeska se pravi kvarcno staklo, a od njega se izrađuje odlično laboratorijsko stakleno posuđe, cilindri za lampe posebne namjene i još mnogo toga. Gorski kristal nije samo ukrasni materijal, on je i piezoelektrik. Radiotehnici je potreban u sve većim količinama, a brzi razvoj ove industrije teško da bi bio moguć da ljudi nisu naučili uzgajati krupnokristalni umjetni kvarc u obliku monokristala.
30-ih godina, Aleksandar Evgenijevič Fersman je napisao: „Za nekoliko decenija geolozi više neće rizikovati svoje živote da bi se penjali na vrhove Alpa, Urala ili Kavkaza u potrazi za kristalima koje neće kopati u sušnim pustinjama Južni Brazil ili u sedimentima Madagaskara. Siguran sam da ćemo potrebne komade kvarca naručiti telefonom iz Državne tvornice kvarca.” Fabrike kvarca pojavile su se čak i ranije nego što je naučnik predvideo. Oni proizvode kristale kvarca, koji ni po čemu nisu inferiorni od prirodnog kamenog kristala, u količinama dovoljnim ne samo za radioelektronsku industriju, ne samo za optiku, već i za nakit. Ako sumnjate u ovu tvrdnju, preporučujemo da kontaktirate zlataru koja je najbliža vašem domu.
Namjerno smo ograničili priču o prirodnim jedinjenjima silicija na tri supstance i u suštini jedno jedinjenje. Još uvijek ne možete sve reći u kratkom eseju, ali jedinjenja s kisikom su najvažnija. Vratimo se, međutim, na sam silicijum.
Uprkos svojoj rasprostranjenosti u prirodi, ovaj element je otkriven relativno kasno. Godine 1825., izvanredni švedski hemičar i mineralog Jens Jakob Berzelius uspeo je da izoluje ne baš čiste amorfne silicijum u obliku smeđeg praha. Da bi to učinio, reducirao je plinovitu tvar metalnim kalijem, sada poznatim kao silicijum tetrafluorid SiF 4, i pored toga izveo sljedeću reakciju:
K 2 SiF 6 + 4K → 6KF + Si.
Novi element je nazvan silicijum (od latinskog silex - kremen). Ruski naziv za ovaj element pojavio se devet godina kasnije, 1834. godine, i sretno je opstao, za razliku od, recimo, "borotvora", do danas.
Silicijum, kao i ugljenik, formira različite alotropne modifikacije. Kristalni silicijum je jednako malo sličan amorfnom silicijumu kao što je dijamant grafitu. Ovo solidan sivo-čelična boja sa metalnim sjajem i kristalnom rešetkom usredsređenom na lice iste vrste kao dijamant. Međutim, amorfni silicijum, kako se ispostavilo, takođe nije amorfan, već fino kristalan.
Prva industrijska metoda proizvodnje silicijuma, izumljena u drugoj polovini 19. veka. poznatog ruskog hemičara N.N. Beketova, bazira se na redukciji silicijum tetrahlorida SiCl 4 sa parama cinka. Tehnički čisti silicijum (95-98% Si) se sada proizvodi uglavnom redukcijom silicijuma u električnom luku između grafitnih elektroda. Metoda redukcije silicijum dioksida koksom u električnim pećima, izumljena još u prošlom stoljeću, još uvijek se koristi. Ovom metodom se proizvodi i tehnički silicij, koji je potreban metalurgiji kao deoksidator koji veže i uklanja kisik iz metala, te kao legirajući aditiv koji povećava čvrstoću i otpornost na koroziju čelika i mnogih legura na bazi obojenih metala. Međutim, ovdje je važno ne pretjerati: višak silicija može dovesti do krhkosti.
Beketova metoda proizvodnje silicija (u reakciji između cinkove pare i silicijum tetrahlorida, hlapljive bezbojne tečnosti sa tačkom ključanja od samo 57,6°C) nije postala stvar prošlosti. Ovo je jedan od načina da se dobije poluvodički silicijum visoke čistoće.
Vjeruje se da bi na apsolutnoj nuli idealno čist i idealno pravilan monokristalni silicij trebao biti idealan električni izolator. Ali idealna čistoća je nedostižna kao i apsolutna nula. U našem slučaju, to je ono što se zove dobro. Nije idealan, već jednostavno visoke čistoće i ultra-čisti silicij je postao najvažniji poluvodički materijal. Na temperaturi različitoj od apsolutne nule, u njoj nastaje vlastita vodljivost, a nosioci električne struje nisu samo slobodni elektroni, već i takozvane rupe - mjesta napuštena elektronima.
Unošenjem određenih legirajućih aditiva u ultra-čisti silicij (u mikro količinama; to se obično radi pomoću ion-beam instalacija), u njemu se stvara provodljivost ove ili one vrste. Dodaci elemenata treće grupe periodnog sistema dovode do stvaranja provodljivosti rupa, a pete - elektronske. Vjerovatno je nepotrebno objašnjavati šta nam danas poluprovodnici znače. Razgovarajmo ukratko o metodama za proizvodnju poluvodičkog silicija.
Jedna od ovih metoda je spomenuta gore. Napominjemo samo da se reakcija cinkove pare visoke čistoće sa vrlo čistim silicijum tetrahloridom odvija na temperaturi od 950°C u cevastom reaktoru od topljenog kvarca. Elementarni silicijum nastaje u obliku igličastih kristala, koji se zatim drobe i ispiru hlorovodoničnom kiselinom, naravno, takođe vrlo čistom. Nakon toga slijedi još jedan korak prečišćavanja - zonsko topljenje, a tek nakon toga polikristalna silicijumska masa se pretvara u monokristale.
Postoje i druge reakcije koje proizvode poluvodički silicij visoke čistoće. To je redukcija triklorosilana SiHCl 3 ili silicijum tetrahlorida SiCl 4 vodonikom i termička razgradnja monosilana, silicijum hidrida SiH 4 ili tetrajodida SiJ 4 . U potonjem slučaju, raspadanje spoja se događa na tantalnoj traci zagrijanoj na 1000°C. Dodatno prečišćavanje zonskim topljenjem prati svaku od ovih reakcija. U poluprovodničkom silicijumu sadržaj nečistoća je izuzetno nizak - 10-5-10-6% pa čak i manje.
Organosilicij
Prvo organsko jedinjenje, koji sadrži silicijum, dobijen je još 1845. godine reakcijom etil alkohola sa silicijum tetrahloridom: SiCl 4 + 4C 2 H 5 OH → Si(OC 2 H 5) 4 + 4HCl. Ali ovo nije bila prva sinteza organosilicijum jedinjenja u smislu kako moderna nauka razume ovaj koncept. hemijska nomenklatura. Danas se kao organosilicij prepoznaju samo ona jedinjenja u kojima postoji veza ugljik-silicij. Tako je prvo organosilicijumsko jedinjenje - tetraetilsilicijum Si (C 2 H 5) 4 - dobijeno tek 1863. godine.
Naravno, tada niko nije zamišljao da će se 100 godina kasnije organosilicijum razviti u samostalnu i važnu granu hemijske nauke, da će organosilicijumska jedinjenja, posebno polimerna, postati od najveće važnosti za mnoge vrste industrije, za transport i građevinarstvo, čak i za svakodnevni život.
Prije pranja, iskusna domaćica namazat će ruke silikonskom kremom, koja će ih zaštititi ne samo od vode, već i od korozivnog djelovanja sode ili praška za pranje rublja. Kada predamo haljinu ili odijelo na čišćenje, dragovoljno doplaćujemo za nabor otporan na gužvanje i za „impregnaciju“, zahvaljujući kojoj će se haljina manje zaprljati. U oba slučaja naša odeća u fabrici hemijskog čišćenja biće tretirana organosilicijumskim tečnostima...
Ova ista grana hemijske nauke dala nam je najotpornije na toplotu i u isto vreme najotpornije na mraz sintetičke gume. Raspon radnih temperatura organosilicijumskih guma je od -80 do +260°C, a ove gume odavno ne postoje u obliku egzotičnih laboratorijskih uzoraka, već u obliku masovnih industrijskih proizvoda.
Organosilicijumski lakovi, koji su rastvori organosilicijumskih polimera, veoma su važni za savremenu elektrotehniku. Imaju izvrsna svojstva električne izolacije i otporni su na vremenske uvjete, promjene temperature i sunčevo zračenje. Evo samo jednog primjera efikasnosti takvih materijala u tehnologiji. Prije uvođenja organosilicijumskih lakova, izolacija elektromotora mašine za sečenje u rudniku trajala je u prosjeku 5 mjeseci. Kada se organosilikonski lak počeo koristiti kao izolacija, vijek trajanja motora prije prve popravke porastao je na 3 godine.
Može se navesti na desetine sličnih primjera, a njihov broj će se svake godine umnožavati: pojavljuju se nove tvari koje, uz silicijum i tradicionalne elemente, organski svijet uključuje aluminijum, titan i druge metale. Svako u molekulu unosi nešto drugačije, a u nekoj fazi količina se pretvara u kvalitet.
Silicijum u mikroorganizmima
Mnogi poznati naučnici su radili i rade u ovoj oblasti hemije. Sovjetsku školu organosilicijumske hemije osnovao je akademik K. A. Andrianov, koji je davne 1937. godine dobio prve organosilicijumske polimere na svetu - poliorganosiloksane.
U preglednom članku o silicijumu napisanom prije deset godina, takav odjeljak ne bi bio potreban. Nauka je premalo znala o ulozi silicijuma u životu viših životinja i ljudi. Bilo je poznato da silicij (njegov dioksid) čini osnovu skeleta nekih morskih organizama - radiolarija, dijatomeja, nekih spužvi, morskih zvijezda. Poznato je i da je to potrebno biljkama: od žitarica i šaša do palmi i bambusa. Što je stabljika biljke čvršća, to se više silicija nalazi u pepelu. Biljke, poput morskih životinja, uzimaju silicijum iz vode. Oko 3 mg/l silicijuma je otopljeno i u slatkoj i u slanoj vodi (u obliku silicijumskih kiselina i njihovih soli). Uloga silicija u životu viših životinja i ljudi dugo je ostala nejasna. Rašireno se vjerovalo da su jedinjenja silicija biološki inertna i beskorisna.
Ali, s druge strane, odavno je poznata ozbiljna bolest - silikoza, uzrokovana dugotrajnim udisanjem prašine koja sadrži slobodni silicijum dioksid. Neki organosilicijumski spojevi - arilsilatroni - pokazali su se toksičnim za sve toplokrvne životinje. A u isto vrijeme poznato je da se silicijum nalazi gotovo svuda u ljudskom tijelu, a najviše u kostima, koži, vezivnog tkiva, kao i u nekim žlijezdama. Kada su kosti slomljene, sadržaj silicija na mjestu prijeloma se povećava skoro 50 puta. Mineralne vode sa visokim sadržajem silicijuma (na primjer, poznata kavkaska voda "Jermuk") blagotvorno djeluju na zdravlje ljudi, posebno starijih.
Ne može se reći da je uloga silicijuma u životu potpuno razjašnjena – naprotiv: pojava novih informacija sve više komplikuje sliku. Mnoge laboratorije širom svijeta danas se bave sintezom i proučavanjem biološki aktivnih spojeva silicija. Osoblje Irkutskog instituta vrlo aktivno radi na nizu problema, koji se ukratko mogu nazvati isto kao što se zove ovo poglavlje, odnosno silicijum i život organska hemija koju vodi dopisni član Akademije nauka SSSR M. G. Voronkov. U jednom od svojih članaka napisao je: „Brojna zapažanja koja su već dostupna omogućavaju nam da dođemo do zaključka o potrebi za opsežnim i temeljitim istraživanjem (uključujući molekularnom nivou) uloga silicijuma u živim organizmima i istraživanje mogućnosti upotrebe spojeva ovog elementa za liječenje i prevenciju raznih bolesti i ozljeda, kao i za suzbijanje starenja.” Vjerovatno samo posljednja teza ovdje zahtijeva objašnjenje. Poenta je da su instalirani starosne karakteristike metabolizam silicija u organizmu: sa godinama sadržaj ovog elementa u koštanom tkivu, arterijama, koži značajno opada...
Ovaj dio našeg znanja o elementu br. 14 još nije postao skup opšteprihvaćenih, utvrđenih istina. Ali, očito, tu se ovih dana odvija prvi red borbe za znanje o silicijumu, najbližem analogu ugljika, vitalnog elementa.
Silicijum (Si) je drugi element glavne (A) podgrupe grupe 4 Periodni sistem, koji je osnovao Dmitrij Ivanovič Mendeljejev. Silicijum je veoma čest u prirodi, pa je na drugom mestu (posle kiseonika) po obilju. Dakle, bez silicijuma i njegovih spojeva, Zemljina kora, koja se više od jedne četvrtine sastoji od spojeva ovog hemijskog elementa, ne bi postojala. Koje su karakteristike silicijuma? Koje su formule njegovih spojeva i njihova upotreba? Koje važne supstance sadrže silicijum? Pokušajmo to shvatiti.
Element silicijum i njegova svojstva
Silicijum postoji u prirodi u nekoliko alotropnih modifikacija - najčešći su kristalni silicijum i amorfni silicijum. Razmotrimo svaku od ovih modifikacija zasebno.
Kristalni silicijum
Silicij u ovoj modifikaciji je tamno siva, prilično tvrda i krhka tvar sa čeličnim sjajem. Takav silicijum je poluprovodnik; njegov korisno svojstvo je da, za razliku od metala, njegova električna provodljivost raste s porastom temperature. Tačka topljenja takvog silicijuma je 1415 °C. Osim toga, kristalni silicijum nije u stanju da se rastvori u vodi i raznim kiselinama.
Upotreba silicijuma i njegovih spojeva u kristalnoj modifikaciji je nevjerovatno raznolika. Na primjer, kristalni silicij je dio solarnih panela instaliranih na svemirskim brodovima i krovovima. Silicijum je poluprovodnik i sposoban je da pretvara sunčevu energiju u električnu energiju.
Osim solarnih ćelija, kristalni silicij se koristi za stvaranje mnogih elektroničkih uređaja i silicijskih čelika.
Amorfni silicijum

Amorfni silicijum je smeđi/tamno smeđi prah sa strukturom nalik dijamantu. Za razliku od kristalnog silicijuma, ova alotropska modifikacija elementa nema striktno uređenu kristalnu rešetku. Uprkos činjenici da se amorfni silicijum topi na temperaturi od približno 1400°C, on je mnogo aktivniji u odnosu na kristalni silicijum. Amorfni silicijum ne provodi struju i ima gustinu od oko 2 g/cm³.
Ova vrsta silicijuma se najčešće koristi u prehrambena industrija i u proizvodnji lijekova.
Hemijska svojstva silicijuma
- Glavno hemijsko svojstvo silicijuma je sagorevanje u kiseoniku, što rezultira stvaranjem izuzetno uobičajenog jedinjenja - silicijum oksida:
Si + O2 → SiO2 (na temperaturi).
- Kada se zagrije, silicijum, kao nemetal, stvara spojeve sa raznim metalima. Takva jedinjenja nazivaju se silicidi. na primjer:
2Ca + Si → Ca2Si (na temperaturi).
- Silicidi se, pak, bez poteškoća razgrađuju uz pomoć vode ili nekih kiselina. Kao rezultat ove reakcije nastaje posebno vodikovo jedinjenje silicija - silan plin (SiH4):
Mg2Si + 4HCl → 2MgCl2 + SiH4.
- Silicijum takođe može da komunicira sa fluorom (u normalnim uslovima):
Si + 2F2 → SiF4.
- A kada se zagrije, silicij stupa u interakciju s drugim nemetalima:
Si + 2Cl2 → SiCl4 (400–600°).
3Si + 2N2 → Si3N4 (1000°).
Si + C → SiC (2000°).
- Takođe, silicijum, u interakciji sa alkalijama i vodom, formira soli koje se nazivaju silikati i gas vodonik:
Si + 2KOH + H2O → K2SiO3 + H2.
Međutim, mi ćemo analizirati većinu hemijskih svojstava ovog elementa razmatrajući silicijum i njegove spojeve, budući da su oni glavne supstance na kojima se zasniva upotreba i interakcija silicijuma sa drugim hemijskim elementima. Dakle, koja su najčešća jedinjenja silicijuma?
Silikonska jedinjenja

Prethodno smo saznali koji je element silicij i koja svojstva ima. Pogledajmo sada formule silikonskih spojeva.
Uz učešće silicijuma nastaje ogroman broj različitih spojeva. Prvo mjesto po prevalenciji zauzimaju jedinjenja kiseonika silicijum Ova kategorija uključuje SiO2 i netopivu silicijumsku kiselinu.
Kiseli ostatak silicijumske kiseline formira različite silikate (na primjer, CaSiO3 ili Al2O3 SiO2). U takvim solima i jedinjenjima silicijuma s kisikom prikazanim gore, element ima tipično oksidacijsko stanje od +4.
Silicijumske soli su takođe prilično česte - silicidi (Mg2Si, NaSi, CoSi) i jedinjenja silicijuma sa vodonikom (na primer, silan gas). Silan se, kao što je poznato, spontano zapali na zraku uz zasljepljujući bljesak, a silicidi se lako razlažu i vodom i raznim kiselinama.
Pogledajmo pobliže silicij i njegove spojeve, koji se smatraju najčešćim.
Silicijum dioksid
Drugi naziv za ovaj oksid je silicijum dioksid. To je čvrsta i vatrostalna supstanca koja je nerastvorljiva u vodi i kiselinama i ima atomsku kristalnu rešetku. U prirodi, silicijum oksid stvara minerale i drago kamenje kao što su kvarc, ametist, opal, ahat, kalcedon, jaspis, kremen i neka druga.
Vrijedi napomenuti da je od silicija primitivni ljudi pravili vlastite alate za rad i lov. Kremen je označio početak takozvanog kamenog doba zbog njegove široko rasprostranjene dostupnosti i sposobnosti stvaranja oštrih reznih rubova prilikom usitnjavanja.
Silicijum oksid čini stabljike biljaka poput trske, trske i preslice, listova šaša i stabljika žitarica jakim. Zaštitni vanjski omotači nekih životinja također sadrže silicijum dioksid.
Osim toga, čini osnovu silikatnog ljepila, koji stvara silikonsko brtvilo i silikonsku gumu.
Hemijska svojstva silicijum oksida
Silicijum dioksid je u interakciji sa ogromnim brojem hemijskih elemenata - i metala i nemetala. na primjer:
- Na visokim temperaturama, silicijum reaguje sa alkalijama, formirajući soli:
SiO2 + 2KOH → K2SiO3 + H2O (na temperaturi).
- Kao tipičan kiseli oksid, ovo jedinjenje proizvodi silikate reakcijom sa različitim metalnim oksidima:
SiO2 + CaO → CaSiO3 (na temperaturi).
- Ili sa karbonatnim solima:
SiO2 + K2CO3 → K2SiO3 + CO2 (na temperaturi).
- Jedno od najvažnijih hemijskih svojstava silicijum dioksida je sposobnost da se iz njega dobije čisti silicijum. To se može učiniti na dva načina - reakcijom dioksida s magnezijem ili ugljikom:
SiO2 + 2Mg → 2MgO + Si (na temperaturi).
SiO2 + 2C → Si + 2CO (na temperaturi)
Silicijumska kiselina

Silicijumska kiselina je veoma slaba. Nerastvorljiv je u vodi i tokom reakcija stvara želatinozni talog, koji ponekad može ispuniti cijeli volumen otopine. Kada se ova smjesa osuši, može se vidjeti formirani silika gel, koji se koristi kao adsorbent (apsorber drugih tvari).
Najpristupačniji i najčešći način dobivanja silicijumske kiseline može se izraziti pomoću formule:
K2SiO3 + 2HCl → 2KCl + H2SiO3↓.
Silicidi
Kada se razmatra silicijum i njegova jedinjenja, veoma je važno govoriti o njegovim solima kao što su silicidi. Silicijum tvori takva jedinjenja sa metalima, poprimajući, u pravilu, oksidaciono stanje -4. Međutim, metali kao što su živa, cink, berilijum, zlato i srebro nisu u stanju da stupe u interakciju sa silicijumom i formiraju silicide.
Najčešći silicidi su Mg2Si, Ca2Si, NaSi i neki drugi.
Silikati
Spojevi kao što su silikati su drugi po obilju nakon silicijum dioksida. Silikatne soli se smatraju dovoljnim složene supstance, budući da imaju složenu strukturu, a također su dio većine minerala i stijena.
Najčešći silikati u prirodi - aluminosilikati - uključuju granit, liskune, razne vrste glina Još jedan dobro poznati silikat je azbest, od kojeg se prave vatrootporne tkanine.
Silikonske aplikacije

Prije svega, silicij se koristi za proizvodnju poluvodičkih materijala i legura otpornih na kiseline. Silicijum karbid (SiC) se često koristi za oštrenje alatnih mašina i poliranje vrednog kamenja.
Rastopljeni kvarc se koristi za izradu stabilnog i jakog kvarcnog posuđa.
Jedinjenja silikona su u osnovi proizvodnje stakla i cementa.

Naočale se međusobno razlikuju po sastavu, koji nužno sadrži silicijum. Na primjer, pored prozorskog stakla, postoje vatrostalna, kristalna, kvarcna, obojena, fotohromna, optička, ogledalna i druga stakla.
Kada se cement pomiješa s vodom, formira se posebna tvar - cementni mort, od kojeg se naknadno dobivaju građevinski materijali poput betona.
Proizvodnju ovih supstanci obavlja silikatna industrija. Osim stakla i cementa, silikatna industrija proizvodi ciglu, porculan, zemljano posuđe i razne proizvode od njih.
Zaključak
Dakle, otkrili smo da je silicijum najvažniji hemijski element, rasprostranjen u prirodi. Silicijum se koristi u građevinarstvu i umjetničkim aktivnostima, a neophodan je i za žive organizme. Mnoge tvari, od jednostavnog stakla do najvrednijeg porculana, sadrže silicij i njegove spojeve.
Studiranje hemije nam omogućava da razumijemo svijet oko nas i shvatimo da nije sve oko nas, čak ni ono najveličanstvenije i najskuplje, toliko misteriozno i zagonetno kao što se čini. Želimo vam uspeh u naučna saznanja i proučavanje tako divne nauke kao što je hemija!
Silicijum (Si) – nalazi se u periodu 3, grupa IV glavne podgrupe periodnog sistema. Fizička svojstva: silicijum postoji u dve modifikacije: amorfnoj i kristalnoj. Amorfni silicijum je smeđi prah gustine 2,33 g/cm3, rastvorljiv u topljenju metala. Kristalni silicijum su tamno sivi kristali čeličnog sjaja, tvrdi i lomljivi, gustine 2,4 g/cm3. Silicijum se sastoji od tri izotopa: Si (28), Si (29), Si (30).
Hemijska svojstva: elektronska konfiguracija: 1s22s22p63 s23p2 . Silicijum je nemetal. Na vanjskom energetskom nivou, silicijum ima 4 elektrona, što određuje njegova oksidaciona stanja: +4, -4, -2. Valencija – 2.4 Amorfni silicijum ima veću reaktivnost od kristalnog silicijuma. U normalnim uslovima, on stupa u interakciju sa fluorom: Si + 2F2 = SiF4. Na 1000 °C Si reaguje sa nemetalima: CL2, N2, C, S.
Od kiselina, silicijum reaguje samo sa mešavinom azotne i fluorovodonične kiseline:
Drugačije se ponaša u odnosu na metale: u rastopljenom Zn, Al, Sn, Pb dobro se otapa, ali ne reaguje s njima; Silicijum stupa u interakciju sa drugim topljenjem metala - sa Mg, Cu, Fe - da bi formirao silicide: Si + 2Mg = Mg2Si. Silicijum gori u kiseoniku: Si + O2 = SiO2 (pesak).
Silicijum dioksid ili silicijum dioksid– stabilna veza Si, široko rasprostranjena u prirodi. Reaguje spajanjem sa alkalijama i bazičnim oksidima, formirajući soli silicijumske kiseline – silikate. Potvrda: u industriji se silicijum u svom čistom obliku dobija redukcijom silicijum dioksida koksom u električnim pećima: SiO2 + 2C = Si + 2CO?.
U laboratoriji se silicijum dobija kalcinacijom belog peska magnezijumom ili aluminijumom:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2O3 + 3Si.
Silicijum stvara kiseline: H2 SiO3 – meta-silicijum kiselina; H2 Si2O5 je dimetasilicijumska kiselina.
Pronalaženje u prirodi: mineral kvarca – SiO2. Kristali kvarca su u obliku heksagonalne prizme, bezbojni i providni, a nazivaju se gorskim kristalom. Ametist je gorski kristal ljubičaste boje sa nečistoćama; dimljeni topaz je smećkaste boje; ahat i jaspis su kristalne vrste kvarca. Amorfni silicijum je rjeđi i postoji u obliku minerala opala – SiO2 nH2O. Diatomit, tripoli ili kieselgur (dijatomejska zemlja) su zemljani oblici amorfnog silicijuma.
42. Koncept koloidnih rastvora
Koloidne otopine– visoko dispergovani dvofazni sistemi, koji se sastoje od disperzione sredine i dispergovane faze. Veličine čestica su srednje između pravih otopina, suspenzija i emulzija. U koloidne čestice molekularni ili jonski sastav.
Postoje tri tipa unutrašnje strukture primarnih čestica.
1. Suspenzoidi (ili ireverzibilni koloidi)– heterogeni sistemi čija se svojstva mogu odrediti razvijenom međufaznom površinom. U poređenju sa suspenzijama, one su više raspršene. Oni ne mogu postojati dugo vremena bez stabilizatora disperzije. Oni se zovu ireverzibilnih koloida zbog činjenice da njihovi sedimenti nakon isparavanja ne stvaraju ponovo sol. Njihova koncentracija je niska - 0,1%. Oni se neznatno razlikuju od viskoziteta dispergovanog medija.
Suspenzoidi se mogu nabaviti:
1) metode disperzije (drobljenje velikih tijela);
2) metode kondenzacije (proizvodnja nerastvorljivih jedinjenja reakcijama razmene, hidrolizom itd.).
Spontano smanjenje disperznosti u suspenzijama zavisi od slobodne površinske energije. Da bi se dobila dugotrajna suspenzija, neophodni su uslovi da se ona stabilizuje.
Stabilni disperzni sistemi:
1) disperzioni medij;
2) disperzovana faza;
3) stabilizator disperzovanog sistema.
Stabilizator može biti jonski, molekularni, ali najčešće visokomolekularni.
Zaštitni koloidi– visokomolekularna jedinjenja koja se dodaju radi stabilizacije (proteini, peptidi, polivinil alkohol, itd.).
2. Asocijativni (ili micelarni koloidi) – semikoloidi koji nastaju kada postoji dovoljna koncentracija molekula koje se sastoje od ugljikovodičnih radikala (difilnih molekula) niskomolekularnih supstanci kada se povezuju u agregate molekula (micele). Micele nastaju u vodenim rastvorima deterdženata (sapuna), organskih boja.
3. Molekularni koloidi (reverzibilni ili liofilni koloidi) – prirodne i sintetičke supstance visoke molekularne težine sa velikom molekulskom težinom. Njihove molekule imaju veličinu koloidnih čestica (makromolekula).
Razrijeđene otopine koloida jedinjenja visoke molekulske težine su homogene otopine. Kada su jako razrijeđene, ovi rastvori se pridržavaju zakona razrijeđenih otopina.
Nepolarne makromolekule se otapaju u ugljovodonicima, polarne - u polarnim rastvaračima.
Reverzibilni koloidi– supstance čiji se suvi ostatak, kada se doda novi deo rastvarača, vraća u rastvor.
U ovoj lekciji proučavat ćete temu "Silicij". Razmotrite informacije o silicijumu: it elektronska struktura gdje se silicij nalazi u prirodi, proučiti alotropiju silicija, objasniti njegova fizička i kemijska svojstva. Naučit ćete o tome gdje se silicij koristi u industriji i drugim područjima i kako se proizvodi. Upoznat ćete silicijum diokside, silicijumsku kiselinu i njene soli – silikate.
Tema: Osnovni metali i nemetali
Lekcija: Silicijum. Plemeniti gasovi
Silicijum je jedan od najčešćih hemijskih elemenata zemljine kore. Njegov sadržaj je skoro 30%. U prirodi se uglavnom nalazi u različitim oblicima silicijum dioksida, silikata i aluminosilikata.
U skoro svim svojim jedinjenjima, silicijum je četvorovalentan. U ovom slučaju, atomi silicijuma su u pobuđenom stanju. Rice. 1.
Rice. 1
Za prelazak u ovo stanje, jedan od 3s elektrona zauzima upražnjeno mjesto u 3p orbitali. U ovom slučaju, umjesto 2 nesparena elektrona u osnovnom stanju, atom silicija u pobuđenom stanju će imati 4 nesparena elektrona. Moći će formirati 4 mehanizmom razmjene.

Rice. 2

Rice. 3
Atomi silicijuma nisu skloni formiranju višestrukih veza, već formiraju spojeve sa jednostrukim vezama -Si-O-. Silicijum, za razliku od ugljenika, ne karakteriše alotropija.
Jedan od alotropske modifikacije je kristalni silicijum, u kojoj je svaki atom silicija u sp 3 hibridizaciji. Rice. 2, 3. Kristalni silicijum je tvrda, vatrostalna i izdržljiva kristalna supstanca tamnosive boje sa metalnim sjajem. U normalnim uslovima - poluprovodnik. Ponekad se izoluje amorfni silicijum kao druga alotropska modifikacija silicijuma. To je tamnosmeđi prah koji je kemijski aktivniji od kristalnog silicija. Kontroverzno je pitanje da li je to alotropska modifikacija.
Hemijska svojstva silicijum
1. Interakcija sa halogenima
Si + 2F 2 → SiF 4
2. Kada se zagrije, silicijum gori u kiseoniku, formirajući silicijum (IV) oksid.
Si + O 2 → SiO 2
3. Na visokim temperaturama, silicijum reaguje sa azotom ili ugljenikom.
3Si + 2N 2 → Si 3 N 4
4. Silicijum ne reaguje sa vodenim rastvorima kiselina. Ali se rastvara u alkalijama.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Kada se silicijum spoji sa metalima, nastaju silicidi.
Si + 2Mg → Mg 2 Si
6. Silicijum ne stupa u direktnu interakciju sa vodonikom, ali se vodonikova jedinjenja silicijuma mogu dobiti reakcijom silicida sa vodom.
Mg 2 Si + 4H 2 O → 2Mg(OH) 2 + SiH 4 (silan)
Silani su po strukturi slični alkanima, ali su značajno reaktivni. Najstabilniji monosilan se pali na vazduhu.
SiH 4 +2 O 2 → SiO 2 + 2H 2 O
Dobivanje silicijuma
Silicijum se dobija redukcijom iz silicijum(IV) oksida
SiO 2 + 2Mg → Si + 2MgO
Jedan od zadataka je dobijanje silicijuma visoke čistoće. U tu svrhu tehnički silicijum se pretvara u silicijum tetrahlorid. Rezultirajući tetrahlorid se reducira u silan, a silan se raspada kada se zagrije u silicijum i vodonik.
Silicijum je sposoban da formira dva oksida: SiO 2 - silicijum oksid (IV) i SiO - silicijum oksid (II).

Rice. 4
SiO - silicijum oksid (II) - to je amorfna tamnosmeđa supstanca koja nastaje kada silicijum reaguje sa silicijum (IV) oksidom
Si + SiO 2 → 2 SiO.
Uprkos svojoj stabilnosti, ova supstanca se gotovo nikada ne koristi.
SiO 2 - silicijum oksid (IV)

Rice. 5

Rice. 6
Ova supstanca čini 12% zemljine kore. Rice. 4. Predstavljen je mineralima kao što su gorski kristal, kvarc, ametist, citrin, jaspis, kalcedon. Rice. 5.
SiO 2 - silicijum oksid (IV) je supstanca nemolekularne strukture.
Njegovo kristalna rešetka- atomska. Rice. 6. Kristali SiO 2 imaju oblik tetraedra, koji su međusobno povezani atomima kiseonika. Tačnija bi bila formula molekula (SiO 2)n. Pošto SiO 2 formira supstancu atomska struktura, a CO 2 je molekularne strukture, onda je razlika u njihovim svojstvima očigledna. CO 2 je gas, a SiO 2 je čvrsta prozirna kristalna supstanca, nerastvorljiva u vodi i vatrostalna.
Hemijska svojstvaSiO 2
1. Silicijum (IV) oksid SiO 2 je kiseli oksid. Ne reaguje sa vodom. Silicijumska kiselina se ne može dobiti hidratacijom SiO 2. Njene soli - silikati - mogu se dobiti reakcijom SiO 2 sa vrućim rastvorima alkalija.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Reaguje sa karbonatima alkalnih i zemnoalkalnih metala.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Interagira sa metalima.
SiO 2 + 2Mg → Si + 2MgO
4. Reakcija sa fluorovodoničnom kiselinom.
SiO 2 + 4HF → SiF 4 + 2H 2 O
Domaći
1. br. 2-4 (str. 138) Rudžitis G.E. hemija. Osnove opšta hemija. 11. razred: udžbenik za obrazovne institucije: osnovni nivo/ G.E. Rudžitis, F.G. Feldman. - 14. izd. - M.: Obrazovanje, 2012.
2. Navedite područja primjene poliorganosiloksana.
3. Uporedite svojstva alotropskih modifikacija silicijuma.