Koja kiselina je najopasnija? Najjača kiselina na svetu. Najjača superfluidnost. Najnevjerovatnije tvari Najjača kiselina bez kisika
Čovjek je oduvijek težio da pronađe materijale koji ne ostavljaju šanse njegovim konkurentima. Od davnina, naučnici su tražili najtvrđe materijale na svijetu, najlakše i najteže. Žeđ za otkrićem dovela je do otkrića idealan gas i savršeno crno tijelo. Predstavljamo vam najviše neverovatne supstance u svijetu.
1. Najcrnja supstanca
Najcrnja tvar na svijetu zove se Vantablack i sastoji se od kolekcije ugljičnih nanocijevi (vidi ugljik i njegove alotrope). Jednostavno rečeno, materijal se sastoji od bezbrojnih „dlaka“, kada se jednom uhvati u njih, svjetlost se odbija od jedne cijevi do druge. Na ovaj način, oko 99,965% svjetlosnog toka se apsorbira i samo se mali dio odbija nazad.
Otkriće Vantablacka otvara široke izglede za upotrebu ovog materijala u astronomiji, elektronici i optici.
2. Najzapaljivija supstanca
Klor trifluorid je najzapaljivija supstanca ikada poznat čovečanstvu. Jak je oksidant i reaguje sa skoro svim hemijski elementi. Klor trifluorid može spaliti beton i lako zapaliti staklo! Upotreba hlor trifluorida je praktično nemoguća zbog njegove fenomenalne zapaljivosti i nemogućnosti da se obezbedi sigurna upotreba.
3. Najotrovnija supstanca
Najmoćniji otrov je botulinum toksin. Znamo ga pod imenom Botox, kako ga zovu u kozmetologiji, gdje je i našao svoju glavnu primjenu. Botulinski toksin je kemikalija koju proizvodi bakterija Clostridium botulinum. Osim što je botulinum toksin najotrovnija supstanca, ima i najveću molekularnu težinu među proteinima. O fenomenalnoj toksičnosti supstance svjedoči činjenica da je samo 0,00002 mg min/l botulinum toksina dovoljno da zahvaćeno područje učini smrtonosnim za ljude na pola dana.
4. Najtoplija supstanca
Ovo je takozvana kvark-gluonska plazma. Supstanca je nastala sudaranjem atoma zlata brzinom skorom svjetlosti. Kvark-gluonska plazma ima temperaturu od 4 triliona stepeni Celzijusa. Poređenja radi, ova brojka je 250.000 puta veća od temperature Sunca! Nažalost, životni vek materije je ograničen na trilionti deo jedne triliontine sekunde.
5. Najkaustičnija kiselina
U ovoj nominaciji šampion je fluorid-antimonova kiselina H. Fluor-antimonova kiselina je 2×10 16 (dvjesto kvintiliona) puta kaustičnija od sumporne kiseline. Vrlo je aktivna tvar i može eksplodirati ako se doda mala količina vode. Isparenja ove kiseline su smrtonosno otrovna.
6. Najeksplozivnija supstanca
Najeksplozivnija supstanca je heptanitrokuban. Veoma je skup i koristi se samo za naučno istraživanje. Ali nešto manje eksplozivni oktogen uspješno se koristi u vojnim poslovima i u geologiji prilikom bušenja bušotina.
7. Najradioaktivnija supstanca
Polonijum-210 je izotop polonija koji ne postoji u prirodi, već ga proizvode ljudi. Koristi se za stvaranje minijaturnih, ali u isto vrijeme vrlo moćnih izvora energije. Ima vrlo kratko vrijeme poluraspada i stoga je sposoban uzrokovati tešku bolest zračenja.
8. Najteža supstanca
Ovo je, naravno, fulerit. Njegova tvrdoća je skoro 2 puta veća od tvrdoće prirodnih dijamanata. Više o fuleritu možete pročitati u našem članku Najtvrđi materijali na svijetu.
9. Najjači magnet
Najjači magnet na svijetu napravljen je od željeza i dušika. Trenutno detalji o ovoj supstanci nisu dostupni široj javnosti, ali je već poznato da je novi super-magnet 18% jači od najjačih magneta koji se trenutno koriste - neodimijuma. Neodimijski magneti su napravljeni od neodimija, željeza i bora.
10. Najtečnija supstanca
Superfluid Helium II nema skoro nikakav viskozitet na temperaturama blizu apsolutne nule. Ova nekretnina je zbog svoje jedinstvena nekretnina iscuriti i izliti iz posude napravljene od bilo kojeg čvrstog materijala. Helijum II ima izglede za upotrebu kao idealan toplotni provodnik u kome se toplota ne rasipa.
Više od jedne generacije hemičara raspravljalo je o tome koja je kiselina najjača. IN različita vremena Ovaj naziv je dat dušičnoj, sumpornoj i hlorovodoničnoj kiselini. Neki su vjerovali da ne može postojati jedinjenje jače od fluorovodonične kiseline. Nedavno su dobijena nova jedinjenja sa jakim kiselim svojstvima. Možda je među njima pronađena najjača kiselina na svijetu? Ovaj članak ispituje karakteristike najmoćnijih postojanih kiselina našeg vremena i daje njihove kratke kemijske karakteristike.
Koncept kiseline
Hemija je egzaktna kvantitativna nauka. I naslov "Najjača kiselina" treba razumno pripisati određenoj supstanci. Koji bi mogao biti glavni pokazatelj koji karakterizira snagu bilo koje veze?
Prvo, sjetimo se klasične definicije kiseline. Ova riječ se uglavnom koristi za složena hemijska jedinjenja koja se sastoje od vodika i kiselinskog ostatka. Broj atoma vodika u spoju ovisi o valentnosti kiselinskog ostatka. Na primjer, u molekulu hlorovodonične kiseline postoji samo jedan atom vodika; a sumporna kiselina već ima dva H + atoma.

Svojstva kiselina
Sve kiseline imaju nešto hemijska svojstva, koji se može nazvati zajedničkim za datu klasu hemijskih jedinjenja.

U svim gore navedenim svojstvima očituje se još jedna "vještina" bilo koje poznate kiseline - to je sposobnost da se odustane od atoma vodika, zamjenjujući ga atomom druge kemijske tvari ili molekulom bilo kojeg spoja. Upravo ta sposobnost karakterizira "snagu" kiseline i stepen njene interakcije s drugim kemijskim elementima.
Voda i kiselina
Prisustvo vode značajno smanjuje sposobnost kiseline da donira atome vodika. To se objašnjava činjenicom da je vodonik sposoban formirati svoj vlastiti hemijske veze između molekula kiseline i vode, pa je njegova sposobnost odvajanja od baze manja od sposobnosti nerazrijeđenih kiselina.
Super kiselina
Riječ "superacid" uvedena je u kemijski rječnik 1927. godine, uz pomoć poznatog hemičara Jamesa Conanta.
Standard za jačinu ovog hemijskog jedinjenja je koncentrovana sumporna kiselina. Hemikalija ili bilo koja mješavina koja je kiselija od koncentrirane sumporne kiseline naziva se super kiselina. Vrijednost superkiseline određena je njenom sposobnošću da prenese pozitivan električni naboj bilo kojoj bazi. Kao osnovni parametar za određivanje kiselosti uzima se odgovarajući H 2 SO 4 indikator. Među jakim kiselinama postoje tvari prilično neobičnih imena i svojstava.
Poznate jake kiseline
Najpoznatije kiseline iz kursa neorganske hemije su jodovodonične (HI), bromovodonične (HBr), hlorovodonične (HCl), sumporne (H 2 SO 4) i azotne (HNO 3) kiseline. Svi imaju visok indeks kiselosti i mogu reagirati s većinom metala i baza. U ovoj seriji, najjača kiselina je mješavina azotne i hlorovodonične kiseline, nazvana “kraljevska voda”. Formula najjače kiseline u ovoj seriji je HNO 3+3 HCl. Ovo jedinjenje je sposobno da rastvori čak i plemenite metale kao što su zlato i platina.

Čudno je da fluorovodonična kiselina, koja je spoj vodika s najjačim halogenom - fluorom, nije bila uključena u kandidate za titulu "Najjača kiselina u hemiji". Jedina karakteristika ove supstance je njena sposobnost da otapa staklo. Stoga se takva kiselina skladišti u polietilenskim posudama.
Jake organske kiseline
Kandidati za titulu „Najjača kiselina u organska hemija» - mravlje i sirćetne kiseline. Mravlja kiselina je najjača u homolognom nizu zasićenih kiselina. Ime je dobio zbog činjenice da se dio sadrži u izlučevinama mrava.

Sirćetna kiselina je nešto slabija od mravlje kiseline, ali je njen spektar distribucije mnogo širi. Često se nalazi u biljnim sokovima i nastaje tokom oksidacije raznih organskih materija.
Najnovija dostignuća u oblasti hemije omogućila su sintetizaciju nove supstance koja se može takmičiti sa tradicionalnim organskim supstancama. Trifluorometansulfonska kiselina ima indeks kiselosti veći od sumporne kiseline. Štaviše, CF3SO3H je stabilna higroskopna tečnost sa utvrđenim fizičko-hemijskim svojstvima u normalnim uslovima. Danas se ovom jedinjenju može pripisati naziv "Najjača organska kiselina".
Mnogi mogu pomisliti da stepen kiselosti ne može biti značajno veći od stepena sumporne kiseline. Ali nedavno su naučnici sintetizirali brojne supstance čiji su parametri kiselosti nekoliko hiljada puta veći od onih u sumpornoj kiselini. Jedinjenja dobijena reakcijom protonskih kiselina sa Lewisovim kiselinama imaju abnormalno visoke vrijednosti kiselosti. IN naučni svet zovu se: kompleksne protonske kiseline.
Magic acid
Da. Sve je tačno. Magic acid. Tako se to zove. Magična kiselina je mješavina fluorovodonika ili fluorosulforonske kiseline sa antimon pentafluoridom. Hemijska formula Ova veza je prikazana na slici:

Ovo čudno imeČarobna kiselina je dobijena na božićnoj zabavi hemičara koja je održana početkom 1960-ih. Jedan od članova istraživačke grupe J. Olaha pokazao je smiješan trik rastvarajući voštanu svijeću u ovoj nevjerovatnoj tekućini. Ovo je jedna od najjačih kiselina nove generacije, ali supstanca koja će je nadmašiti po jačini i kiselosti već je sintetizirana.
Najjača kiselina na svetu
Karboranska kiselina je karboranska kiselina, koja je daleko najjače jedinjenje na svijetu. Formula najjače kiseline izgleda ovako: H(CHB11Cl11).
Ovo čudovište je stvoreno 2005. godine na Kalifornijskom univerzitetu u bliskoj saradnji sa Novosibirskim institutom za katalizu SB RAS.
Sama ideja sinteze nastala je u glavama naučnika zajedno sa snom o novim, do sada neviđenim molekulima i atomima. Nova kiselina je milion puta jača od sumporne kiseline, ali nije nimalo agresivna, a najjača kiselina se lako može čuvati u staklenoj boci. Istina, s vremenom se staklo otapa, a s povećanjem temperature brzina ove reakcije značajno raste.

Ova nevjerovatna mekoća je posljedica visoke stabilnosti nove smjese. Kao i sve kisele hemikalije, karboranska kiselina reaguje spremno, donirajući svoj jedini proton. U ovom slučaju, kiselinska baza je toliko stabilna da se hemijska reakcija ne odvija dalje.
Hemijska svojstva karboranske kiseline
Nova kiselina je odličan donor H+ protona. To je ono što određuje snagu ove supstance. Otopina karboranske kiseline sadrži više vodikovih jona od bilo koje druge kiseline na svijetu. IN hemijska reakcija SbF 5 - antimon pentafluorid, vezuje fluor ilon. U tom slučaju se oslobađa sve više i više atoma vodika. Stoga je karboranska kiselina najjača na svijetu - suspenzija protona u njenoj otopini je 2 × 10 19 puta veća od one u sumpornoj kiselini.
kako god kisele baze Ova veza je neverovatno stabilna. Molekul ove supstance sastoji se od jedanaest atoma broma i isto toliko atoma hlora. U svemiru te čestice formiraju složenu, geometrijski pravilnu figuru, koja se naziva ikosaedar. Ovakav raspored atoma je najstabilniji i to objašnjava stabilnost karboran kiseline.

Značenje karboranske kiseline
Najjača kiselina na svijetu svojim je kreatorima donijela zaslužene nagrade i priznanja u naučnom svijetu. Iako sva svojstva nove supstance nisu u potpunosti shvaćena, već postaje jasno da značaj ovog otkrića prevazilazi laboratorije i istraživačke institute. Karboranska kiselina može se koristiti kao moćan katalizator u raznim industrijskim reakcijama. Osim toga, nova kiselina može stupiti u interakciju s najtvrdokornijim kemikalijama - inertnim plinovima. Trenutno se radi na tome da se omogući reakcija ksenona.
Nesumnjivo, zadivljujuća svojstva novih kiselina naći će svoju primjenu u različitim oblastima nauke i tehnologije.
Postoje mnoge kiseline koje čak i u minimalnim količinama predstavljaju opasnost za ljude. Mnogi ljudi vjeruju da je sumporna kiselina najopasnija, ali to apsolutno nije istina. Karboranska kiselina se smatra najjačom, koja se može čuvati samo u posebnim posudama. Višestruko je jača od sumporne kiseline i omogućava brzo otapanje metala, stakla i drugih tvari koje su otporne na druge kemikalije. Ali ako je karboranska kiselina vrlo rijetka, i to samo u laboratorijskim uvjetima, tada možete naići na drugu moćnu supstancu u Svakodnevni život. Prema mnogim stručnjacima, najotrovnija kiselina je cijanovodonična kiselina, a može se naći ne samo u laboratoriji, već iu hrani.
Kako se možeš otrovati?
Cijanovodonična kiselina je veoma toksična. Kada uđe u ljudski organizam, znaci trovanja se javljaju prilično brzo. Ova supstanca može ući u organizam sa proizvodima koji je sadrže, kao i sa onim proizvodima koji su tretirani cijanidom.
Većina ove toksične supstance nalazi se u bademima. Ukupan iznos može doseći i do 3%. Osoba treba da pojede samo malu šaku badema da bi se otrovala. Osim toga, ova opasna tvar se nalazi u sjemenkama bobičastog voća i nekih plodova. Većina kiselina sadrži:
- breskva – do 2,8%;
- kajsija – do 1,6%;
- šljiva – do 0,95%;
- trešnja – oko 0,8%;
- jabuka – oko 0,6%.
U zrnu badema i jezgri voća cijanovodonična kiselina nije prisutna u čistom obliku, već u obliku amigdalin glikozida. Upravo ta supstanca daje specifičan ukus i aromu orašastim plodovima. Jednom u ljudskom tijelu, amigdalin se razlaže na tri komponente, od kojih je jedna cijanovodonična kiselina. Ovom supstancom posebno su bogati gorki bademi, tako da odrasli mogu jesti ovaj proizvod u malim količinama, ali ga djeca nikako ne bi smjela jesti.
Veliku opasnost predstavljaju vina od bobica i voća sa sjemenkama. Vino natopljeno trešnjama sa košticama, šljivama i kajsijama može dovesti do trovanja.
Kompoti i džem od bobičastog voća zajedno sa sjemenkama ne predstavljaju opasnost po zdravlje. Kada se zagrije na 80 stepeni, cijanovodonična kiselina se raspada na sigurne komponente.
Koliko kiseline će izazvati trovanje
 Količina hrane koju trebate pojesti da biste se otrovali može značajno varirati. Zavisi od starosti osobe, tjelesne težine, opšte stanje zdravlje i prisutnost kroničnih patologija. Ali postoje proseci koje treba pratiti.
Količina hrane koju trebate pojesti da biste se otrovali može značajno varirati. Zavisi od starosti osobe, tjelesne težine, opšte stanje zdravlje i prisutnost kroničnih patologija. Ali postoje proseci koje treba pratiti.
Do teške intoksikacije može doći ako pojedete 30 oraha badema, više od 50 koštica kajsije, više od 70 koštica šljive ili trešnje. Možete se otrovati ako pojedete više od 100 sjemenki jabuke.
Pod uticajem same otrovne kiseline može doći do smrtonosnog trovanja. Kritična doza amigdalina je 1 mg po kilogramu tjelesne težine. Dovoljno je pojesti 40 zrna gorkog badema ili 100 koštica kajsije da biste dobili smrtonosno trovanje.
Gurmani koji zaista vole bademove orahe u nepromijenjenom obliku trebali bi kupiti delikatesu samo u specijaliziranim trgovinama. Pakovanje mora sadržavati sve podatke o proizvođaču i sastavu proizvoda. Čak i slatki bademi mogu dovesti do trovanja ako se konzumiraju u prevelikoj količini.
Gorki bademi se danas koriste samo u proizvodnji određenih lijekova i kozmetičkih proizvoda. Takvi orašasti plodovi se praktički ne jedu.
Simptomi trovanja
Cijanovodonična kiselina, kada uđe u krvotok, dolazi u kontakt sa crvenim krvnim zrncima, dok blokira odvajanje kiseonika i njegov dalji prenos u tkiva. Zbog toga se količina kisika u krvi jako povećava, ali on uopće ne dolazi do organa, što dovodi do hipoksije. Mozak je prvenstveno zahvaćen. Sve funkcije ovog organa su ozbiljno inhibirane, a funkcionisanje svih sistema i drugih važnih organa u organizmu je poremećeno.
Prilikom trovanja ovom kiselinom pojavljuju se sljedeći karakteristični znakovi:
- koža i sve sluznice postaju svijetlo ružičaste;
- jaka glavobolja, kao i vrtoglavica, usne utrnu i zjenice se šire;
- postoji neravnoteža, osoba ne može normalno stajati na nogama, poremećena je koordinacija pokreta;
- puls se ubrzava, kao i disanje;
- žrtva osjeća bol u grudima i kratak dah;
- javlja se mučnina i povraćanje;
- postoji metalni ukus i gorčina u ustima;
- može doći do nekontrolisanog pražnjenja crijeva.
Žrtva ispušta karakterističnu aromu gorkog badema, po čemu se može utvrditi da je osoba otrovana. Ako je stanje vrlo teško, ubrzano disanje se brzo zamjenjuje sporim pulsom. Dolazi do paralize respiratornog centra i počinju konvulzije.
Ako se u slučaju trovanja cijanovodonične kiseline žrtvi ne pruži pomoć u roku od 3 minute, nastupit će smrt.
Urgent Care
U slučaju trovanja jakom kiselinom - cijanovodonične kiseline, morate odmah pozvati hitnu pomoć. Prije dolaska ljekara žrtvi se pruža prva pomoć koja se sastoji od sljedećih mjera:

Protuotrov za cijanovodičnu kiselinu je slaba otopina metilen plavog. Ovaj lijek obično daju ljekari hitne pomoći.
Nakon ukazane prve pomoći, žrtvu treba skinuti sa uske odjeće i staviti u krevet, uzdignute glave sa jastucima. Ako osoba ima zbunjenu svijest, onda se preporučuje da ponjuši pamučni štapić navlažen amonijakom. Amonijak, kada uđe u krv, neutralizira kiselinu.
Ako osoba nema disanje ili puls, potrebno je što prije izvršiti kompresije prsnog koša i umjetno disanje. Takve mjere se moraju provesti u prvih nekoliko minuta nakon prestanka vitalnih procesa.
U bolničkom okruženju pacijentu se daju antikonvulzivi, antidoti i lijekovi za obnavljanje normalne cirkulacije krvi. Tokom procesa oporavka, pacijentu se propisuje kompleks vitamina.
Nakon trovanja cijanovodonične kiseline, osoba treba neko vrijeme izbjegavati fizički i psihički stres. U ovom trenutku pacijentu se preporučuje da pije dosta tečnosti, uključujući mleko. Također treba puno šetati na svježem zraku, pridržavati se uravnotežene prehrane i odreći se svih loših navika.
Brzi razvoj nauke omogućava naučnicima da dođu do novih senzacionalnih otkrića u oblasti fizike, hemije i drugih oblasti. Naučni svijet je sistematski šokiran vijestima o stvaranju novih supstanci sa jedinstvenim, do sada neviđenim svojstvima. Naravno, obični ljudi ne prate uvijek takva otkrića. Ne znaju svi da je najjača kiselina na svijetu stvorena u Americi 2005. godine. Za mnoge, najmoćnija takva hemikalija ostaje sumporna kiselina, koja je dobro proučavana u školi.
Karboranska kiselina je najjača na svijetu
2005. godine naučnici koji rade na Kalifornijskom univerzitetu u SAD uspjeli su stvoriti novu kiselinu neviđene snage. Izumljeno jedinjenje je milion puta jače od koncentrovane sumporne kiseline. Naučnici su u tom trenutku krenuli u pronalaženje novog molekula koji će postati pravo otkriće u naučnom svijetu i uspjeli su postići pozitivan rezultat.
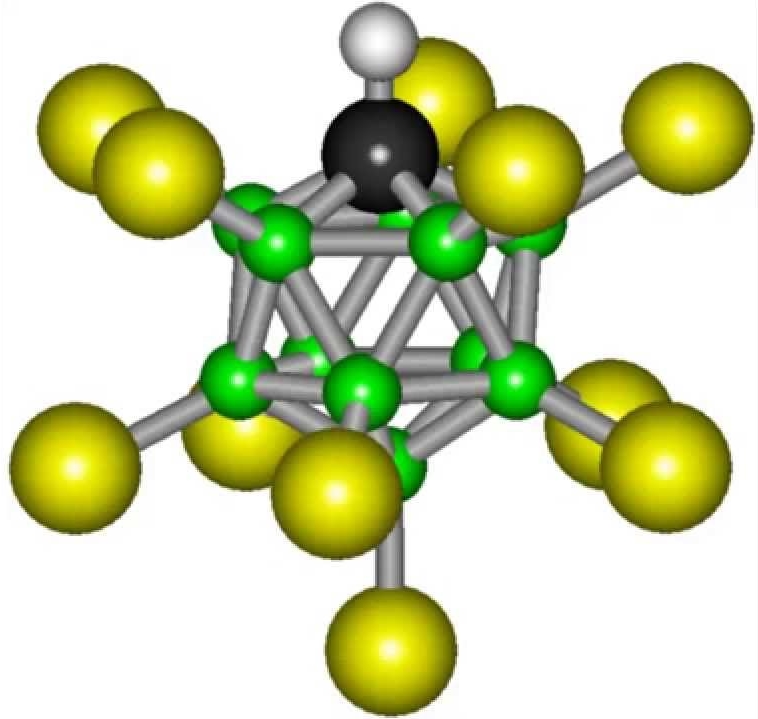
Formula karboran kiseline nije mnogo složena: H(CHB11Cl11). Ali i dalje neće biti moguće sintetizirati takvu tvar u običnom laboratoriju. Karboranska kiselina je više od trilion puta kiselija od obične vode.
Jedinstveno svojstvo najjače kiseline
Ako se negdje spomene najmoćnija kiselina na svijetu, ljudska mašta zamišlja supstancu koja rastvara sve što joj se nađe na putu. Zapravo, destruktivna svojstva uopće nisu glavni znak snage kemijske tvari. Na primjer, mnogi su vjerovali da je najmoćnija kiselina fluorovodonična kiselina, jer otapa staklo. Ali ovo je daleko od istine. Fluorovodonična kiselina korodira staklene posude, ali se može čuvati u polietilenskim posudama.

Prepoznata kao najmoćnija karboran kiselina na svijetu, lako se može skladištiti u staklenim posudama. Činjenica je da ovu hemikaliju karakteriše značajna hemijska stabilnost. Poput drugih sličnih spojeva, karboran kiselina, kada reagira s reagensima, oslobađa nabijene atome vodika. Nakon takve reakcije, sastav ima blagi negativni naboj i nema destruktivno djelovanje na okolne materijale.
Dalji rad sa karboranskom kiselinom
Naravno, tvorci karboranske kiseline postali su dobro poznati u svjetskoj naučnoj zajednici. Štaviše, sjajni naučnici su nagrađeni mnogim zasluženim nagradama za značajan doprinos razvoju nauke. Upotreba nove supstance više nije ograničena na naučne laboratorije: karboran kiselina se koristi u industriji kao moćan katalizator.

Jedinstvena karakteristika najmoćnije kiseline na svijetu je njena sposobnost interakcije s inertnim plinovima. Danas se provode mnoge studije kako bi se utvrdila mogućnost reakcije između ksenona i karboranske kiseline. Naučnici takođe neumorno rade na proučavanju drugih svojstava najmoćnije kiseline.
Najpoznatija jaka kiselina
Naučnici su dobro upoznati sa karboranskom kiselinom. Obični ljudi najčešće vjeruju da je sumporna kiselina najjača. To je zbog česte upotrebe tvari u industriji. Često ga koriste proizvođači mineralnih đubriva za proizvodnju superfosfata i amonijum sulfata.
Sumporna kiselina se široko koristi u metalurškoj industriji. Također se koristi za čišćenje metala od oksidacije. Proizvodnja tečnog goriva ne može se obaviti bez upotrebe sumporne kiseline. Može se koristiti za čišćenje sljedećih proizvoda:
- ulja za podmazivanje;
- kerozin;
- parafin;
- mineralne masti.

Ali nije samo industrijska upotreba ono zbog čega mnogi ljudi vjeruju da je sumporna kiselina najjača na svijetu. Ovo mišljenje je formirano zbog činjenice da se supstanca, kada dođe na meso, ugljeniše. Ovo svojstvo sumporne kiseline često se koristi u snimanju kriminalističkih filmova.
Najjača organska kiselina
Ako govorimo o najjačoj kiselini u organskoj hemiji, onda liderstvo ovdje pripada mravljoj kiselini. Supstanca je tako nazvana jer je pronađena u izlučevinama mrava. Mravlja kiselina ima širok spektar primjena. Često se koristi u medicini jer ima analgetska i iritirajuća svojstva. Mravlja kiselina je prisutna u mnogim mastima koje se koriste za liječenje modrica, proširenih vena i otoka. Lijekovi koji sadrže ovu supstancu mogu pomoći da se riješite akni.

Mravlja kiselina se takođe široko koristi u hemijskoj industriji. Takođe se koristi u poljoprivredi i pčelarstvu. Supstanca se takođe koristi u hrani kao aditiv E236.
Unatoč svojoj rasprostranjenosti, mravlja kiselina može predstavljati ozbiljnu prijetnju. Dodir koncentrovane supstance sa kožom izaziva opekotine ili jak bol. Čak i udisanje para mravlje kiseline može uzrokovati oštećenje respiratornog trakta. Ali pozitivno svojstvo tvari je da se brzo eliminira iz tijela bez nakupljanja u njemu.
Mnogi ljudi pokušavaju sami pronaći odgovor na pitanje koja je najjača kiselina. To nije teško razumjeti, ali morate pročitati posebnu literaturu. Za one koji samo žele da znaju odgovor ovo pitanje, ovaj članak je napisan.
Mnogi ljudi vjeruju da je najjača kiselina fluorovodonična kiselina, jer može otopiti staklo. Ova presuda je praktično neosnovana. U razumijevanju drugih, najjača kiselina je sumporna kiselina. Posljednja izjava ima sasvim logično objašnjenje. Činjenica je da je sumporna kiselina vrlo jaka među onima koji se koriste u industriji. U kontaktu sa živim tkivom, može ugljenisati meso i ostaviti teške opekotine za koje je potrebno dugo da zacijele i koje su problematične. Njegova proizvodnja ne zahtijeva posebne materijalne troškove. I slobodno se može reći da nije najjača. Nauka poznaje takozvane superkiseline. O njima ćemo dalje. Ali na nivou domaćinstva, najčešća od jakih kiselina je i dalje sumporna kiselina. Zato je opasna.
Pa kako kiselina može biti jaka i nježna? Odgovor leži u tome kako hemičari određuju jačinu kiseline. Jačina kiseline je sposobnost kiseline da doda ion vodonika osnovnim molekulima. Drugi primjer je izbor kiseline za čišćenje naslaga kamenca u bakrenom kotlu, napomenuo je. Mudri vlasnik kuće bira hlorovodoničnu kiselinu u odnosu na azotnu kiselinu jer hlorni deo hlorovodonične kiseline ne napada bakar, dok nitratni deo azotne kiseline rastvara kotlić u neredu otrovnih smeđih isparenja.
Mnogi moderni hemičari vjeruju da je najjača kiselina na svijetu karboran. To potvrđuju i rezultati detaljnih istraživanja. Ova kiselina je više od milion puta snažnija od koncentrovane sumporne kiseline. Njegovo fenomenalno svojstvo je sposobnost skladištenja u epruveti, što mnoge druge supstance iz pomenute serije nemaju. Hemijski sastav, koji se smatrao najjedljivijim, nije se mogao sačuvati u staklenim posudama. Činjenica je da karboranska kiselina ima značajnu hemijsku stabilnost. Kao i druge njemu slične tvari, kada reagira s drugim reagensima, donira im atome vodika s nabojima. Međutim, sastav koji ostaje nakon reakcije, iako ima negativan naboj, vrlo je stabilan i ne može dalje djelovati. Karboranska kiselina ima jednostavnu formulu: H(CHB 11 Cl 11). Ali dobiti gotovu tvar u običnoj laboratoriji nije lako. Vrijedi napomenuti da je više od trilijuna puta kiselija od obične vode. Prema pronalazaču, ovu supstancu pojavio se kao rezultat razvoja novih hemikalija.
Nove "jake, ali nježne" kiseline nazivaju se karbonatne kiseline. Tajna njihove moći je dvostruka. Ono što je najvažnije, karbonatni dio kiseline je izuzetno slaba baza, slabija od fluorsulfatnog dijela fluorsulfurne kiseline, koja je bila prethodni rekorder za najjaču kiselinu. Drugo, karborani imaju izuzetnu hemijsku stabilnost.
Prema Reedu, oni imaju ikosaedarski raspored od jedanaest atoma bora plus jedan atom ugljika, što je vjerovatno kemijski najstabilniji klaster atoma u cijeloj hemiji. To znači da karboranski dio kiseline ne može sudjelovati u hemiji korozije i razgradnje koju pokazuju fluorid i nitrat u fluorovodoničnoj kiselini i azotne kiseline. Kao rezultat toga, karboranske kiseline mogu dodati ione vodika u slabo bazične molekule bez uništavanja često osjetljivih, pozitivno nabijenih molekula koji se formiraju.
Lista najkaustičnijih supstanci sadrži fluorovodonične, fluorovodične i druge jake kiseline. Industrijski reagensi nisu uključeni. Međutim, i dalje morate biti oprezni s uobičajenim kiselinama kao što su sumporna, klorovodična, dušična i druge. Ne bih nikoga plašio, ali supstance sa ove liste obično se koriste za napade na zdravlje i namjerno narušavanje izgleda.
To je njihov jak, ali nežan kvalitet, dodao je Reed. Nijedan od ovih pozitivno nabijenih molekula ranije nije bio "punjen" na sobnoj temperaturi jer su ih prethodno korištene kiseline razložile. Snažne, ali nježne karbonanske kiseline prevazilaze ovu poteškoću, omogućavajući hemičarima da bliže pogledaju važne molekule čije je postojanje obično prolazno, rekao je Reed. Zakiseljene molekule su važni kratkotrajni međuprodukti u velikom broju kemijskih transformacija kataliziranih kiselinama, uključujući probavu hrane, poboljšanje benzina, formiranje polimera i farmaceutsku sintezu.
 je da je među masnim kiselinama koje se nalaze u hrani mravlja kiselina najjača. Često se koristi za konzerviranje povrća i u medicinske svrhe, ali samo u obliku rastvora.
je da je među masnim kiselinama koje se nalaze u hrani mravlja kiselina najjača. Često se koristi za konzerviranje povrća i u medicinske svrhe, ali samo u obliku rastvora.
Opet se mora reći da je najjača kiselina karboran. Ali danas moramo biti oprezniji prema supstancama koje se koriste u industriji i svakodnevnom životu. Hemija je prilično korisna i složena znanost, ali široko rasprostranjena proizvodnja jednostavnih spojeva ne zahtijeva posebno znanje, pa je stoga lako dobiti kiselinu u dovoljnim količinama. To stvara povećanu opasnost u slučaju neopreznog rukovanja ili provođenja loših namjera.
Koliko su jake karboranske kiseline? Najjača od njih je najmanje milion puta jača od koncentrovane sumporne kiseline i stotine puta jača od prethodnog rekordera, fluorosumporne kiseline. Koncentrirana sumporna kiselina je već više od milijardu puta jača od razrijeđene bazenske ili želučane kiseline. Kisela sredina jednaka ili veća od kiselosti karbonatnih kiselina ranije je postignuta dodavanjem pentafluorida antimona u fluorosumpornu kiselinu, ali ove mješavine su vrlo korozivne i imaju druga ograničenja.
Govoreći jezikom hemije, kiseline su one supstance koje pokazuju sposobnost oslobađanja vodikovih katjona, odnosno supstance koje imaju sposobnost da prihvate elektronski par kao rezultat formiranja kovalentna veza. Međutim, u običnom razgovoru pod kiselinom se najčešće podrazumijevaju samo oni spojevi koji, kada se formiraju u vodenim otopinama, proizvode višak H30+. Prisustvo ovih kationa u otopini daje supstanci kiselkast okus i sposobnost reagiranja na indikatore. U ovom materijalu ćemo govoriti o tome koja je tvar najjača kiselina, a također ćemo govoriti o drugim kiselim tvarima.
Kiseline koje su ovako jake nazivaju se superkiseline i one reagiraju s ugljovodonicima iz nafte u procesu koji se naziva kreking ugljikovodika. Ovo je važan proces u povećanju nivoa oktana u benzinu. Nove kiseline mogu biti vrlo važne u razumijevanju i poboljšanju ovog procesa, rekao je Reed. Karboranske kiseline vode ovo polje još dalje.
Najpoznatija jaka kiselina
Postoje mnoge druge molekule koje nestalno reaguju sa tradicionalnim kiselinama i stoga nisu baš korisne. Karboranske kiseline pružaju vrlo čistu kiselost bez ikakve žestine. Stoga bi trebalo omogućiti čistiju kiselinsku katalizu reakcija važnih za proizvodnju lijekova i naftnih derivata.
Fluorovodonična kiselina antimon pentafluorid (HFSbF5)
Za opisivanje kiselosti neke tvari postoji PH indikator, koji je negativni decimalni logaritam koncentracije vodikovih iona. Za obične supstance, ovaj indikator se kreće od 0 do 14. Međutim, ovaj indikator nije prikladan za opisivanje HFSbF5, koji se naziva i “super kiselina”.
Reed kaže: Naše istraživanje uključuje pravljenje molekula koji nikada prije nisu napravljeni. Karboranske kiseline nam to omogućavaju. To je prava vrijednost ove studije. Nauka napreduje, a istovremeno studenti doživljavaju uzbuđenje otkrića dok postaju naučnici.
Univerzitet Kalifornije, Riverside, je doktorant istraživački univerzitet, živa laboratorija za inovativna istraživanja o pitanjima kritičnim za unutrašnjost južne Kalifornije, državu i zajednice širom svijeta. Jaka kiselina se definira kao pH vrijednost, što je jačina vodonika koja čini kiselinu jakom. Međutim, pH vrijednost ne radi u rastućem redoslijedu. Što je pH vrijednost niža, kiselina će biti jača. pH skala se kreće od 1 do rastvora sa pH vrednošću manjom od 7 smatraju se kiselinama, dok se rastvori sa pH većim od 7 smatraju bazama.
Ne postoje tačni podaci o djelovanju ove tvari, ali je poznato da je čak 55% otopina HFSbF5 gotovo 1.000.000 puta jača od koncentriranog H2SO4, koji se u običnim umovima smatra jednom od najjačih kiselina. Međutim, pentafluorid antimona je prilično rijedak reagens, a sama tvar stvorena je samo u laboratorijskim uvjetima. Ne proizvodi se u industrijskom obimu.
Lista najjačih kiselina i njihova upotreba
Kiseline sa pH vrednošću manjom od 1 smatraju se najjačim, a rastvori sa pH vrednošću iznad 13 smatraju se jakom bazom. pH vrijednost je 2 i smatra se jednom od korisnih kiselina. Sol ili tartar koji se nalazi u njemu prirodno se razvija tokom proizvodnje vina. Miješa se s natrijum bikarbonatom i komercijalno se prodaje kao pekarski proizvodi. Koristi se u kulinarstvu i ima jedinstven kiselkast ukus.
Činjenica je da je to izvor dijamanata koji se nalaze na čepu ili dnu boce. Ovo se koristi kao organsko jedinjenje, a proizvodi se uz pomoć svih živih organizama. Ovi slatkiši nose upozorenja o njima, obavještavajući kupce da mogu izazvati iritaciju usta. Limun se obično nalazi u limunu i ima pH vrijednost. Obično se nalazi u hrani od citrusnog voća, a djeluje i kao međuprodukt u ciklusu limunske kiseline koji se javlja u metabolizmu aerobnih organizama. To je jaka i jestiva kiselina koja se koristi u aromama hrane i pića, poput bezalkoholnih pića. i limunade.
Karboranska kiselina (H(CHB11Cl11))
Još jedna super kiselina. H(CHB11Cl11)) je najjača kiselina na svijetu koja se može čuvati u posebnim posudama. Molekul supstance ima oblik ikosaedra. Karboranska kiselina je mnogo jača od sumporne kiseline. Može rastvoriti metale, pa čak i staklo.
Ova supstanca je stvorena na Univerzitetu Kalifornije u Sjedinjenim Američkim Državama uz učešće naučnika Novosibirskog instituta za katalitičke procese. Kako je rekao jedan od zaposlenika američkog sveučilišta, ideja koja stoji iza kreacije bila je želja da se stvore molekule do tada nepoznate nikome.
Dodaje se u sladoled, gdje djeluje kao emulgator koji sprječava oslobađanje masti. Djeluje i kao sredstvo za čišćenje i može se koristiti za uklanjanje kamenca sa isparivača i kotlova. Omekšava vodu, što ga čini korisnim u pravljenju deterdženata za pranje rublja i sapuna. Bez mirisa je i može se koristiti u kozmetičkim i dijetetskim suplementima.
Stoga se koristi u širokom spektru industrijskih, ali i domaćih proizvoda. Sumpor je također poznat kao sumporni; pH vrijednost je 5 i to hemijsko jedinjenje. Malo je dokaza da postoji u rastvoru, ali postoji u gasnoj fazi. Osnove za to su uobičajeni anjoni, bisulfat i sulfit. Djeluje kao redukcijsko sredstvo i dezinficijens. Oni također djeluju kao blagi izbjeljivači i mogu pomoći onim materijalima koji su uništeni hlornim izbjeljivačima.
Snaga H(CHB11Cl11)) je zbog činjenice da savršeno donira ion vodonika. U otopinama ove tvari koncentracija ovih iona je mnogo veća nego u ostalima. Drugi dio molekule, nakon oslobađanja vodika, uključuje jedanaest atoma ugljika, koji formiraju ikosaedar, koji je prilično stabilna struktura, povećavajući inertnost korozije.
pH vrijednost je 5 i radi se o mineralnoj kiselini. Inhibitor rđe Aditiv za hranu koji se koristi u stomatološkim proizvodima Sredstvo za dispergiranje elektrolita Industrijsko jetkanje koje se koristi u proizvodima za čišćenje doma. Takođe je kristalna čvrsta supstanca, deluje kao redukciono sredstvo i ima konjugirajuću bazu.
Još jedna najjača kiselina je poznatiji fluorovodonik. Industrija ga proizvodi u obliku rješenja, najčešće četrdeset, pedeset ili sedamdeset posto. Supstanca je dobila ime po fluorom, koji služi kao sirovina za fluorovodonik.
Ova supstanca nema boju. Kada se rastvori u H20, dolazi do značajnog oslobađanja toplote. Na niskim temperaturama, HF je sposoban da formira slaba jedinjenja sa vodom.
Upija vlagu iz vazduha i bezbojna je kristalna čvrsta supstanca. Formira sirup i rastvorljiv je u vodi kada se otpusti na visokoj temperaturi. Ova pH vrijednost je 0 i to je bezbojna tekućina. Koristi se za. Proizvodnja neorganskih i organskih nitrata Proizvodnja nitro jedinjenja za đubriva Boje-intermedijari Organske hemikalije Eksplozivi. Ako je osoba stalno izložena parama, to može uzrokovati kemijski penomonitis i kronični bronhitis.
Supstanca korodira staklo i mnoge druge materijale. Za njegov transport se koristi polietilen. Vrlo dobro reaguje sa većinom metala. Ne reaguje sa parafinom.
Prilično otrovan i ima narkotički efekat. Ako se proguta, može izazvati akutno trovanje, oštećenje hematopoeze, zatajenje organa i poremećaj respiratornog sistema.
To je bezbojna tečnost koja ispušta bele pare kada se ispusti u vodu. Dva druga imena za ovu kiselinu su sumporov oksid i sumporni anhidrid. Široko se koristi u proizvodnji hemikalija i eksploziva. Na primjer, koristi se u proizvodnji sintetičkih deterdženata, lijekova, industrijskih boja i pigmenata, gnojiva itd. Dugotrajno izlaganje može imati negativne posljedice po zdravlje i može ozbiljno oštetiti ljudsko tijelo.
Hlorovodonična kiselina ima pH vrednost. Ovo je agresivna i najmoćnija kiselina, koja se uglavnom koristi u laboratorijskim uslovima. Formiranje ove kiseline vrši se otapanjem klorovodika u vodi. Koristi se za mnoge stvari kao što su proizvodnja hlorida, đubriva i umiranje. Ostale upotrebe kiseline uključuju tekstil, galvanizaciju i proizvodnju gume. Ako je osoba izložena ovoj jakoj klorovodičnoj kiselini, tada će izlaganje dovesti do sljedećih stvari.


Supstanca je jaka kiselina sa dvije baze. Sumpor u spoju ima najviše oksidacijsko stanje (plus šest). Bez mirisa je i boje. Najčešće se koristi u otopini s vodom ili sumpornim anhidridom.
Postoji nekoliko načina da se dobije H2S04:
- Industrijska metoda (oksidacija dioksida).
- Metoda tornja (proizvodnja pomoću dušikovog oksida).
- Drugi (zasnovani na dobivanju tvari iz interakcije sumpor-dioksida sa razne supstance, nije baš uobičajeno).
Koncentrovani H2SO4 je vrlo jak, ali i njegove otopine predstavljaju ozbiljnu opasnost. Kada se zagrije, prilično je jak oksidant. U interakciji s metalima, oni oksidiraju. U ovom slučaju, H2S04 se reducira u sumpor dioksid.
H2SO4 je veoma zajedljiv. Može zahvatiti kožu, respiratorni trakt, sluzokože i unutrašnje organe ljudi. Veoma je opasno ne samo uneti ga u telo, već i udisati njegove pare.
Mravlja kiselina (HCOOH)
Ova supstanca je zasićena kiselina sa jednom bazom. Zanimljivo je da se uprkos svojoj snazi koristi kao dodatak prehrani. U normalnim uslovima je bezbojan, rastvorljiv u acetonu i lako se meša sa vodom.
HCOOH je opasan u visokim koncentracijama. Sa koncentracijom manjom od deset posto, djeluje samo iritativno. Na višim nivoima, može korodirati tkiva i mnoge supstance.
Koncentrovani HCOOH u kontaktu sa kožom izaziva veoma jaku opekotinu koja izaziva jak bol. Pare tvari mogu oštetiti oči, respiratorne organe i sluzokože. Unošenje unutra izaziva ozbiljno trovanje. Međutim, kiselina u vrlo slabim koncentracijama lako se obrađuje u tijelu i uklanja iz njega.

U slučaju trovanja metanolom u organizmu se stvara i mravlja kiselina. To je njen posao ovaj proces dovodi do oštećenja vida zbog oštećenja vidnog živca.
Ova tvar se u malim količinama nalazi u voću, koprivi i izlučevinama nekih insekata.
dušična kiselina (HNO3)
Dušična kiselina je jaka kiselina sa jednom bazom. Dobro se miješa sa H20 u različitim omjerima.
Ova tvar je jedan od najpopularnijih proizvoda kemijske industrije. Postoji nekoliko metoda za njegovu pripremu, ali najčešće se koristi oksidacija amonijaka u prisustvu platinastog katalizatora. HNO3 se najčešće koristi u proizvodnji đubriva za poljoprivredu. Osim toga, koristi se u vojnoj sferi, u stvaranju eksploziva, u industriji nakita, za određivanje kvaliteta zlata, kao i u stvaranju određenih lijekova (na primjer, nitroglicerina).

Supstanca je veoma opasna za ljude. Pare HNO3 oštećuju respiratorni trakt i sluzokožu. Kiselina koja dospije na kožu ostavlja iza sebe čireve kojima je potrebno jako dugo da zacijele. Koža takođe poprima žutu nijansu.
Kada je izložen toplini ili svjetlosti, HNO3 se razgrađuje do dušikovog dioksida, koji je prilično otrovan plin.
HNO3 ne reaguje sa staklom, zbog čega se ovaj materijal koristi za skladištenje supstance. Kiselinu je prvi nabavio alhemičar Džabir.