Pojam teorije kristalnog polja. Modeli hemijskog vezivanja. Teorija kristalnog polja. Kompleksi niskog i visokog okretanja
Slabo polje jako polje
Srednje polje
Frac34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
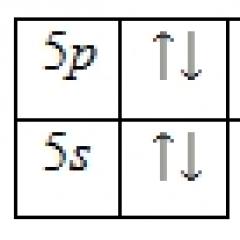
Ligandi slabog polja sa elementima serije 3d formiraju komplekse visokog spina, a ligandi jakog polja formiraju komplekse sa niskim spinom. Razlika između njih utiče na elektronsku strukturu kompleksa samo za konfiguracije d 4 – d 7:
3+ d 5 3– d 5
high-spin kompleks-nisko-spin kompleks
H 2 O – ligand slabog polja CN – – ligand jakog polja
Nisko-spin kompleksi su uvijek stabilniji od kompleksa visokog okreta. Ligandi srednjeg polja, u zavisnosti od uslova (naboja i prirode centralnog atoma), mogu formirati i komplekse sa visokim i niskim spinom.
Primjer. Na osnovu TCP, napravite pretpostavku o elektronskoj strukturi heksaamin kobalta(II) (Δo = 21600 cm–1, P = 21000 cm–1) i heksaamin kobalta(III) jona (Δo = 9500 cm–1, P = 22500 cm–1).
Amonijak je ligand srednjeg polja i, u zavisnosti od stepena oksidacije metala, može formirati i komplekse sa visokim i niskim obrtom. Otkrijmo koji će kompleksi biti energetski stabilniji za kobalt(II) i kobalt(III). Da biste to učinili, uporedite ESC svakog jona u jakom i slabom polju:
(a) 3+, d 6

jako polje slabo polje
ESKP (jako polje) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 cm –1
ESKP (slabo polje) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 cm – 1
Dobitak energije je veći u slučaju kompleksa sa niskim okretanjem.
(b) 2+ , d 7

jako polje slabo polje
ESKP (jako polje) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 cm–1
ESKP (slabo polje) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 cm – 1
Dobitak energije je veći u slučaju kompleksa sa visokim okretanjem.
Dakle, jon 3+ ima niski spin, a 2+ ion visokog spina.
ESC raste sa povećanjem Δo, međutim, on je različit za stanja sa visokim i niskim spinom (slika 1.28. Ovisnost ESC za komplekse sa visokim i niskim spinom sa konfiguracijom d 6 od vrednosti Δo = 10Dq Područje u kojem je moguće postojanje obje države je osenčeno). Područje blizu točke presjeka ovih dviju linija odgovara kompleksima koji mogu postojati iu stanjima visokog i niskog spina.
Primer je kompleks gvožđa(II) tiocijanata sa 1,10-fenantrolinom, koji je visoko-spin (paramagnetičan) na niskim temperaturama i nisko-spin (dijamagnetičan) na povišenim temperaturama (M. Marchivie, P. Guionneau, J. A. K. Howard , G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, v. 124, str. 194). Promjenu višestrukosti prati promjena međuatomskih udaljenosti i geometrije koordinacionog okruženja: kompleks sa niskim spinom je pravilan oktaedar, a kompleks sa visokim spinom je iskrivljen. Obrnuti prijelaz u stanje visokog spina moguć je pod utjecajem visokih pritisaka ili zračenja. Trenutno je poznato nekoliko desetina takvih sistema.
Govoreći o svojstvima σ-donora i π-akceptora liganda, izašli smo iz okvira TCP, koristeći pristupe molekularne orbitalne metode primijenjene na kompleksna jedinjenja (1. tom). Podsjetimo da je slika cijepanja d-orbitala fragment opće šeme molekularnih orbitala u oktaedarskom kompleksu, gdje se t 2g orbitale smatraju nevezujućim, a npr. antivezujućim (slika 1. svezak) .
Formiranje veza u oktaedarskom kompleksu bez π-veze uključuje s-, p- i d-orbitale metala i jednu orbitalu iz svakog liganda. Od 15 atomskih orbitala nastaje 15 molekularnih orbitala, njih šest (a 1 g, t 1 u, e g (fusnota: slovo u oznaci orbitala označava stepen njihove degeneracije: t - tri puta degenerisano, e - dvostruko degenerisan, a - nedegenerisan, i prisustvo centra simetrije: g - simetričan, u - asimetričan)) σ-vezujući, tri (t 2 g) - nevezujući i šest (e g *, t 1 u *, a 1 g *) σ-labavljenje. Vezne orbitale su po energiji bliže ligandnim orbitalama, dok su orbitale koje se ne vezuju uglavnom lokalizovane na atomu metala. Energija d xy , d xz , d yz (t 2 g) metalnih orbitala se praktično ne menja tokom formiranja kompleksa.
Prisustvo niskoenergetske prazne orbitale u ligandu, simetrično slične metalnim orbitalama, dovodi do smanjenja energije t 2g orbitala, praktično bez uticaja na npr. povećanje Δo (Sl. 1.29. Fragmenti MO dijagram za kompleks kobalta(III) sa σ-donorskim ligandom (a) i σ-donor, π-akceptor ligandom (b)).
Jahn-Teller efekat. Godine 1937. Yang i Teller su dokazali teoremu prema kojoj je svaki nelinearni molekul u degeneriranom elektronskom stanju nestabilan i spontano prolazi kroz distorziju koja smanjuje njegovu simetriju i dovodi do uklanjanja degeneracije. Teorema predviđa samo samu činjenicu otklanjanja degeneracije, ali ne ukazuje na to kako će se ona ukloniti. Na osnovu ove teoreme objašnjeno je izobličenje oktaedarske geometrije niza kompleksa, a sama činjenica prisustva takve distorzije nazvana je Jahn-Teller efektom. Pogledajmo primjer. Kompleksi bakra(II) sa konfiguracijom d9, po pravilu, ne predstavljaju pravilan oktaedar, već su izduženi ili sabijeni duž jedne od osi (Sl. 1.30. Distorzija oktaedarske geometrije u kompleksima bakra(II)). Razmotrimo slučaj proširenog oktaedra. Uklanjanje liganada lociranih duž z ose uzrokuje uklanjanje degeneracije zbog promjene energija orbitala. Orbitale usmjerene duž ose z (d xz, d yz, d z 2) slabije djeluju s orbitalama liganada u odnosu na orbitale koje nemaju z komponentu (d xy, d x 2 -y 2), te stoga smanjuju njihovu energiju. Par orbitala iste simetrije, sa z-komponentom (d xz, d yz), ostaje degenerisan i dobija povećanu energiju. (Sl. 1.31. Promjena energija d-orbitala kada je oktaedar izobličen). Jahn-Tellerov efekat se najjače manifestira u kompleksima s nejednako popunjenim e g orbitalama, odnosno sa konfiguracijama t 2g 3 e g 1 (koja odgovara d 4 ionu u slabom polju: CrCl 2, K 3 MnF 6) i t 2g 6 e g 3 (odgovara d 9 jonu: skoro svi kompleksi bakra(II)) i t 2g 6 e g 1 (odgovara d 7 jonu u jakom polju, rijetko, K 3 NiF 6). Beznačajan Jahn-Tellerov efekat je tipičan za komplekse sa nejednako popunjenim t 2g orbitalama, odnosno za elektronske konfiguracije t 2g 1 (d 1), t 2g 2 (d 2), t 2g 4 (d 4 u jakom polju) , t 2g 5 (d 5 u jakom polju), t 2g 5 e g 1 (d 6 u slabom polju), t 2g 5 e g 2 (d 7 u slabom polju). Joni sa konfiguracijama d 3 i d 5 u slabom polju, d 3 i d 6 u jakom polju, d 8 i d 10 nisu ni pod kojim okolnostima Jahn-Teller.
Jahn-Teller efekat se manifestuje u nejednakosti dužina veza u mnogim kompleksima bakra(II) i mangana(III) i u nemonotonoj promeni stepenastih konstanti stabilnosti kompleksa. Na primjer, u bezvodnom bakar(II) hloridu, atom bakra je okružen sa šest atoma hlora, od kojih se četiri nalaze na udaljenosti od 0,230 nm, a druga dva na udaljenosti od 0,295 nm od njega.
Poznati su kompleksi bakra(II) (Cl 2, (C 6 H 5 SO 3) 2 itd.), koji se sastoje od nekoliko kristalografski neekvivalentnih Jahn-Teller jona, svaki sa svojom vrstom distorzije, koji se pretvaraju jedan u drugi, mijenjajući se udaljenost metal-ligand toliko brza da se sveukupno sve udaljenosti metal-ligand čini da su iste. Ovaj slučaj je pozvan dinamički ili pulsirajući Jahn-Teller efekt(P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214) .
Jahn-Tellerov efekat, međutim, nije univerzalni zakon. Trenutno su poznati kompleksni joni sa Jahn-Teller konfiguracijom, koji su neiskrivljeni oktaedri: 4–, 3+.
Dijeljenje u poljima sa simetrijom koja nije oktaedarska.
Pored oktaedarskih, poznati su i mnogi kompleksi različite geometrije - kvadratno-ravninski, tetraedarski, trigonalno-piramidalni, kvadratno-piramidalni, linearni itd. Podjela u svakom od ovih polja je drugačija nego u oktaedru, tj. određen simetrijom koordinacijskog poliedra.
Kvadratno-planarni kompleksi se mogu smatrati ekstremnim slučajem tetragonalne distorzije oktaedarske geometrije, kada se ligandi smješteni duž jedne od koordinatnih osa uklone u beskonačnost (slika 1.27b). Oznake orbitala prikazane su na slici. Planarno-kvadratni kompleksi su najtipičniji za jone elektronske konfiguracije d 8 – Ni 2+, Pd 2+, Pt 2+, Au 3+. Njihova stabilnost naglo raste sa povećanjem Δ, odnosno kada se prelaze sa elemenata 3d serije na teške prelazne elemente. Tako, na primjer, ako paladij, platina i zlato imaju gotovo sve komplekse s koordinacijskim brojem od četiri kvadrata, tada nikal formira planarno-kvadratne komplekse samo s ligandima visokog polja: 2–, Ni(dmg) 2. Kompleksi nikla(II) sa ligandima niskog polja, kao što su halogeni, imaju tetraedarsku geometriju.
Neki kvadratno-planarni kompleksi prelaznih metala formiraju lance u čvrstom obliku sa ligandima za premošćivanje, na primer Pt-CN-Pt u K 2 Br 0,3, gde su atomi platine delimično u +4 oksidacionom stanju. Visoka sposobnost prodiranja 5d orbitala osigurava njihovo preklapanje sa formiranjem jednog energetskog pojasa, a samim tim i metalnu provodljivost u pravcu lanca. Takvi molekularni kompleksi su sposobni da provode električnu struju i trenutno se intenzivno proučavaju.
U polju tetraedarske simetrije, orbitale d xy , d yz , d xz imaju maksimalnu energiju, zovu se t 2 -orbitale, a minimalna energija su orbitale d x 2 –y 2 i d z 2, označavaju se e . Zbog prisustva manjeg broja liganada i njihovog različitog rasporeda, tetraedarsko polje (Sl. 1.32. Poređenje cijepanja u tetraedarskom i oktaedarskom polju) ispada 2,25 puta slabije od oktaedarskog: .
Većina tetraedarskih kompleksa je sa visokim okretanjem (fusnota - Poznato je nekoliko primjera tetraedarskih kompleksa sa niskim okretajem, na primjer, Cr(N(Si(CH 3) 3) 2 ) 3 NO (hrom(II), d 4 ; D. C. Bradley, Chem. Ber., 1979, 11, 393); CoL 4, gdje je L 1-norbornil (kobalt(IV), d 5; E. K: Brune, D. S. Richeson, K. H. Theopold, Chem. Commun., 1986. , 1491)). Maksimalna stabilizacija tetraedarskog okruženja kristalnim poljem postiže se konfiguracijama d 2 (FeO 4 2–, MnO 4 3–) i d 7 (2–). Zbog relativno niske energije stabilizacije, tetraedarske komplekse češće formiraju joni sa konfiguracijama d 0 (TiCl 4, MnO 4 –, CrO 4 2–), d 5 u slabom polju (FeCl 4 –) i d 10 (ZnCl 4 2–) sa nultim ESKP, kao i jonima neprelaznih metala (AlCl 4 –). Formiranju tetraedarskih kompleksa u odnosu na oktaedarske često pogoduje sterički faktor, na primjer, ion je stabilniji od 3–.
Korištenje TCP-a za objašnjenje stabilnosti kompleksa. Irving-Williams serija. Teorija kristalnog polja omogućava objašnjenje nemonotonske prirode promjena energija kristalne rešetke oksida i halogenida, konstante stabilnosti kompleksa itd. Redoslijed promjene energija hidratacije dvostruko nabijenih katjona 3d metala generalno se poklapa sa prirodom promena u ESC u visokospinskim kompleksima (slika 1.33. Promena energije hidratacije dvonabijenih katjona metala 3d serije (a) i promena ESC u visokospinskim kompleksima (b)) ), što je jača stabilizacija kristalnog polja, to je veća hidratacija. Poznato je da konstante supstitucije molekule vode ligandom slabog polja L
2+ + L x– = (2-x)+ + H 2 O
pridržavajte se Irving-Williams serije: Mn 2+< Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ < Zn 2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Nefeloauksetički efekat. Otkriveno je da međusobno odbijanje d-elektrona slabi kada se atom stavi u polje liganada. Ovaj efekat liganda na d-elektrone atoma metala naziva se nefeloauksetički efekat od grčkih reči νεφελη – oblak i αυξανω – povećanje. Niz liganada, raspoređenih po povećanju njihovog uticaja na metalne orbitale, skoro u potpunosti odgovara spektrohemijskom nizu. Razlog nefeloaksetičkog efekta je preklapanje d-orbitala metala sa orbitalama liganada, zbog čega se d-oblak širi u prostoru. Prisustvo ovog efekta jasno pokazuje ograničenja najjednostavnijeg elektrostatičkog modela - teorije kristalnog polja, koja pretpostavlja da su lignade tačkasti negativni naboji.
Teorija polja liganda. Teoriju kristalnog polja razvio je Bethe 1929. Trenutno se široko koristi u modificiranom obliku sa korekcijama za neku kovalentnost veze metal-ligand. Ova teorija se zove teorija polja liganda. Prisustvo kovalentnog doprinosa menja energiju metalnih orbitala u poređenju sa onom izračunatom TCP. Udio kovalentnosti se uzima u obzir uvođenjem korektivnih faktora koji omogućavaju izjednačavanje eksperimentalnih vrijednosti sa izračunatim.
Bojanje kompleksa.
Boja kompleksa d-prijelaznih elemenata povezana je s prijelazima elektrona s jedne d-orbitale na drugu. Ovo je jasno ilustrovano primjerom jona Ti 3+, o kojem se govori u prvom tomu udžbenika. Apsorbirajući energiju koja odgovara plavom i zelenom dijelu vidljivog spektra, jedini d-elektron u Ti 3+ jonu prelazi na e g orbitalu (Sl. 1.35. Spektar 3+ jona). Boja jona je zbog dodatnih boja - crvene i ljubičaste. (Fusnota - Pažljiv čitalac će primetiti izvesnu asimetriju apsorpcionog pojasa. To je posledica blagog cepanja nivoa t 2g izazvanog Jahn-Teller efektom). Dijagram koji prikazuje komplementarne boje i koji je dobro poznat svakom umjetniku prikazan je na drugom listu udžbenika. Energija prijelaza, izražena u recipročnim centimetrima (1000 cm –1 = 12 kJ), odgovara parametru cijepanja Δο - najčešće se određuje iz elektronskih spektra. Talasna dužina je obrnuto proporcionalna energiji:
 .
.
U slučaju kompleksa sa velikim brojem elektrona, slika spektra postaje složenija i u njoj se pojavljuju dodatne trake. To je zbog činjenice da se pobuđeno stanje t 2g 1 e g 1 može realizovati na nekoliko načina, u zavisnosti od toga na kojoj se d-orbitali nalaze elektroni. Na primjer, stanje u kojem elektroni zauzimaju d xy i d x 2 –y 2 orbitale bit će veće energije od stanja d xy 1 d z 2 1 zbog većeg odbijanja elektrona duž x ose. Energija koja odgovara pojasu sa najnižom energijom jednaka je parametru cijepanja Δo.
Da bismo detaljnije opisali elektronske spektre, potrebno je uvesti neke koncepte. Nazovimo bilo koji raspored elektrona na podnivou mikrostanje. Broj mikrostanja N, u kojima n elektrona zauzimaju x orbitala, jednak je

Svako mikrostanje karakteriziraju vlastite vrijednosti spina i ugaonog momenta. Skup mikrostanja sa identičnim energijama naziva se termin, na primjer, 3 P, 5 D, 1 S. Digitalni indeks označava višestrukost, koja se izračunava kao:
višestrukost = broj nesparenih elektrona u osnovnom stanju + 1.
Nazivi pojmova čitaju se sa naznakom višestrukosti: „triplet P“, „kvintet D“, „singlet S“. Slovo označava ukupni ugaoni moment L atoma ili jona, koji je jednak maksimalnoj vrijednosti zbira ugaonih momenta m l pojedinačnih orbitala koje zauzimaju elektroni. Na primjer, ion Ti 3+ sadrži jedan d-elektron, broj mikrostanja je N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (pošto je za d-orbitalu m l = –2, –1, 0, 1, 2 broj elektrona 1, stoga je maksimalni zbir m l jednak najvećoj vrijednosti m l), višestrukost 1 + 1 = 2. Dakle, član osnovnog stanja (sa najmanjom energijom) je 2 D. U slučaju jona s elektronskom konfiguracijom d 2 N = (2´5)!/2!( 2´5 – 2)! = 45, L = 3(F) (budući da je za d-orbitalu m l = –2, –1, 0, 1, 2 broj elektrona 2, stoga je maksimalni zbir dvije najveće vrijednosti jednako m l), višestrukost 2 + 1 = 3. Shodno tome, termin osnovnog mikrostanja je 3 F. Sa drugačijim rasporedom dva elektrona na d-podnivou, postižu se stanja opisana drugim pojmovima - 3 P, 1 G , 1 D, 1 S, itd. Odnos između brojčanih vrijednosti L i abecednih simbola je dat u nastavku:
L = 0 1 2 3 4 5 6 7
Slično, možemo izvesti termine osnovnog i pobuđenog stanja za druge jone d-elemenata (Tabela 1.5.). Imajte na umu da su pojmovi za jone sa konfiguracijom d n i d 10-n isti.
Table. 1.5.
Termini osnovnih i najbližih pobuđenih stanja za različite konfiguracije d-elektrona.
Termini su podijeljeni u oktaedarskom polju poput orbitala, označenih sličnim slovima. D termini se dele na T 2 g i E g komponente, kao d-orbitale, F termini - na T 1 g, T 2 g i A 2 g, kao f-orbitale. S i P termini uopće nisu podijeljeni. Mogućnosti za prelaze elektrona između različitih stanja ograničene su pravilima selekcije. Dakle, u kompleksima su dozvoljeni samo prijelazi između stanja sa istom multiplicitetom. Svaki takav prijelaz odgovara pojasu u spektru apsorpcije. Kao primjer, razmotrite elektronski spektar kompleksa 3+ (slika 1.36. Elektronski spektar kompleksa 3+). Tri trake su rezultat tri elektronska prijelaza: 4 A 2 g ® 4 T 2 g, 4 A 2 g ® 4 T 1 g, 4 A 2 g ® 4 T 1 g (P). Prijelaz sa najnižom energijom odgovara vrijednosti parametra cijepanja: Δo = 17400 cm–1. Kompleks apsorbuje svetlost u crvenom (17400 cm–1) i plavom (23000 cm–1) delovima vidljivog spektra i u bliskom ultraljubičastom (37800 cm–1), stoga ima ljubičastu boju.
Prema Laporteovom pravilu, prijelazi između stanja s istim paritetom, koji uključuju s-s, p-p, d-d, f-f prijelaze, su malo vjerojatni, ili su, govoreći spektroskopijskim jezikom, zabranjeni u oktaedarskim kompleksima. Zabranjeni prijelazi su mogući, ali se javljaju s malim intenzitetom. Zbog toga soli prelaznih metala imaju uočljivu boju samo u koncentriranim rastvorima. Višestruko je slabija od boje permanganata ili dikromata, čiji ioni ne sadrže d-elektrone.
Laporteovo pravilo je primjenjivo samo u slučaju kompleksa koji imaju centar simetrije. Kada se oktaedar izobliči, centar simetrije nestaje, Laportova zabrana se ukida i pojavljuje se boja. Na primjer, 3+ jon je bezbojan, ali otopine soli željeza(III) su često žuto-narandžaste zbog hidrolize koja dovodi do stvaranja asimetričnih čestica sa iskrivljenim oktaedarskim okruženjem.
Boju kompleksa, pored d-d prijelaza s jedne metalne d-orbitale na drugu (od t 2g do e g u oktaedarskim kompleksima), određuju još dva faktora: prijelazi sa ligandnih orbitala na metalne orbitale (oni se nazivaju prijenosom naboja ) i prijelazi unutar orbitala liganda. Ovi prijelazi ne potpadaju pod Laporteovo pravilo i stoga imaju veliki intenzitet.
Opseg prijenosa naboja prisutan je u elektronskom spektru bilo kojeg spoja, međutim, u nekim slučajevima je u ultraljubičastom dijelu spektra i ne percipiramo ga kao boju. Ako se smanji razlika između energija orbitala liganda i metalnih orbitala, pojas prijenosa naboja pada u vidljivi dio spektra. Upravo prijenos naboja objašnjava intenzivnu boju permanganata, dikromata, živinog sulfida, titanijum(IV) perokso kompleksa i mnogih drugih spojeva sa praznim d-orbitalama. U nekim slučajevima, pod utjecajem svjetlosti, prijenos naboja sa orbitala liganda na orbitale metala se događa nepovratno, odnosno praćen je kemijskim procesom. Primjer je fotohemijska razgradnja srebrnih halogenida, koja je osnova crno-bijele fotografije: Ag + Br – ¾® Ag 0 + Br 0 .
U elektronskom spektru kalijum permanganata uočavaju se četiri trake koje odgovaraju prijelazima elektrona sa orbitala koje se ne vezuju pretežno lokalizovane na ligandu (a 1, t 2 σ orbitale i e, t 1, t 2 π orbitale) u e*, t2 '' antivezujuće orbitale orbitale lokalizovane na atomu metala ((Sl. 1.37. Energetski dijagram tetraedarskog jona MnO 4 - sa π-vezom. Prelazi elektrona su prikazani strelicama):
ν 1 , Mn(e*) ¾ O(t 1) 17700 cm –1
ν 2 , Mn(t 2 '') ¾ O(t 1) 29500 cm –1
ν 3 , Mn(e*) ¾ O(t 2) 30300 cm –1
ν 4 , Mn(t 2 '') ¾ O(t 2) 44400 cm –1
Opseg sa najnižom energijom spada u vidljivi deo spektra (λ = 107/17700 = 565 nm), što odgovara apsorpciji zelene svetlosti i transmisiji grimizno-crvene svetlosti.
3. Mehanizmi reakcija koje uključuju kompleksna jedinjenja.
Velika većina hemijskih procesa odvija se kao sekvencijalni lanac nekih elementarnih faza, a jednadžba reakcije nosi samo informacije o glavnim krajnjim proizvodima reakcije. Ovaj niz elementarnih transformacija na putu od polaznih supstanci do proizvoda naziva se mehanizam. Intermedijarni, obično nestabilni spojevi kroz koje teče put od reaktanata do proizvoda nazivaju se međuprodukti. Svaki intermedijer ima određeni vijek trajanja, obično izuzetno kratak, do 10 -14 s. Na energetskom profilu reakcije odgovara minimumu (Sl. a) (Sl. 1.38. Energetski profili reakcije koja se odvija kroz: (a) srednje, (b) prelazno stanje.). U pravilu se intermedijari mogu detektirati u reakcijskoj smjesi spektralnim metodama, a samo u rijetkim slučajevima mogu se izolirati u pojedinačnom obliku. Stoga se glavne informacije o mehanizmu reakcije obično dobijaju proučavanjem njegove kinetike – određivanjem konstanti brzine i izračunavanjem parametara aktivacije (entalpija, entropija, zapremina). U ovom slučaju mehanizam je model koji je u skladu sa kinetičkim podacima, model koji se može poboljšati, modificirati, revidirati.
U nekim reakcijama ne nastaju međuprodukti, a prijelaz iz reaktanata u produkte odvija se uzastopno - jedan od atoma se postupno uklanja, a drugi se približava. U ovom slučaju se kaže da se reakcija odvija prelazno stanje ili aktivirani kompleks. Odgovara maksimumu u energetskom profilu reakcije (slika B).
Dodatak: Labilni i inertni kompleksi
Termodinamička stabilnost čestice određena je promjenom Gibbsove energije za reakciju njene disocijacije, odnosno vrijednošću konstante stabilnosti ovog procesa. Kinetička stabilnost pokazuje koliko brzo određena čestica stupa u interakciju s drugim česticama ili se raspada. Razmatra se hemijska čestica inertan, ako reaguje s poluživotom dužim od 1 minute. Čestice koje reaguju većom brzinom nazivaju se labilan. Mora se imati na umu da kinetička i termodinamička stabilnost ne ovise jedna o drugoj, odnosno da ista tvar može imati visoku konstantu stabilnosti i istovremeno biti inertna, ili, obrnuto, labilna. Neki takvi primjeri dati su u tabeli 1.6.
Tabela 1.6. Konstante stabilnosti i brzine supstitucije liganda u cijano-kompleksima nekih metala.
Henry Taube je pokazao vezu između kinetičke stabilnosti oktaedarskih kompleksa i elektronske konfiguracije centralnog jona u oktaedarskom polju. Prema Taubeu, sljedeći kompleksi su labilni:
· posjeduju barem jednu slobodnu t 2g orbitalu - mogu je koristiti u reakcijama prema asocijativnom (A, I a) mehanizmu, ili
· imati barem jedan elektron u eg orbitali - ovo pospješuje reakciju disocijativnim (D, I d) mehanizmom, jer Uklanjanje elektrona sa eg orbitale smanjuje energiju prelaznog stanja.
Tako su oktaedarski kompleksi hroma(III) (t 2g 3), niskospinovi kompleksi gvožđa(II) (t 2g 6) i gvožđa(III) (t 2g 5), kao i kompleksi 4d-, 5d- prelazni elementi se klasifikuju kao inertni sa brojem d-elektrona većim od dva.
KRAJ DODATAKA
Jedinstvena klasifikacija neorganskih reakcija još nije razvijena. Uobičajeno, možemo predložiti sljedeću shemu (Slika 1.39. Šema koja ilustruje klasifikaciju neorganskih reakcija):
1) Reakcije supstitucije, dodavanja ili eliminacije liganada utiču na promenu koordinacione sfere metala,
2) Redoks reakcije su povezane s promjenom elektronske konfiguracije metala, ali ne utječu na njegovo koordinacijsko okruženje,
3) Reakcije koordinisanih liganada uključuju promjenu liganda bez promjene koordinacijske sfere kompleksa.
Reakcije supstitucije. U širem smislu, reakcije supstitucije označavaju procese zamjene nekih liganada u koordinacionoj sferi metala drugim. Takve reakcije se mogu odvijati sa ili bez promjene oksidacijskog stanja. Slijedeći gornju klasifikaciju, ovaj termin ćemo koristiti samo u odnosu na reakcije koje se odvijaju bez promjene oksidacijskih stanja.
Klasifikaciju supstitucijskih reakcija u neorganskoj hemiji razvili su Langford i Grey. Zasniva se na definiciji takozvanog ograničavajućeg mehanizma, a ne na opisu određenog mehanizma. Prvo se utvrđuje stehiometrijski mehanizam, a zatim unutrašnji. Stehiometrijski mehanizam je niz elementarnih faza u prelasku sa polaznih supstanci na produkte. Može biti disocijativna (D), asocijativna (A) i razmjena (recipročna razmjena, I). Disocijativni i asocijativni procesi predstavljaju, takoreći, dva ograničavajuća slučaja, direktno suprotna jedan drugom. Oba procesa se odvijaju u dvije faze kroz formiranje međuproizvoda.
disocijativno (D)
Proces je dvostepeni, u graničnom slučaju teče kroz međuprodukt sa smanjenom koncentracijom:
ML 6 + L, + Y ¾® ML 5 Y
asocijativno (A)
Proces je dvofazni, karakteriziran formiranjem međuprodukta s povećanom koncentracijom:
ML 6 + Y, ¾® ML 5 Y + L
Međusobna razmjena (I)
Većina reakcija razmjene odvija se kroz ovaj mehanizam. Proces je jednofazni i nije praćen formiranjem međuproizvoda. U prelaznom stanju, reagens i odlazeća grupa su povezani sa reakcionim centrom, ulaze u njegovu najbližu koordinacionu sferu, a tokom reakcije jedna grupa se zamenjuje drugom, dolazi do razmene dva liganda:
ML 6 + Y ML 5 Y + L.
Prijelazno stanje je ili kompleks vanjske sfere ili, u slučaju nabijenih liganada, jonski par MX 5 L + Y - .
Interni mehanizam (a ili d) karakteriše proces supstitucije liganda na molekularnom nivou. Pokazuje koji od dva procesa - formiranje ili kidanje veze u prelaznom stanju - ograničava. Ako je brzina reakcije određena formiranjem veze između reakcionog centra i reagensa, govorimo o asocijativnoj aktivaciji. Inače, kada je ograničavajući faktor prekid veze između reakcionog centra i odlazeće grupe, proces se nastavlja disocijativnom aktivacijom. Okrećući se stehiometrijskom mehanizmu, lako je uočiti da disocijativni proces uvijek odgovara disocijativnoj aktivaciji, a asocijativni proces uvijek odgovara asocijativnoj aktivaciji, odnosno da se koncept unutrašnjeg mehanizma pokazuje informativnim samo u slučaju mehanizam međusobne razmjene - može se dogoditi i s disocijativnom (I d) i asocijativnom (I a) aktivacijom. U slučaju recipročnog mehanizma razmene sa asocijativnom aktivacijom (Ia), brzina reakcije zavisi od prirode Y. U prelaznom stanju, atom metala je čvrsto vezan i za odlazeću grupu i za napadački nukleofil. Primjer je proces zamjene atoma klora s bromom i jodom u kompleksu platine s dietilentriaminom (dien):
Y - ¾¾® + + Cl -
Y = Br, I brzine jako variraju.
U slučaju mehanizma recipročne razmene sa disocijativnom aktivacijom (Id), brzina reakcije ne zavisi od prirode reagensa Y. Napadajuće i odlazeće grupe u prelaznom stanju su slabo vezane za centralni ion. Ovaj mehanizam se koristi za zamjenu vode aminom u akva kompleksima mnogih prijelaznih metala, na primjer, nikla:
2+ + Y ¾¾® 2+ + H 2 O
Y = NH 3 , py brzine su bliske.
Proučavanje mehanizama supstitucijskih reakcija u kompleksima mnogih metala tek je u početnoj fazi. Sveobuhvatne informacije dobijene su samo za kvadratno-planarne komplekse platine i oktaedarske komplekse hroma(III) i kobalta(III). Može se smatrati čvrsto utvrđenim da se u kompleksima platine(II) supstitucija odvija prema asocijativnom mehanizmu (A, Ia) kroz srednje ili prelazno stanje u obliku trigonalne bipiramide. Oktaedarski kompleksi kobalta(III) reaguju disocijativno (D, Id mehanizmi). Konkretni primjeri takvih reakcija bit će uzeti u obzir pri opisivanju hemije ovih elemenata.
Redox reakcije. Većina redoks procesa je složena kombinacija pojedinačnih elementarnih faza, od kojih svaki uključuje prijenos jednog ili, mnogo rjeđe, dva elektrona. Istovremeni prijenos većeg broja elektrona u otopinama je nemoguć.
Prenos jednog elektrona može se desiti kroz jedan od dva mehanizma: spoljašnju sferu, tj. tuneliranjem, ili unutrašnju sferu, kroz ligand za premošćivanje. Mehanizam intrasfere se realizuje u kompleksima koji sadrže halogenide, hidroksidne jone i karboksilne grupe koje mogu delovati kao mostovi između metala. Primjer je reakcija između pentamin klorokobalta(III) i heksaakvahrom(II) jona. Proces se grubo može podijeliti u tri faze: formiranje heterometalnog kompleksa sa premošćujućim hloridnim ionom, prijenos elektrona i razgradnja premosnog kompleksa. Nastali 2+ jon, koji je labilan, trenutno se pretvara u akva kompleks, a inertni [(H 2 O) 5 CrCl] 2+ ne stupa u interakciju s vodom:

Ako u sistemu nema čestica koje bi mogle djelovati kao mostovi, proces se odvija u vanjskoj sferi:
2+ + 3+ = 3+ + 2+ .
Posebno je potrebno istaći reakcije oksidativnog dodavanja i reduktivne eliminacije, o kojima se govori u poglavlju 6.
Reakcije koordiniranih liganada. Ova grupa reakcija uključuje procese modifikacije liganada koordiniranih metalnim jonom. Na primjer, diketonatni kompleksi, poput slobodnih diketona, mogu biti nitrirani, acilirani ili halogenirani. Najzanimljiviji i najneobičniji primjer reakcija koordinisanih liganada je sinteza šablona– jedinstvena metoda “sastavljanja” liganda na ion metala. Primjer je sinteza ftalocijanina iz nitrila ftalne kiseline, koja se događa u prisutnosti iona bakra(II) i sinteza makrociklične Schiffove baze iz 2-aminobenzaldehida, koja se događa u prisustvu iona nikla(II):

U nedostatku metala, proces se odvija drugačijim putem, a željeni proizvod je prisutan u samo maloj količini u reakcijskoj smjesi. Ion metala djeluje u sintezi šablona kao matrica („template”), stabilizirajući jedan od proizvoda koji su međusobno u ravnoteži i pomjerajući ravnotežu prema njegovom formiranju. Na primjer, u reakciji X + Y ¾® nastaje mješavina proizvoda A i B, u kojoj prevladava B, koji ima nižu energiju. U prisustvu metalnog jona, supstanca A preovlađuje u produktima reakcije u obliku kompleksa sa M (slika 1.40. Energetski dijagram interakcije X i Y u odsustvu metalnog jona (levo) i u njegovom prisustvo (b)).
Pitanja i zadaci
1. Koje od sljedećih jedinjenja ima strukturu perovskita? BaTiO 3, LiNbO 3, LaCrO 3, FeTiO 3, Na 2 WO 4, CuLa 2 O 4, La 2 MgRuO 6. Tabela jonskih radijusa data je u Dodatku. Imajte na umu da u složenim oksidnim fazama B pozicije mogu sadržavati katione dva različita metala.
2. Koristeći TCP, odredite da li će sljedeći spineli biti pravi ili obrnuti: ZnFe 2 O 4, CoFe 2 O 4, Co 3 O 4, Mn 3 O 4, CuRh 2 O 4.
3. Tiocijanat jon SCN - ima dva donorska centra - tvrdi i meki. Predvidite kakvu će strukturu imati tiocijanatni kompleksi kalcijuma i bakra(I). Zašto nije moguće dobiti bakar(II) tiocijanat?
4. Spektar Cr 2+ akva jona (termin osnovnog stanja 5 D) ima dvije trake (Sl. 1.41. Spektar Cr 2+ akva jona), iako među terminima najbližih pobuđenih stanja nema ni jednog sa ista mnogostrukost. Šta ovo objašnjava? Koje boje ima ovaj jon?
5. Koristeći Δο vrijednosti ispod, izračunajte ESC za sljedeće komplekse u kJ/mol:
(a) 2–, Δο = 15000 cm–1,
(b) 2+, Δο = 13000 cm–1,
(c) 2–, Δο (za 4–)= 21000 cm–1,
Uzmite energiju uparivanja jednaku 19000 cm –1, 1 kJ/mol = 83 cm –1. Izračunajte njihove magnetne momente (spin komponentu).
6. Koristeći TCP, objasnite zašto CN – jon reaguje sa jonom heksaakvanikl(III) da bi formirao heksacijanoferat(II), a sa ionom heksaakvanikl(II) formirajući tetracijanonikel(II).
7. Ispod su reakcijske konstante za sekvencijalnu zamjenu vode u akva kompleksu bakra(II) amonijakom: K 1 = 2´10 4 , K 2 = 4´10 3 , K 3 = 1´10 3 , K 4 = 2´10 2 , K5 = 3´10 –1, K6<< 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. Kako se mijenja krutost katjona pri kretanju duž 3d reda? Da li je to u skladu sa redoslijedom promjene konstanti stabilnosti kompleksa (Irving-Williamsov niz, slika 1.34).
9. Objasni zašto je heksakvatični ion gvožđa (III) bezbojan, a rastvori soli gvožđa (III) obojeni.
10. Predložite mehanizam za reakciju 3– + 3– = 4– + 2–, ako je poznato da uvođenje tiocijanatnog jona u rastvor dovodi do promene brzine reakcije, a brzina je praktično nezavisna od prisustvo amonijaka. Ponudite objašnjenje za ove činjenice.
Koncept promjena u elektronskoj strukturi jona prijelaznih metala pod djelovanjem električnog polja nabijenih čestica koje ih okružuju predložio je Becquerel, a dalje ga je razvio H.A. Bethe i J. Van Vleck na početku XX V. Ovi koncepti su primijenjeni na opis elektronske strukture i svojstava kompleksnih jedinjenja samo u sredini XX veka od H. Hartmanna i model je nazvan „teorija kristalnog polja“ (CFT).
Osnovne odredbe TCH za prelazne komplekse d metali Sl. 24):
1. - Kompleks postoji i stabilan je zbog elektrostatičke interakcije agensa za stvaranje kompleksa sa ligandima.
2. - Ligandi se uzimaju u obzir bez uzimanja u obzir njihove elektronske strukture kao tačkastih naelektrisanja ili dipola.
3. - Pod uticajem električnog polja liganada, valencija se petostruko degeneriše ( n -1) d orbitale se dijele ovisno o simetriji okruženja liganda.
4. - Raspodjela valentnih elektrona metala među podijeljenim ( n -1) d orbitale zavise od omjera energije spin-uparivanja i energije cijepanja.
Razmotrimo, na primjer, promjenu energije peterostruko degenerisane ( n -1) d orbitale centralnog metalnog jona M n+ , smješten u centru koordinata, pod utjecajem oktaedarskog polja negativno nabijenih liganada [ ML 6] z , koji se nalazi na koordinatnoj osi (slika 25). Kao rezultat odbijanja valentnih elektrona metala od negativno nabijenih liganada s ravnomjernom raspodjelom negativnog naboja oko metala (sferično simetrično električno polje), energija svih pet d orbitale će se povećati za iznos E 0 u poređenju sa slobodnim M n+ ion. Zbog d orbitale imaju različite prostorne orijentacije, a s koncentracijom negativnih naboja na ligandima smještenim na koordinatnim osa, povećanje njihove energije se razlikuje. Energy Boost d z 2 i d x 2- y 2 orbitale usmjerene prema ligandima na koordinatnoj osi imaju veći energetski porast dxy, dxz i dyz orbitale usmjerene između koordinatnih osa.
Energija fisijepeterostruko degenerisan ( n -1) orbitale u dvostruko degenerisane d x 2- y 2, z 2 orbitale i trostruko degenerisan d xy, xz, yz orbitale se nazivaju (slika 26) parametar cijepanja kristalnog polja. Pošto je energija rascepa d orbitale u oktaedarskom polju liganada se ne mijenja u odnosu na sferno simetrično električno polje, tada se povećava energija dva d x 2- y 2, z 2 orbitale se javlja na 0,6D 0 i smanjenje energije za tri d xy , xz , yz orbitale za 0,4 D 0 .
Za označavanje stepena degeneracije i simetrije metalnih orbitala rascijepljenih pod uticajem električnog polja liganada, koriste se posebni simboli. Trostruko degenerisan i simetričan u odnosu na centar simetrije i rotacije oko koordinatnih osa d xy , xz , yz t 2 g ", dok je dvostruko degenerisan i takođe simetričan u odnosu na centar simetrije d x 2- y 2, z 2 orbitale su označene simbolom " npr " Dakle, pod uticajem oktaedarskog električnog polja liganda, petostruko degeneriše ( n -1) d orbitale agensa za stvaranje kompleksa podijeljene su na trostruko i dvostruko degenerisane orbitale različitih energija t 2 g i e g orbitale.
Slično razmatranje promjene energije peterostruko degeneriranog ( n -1) d orbitale slobodnog metalnog jona u tetraedarskom okruženju liganada u [ ML 4 ]z kompleksi pokazuje (Sl. 27) njihovo cijepanje također na dvostruko (e) i trostruko ( t ) degenerisane orbitale, međutim, sa suprotnim energetskim položajem. Subscript " g " kada je označeno "e" i " t » orbitale nisu naznačene jer tetraedarski kompleks nema centar simetrije. Smanjenje broja liganada tetraedarskog kompleksa u odnosu na oktaedarski kompleks dovodi do prirodnog smanjenja parametra cijepanja kristalnog polja:D T = 4/9 D O .
Smanjenje simetrije ligandnog okruženja metala, na primjer, tetragonalno izobličenje oktaedra [ ML 6] z kompleksi povezani s produžavanjem metal-ligand veza s aksijalnim ligandima [ ML 4 X 2 ] z i formiranje u graničnom slučaju ravni kvadrat [ ML 4 ]z kompleksa, dovodi (slika 28) do dodatnog cijepanja valencije ( n -1) d metalne orbitale.
Punjenje split ( n -1) d metalne orbitale se odvijaju u skladu sa Paulijevim principima i minimalnom energijom. Za oktaedarske komplekse sa d 1 , d 2 i d 3 elektronska konfiguracija metala, valentni elektroni, prema Hundovom pravilu, naseljavaju t 2 g orbitale s paralelnim okretima, što dovodi do t 2 g 1 , t 2 g 2 i t 2 g 3 elektronska struktura kompleksa.
Za metale sa d 4 elektronska konfiguracija, tri elektrona se također naseljavaju t 2 g orbitale sa paralelnim spinovima. Populacija četvrtog elektrona zavisi od troškova energije za vrednost energije spinskog uparivanja (E sp.-sp.) tokom populacije t 2 g orbitale sa antiparalelnim spinom i kršenjem Hundovog pravila, ili savladavanje energije cijepanja kristalnim poljemD o prilikom prijave npr orbitale sa paralelnim spinom u skladu sa Hundovim pravilom. U prvom slučaju formira se kompleks sa t 2 g 4 elektronska struktura i smanjena brojnost okretanja u poređenju sa slobodnim metalom 2 S +1 = 3 (S - total spin), tzv low-spin. Kada je Hundovo pravilo ispunjeno i četvrti elektron je naseljen npr orbitale, formira se kompleks sa t 2 g 3 e g 1 elektronska struktura i slobodni spin multiplet nalik metalu 2 S +1 = 5. Takvi kompleksi se nazivaju high-spin.
Slično, pri distribuciji valencije d5, d6 i d7 metalni elektroni t 2 g i e g orbitale oktadričkih kompleksa u zavisnosti od odnosa E sp.-sp. ID O Moguće je formiranje dvije vrste kompleksa:
Kod E sp.-sp. > D O formiraju se visokospinalni kompleksi sa elektronskom strukturom metala t 2 g 3 e g 2 , t 2 g 4 e g 2 , t 2 g 5 e g 2 prema Hundovom pravilu i višestrukost okretanja slobodnog metala - 2 S +1 = 6, 5, 4;
E sp.-sp.< D O formiraju se niskospinalni kompleksi sa elektronskom strukturom metala t 2 g 5 e g 0 , t 2 g 6 e g 0 , t 2 g 6 e g 1 i manji broj okretaja u poređenju sa slobodnim metalom 2 S +1 = 2, 1, 2.
Metalni kompleksi sa d 8, d 9 i d 10 elektronske konfiguracije karakteriše jedan tip distribucije elektrona - t 2 g 6 e g 2 , t 2 g 6 e g 3 , t 2 g 6 e g 4 sa višestrukim okretanjem sličnom slobodnom metalu: 2 S +1 = 3, 2 i 0.
Dakle, parametarD, karakterizirajući cijepanje ( n -1) d metalne orbitale pod uticajem električnog polja liganada jedna je od glavnih karakteristika promene svojstava kompleksa u poređenju sa slobodnim ionom metala. To je vrijednost parametraDodređuje za niz elektronskih konfiguracija metala određuje mogućnost formiranja kompleksa visokog ili niskog spina s različitim distribucijama elektrona po podijeljenim orbitalama i različitim svojstvima.
Vrijednost parametra cijepanja kristalnog poljaDzavisi od prirode metala kompleksirajućeg agensa, liganada koji ga okružuju i njihovog prostornog položaja oko agensa za kompleksiranje:
1. Ligandi prema rastućem parametruDza komplekse istog metala i slične geometrijske strukture nalaze se u tzv. spektrohemijskom nizu: ja -< Br - < Cl - < F - < OH - < C 2 O 4 2- ~ H 2 O < NCS - < NH 3 ~ En < NO 2 - < CN - < CO . Na početku reda nalaze se ligandi "slabog polja" - halogenidni joni, hidroksidni i oksalatni joni, voda, koji formiraju pretežno visokospinalne komplekse. Ligandi na desnoj strani serije: ugljen monoksid, cijanid i nitritni joni nazivaju se ligandi "visokog polja" i tipično se karakterišu formiranjem kompleksa sa niskim spinom. Za ligande u sredini serije - tiocijanat ion, amonijak, etilendiamin, u zavisnosti od prirode metala, formiraju se kompleksi visokog ili niskog spina.
2. Povećanje efikasnosti električnog polja liganda na d metalne orbitale sa povećanjem njihove veličine u redu 3 d<< 4 d < 5 d , kao i povećanje stepena oksidacije metala dovodi do povećanja parametraD u seriji: Mn(II)< Ni (II ) < Co (II ) < Fe (II ) < V (II ) < Fe (III ) < Co (III ) < Mn (IV ) < Mo (III ) < Rh (III ) < Ru (III ) < Pd (IV ) < Ir (III ) < Pt (IV ).
3. Parametar Dza tetraedarske komplekse je samo 4/9 parametraDoktaedarski kompleksi.
“Teški” kompleksi 4 d i 5 d metali, gotovo bez obzira na prirodu liganda, formiraju pretežno nisko-spin komplekse, dok je formiranje nisko- ili visoko-spin kompleksa "lagano" 3 d metala je uglavnom određena jačinom polja liganda.
Za razliku od MMS-a, teorija kristalnog polja koja opravdava razliku u magnetnim svojstvima kompleksa istog metalnog jona sa različitim ligandnim okruženjima, na primjer, dijamagnetnim [ Fe(CN ) 6 ] 4- i paramagnetski [ Fe(H2O ) 6 ] 2+ ne koristi hipotezu o njihovoj intraorbitalnoj ( d 2 sp 3 hibridizacija) i vanjska orbitalna ( sp 3 d 2 hibridizacija) struktura. Razlika u magnetnim svojstvima određena je prirodom niskog i visokog spina distribucije 6-valentnih elektrona Fe(II ) podjelom t 2 g i e g orbitale (slika 29). Kao jaki i slabi ligandi polja formiraju se joni cijanida i molekuli vode Fe(II ) nisko- i visoko-spin kompleksi sa t 2 g 6 e g 0 i t 2 g 4 e g 2 raspodjela elektrona, koja određuje dijamagnetizam [ Fe(CN ) 6 ] 4- i paramagnetizam [ Fe(H2O ) 6 ] 2+ kompleksa.
Dijeljenje peterostruko degenerisanih ( n -1) d metalne orbitale u kompleksima i promjene parametaraDu zavisnosti od prirode liganada, određuje karakterističnu boju kompleksa kako u čvrstom stanju tako iu rastvorima. Kada kompleks apsorbuje elektromagnetno zračenje u vidljivom području spektra (400-750) nm, energija kvanta je E jednaka vrijednosti D, prijenos elektrona se događa iz t 2 g na e g orbitale. Neapsorbovano elektromagnetno zračenje vidljivog područja spektra određuje boju kompleksa u skladu sa „Njutnovim krugom boja“ (slika 30), prikazujući primarnu i sekundarnu boju vidljivog zračenja.
Aquacomplex titanium( III) [Ti (H 2 O) 6] 3+ c t 2 g 1 e g 0 elektronska distribucija kao rezultat fotoekscitacije, koja odgovara prijelazu elektrona na višu energiju e g orbitale:
3+ (t 2g 1 e g 0) + hn= * 3+ (t 2g 0 e g 1)
apsorbuje kvante svjetlosti u žutom području spektra, što dovodi do njegove ljubičaste boje. Promjena ligandnog okruženja metalnog jona u skladu sa položajem liganda u spektrohemijskom nizu dovodi do promjene parametraDi, kao posljedica toga, na promjenu energije i talasne dužine kvanta koje apsorbuje kompleks i na karakterističnu boju kompleksa - na primjer, u seriji [ CuCl 4 ] 2- , [ Cu (H 2 O ) 4 ] 2+ , [ Cu (NH 3 ) 4 ] 2+ boja kompleksa se mijenja iz zelene u plavu i ljubičastu.
Zajedno sa kristalnim poljem cijepa energijuD, takođe igra važnu ulogu u TCH energija stabilizacije kristalnog polja(ESKP) - dobitak u energiji pri distribuciji elektrona među onima koji su podijeljeni u kompleksu ( n -1) d metalne orbitale u poređenju sa energijom petostruko degenerisane ( n -1) d metalne orbitale u ekvivalentnom sfernom električnom polju (sl. 31, 32).
ESCP oktadralnih i tetraedarskih kompleksa.|
Mn+ |
Oktaedarski kompleksi |
Tetraedarski kompleksi |
|
|
Low spin |
Visoko okretanje |
Visoko okretanje |
|
|
0.4 D o |
0.6 D T |
||
|
0.8 D o |
1.2 D T |
||
|
1.2 D o |
0.8 D T |
||
|
d 4 |
1.6 D o |
0.6 D o |
0.4 D T |
|
d 5 |
2.0 D o |
0 D o |
0 D T |
|
d 6 |
2.4 D o |
0.4 D o |
0.6 D T |
|
d 7 |
1.8 D o |
0.8 D o |
1.2 D T |
|
d 8 |
1.2 D o |
0.8 D T |
|
|
d 9 |
0.6 D o |
0.4 D T |
|
|
d 10 |
0 D o |
||
Procjena EXP vrijednosti kompleksa dobija se na osnovu dijagrama cijepanja ( n -1) d metalne orbitale u električnom polju liganada, pokazujući smanjenje ili povećanje energije sistema u poređenju sa sfernim električnim poljem kada se elektroni popune razdvojenim ( n -1) d orbitale. Za oktaedarski [ ML 6] z kompleksi (slika 32) naseljenost svakog elektrona t 2 g orbitale dovodi do povećanja energije sistema za 0,4D oh, prijava npr zahtijeva utrošak energije 0,6D O . Za tetraedarski [ ML 4 ]z kompleksi sa suprotnim energetskim pozicijama e i t metalne orbitale - zauzimanje svakog elektrona cijepanjem e i t orbitale je praćeno smanjenjem i povećanjem energije sistema za 0,6D t i 0,4 D T .
Kao odraz termodinamičke stabilnosti kompleksa, procjene njihovih ESCR vrijednosti su u skladu s eksperimentalnim podacima o promjenama energije kristalne rešetke za komplekse heksafluorida visokog spina 3 d metali (Sl. 33).
ESC vrijednosti nam omogućavaju da odredimo najpoželjniji koordinacijski izomer (slika 34), na primjer [ Cu (NH 3 ) 6 ][ NiCl 4 ] ili [ Ni (NH 3 ) 6 ][ CuCl 4 ]. Da biste to učinili, izračunajte razliku u ESC za kompleksni kation i anion izomera. ESCR vrijednost [ Cu (NH 3 ) 6 ] 2+ i [NiCl 4 ] 2- je 0,6 D o i 0.8 D T respektivno. S obzirom na toD t = 4/9 D o , razlika između ESCP vrijednosti [ Cu (NH 3 ) 6 ] 2+ i [NiCl 4 ] 2- će biti 19/45D o . Slično, vrijednosti ESKP [ Ni (NH 3 ) 6 ] 2+ i [CuCl 4 ] 2- je 1,2 D o i 0.4 D T , a razlika između njih je 28/45D o . Velika razlika ESCP kompleksnog kationa [ Ni (NH 3 ) 6 ] 2+ i anion [CuCl 4 ] 2- u poređenju sa [ Cu (NH 3 ) 6 ] 2+ i [NiCl 4 ] 2- prikazuje poželjnije formiranje izomera sastava [ Ni (NH 3 ) 6 ][ CuCl 4 ].
Zajedno sa magnetskim i optičkim svojstvima uticaja elektronske strukture metala na termodinamičku stabilnost kompleksa, TKP predviđa izobličenje geometrijske strukture kompleksa sa neravnomernom raspodelom elektrona po rascepu ( n -1) d metalne orbitale (slika 35). Za razliku od pravilne oktaedarske strukture [ Co (CN) 6 ] 3- s t 2 g 6 e g 0 elektronska distribucija, tetragonalno izobličenje sličnog kompleksa [ Cu (CN) 6 ] 4- s t 2 g 6 e g 3 elektronska distribucija koja sadrži 3 elektrona na 2-struko degenerisana npr orbitale, dovodi do efektivne transformacije oktaedra u kvadratno-planarni kompleks:
4- = 2- + 2CN - .
Sve navedeno pokazuje da relativna jednostavnost i široke mogućnosti TCT-a za objašnjenje i predviđanje fizičko-hemijskih svojstava kompleksa određuju veliku popularnost ovog modela za opisivanje hemijskih veza u kompleksnim jedinjenjima. Istovremeno, fokusirajući se na promjene u elektronskoj strukturi metala tokom formiranja kompleksa, TCP ne uzima u obzir elektronsku strukturu liganada, smatrajući ih tačkastim negativnim nabojima ili dipolima. Ovo dovodi do brojnih ograničenja TCP-a pri opisivanju elektronske strukture kompleksa. Na primjer, u okviru TCP-a teško je objasniti položaj određenog broja liganada i metala u spektrohemijskim serijama, što je povezano sa određenim stepenom kovalentnosti i mogućnošću stvaranja višestrukih metal-ligand veza. Ova ograničenja se eliminišu kada se razmatra elektronska struktura kompleksnih jedinjenja korišćenjem složenije i manje vizuelne metode molekularnih orbitala.
Teorija valentne veze bila je prva od kvantnomehaničkih teorija korišćenih za približno objašnjenje prirode hemijskih veza u kompleksnim jedinjenjima. Njegova primjena se zasnivala na ideji mehanizam donor-akceptor formiranje kovalentnih veza između liganda i agensa za stvaranje kompleksa. Ligand broji donor čestica, sposoban da prenese par elektrona akceptor – agens za kompleksiranje, koji obezbjeđuje slobodne kvantne ćelije (atomske orbitale) svojih energetskih nivoa za formiranje veza.
Za formiranje kovalentnih veza između agensa za formiranje kompleksa i liganada potrebno je da se prazni s-, str- ili d-atomske orbitale kompleksirajućeg agensa su podvrgnute hibridizacija određeni tip. Hibridne orbitale zauzimaju određenu poziciju u prostoru, a njihov broj odgovara koordinacijski broj agens za kompleksiranje.
Ovo se često dešava kombinujući nesparene elektrone kompleksirajući agens u parove, što omogućava oslobađanje određenog broja kvantnih ćelija – atomskih orbitala, koje potom učestvuju u hibridizaciji i stvaranju hemijskih veza.
Usamljeni parovi elektrona liganada stupaju u interakciju sa hibridnim orbitalama agensa za stvaranje kompleksa, i preklapanje odgovarajuće orbitale kompleksirajućeg agensa i liganda sa pojavom povećane elektronske gustine u internuklearnom prostoru. Elektronski parovi agensa za stvaranje kompleksa, zauzvrat, stupaju u interakciju sa slobodnim atomskim orbitalama liganda, jačanje veze putem dativnog mehanizma. Dakle, hemijsko povezivanje u kompleksnim jedinjenjima je uobičajeno kovalentna dovoljna veza izdržljiv I energetski povoljno.
Elektronski parovi koji se nalaze u hibridnim orbitalama kompleksirajućeg agensa teže da zauzmu poziciju u prostoru u kojoj je njihovo međusobno odbijanje minimalno. Ovo vodi do strukturaČini se da su kompleksni ioni i molekuli u određenoj zavisnosti od vrsta hibridizacije.
Razmotrimo formiranje nekih kompleksa sa stanovišta teorije valentnih veza. Prije svega, napominjemo da su valentne orbitale atoma agenasa za stvaranje kompleksa bliske po energiji:
E (n- 1)d » E ns » E n.p. » E nd
|
Tip hibridizacije |
Geometrija kompleksa |
||
|
linearno |
-
|
||
|
trouglasti |
- |
||
|
tetraedar |
2-
|
||
|
2-
|
|||
|
sp 3 d(z 2) |
trigonalna bipiramida |
||
|
sp 3 d(x 2 - y 2) |
kvadratna piramida |
3-
|
|
|
sp 3 d 2 , |
3+ |
||
|
sp 3 d 3 |
pentagonalna bipiramida |
4-
|
Na primjer, kation 2+ uključuje agens za stvaranje kompleksa cink(II). Elektronska ljuska ovog konvencionalnog jona ima formulu 3 d 10 4s 0 4str 0 i može se konvencionalno prikazati na sljedeći način:
Prazan 4 s- i 4 str-orbitale atoma cinka(II) formiraju četiri sp 3-hibridne orbitale orijentirane prema vrhovima tetraedra.
Svaki molekul amonijaka ima usamljeni par elektrona na atomu dušika. Orbitale atoma dušika koje sadrže usamljene parove elektrona se preklapaju sa sp 3-hibridne orbitale cinka(II), koje formiraju tetraedarski kompleksni kation tetraaminskog cinka(II) 2+:
Pošto 2+ jon nema nesparene elektrone, on se pokazuje dijamagnetski svojstva.
Tetrahlormanganat(II) jon 2- sadrži pet nesparenih elektrona po 3 d-orbitale i prazna 4 s- i 4 str-orbitale. Formiraju se prazne orbitale sp 3-hibridne orbitale koje se preklapaju sa str-atomske orbitale hloridnih jona: 
Tako dobijeni tetraedarski jon 2- je paramagnetski, budući da sadrži pet nesparenih elektrona.
Korištenje konvencionalnog algoritma predviđanja tip hibridizacije atomskih orbitala u okviru metode valentne veze može se odrediti geometrija kompleksa različitog sastava. Da biste to učinili, prije svega, potrebno je napisati elektronsku formulu za valentni nivo i konstruirati dijagram raspodjele elektrona po kvantnim ćelijama. Na primjer, za neutralni atom nikla:

Prijelaz 4 s-elektroni za 3 d-podnivo transformacije paramagnetski Ni atom 0 in dijamagnetskičestica Ni*: 
Rezultirajuće prazne orbitale prolaze kroz hibridizaciju, formirajući tetraedačku konfiguraciju. Tako izgrađen tetraedarski dijamagnetski tetrakarbonilnikl kompleks (CN = 4), koji se odlikuje značajnom stabilnošću.
Ako je agens za stvaranje kompleksa nikal(II) sa elektronskom konfiguracijom 3 d 8 4s 0 4str 0, onda potreba za pomicanjem elektrona sa 4 s-podnivo prije nego što hibridizacija nestane, pošto postoji dovoljan broj slobodnih orbitala da se realizuje koordinacijski broj 4: 
Ova struktura je nestabilna paramagnetski tetrabromonikolat(II)-jon 2- kompleks. Međutim, kada se kombinuju dva elektrona 3 d-podnivo u par i transformacija jedne od kvantnih ćelija ovog podnivoa u praznu mijenja i tip hibridizacije i karakteristike rezultirajućeg kompleksa: 
Tip hibridizacije dsp 2 i planarni kvadratni oblik kompleksa ostvaruju se formiranjem štale dijamagnetski kompleksni tetracijanonikolat(II)-ion 2- (CN = 4): 
Ako se sinteza cijanidnog kompleksa provodi u uvjetima viška liganda, može se ostvariti koordinacijski broj od 5: 
Stabilan dijamagnetski kompleks pentacijanonikolat(II)-iona 3- ima oblik kvadratne piramide: 
Oktaedarski kompleks nikla(II) 2+ paramagnetski, ali prilično stabilan. Treba mu obrazovanje sp 3 d 2 -hibridizacija atomskih orbitala nikla: 
Ako atomske orbitale vanjske d-podnivo, složen, po pravilu, u velikoj meri paramagnetski i zove se vanjska orbitalna ili high-spin. Struktura takvih kompleksa može odgovarati tipu hibridizacije, npr. sp 3 d 2 .
Takvi kompleksi, tokom formiranja kojih se odvija hibridizacija uz učešće atomskih orbitala spoljašnjeg d-podnivoi se nazivaju intra-orbitalni ili low-spin i, po pravilu, dijamagnetski ili slabo paramagnetna(svi ili skoro svi elektroni agensa za stvaranje kompleksa su upareni, a tip hibridizacije, npr. d 2 sp 3 ili dsp 2).
Kada se ispituju kompleksi gvožđa(II), nalaze se i spoljni orbitalni i intraorbitalni kompleksi.


Dijagram ispod pokazuje kako se formiraju paramagnetski high-spin heksafluoroferat(II)-jon 4- i dijamagnetski low-spin heksacijanoferat(II) jon 4-.
Sama teorija valentnih veza ne daje odgovor na pitanje koja vrsta kompleksa se formira u svakom konkretnom slučaju, jer ova metoda ne uzima u obzir utjecaj prirode liganda. Stoga se metoda valentne veze nužno mora dopuniti podacima o magnetskim svojstvima kompleksa ili informacijama o utjecaju liganda na prirodu formiranog kompleksa.
.Teorija kristalnog polja zamenio teoriju valentnih veza 40-ih godina 20. veka. U svom čistom obliku, trenutno se ne koristi, jer ne može objasniti stvaranje kovalentnih veza u kompleksnim jedinjenjima i ne uzima u obzir pravo stanje liganada (na primjer, njihove stvarne veličine) čak ni u slučaju bliskih interakcija. čisto elektrostatički.
Već sredinom 50-ih, pojednostavljena teorija kristalnog polja zamijenjena je poboljšanom teorija polja liganda, uzimajući u obzir kovalentnu prirodu hemijskih veza između agensa za stvaranje kompleksa i liganda.
Međutim, najopštiji pristup objašnjavanju formiranja kompleksnih jedinjenja je dat teorija molekularne orbite(MO), koja trenutno prevladava nad svim ostalima. Metoda molekularne orbite omogućava kako čisto elektrostatičku interakciju u odsustvu preklapajućih atomskih orbitala, tako i cijeli skup srednjih stupnjeva preklapanja.
Pogledajmo osnovne koncepte teorija kristalnog polja, koja, kao i teorija valentnih veza, zbog svoje velike jednostavnosti i jasnoće još uvijek zadržava svoju važnost za kvalitativni opis kemijskih veza u složenim spojevima.
U teoriji kristalnog polja razmatra se hemijska veza između agensa za stvaranje kompleksa i liganda elektrostatički. Prema ovoj teoriji, ligandi se nalaze oko agensa za kompleksiranje na vrhovima pravilnih poliedara ( poliedri) kao tačkaste naknade. Teorija ne uzima u obzir stvarni volumen liganda.
Ligandi, poput tačkastih naboja, stvaraju oko agensa za stvaranje kompleksa elektrostatičko polje(„kristalno polje“, ako uzmemo u obzir kristal kompleksnog jedinjenja, ili ligand polje), u kojem su energetski nivoi agensa za stvaranje kompleksa i, prije svega, d-podnivoi se razdvajaju, a njihova energija se mijenja. Od prirode cijepanja ovisi energija novih energetskih nivoa simetrija raspored liganada (oktaedarski, tetraedarski ili drugo kristalno polje). Kada su molekuli H 2 O, NH 3 , CO i drugi koordinirani kao ligandi, oni se smatraju kao dipoli, orijentisan sa negativnim nabojem prema agensu za stvaranje kompleksa.
Razmotrimo slučaj oktaedarskog rasporeda liganada (na primjer, 3- ili 3+). U središtu oktaedra nalazi se atom koji formira kompleks M(+n) sa uključenim elektronima d-atomske orbitale, a na njenim vrhovima se nalaze ligandi u obliku tačkastih negativnih naboja (na primjer, F - joni ili polarni molekuli poput NH 3). U konvencionalnom jonu M(+n) koji nije povezan sa ligandima, energije svih pet d-AO su isti (tj. atomske orbitale degenerisati).
Međutim, u oktaedarskom polju liganada d-AO-ovi agensa za stvaranje kompleksa spadaju u nejednako pozicija. Atomske orbitale d(z 2) i d(x 2 -
y 2), izdužene duž koordinatnih ose, najbliže su ligandima. Između ovih orbitala i liganada koji se nalaze na vrhovima oktaedra, javljaju se značajne razlike odbojne sile, što dovodi do povećanja orbitalne energije. Drugim riječima, ove atomske orbitale podliježu maksimalna izloženost polju liganda. Jako stisnuta opruga može poslužiti kao fizički model takve interakcije. 

Ostala tri d-AO – d(xy), d(xz) I d(yz), koji se nalaze između koordinatnih osa i između liganada, nalaze se na većoj udaljenosti od njih. Interakcija takvih d-AO sa ligandima je minimalan, a samim tim i energija d(xy), d(xz) I d(yz)-AO se smanjuje u odnosu na originalni. 

Dakle, peterostruko degenerisan d-AO kompleksirajući agens, ulazi oktaedarsko ligandno polje, izložena razdvajanje u dvije grupe novih orbitala – trostruko degenerisane orbitale sa nižom energijom, d(xy), d(xz) I d(yz), I dvostruko degenerisane orbitale sa višom energijom d(z 2) i d(x 2 -
y 2). Ove nove grupe d-orbitale sa niže I veća energija označiti d e i d g: 
Energetska razlika dva nova podnivoa d e i d g je dobio ime parametar razdvajanja D0:
E 2 – E 1 = D0
Lokacija dva nova energetski podnivoi d e i d g u odnosu na original ( d-AO) na energetskom dijagramu asimetrično:
(E 2 – E 0) > (E 0 – E 1).
Kvantnomehanička teorija to zahtijeva kada su novi energetski nivoi potpuno napunjeni elektronima, ukupna energija ostaje nepromijenjena, tj. ona bi trebala ostati jednak E 0 .
Drugim riječima, jednakost mora biti zadovoljena
4(E 2 – E 0) = 6(E 0 – E 1),
gdje su 4 i 6 – maksimum broj elektrona po d g - i d e -AO. Iz ove jednakosti slijedi da
(E 2 – E 0) / (E 0 – E 1) = 3/2 i
(E 2 – E 1) / (E 0 – E 1 >) = 5/2, ili
D0/( E 0 – E 1) = 5/2, odakle ( E 0 – E 1) = 2/5 ´ D 0 >. Postavljanje svakog elektrona od maksimalno šest mogućih na d e-orbitale uzroci smanjiti (dobitke) energije od 2/5 D 0 . Naprotiv, postavljanje svakog elektrona od četiri moguća na d g orbitale uzrokuju povećati (trošak) energije od 3/5 D 0 . Ako je naseljen elektronima d e - i d g -orbitale u potpunosti, onda ne pobjeda energije neću(baš kao što neće dodatna potrošnja energije): 4 ´ 3/5 ´ D 0 - 6 ´ 2/5 ´ D 0 = 0. Ali ako original d-AO je samo popunjen djelomično i sadrži od 1 do 6 elektrona, a ti elektroni su postavljeni samo na d e -AO, onda dobijamo značajan energetski dobitak. Specifičnost svakog liganda utiče na polje koje ovaj ligand stvara - jaka ili slab. Kako jače polje ligandi nego više značenje parametar razdvajanja D0. Proučavanje parametra cijepanja obično se zasniva na spektroskopski istraživanja. Talasne dužine apsorpcione trake kompleksi l u kristalnom stanju ili u rastvoru, usled prelaska elektrona iz d e - uključeno d g-AO, povezan sa parametar razdvajanja D 0 kako slijedi: n = 1/l; D gdje je Plankova konstanta h jednako 6,626 ´ 10 - 34 J. s; Parametar razdvajanja, osim vrste liganda, zavisi na stepen oksidacije I priroda agens za kompleksiranje. At povećanje nuklearnog naboja atoma koji formira kompleks D 0 se takođe povećava. Kationi heksaaminiridijum(III) 3+, heksaaminiridijum(III) 3+ i heksaaminiridijum(III) 3+ ( Z= 27, 45 i 77) karakteriziraju parametri cijepanja jednaki 22900, 34100 i 41000 cm -1. Zavisnost D0 o prirodi liganada je raznovrsnija. Kao rezultat proučavanja brojnih kompleksnih jedinjenja, ustanovljeno je da se u smislu njihove sposobnosti da povećaju parametar cijepanja kompleksirajućih metala koji se nalaze u njihovim uobičajenim oksidacijskim stanjima, najčešći ligandi mogu rasporediti u sljedeće: spektrohemijske serije, duž koje vrijednost D 0 monotono raste: Dakle, najjače elektrostatičko polje oko agensa za stvaranje kompleksa i najjače cijepanje d-AO je uzrokovan NO 2 - ligandima, CN -
i CO. Razmotrimo distribuciju elektrona preko d e - i d g-orbitale u oktaedarskom polju liganada. Provjeri d e - i d g-orbitale se odvija u potpunom skladu sa Hundovo pravilo I Paulijev princip. U ovom slučaju, bez obzira na vrijednost parametra cijepanja, prva tri elektrona zauzimaju kvantne ćelije d e-podnivo: Ako je broj elektrona po d- postoji više od tri podnivoa kompleksirajućeg agensa, postoje dvije mogućnosti za njihovo postavljanje na podijeljene podnivoe. Pri niskoj vrijednosti parametra cijepanja (slabo polje liganada), elektroni savladavaju energetsku barijeru odvajajući d e - i d g-orbitale; četvrti, a zatim peti elektroni naseljavaju kvantne ćelije d g-podnivo. Sa jakim ligandnim poljem i visokom D0 vrijednošću, populaciju naseljavaju četvrti i peti elektroni d g-podnivo isključen; popunjavanje u toku d e-orbitale. At ligandi slabog polja naseljavanje kvantnih ćelija sa 4 ili 5 elektrona paralelnih okretaja, pa se rezultirajući kompleks ispostavi da je jak paramagnetski. U jakom polju liganda formiraju se jedan, a zatim dva elektronska para d e -podnivo, dakle paramagnetizam ispada da je kompleks mnogo slabiji. Šesti, sedmi i osmi elektron u slučaju slabog polja završavaju ponovo d e -podnivo, koji dopunjuje konfiguracije elektronskim parovima (jedan u slučaju d 6, dva – d 7 i tri - d 8): U slučaju jakog ligandnog polja, šesti elektron se naseli d e -AO, što dovodi do dijamagnetizam kompleksa, nakon čega sedmi i osmi elektron odlaze u d g-podnivo: Očigledno, sa konfiguracijom od osam elektrona razlike u strukturi između kompleksa sa ligandima slab I jaka polja nestaju. Zauzetost orbitala devetim i desetim elektronom se također ne razlikuje za komplekse oba tipa: Vratimo se na razmatranje elektronske strukture oktaedarskih kompleksnih jona 3+ i 3-. Prema lokaciji u spektrohemijske serije, amonijak NH 3 je jedan od liganada jako polje
, i fluorid ion F - – slabo polje
. Prema tome, zauzimanje atomskih orbitala elektronima u ovim kompleksima će se dogoditi prema sljedećoj shemi: U 3- anionu, F - ligandi stvaraju slabo kristalno polje (D 0 = 13000 cm - 1), a svi elektroni originalnog 3 d 6 -JSC nalaze se na d e - i d g orbitale bez ikakvog uparivanja. Kompleksni jon je high-spin i sadrži četiri nesparena elektrona, tako da paramagnetski. U 3+ jonu, NH 3 ligandi stvaraju jako kristalno polje (D 0 = 22900 cm - 1), sva 3 d 6 -elektroni se postavljaju na energetski povoljniji d e-orbitale. Prijenos elektrona iz d e - uključeno d g-orbitale nemoguće jer takođe visoka energetska barijera. Dakle, ovaj kompleksni kation je low spin, ne sadrži nesparene elektrone i dijamagnetski. Na sličan način mogu se predstaviti šeme za raspodjelu elektrona po orbitalama u oktaedarskom polju za 2+ i 4- ione: H 2 O ligandi stvaraju slabo polje; razmjena elektrona između d e - i d g-orbitale ne izaziva nikakve poteškoće i stoga je broj nesparenih elektrona u kompleksnom jonu isti kao u konvencionalnom Fe + II jonu. Rezultirajući aqua kompleks je high-spin, paramagnetski. Mnoga kompleksna jedinjenja u kristalnom stanju i vodenom rastvoru su jarke boje. Tako je vodeni rastvor koji sadrži 2+ kationa obojen intenzivno plavom bojom, 3+ kationi daju rastvoru ljubičastu boju, a 2+ kationi daju joj crvenu boju. Teorija kristalnog polja omogućava objašnjenje pojave jedne ili druge boje u složenim spojevima. Ako svjetlost prolazi kroz otopinu ili kristalni uzorak tvari vidljivi dio spektra, tada su u principu moguće tri opcije za fizičko ponašanje uzorka: nema apsorpcije svetlosti bilo koje talasne dužine (uzorak supstance bezbojan, iako može imati apsorpcione trake u ultraljubičastom području spektra); potpuna apsorpcija svjetlosti preko cijelog raspona valnih dužina (uzorak će se pojaviti crna); konačno, apsorpcija svetlosti samo određene talasne dužine(onda će uzorak imati boja komplementarna apsorbiranoj uski dio spektra). Tako se određuje boja otopine ili kristala frekvencija apsorpcionih traka vidljivo svjetlo: Apsorpcija svjetlosnih kvanta kompleksima (na primjer, onima sa oktaedarskom strukturom) objašnjava se interakcijom svjetlosti s elektronima koji se nalaze na d e -podnivo, praćen njihovim prelaskom na prazne orbitale d g-podnivo. Na primjer, pri prolasku svjetlosti kroz vodeni rastvor koji sadrži heksaakvatitanijum(III) 3+ katione, u žuto-zelenoj oblasti spektra detektuje se traka apsorpcije svetlosti (20300 cm - 1, l » 500 nm). To je zbog prijelaza jednog elektrona agensa za stvaranje kompleksa iz d e-AO uključen d g-podnivo: Stoga otopina koja sadrži 3+ poprima ljubičastu boju (pored apsorbirane žuto-zelene). Otopina vanadijeve soli Cl 3 je zelene boje. To je također zbog odgovarajućih prijelaza elektrona kada apsorbuju dio energije svjetlosnog snopa. U osnovnom stanju, sa elektronskom konfiguracijom vanadijuma(III) 3 d 2, dva nesparena elektrona su zauzeta d e-podnivo: Postoji samo dvije opcije za prijelaz dva elektrona on d g -podnivo: bilo oboje elektroni su zauzeti d g -AO, ili samo jedan Od njih. Bilo koji drugi prijelazi elektrona povezani sa smanjenjem ukupnog spina su zabranjeni. Ako agens za kompleksiranje ima elektronsku konfiguraciju d 0 ili d 10 onda tranzicije elektrona With d e - uključeno d g -podnivo ili obrnuto nemoguće bilo zato odsustvo elektrona, bilo zato odsustvo slobodnih orbitala. Zbog toga rastvori kompleksa sa agensima za stvaranje kompleksa kao što su Sc(III), Cu(I), Zn(II), Cd(II) itd., ne apsorbuju energiju u vidljivom delu spektra i pojavljuju se bezbojan: Selektivnost apsorpcije svetlosti ne zavisi samo od agens za kompleksiranje I njegovo oksidaciono stanje, ali i iz vrsta liganada. Prilikom zamjene liganada na lijevoj strani spektrohemijskog niza u kompleksnom spoju sa ligandima koji stvaraju jaka uočeno elektrostatičko polje povećati dio energije koju apsorbuju elektroni iz propuštene svjetlosti i, kao posljedica, smanjiti talasnu dužinu odgovarajućeg apsorpcionog pojasa. Dakle, vodeni rastvor koji sadrži tetraakvabakar(II) 2+ katjone je plave boje, a rastvor tetraaminbakar(II) 2+ sulfata je intenzivno plave boje. ________________________ Ponovite: >>> Prijave
Dobitak energije zbog prioritetno poravnanje elektrona d e-atomske orbitale se nazivaju energija stabilizacije kompleksa ligandnim poljem.
brzina svetlosti With
= 3 ´ 10 10 cm/s.
Jedinica D 0 je isti kao i talasni broj n: cm - 1, što približno odgovara 12 J/mol.
U kompleksnim jedinjenjima koja uključuju kompleksatore istog perioda i u istom oksidacionom stanju, sa istim ligandima, parametar cijepanja je približno isti. Sa povećanjem stepena oksidacije kompleksirajućeg agensa, vrednost D 0 povećava. Tako je za akva komplekse 2+ i 2+ vrijednost parametra cijepanja 7800 i 10400 cm - 1, a za 3+ i 3+ - 13700 i 21000 cm - 1, respektivno.
I-Br - Cl - » NCS - NE 3 - F -Oh - H2O » H - NH 3 NE 2 -CN - "NE" CO. 









Suprotno tome, CN - ligandi uzrokuju značajno cijepanje d-AO, u iznosu od 33000 cm - 1. To znači da postoji jaka sklonost ka alociranju svih elektrona on d e-orbitale. Energy Gain, dobijen sa takvom populacijom orbitala, mnogo je veći od troškova energije zbog uparivanja elektrona.


Navedeni prelazi elektrona koji su primili višak energije odgovaraju apsorpcioni pojas oko 400 nm u apsorpcionom spektru rastvora heksaakvavanadijum(III) hlorida. Apsorpcija ljubičasto-ljubičastog područja spektra daje dodatnu boju otopini - svijetlo zelena.

I John Van Vleck da opiše niža stanja katjona prijelaznih metala okruženih ligandima - i anionima i neutralnim molekulima. Teorija kristalnog polja je dalje kombinovana [i rafinirana] sa (delokalizovanom) teorijom molekularne orbite u opštiju teoriju koja uzima u obzir delimičnu kovalentnost veze metal-ligand u koordinacionim jedinjenjima.
Teorija kristalnog polja omogućava predviđanje ili tumačenje spektra optičke apsorpcije i spektra elektronske paramagnetne rezonance kristala i kompleksnih jedinjenja, kao i entalpije hidratacije i stabilnosti u rastvorima kompleksa prelaznih metala.
Pregled teorije kristalnog polja[ | ]
Prema TCP, interakcija između prijelaznog metala i liganada proizlazi iz privlačenja između pozitivno nabijenog metalnog kationa i negativnog naboja elektrona u nevezujućim orbitalama liganda. Teorija smatra promjenu energije pet degeneriranih d-orbitale okružene tačkastim nabojem liganada. Kako se ligand približava metalnom jonu, elektroni liganda postaju bliži nekima d-orbitale od drugih, uzrokujući gubitak degeneracije. Elektroni d-orbitale i ligandi se međusobno odbijaju kao naboji istog predznaka. Dakle, energija onih d-elektroni koji su bliže ligandima postaju viši od onih koji su udaljeniji, što dovodi do cijepanja energetskih nivoa d-orbitale.
Sljedeći faktori utiču na podjelu:
- Priroda jona metala.
- Stepen oksidacije metala. Što je oksidacijsko stanje veće, to je veća energija cijepanja.
- Raspored liganada oko metalnog jona.
- Priroda liganada koji okružuju ion metala. Što je jači efekat liganada, veća je razlika između visokog i niskog nivoa energije.
Najčešći tip koordinacije liganda je oktaedarski, u kojem šest liganada stvara kristalno polje oktaedarske simetrije oko metalnog jona. U oktaedarskom okruženju metalnog jona s jednim elektronom u vanjskoj ljusci, d-orbitale su podijeljene u dvije grupe s razlikom u energetskim nivoima Δ oct ( energija fisije), dok je energija orbitala dxy, dxz I d yz biće niži od d z 2 i d x 2 -y 2, budući da se orbitale prve grupe nalaze dalje od liganada i doživljavaju manje odbijanja. Tri niskoenergetske orbitale su označene kao t 2g, i dva sa visokim - like npr.
Sljedeći najčešći su tetraedarski kompleksi u kojima četiri liganda formiraju tetraedar oko metalnog jona. U ovom slučaju d-orbitale su takođe podeljene u dve grupe sa razlikom u nivoima energije Δ tetr. Za razliku od oktaedarske koordinacije, orbitale će imati nisku energiju d z 2 i d x 2 -y 2, a visoka - d xy , d xz I d yz. Osim toga, pošto elektroni liganada nisu direktno u smjeru d-orbitale, energija cijepanja će biti niža nego kod oktaedarske koordinacije. Koristeći TCP također možete opisati plano-kvadrat i druge geometrije kompleksa.
Razlika u nivoima energije Δ između dvije ili više grupa orbitala također ovisi o prirodi liganada. Neki ligandi uzrokuju manje cijepanje od drugih, a razlozi za to su objašnjeni. Spektrohemijske serije- eksperimentalno dobijena lista liganada, poredanih uzlaznim redoslijedom Δ:
Oksidacijsko stanje metala također utiče na Δ. Metal s višim oksidacijskim stanjem privlači ligande bliže zbog veće razlike naboja. Ligandi bliže metalnom ionu uzrokuju veće cijepanje.
Kompleksi niskog i visokog okretanja[ | ]
Ligandi koji uzrokuju veliko cijepanje d-nivoi, kao što su CN− i CO, nazivaju se ligandi jako polje. U kompleksima sa takvim ligandima, nepovoljno je da elektroni zauzimaju visokoenergetske orbitale. Posljedično, orbitale niske energije su potpuno ispunjene prije nego što se počnu puniti orbitale visoke energije. Takvi kompleksi se nazivaju low-spin. Na primjer, NO 2 − je ligand visokog polja koji proizvodi veliko cijepanje. Sve 5 d-elektroni oktaedarskog jona 3− biće locirani na donjem nivou t 2g .
Nasuprot tome, ligandi koji uzrokuju malo cijepanje, kao što su I− i Br−, nazivaju se ligandi slabo polje. U ovom slučaju, lakše je postaviti elektrone u orbitale visoke energije nego postaviti dva elektrona u istu orbitalu niske energije, jer se dva elektrona na istoj orbiti međusobno odbijaju, a energetski trošak postavljanja drugog elektrona u orbitu je veća od Δ. Dakle, prije nego što se pojave upareni elektroni, u svakom od pet d-orbitale moraju biti postavljene jedan po jedan elektron u skladu sa Hundovim pravilom. Takvi kompleksi se nazivaju high-spin. Na primjer, Br− je ligand slabog polja koji uzrokuje malo cijepanje. Sve 5 d-orbitale jona 3−, koji takođe ima 5 d-elektroni će biti zauzeti jednim elektronom.
Energija cijepanja za tetraedarske komplekse Δ tetr je približno jednaka 4/9Δ oct (za isti metal i ligande). Kao rezultat, razlika u nivoima energije d-orbitale su obično ispod energije uparivanja elektrona, a tetraedarski kompleksi su obično visokog spina.
Dijagrami distribucije d-elektroni omogućavaju predviđanje magnetnih svojstava koordinacionih spojeva. Kompleksi s nesparenim elektronima su paramagnetični i privlače ih magnetsko polje, dok su kompleksi bez dijamagneta i slabo se odbijaju.
Energija stabilizacije kristalnog polja[ | ]
Energija stabilizacije kristalnog polja (CFE) je energija elektronske konfiguracije jona prelaznog metala u odnosu na prosečnu energiju orbitala. Do stabilizacije dolazi zbog činjenice da je u polju liganda nivo energije nekih orbitala niži nego u hipotetičkom sfernom polju, u kojem svih pet d-orbitale imaju istu silu odbijanja, i sve d-orbitale su degenerisane. Na primjer, u oktaedarskom slučaju nivo t 2g niži od prosječnog nivoa u sfernom polju. Posljedično, ako ove orbitale sadrže elektrone, tada je ion metala stabilniji u polju liganda u odnosu na sferno polje. Naprotiv, energetski nivo orbitala npr iznad prosjeka, a elektroni sadržani u njima smanjuju stabilizaciju.
Energija stabilizacije oktaedarskim poljem
Postoje tri orbitale u oktaedarskom polju t 2g stabiliziran u odnosu na prosječni nivo energije za 2/5 Δ oktave, i dvije orbitale npr destabilizovan za 3/5 Δ okt. Gore su bili primjeri dvije elektronske konfiguracije d 5 . U prvom primjeru postoji kompleks sa niskim spinom 3− sa pet elektrona unutra t 2g. Njegov ESP je 5 × 2 / 5 Δ okt = 2Δ okt. U drugom primjeru, kompleks sa visokim spinom 3− sa ESKP (3 × 2 / 5 Δ oct) − (2 × 3 / 5 Δ oct) = 0. U ovom slučaju, stabilizirajući efekat elektrona u orbitalama niskog nivoa je neutraliziran destabilizirajućim učinkom elektrona u orbitalama visokog nivoa.
Dijagrami cijepanja d-nivoa kristalnim poljem[ | ]
| oktaedarski | pentagonalno-bipiramidalni | kvadratno-antiprizmatični |
|---|---|---|
Teorija kristalnog polja zamenio teoriju valentnih veza 40-ih godina 20. veka. U svom čistom obliku, trenutno se ne koristi, jer ne može objasniti stvaranje kovalentnih veza u kompleksnim jedinjenjima i ne uzima u obzir pravo stanje liganada (na primjer, njihove stvarne veličine) čak ni u slučaju bliskih interakcija. čisto elektrostatički.
Već sredinom 50-ih, pojednostavljena teorija kristalnog polja zamijenjena je poboljšanom teorija polja liganda, uzimajući u obzir kovalentnu prirodu hemijskih veza između agensa za stvaranje kompleksa i liganda.
Međutim, najopštiji pristup objašnjavanju formiranja kompleksnih jedinjenja je dat teorija molekularne orbite(MO), koja trenutno prevladava nad svim ostalima. Metoda molekularne orbite omogućava kako čisto elektrostatičku interakciju u odsustvu preklapajućih atomskih orbitala, tako i cijeli skup srednjih stupnjeva preklapanja.
Pogledajmo osnovne koncepte teorija kristalnog polja, koja, kao i teorija valentnih veza, zbog svoje velike jednostavnosti i jasnoće još uvijek zadržava svoju važnost za kvalitativni opis kemijskih veza u složenim spojevima.
U teoriji kristalnog polja razmatra se hemijska veza između agensa za stvaranje kompleksa i liganda elektrostatički. Prema ovoj teoriji, ligandi se nalaze oko agensa za kompleksiranje na vrhovima pravilnih poliedara ( poliedri) kao tačkaste naknade. Teorija ne uzima u obzir stvarni volumen liganda.
Ligandi, poput tačkastih naboja, stvaraju oko agensa za stvaranje kompleksa elektrostatičko polje(„kristalno polje“, ako uzmemo u obzir kristal kompleksnog jedinjenja, ili ligand polje), u kojem su energetski nivoi agensa za stvaranje kompleksa i, prije svega, d-podnivoi se razdvajaju, a njihova energija se mijenja. Od prirode cijepanja ovisi energija novih energetskih nivoa simetrija raspored liganada (oktaedarski, tetraedarski ili drugo kristalno polje). Kada su molekuli H 2 O, NH 3 , CO i drugi koordinirani kao ligandi, oni se smatraju kao dipoli, orijentisan sa negativnim nabojem prema agensu za stvaranje kompleksa.
Razmotrimo slučaj oktaedarskog rasporeda liganada (na primjer, -3 ili 3+). U središtu oktaedra nalazi se kompleksirajući ion M(+ n) sa elektronima na d-atomske orbitale, a na njenim vrhovima se nalaze ligandi u obliku tačkastih negativnih naboja (na primjer, F - joni ili polarni molekuli poput NH 3). U konvencionalnom jonu M(+ n), koji nije povezan sa ligandima, energije svih pet d-AO su isti (tj. atomske orbitale degenerisati).
Međutim, u oktaedarskom polju liganada d-AO-ovi agensa za stvaranje kompleksa spadaju u nejednako pozicija. Atomske orbitale d(z 2) i d(x 2 -y 2), izdužene duž koordinatnih ose, najbliže su ligandima. Između ovih orbitala i liganada koji se nalaze na vrhovima oktaedra, javljaju se značajne razlike odbojne sile, što dovodi do povećanja orbitalne energije. Drugim riječima, ove atomske orbitale podliježu maksimalna izloženost polju liganda. Jako stisnuta opruga može poslužiti kao fizički model takve interakcije.
Ostala tri d-AO – d(xy), d(xz) I d(yz), koji se nalaze između koordinatnih osa i između liganada, nalaze se na većoj udaljenosti od njih. Interakcija takvih d-AO sa ligandima je minimalan, a samim tim i energija d(xy), d(xz) I d(yz)-AO se smanjuje u odnosu na originalni.
Dakle, peterostruko degenerisan d-AO kompleksirajući agens, ulazi oktaedarsko ligandno polje, izložena razdvajanje u dvije grupe novih orbitala – trostruko degenerisane orbitale sa nižom energijom, d(xy), d(xz) I d(yz), I dvostruko degenerisane orbitale sa višom energijom d(z 2) i d(x 2 -y 2). Ove nove grupe d-orbitale sa niže I veća energija označiti dε i dγ:
d(z 2) i d(x 2 -y 2)
d(xy), d(xz),d(yz)
Energetska razlika dva nova podnivoa dε i dγ je imenovan parametar razdvajanja Δ 0:
E 2 – E 1 = Δ 0 ≈ 0
Lokacija dva nova energetski podnivoi dε i dγ u odnosu na original ( d-AO) na energetskom dijagramu asimetrično:
(E 2 – E 0) > (E 0 – E 1).
Kvantnomehanička teorija to zahtijeva kada su novi energetski nivoi potpuno napunjeni elektronima, ukupna energija ostaje nepromijenjena, tj. ona bi trebala ostati jednak E 0 .
Drugim riječima, jednakost mora biti zadovoljena
4(E 2 – E 0) = 6(E 0 – E 1),
gdje su 4 i 6 – maksimum broj elektrona po dγ- i dε-AO. Iz ove jednakosti slijedi da
(E 2 – E 0) / (E 0 – E 1) = 3/2 i
(E 2 – E 1) / (E 0 – E 1) = 5/2, ili
Δ 0 / ( E 0 – E 1) = 5/2, odakle ( E 0 – E 1) = 2/5Δ 0 .
Postavljanje svakog elektrona od maksimalno šest mogućih na dε orbitale uzrok smanjiti (dobitke) energije za 2/5 Δ 0 .
Naprotiv, postavljanje svakog elektrona od četiri moguća na dγ orbitale uzrok povećati (trošak) energije za 3/5 Δ 0 .
Ako je naseljen elektronima dε- i dγ-orbitale u potpunosti, onda ne pobjeda energije neću(baš kao što neće dodatna potrošnja energije).
Ali ako original d-AO je samo popunjen djelomično i sadrži od 1 do 6 elektrona, a ti elektroni su postavljeni samo na dε-AO, onda dobijamo značajan energetski dobitak.
Dobitak energije zbog prioritetno poravnanje elektrona dε-atomske orbitale se nazivaju energija stabilizacije kompleksa ligandnim poljem.
Specifičnost svakog liganda utiče na polje koje ovaj ligand stvara - jaka ili slab. Kako jače polje ligandi nego više značenje parametar razdvajanja Δ 0 .
Proučavanje parametra cijepanja obično se zasniva na spektroskopski istraživanja. Talasne dužine apsorpcione trake kompleksi u kristalnom stanju ili u rastvoru, usled prenosa elektrona iz dε- on dγ-AO, povezan sa parametar razdvajanjaΔ 0 kako slijedi:
λ = c / ν; Δ 0 = E 2 – E 1 = h ν = h · ( c / λ),
gdje je Plankova konstanta h jednako 6,6260693 ∙ 10 -34 J s;
brzina svetlosti With
= 3 · 10 10 cm/s.
JedinicaΔ 0 je isti kao i talasni broj: cm -1, što približno odgovara 12 J/mol. Parametar razdvajanja, osim vrste liganda, zavisi na stepen oksidacije I priroda agens za kompleksiranje.
U kompleksnim jedinjenjima koja uključuju kompleksatore istog perioda i u istom oksidacionom stanju, sa istim ligandima, parametar cijepanja je približno isti. Sa povećanjem stepena oksidacije agensa za stvaranje kompleksa, vrednost Δ 0 povećava. Tako je za akva komplekse 2+ i 2+ vrijednost parametra cijepanja 7800 i 10400 cm -1, a za 3+ i +3 13700 i 21000 cm -1, respektivno. At povećanje nuklearnog naboja atoma koji formira kompleks Δ 0 takođe raste. Kationi heksaaminiridijum(III) 3+, heksaaminiridijum(III) 3+ i heksaaminiridijum(III) 3+ ( Z= 27, 45 i 77) karakteriziraju parametri cijepanja jednaki 22900, 34100 i 41000 cm -1.
Zavisnost Δ 0 o prirodi liganada je raznovrsnija. Kao rezultat proučavanja brojnih kompleksnih jedinjenja, ustanovljeno je da se u smislu njihove sposobnosti da povećaju parametar cijepanja kompleksirajućih metala koji se nalaze u njihovim uobičajenim oksidacijskim stanjima, najčešći ligandi mogu rasporediti u sljedeće: spektrohemijske serije, duž koje se monotono povećava vrijednost Δ 0:
I > Br > Cl > NCS - ≈ NO 3 - > F - > OH - > H 2 O > H - > NH 3 > NO 2 - > CN - > NO > CO.
Dakle, najjače elektrostatičko polje oko agensa za stvaranje kompleksa i najjače cijepanje d-AO je uzrokovan ligandima CN-, NO i CO. Razmotrimo distribuciju elektrona preko dε- i dγ-orbitale u oktaedarskom polju liganada. Provjeri dε- i dγ-orbitale se javljaju u potpunom skladu sa Hundovo pravilo I Paulijev princip. U ovom slučaju, bez obzira na vrijednost parametra cijepanja, prva tri elektrona zauzimaju kvantne ćelije dε-podnivo:
![]() dε
dε
Ako je broj elektrona po d- postoji više od tri podnivoa kompleksirajućeg agensa, postoje dvije mogućnosti za njihovo postavljanje na podijeljene podnivoe. Pri niskoj vrijednosti parametra cijepanja (slabo polje liganada), elektroni savladavaju energetsku barijeru odvajajući dε- i dγ-orbitale; četvrti, a zatim peti elektroni naseljavaju kvantne ćelije dγ-podnivo.
![]() dε
dε
Sa jakim poljem liganda i visokom vrijednošću Δ 0, populacija četvrtog i petog elektrona dγ-podnivo je isključen; popunjavanje u toku dε-orbitale.
![]() dε
dε
At ligandi slabog polja naseljavanje kvantnih ćelija sa 4 ili 5 elektrona paralelnih okretaja, pa se rezultirajući kompleks ispostavi da je jak paramagnetski. U jakom polju liganda formiraju se jedan, a zatim dva elektronska para dε-podnivo, dakle paramagnetizam ispada da je kompleks mnogo slabiji. Šesti, sedmi i osmi elektron u slučaju slabog polja završavaju ponovo dγ-podnivo, dopunjujući konfiguracije elektronskim parovima (jedan u slučaju d 6, dva – d 7 i tri - d 8):
![]() dε
dε
U slučaju jakog ligandnog polja, šesti elektron se naseli dε-AO, vodi do dijamagnetizam kompleksa, nakon čega sedmi i osmi elektron odlaze u dγ-podnivo:
![]() dε
dε
Očigledno, sa konfiguracijom od osam elektrona razlike u strukturi između kompleksa sa ligandima slab I jaka polja nestaju. Zauzetost orbitala devetim i desetim elektronom se također ne razlikuje za komplekse oba tipa:
![]() dε
dε
Vratimo se razmatranju elektronske strukture oktaedarskih kompleksnih jona 3+ i -3. Prema lokaciji u spektrohemijske serije, amonijak NH 3 je jedan od liganada jako polje, i fluorid ion F - – slabo polje. U -3 anionu, F - ligandi stvaraju slabo kristalno polje (Δ 0 = 13000 cm -1), a svi elektroni originalnog 3 d 6 -JSC nalaze se na dε- i dγ orbitale bez ikakvog uparivanja. Kompleksni jon je high-spin i sadrži četiri nesparena elektrona, tako da paramagnetski:

U 3+ jonu, NH 3 ligandi stvaraju jako kristalno polje (Δ 0 = 22900 cm -1), sva 3 d 6 -elektroni se postavljaju na energetski povoljniji dε-orbitale. Prijenos elektrona iz dε- on dγ orbitale nemoguće jer takođe visoka energetska barijera. Dakle, ovaj kompleksni kation je low spin, ne sadrži nesparene elektrone i dijamagnetski:

Na sličan način mogu se predstaviti šeme za raspodjelu elektrona po orbitalama u oktaedarskom polju za 2+ i -4 iona:


H 2 O ligandi stvaraju slabo polje; razmjena elektrona između dε- i dγ-orbitale ne izazivaju nikakve poteškoće i stoga je broj nesparenih elektrona u kompleksnom jonu isti kao u konvencionalnom ionu Fe + II. Rezultirajući aqua kompleks je high-spin, paramagnetski.
Suprotno tome, CN - ligandi uzrokuju značajno cijepanje d-AO, u iznosu od 33000 cm -1. To znači da postoji jaka sklonost ka alociranju svih elektrona on dε-orbitale. Energy Gain, dobijen sa takvom populacijom orbitala, mnogo je veći od troškova energije zbog uparivanja elektrona.
Iz perspektive metode valentne veze, hibridizacija valentnih orbitala koje formiraju vezu u akva kompleksu uključuje d-AO eksterni podnivo (4 sp 3 d 2), a kod niskog okreta - d- interni podnivo AD (3 d 2 4sp 3).
Dakle, u kompleksima sa visokim spinom sa ligandima slabog polja dolazi do hibridizacije uz učešće d-AO vanjskog podnivoa i niskog spina sa ligandima visokog polja - d- AD internog podnivoa. Broj nesparenih elektrona u kompleksu može se odrediti elektronskom paramagnetnom rezonancom (EPR). Pomoću instrumenata ove metode, zvanih EPR spektrometri, proučavaju se paramagnetne supstance.
Teorija kristalnog polja omogućava objašnjenje pojave jedne ili druge boje u složenim spojevima. Među složenim jedinjenjima, značajan broj u kristalnom stanju i vodenom rastvoru odlikuje se sjajnom bojom. Tako je vodeni rastvor koji sadrži 2+ kationa obojen intenzivno plavom bojom, 3+ kationi daju rastvoru ljubičastu boju, a 2+ kationi daju joj crvenu boju. Ako svjetlost prolazi kroz otopinu ili kristalni uzorak tvari vidljivi dio spektra, tada su u principu moguće tri opcije za fizičko ponašanje uzorka: nema apsorpcije svetlosti bilo koje talasne dužine (uzorak supstance bezbojan, iako može imati apsorpcione trake u ultraljubičastom području spektra); potpuna apsorpcija svjetlosti preko cijelog raspona valnih dužina (uzorak će se pojaviti crna); konačno, apsorpcija svetlosti samo određene talasne dužine(onda će uzorak imati boja komplementarna apsorbiranoj uski dio spektra).

Tako se određuje boja otopine ili kristala frekvencija apsorpcionih traka vidljivo svetlo. Apsorpcija svjetlosnih kvanta kompleksima (na primjer, onima sa oktaedarskom strukturom) objašnjava se interakcijom svjetlosti s elektronima koji se nalaze na dε-podnivo, praćen njihovim prelaskom na prazne orbitale dγ-podnivo. Na primjer, kada se svjetlost propušta kroz vodeni rastvor koji sadrži heksaakvatitanijum(III) 3+ katione, u žuto-zelenoj oblasti spektra detektuje se traka apsorpcije svetlosti (20300 cm -1, λ=500 nm). To je zbog prijelaza jednog elektrona agensa za stvaranje kompleksa iz dε-AO uključen dγ-podnivo:

Stoga otopina koja sadrži 3+ poprima ljubičastu boju (pored apsorbirane žuto-zelene). Otopina vanadijeve soli Cl 3 je zelene boje. To je također zbog odgovarajućih prijelaza elektrona kada apsorbuju dio energije svjetlosnog snopa. U osnovnom stanju, sa elektronskom konfiguracijom vanadijuma(III) 3 d 2, dva nesparena elektrona su zauzeta dε-podnivo:

Postoji samo dvije opcije za prijelaz dva elektrona on dγ-podnivo: bilo oboje elektroni su zauzeti dγ-AO, ili samo jedan Od njih. Bilo koji drugi prijelazi elektrona povezani sa smanjenjem ukupnog spina su zabranjeni.
Navedeni prelazi elektrona koji su primili višak energije odgovaraju apsorpcioni pojas oko 400 nm u apsorpcionom spektru rastvora heksaakvavanadijum(III) hlorida. Apsorpcija ljubičasto-ljubičastog područja spektra daje dodatnu boju otopini - svijetlo zelena. Ako agens za kompleksiranje ima elektronsku konfiguraciju d 0 ili d 10 onda tranzicije elektrona With dε- on dγ-podnivo ili obrnuto nemoguće bilo zato odsustvo elektrona, bilo zato odsustvo slobodnih orbitala. Stoga, rješenja kompleksa sa agensima za stvaranje kompleksa kao što je Sc(III) (3 d 0), Cu(I) (3 d 10), Zn(II) (3 d 10), Cd(II) (4 d 10), itd., ne apsorbiraju energiju u vidljivom dijelu spektra i pojavljuju se bezbojan. Selektivnost apsorpcije svetlosti ne zavisi samo od agens za kompleksiranje I njegovo oksidaciono stanje, ali i iz vrsta liganada. Prilikom zamjene liganada na lijevoj strani spektrohemijskog niza u kompleksnom spoju sa ligandima koji stvaraju jaka uočeno elektrostatičko polje povećati dio energije koju apsorbuju elektroni iz propuštene svjetlosti i, kao posljedica, smanjiti talasnu dužinu odgovarajućeg apsorpcionog pojasa. Dakle, vodeni rastvor koji sadrži tetraakvabakar(II) 2+ katjone je plave boje, a rastvor tetraaminbakar(II) 2+ sulfata je intenzivno plave boje.
Povezane informacije.