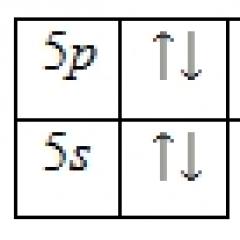
Protolitička teorija kiselina i baza. Kiseline i baze u organizacionoj hemiji. Konjugirana kiselina i konjugirana baza. Kiselinsko-bazne ravnoteže, primjeri. Utjecaj supstituenata u molekulu na kiselost i bazičnost Savremene ideje o kiselini
Kiseline i baze ispoljavaju svoja svojstva samo u prisustvu jedne druge.Nijedna supstanca neće odustati od protona ako u sistemu nema akceptora protona - baze, i obrnuto.tj. formiraju konjugirani kiselinsko-bazni par u kojoj što je kiselina jača, to je njena konjugirana baza slabija, a što je baza jača to je njena konjugirana kiselina slabija.
Kiselina koja daje proton postaje konjugirana baza, a baza koja prihvata proton postaje konjugirana kiselina. Kiselina se obično označava kao AN, a baza je B
Na primjer: HC1- H + + C1 -, HC1 - jaka kiselina; C1 - ion - konjugirana slaba baza;
CH 3 COOH - CH 3 COO - + H +, CH 3 COOH je slaba kiselina, a CH 3 COO - je konjugirani jak bazni ion.
Opšti pogled se može predstaviti na sljedeći način:
N+¦ : A + B N:V+ + A:-
skup osnova otpora otpor
nešto osnovno
Već smo rekli da se kisela svojstva jedinjenja otkrivaju samo u prisustvu baze, a bazna svojstva - u prisustvu kiseline, tj. u jedinjenjima postoji određena kiselinsko-bazna ravnoteža, za čije proučavanje se koristi H 2 O kao rastvarač. U odnosu na H 2 O kao kiselinu ili kao bazu, određuju se kiselinsko-bazna svojstva jedinjenja.
Za slabe elektrolite, kiselost se kvantificira TO Rav reakcija koja uključuje prijenos H + iz kiseline u H 2 O kao bazu.
CH 3 COOH + H 2 O - CH 3 COO - + H 3 O +
koja je bazna kiselina
CH 3 COO - - acetatni jon, konjugirana baza;
H 3 O + - hidronijum jon, konjugirana kiselina.
Koristeći vrijednost konstante ravnoteže ove reakcije i uzimajući u obzir da je koncentracija H 2 O gotovo konstantna, možemo odrediti proizvod K? zove konstanta kiselosti TO kiselost (K A).

Što je veći K a, to je jača kiselina. Za CH 3 COOH K a = 1,75 10 -5. tako male vrijednosti su nezgodne u praktičnom radu, pa se K a izražava kroz rK A (pK = -?g K A). Za CH 3 COOH pK a = 4,75. Što je niža pKa vrijednost, to je kiselina jača.
Jačina baza je određena pK vrijednosti BH+.
Kisela svojstva organskih jedinjenja sa funkcionalnim grupama koje sadrže vodonik (alkoholi, fenoli, tioli, karboksilne kiseline, amini).
Organske kiseline
U organskim jedinjenjima, ovisno o prirodi elementa s kojim je H + povezan, razlikuju se sljedeće kiseline:
HE- kiseline (karboksilne kiseline, fenoli, alkoholi)
CH - kiseline (ugljovodonici i njihovi derivati)
NH- kiseline (amini, amidi, imidi)
SH- kiseline (tioli).
Kiselinski centar je element i njemu pripadajući atom vodika.
Jačina kiseline zavisi od toga anjonska stabilnost, one. od konjugatne baze, koja nastaje kada se H + odvoji od molekula. Što je anjon stabilniji, to je veća kiselost jedinjenja.
Stabilnost aniona zavisi od brojnih faktora koji doprinose delokalizaciji naelektrisanja. Što je delokalizacija naboja veća, anjon je stabilniji, kisela svojstva su jača.
Faktori koji utiču na stepen delokalizacije:
- 1. Priroda heteroatoma u kiselom mjestu
- 2. Elektronski efekti atoma ugljikovodičnih radikala i njihovih supstituenata
- 3. Sposobnost anjona za solvataciju.
- 1. Zavisnost kiselosti od heteroatoma.
Priroda heteroatoma se razumije kao njegova elektronegativnost (E.O.) i polarizabilnost. Što je veći (E.O.), lakše dolazi do heterolitičkog cijepanja u molekulu. U periodima s lijeva na desno, kako se naboj jezgra povećava, (E.O) raste, tj. sposobnost elemenata da drže negativan naboj. Kao rezultat pomaka u gustini elektrona, veza između atoma je polarizirana. Što je više elektrona i što je veći radijus atoma, što su elektroni vanjskog energetskog nivoa udaljeniji od jezgra, veća je polarizabilnost i veća kiselost.
Primjer: CH- NH- OH- SH-
povećanje E.O. i kiselost
C, N, O - elementi istog perioda. E.O. raste tokom perioda, povećava se kiselost. U ovom slučaju polarizacija neće uticati na kiselost.
Polarizabilnost atoma u periodu se neznatno mijenja, pa je glavni faktor koji određuje kiselost E.O.
Sada razmislite o OH-SH-
povećana kiselost
O, S - su u istoj grupi, radijus u grupi se povećava odozgo prema dolje, stoga se povećava i polarizabilnost atoma, što dovodi do povećanja kiselosti. S ima veći atomski radijus od O, tako da tioli pokazuju jače kisele osobine u odnosu na alkohole.
Uporedite tri jedinjenja: etanol, etantiol i aminoetanol:
H 3 C - CH 2 - HE, H 3 C - CH 2 - SH i H 3 C - CH 2 - N.H. 2
- 1. Uporedimo po radikalima - isti su;
- 2. Po prirodi heteroatoma u funkcionalnoj grupi: S i O su u istoj grupi, ali S ima veći atomski radijus i veću polarizabilnost, stoga etanetiol ima jača kisela svojstva
- 3. Sada uporedimo O i N. O ima veći EO, stoga će kiselost alkohola biti veća.
- 2. Utjecaj ugljikovodičnih radikala i supstituenata prisutnih u njemu
Potrebno je skrenuti pažnju studentima da jedinjenja koja se upoređuju moraju imati isti kiselinski centar i isti rastvarač.
Supstituenti koji povlače elektrone (E.A.). doprinose delokalizaciji elektronske gustine, što dovodi do stabilnosti anjona i, shodno tome, povećanja kiselosti.
Supstituenti koji doniraju elektrone (E.D.). naprotiv, doprinose koncentraciji elektronske gustine u kiselinskom centru, što dovodi do smanjenja kiselosti i povećanja bazičnosti.
Na primjer: monohidratni alkoholi pokazuju slabija kisela svojstva u odnosu na fenole.
Primjer: H 3 C > CH 2 > OH
- 1. Kiselinski centar je isti
- 2. Rastvarač je isti
U monohidričnim alkoholima, elektronska gustina se pomera sa ugljikovodičnih radikala na OH grupu, tj. radikal pokazuje +I efekat, tada je velika količina elektronske gustine koncentrisana na OH grupu, usled čega je H + čvršće vezan za O i prekid veze O-H je otežan, stoga monohidratni alkoholi pokazuju slaba kisela svojstva .
U fenolu, naprotiv, benzenski prsten je E.A., a OH grupa je E.D.
Zbog činjenice da hidroksilna grupa ulazi u zajedničku konjugaciju sa benzenskim prstenom, dolazi do delokalizacije elektronske gustine u molekulu fenola i povećava se kiselost, jer konjugacija je uvijek praćena povećanjem kiselih svojstava.
Povećanje ugljikovodičnih radikala u monokarboksilnim kiselinama također utječe na promjenu kiselih svojstava, a kada se supstituenti unesu u ugljovodonik, dolazi do promjene kiselih svojstava.
primjer: U karboksilnim kiselinama pri disocijaciji nastaju karboksilatni ioni - najstabilniji organski anioni.

U karboksilatnom jonu, negativni naboj zbog p, p-konjugacije ravnomjerno je raspoređen između dva atoma kisika, tj. delokalizovan je i, shodno tome, manje koncentriran, stoga je u karboksilnim kiselinama kiselinski centar jači nego u alkoholima i fenolima.



Sa povećanjem ugljikovodika radikala, koji igra ulogu E.D. kiselost monokarboksilnih kiselina opada zbog smanjenja d+ na atomu ugljika karboksilne grupe. Dakle, u homolognom nizu kiselina, mravlja kiselina je najjača.



Prilikom predstavljanja E.A. supstituent u ugljikovodičnom radikalu, na primjer hlor - povećava se kiselost spoja, jer zbog -I efekta, elektronska gustina je delokalizirana i d + na C atomu karboksilne grupe raste, stoga će u ovom primjeru trihloroctena kiselina biti najjača.
3. Utjecaj rastvarača.
Interakcija molekula ili jona otopljene tvari s otapalom naziva se proces rješenje. Stabilnost anjona značajno ovisi o njegovoj solvataciji u otopini: što je ion više solvatiran, to je stabilniji, a što je solvatacija veća, to je manja veličina jona i manja je delokalizacija negativnog naboja u njemu.
Izrazi "kiselina" i "baza" koriste se za označavanje dvije grupe spojeva koji imaju skup dijametralno suprotnih svojstava. Godine 1923. I. Brønsted i T. Lowry su predložili opću protolitičku teoriju kiselina i baza. Prema ovoj teoriji, sljedeće definicije odgovaraju konceptima kiseline i baze.
Kiselina je molekul ili ion koji može donirati vodikov kation (proton). Kiselina je donor protona.
Baza je molekul ili ion koji je sposoban da veže vodikov kation (proton). Baza je akceptor protona.
Kiselina, koja odustaje od protona, pretvara se u česticu koja teži da ga prihvati, što se naziva konjugirana baza:

Baza se, dodajući proton, pretvara u česticu koja ga teži da oda, što se zove konjugirana kiselina:

Kombinacija kiseline i njene konjugirane baze ili baze i njene konjugirane kiseline naziva se konjugirani kiselinsko-bazni parovi.
Jačina kiseline određena je njenom sposobnošću da donira proton, odnosno jaka kiselina je aktivni donor protona. Jačina kiselina u vodenim otopinama opada sljedećim redoslijedom:

Jačina baze je određena njenom sposobnošću da prihvati proton, odnosno jaka baza je aktivni akceptor protona. Jačina baza u vodenim rastvorima, odnosno njihov afinitet za protone, opada u nizu:
Jake kiseline, koje lako doniraju proton, pretvaraju se u konjugirane baze, koje ne prihvataju lako proton. Stoga je disocijacija ovih kiselina gotovo nepovratna:
Slabe kiseline, koje teško odustaju od protona, pretvaraju se u konjugirane baze koje aktivno prihvataju proton, što čini disocijaciju slabih kiselina reverzibilnim procesom, a ravnoteža se pomjera prema nedisocijacijskom obliku:

Jake i slabe baze ponašaju se na sličan način, pretvarajući se kao rezultat reakcije u odgovarajuće konjugirane kiseline, odnosno u ovim slučajevima postoje i konjugirani kiselinsko-bazni parovi:
Neke supstance su u nekim reakcijama sposobne da deluju kao donor protona, donirajući ga jedinjenjima koja imaju veći afinitet za proton, au drugima - kao akceptor protona, oduzimajući ga jedinjenjima sa manjim afinitetom za proton. Takve supstance se nazivaju amfoliti.
Amfoliti su molekule ili ioni koji mogu i donirati i prihvatiti proton, te stoga ulaze u reakcije karakteristične i za kiseline i za baze. Amfolit pokazuje svojstva kiseline ili baze u zavisnosti od toga sa kojim supstancama je u interakciji. Tipičan amfolit je voda, jer kao rezultat njegove elektrolitičke disocijacije nastaju i jaka kiselina i jaka baza:
![]()
Osim toga, voda stupa u interakciju s kiselinama, djelujući kao baza, i s bazama, pokazujući svojstva kiseline:
Amfoliti su hidroksidi nekih metala (Zn, Al, Pb, Sn, Cr):
Amfoliti su hidroanioni polibaznih kiselina, na primjer HC0 3 -, HP0 4 2- i H2PO4-.
Amfoliti su također spojevi čije molekule sadrže dvije različite kiselinsko-bazne grupe, na primjer, biološki važne a-amino kiseline. Kao rezultat prijenosa protona iz karboksilne grupe u amino grupu, molekul α-amino kiseline se transformira iz tautomera* koji ne sadrži nabijene grupe u tautomer koji ima bipolarno-jonsku (zwitterionsku) strukturu. Dakle, a-amino kiseline karakteriziraju prototropski tautomerizam(Odjeljak 21.2.1).

U kristalnom stanju i u vodenim rastvorima, ova ravnoteža za α-amino kiseline je skoro potpuno pomerena prema tautomeru sa bipolarnom strukturom. Dakle, za glicin u vodenom rastvoru, sadržaj tautomera sa bipolarnom jonskom strukturom je 223 000 puta veći od sadržaja drugog tautomera.
Zbog ove strukturne karakteristike, molekule α-aminokiselina pokazuju kisela svojstva zbog amonijum grupe (NH 3 +), a bazna zbog jonizovane karboksilne grupe (-COO-), delujući kao amfoliti:

Kao i svi amfoliti, α-amino kiseline su slabi elektroliti.
Prema protolitičkoj teoriji to su kiseline, baze i amfoliti protoliti, a proces prelaska protona iz kiseline u bazu naziva se protoliza a objašnjava se činjenicom da ove dvije supstance imaju različite afinitete prema protonima. Kiselinsko-bazna interakcija uvijek uključuje dva konjugirana kiselinsko-bazna para, a prijenos protona uvijek se događa u pravcu stvaranja slabijih kiselina, uključujući i one konjugirane. Ako je sklonost reaktanata da komuniciraju s protonom srazmjerna, onda protolitička ravnoteža.
Protolitička, ili acidobazna, ravnoteža ustanovljen kao rezultat takmičenja za proton(H+) između baza međusobno konjugiranih kiselinsko-baznih parova(NA, A- I VN + , V). Protolitička ravnoteža se uvijek pomjera prema stvaranju slabije kiseline:

Protolitička ravnoteža može se shematski prikazati sljedećim dijagramom:

Prijenos protona se uvijek odvija iz jake kiseline To na anjon slabe kiseline, što je praćeno istiskivanjem slabe kiseline iz njene soli pod uticajem jače kiseline.
Protolitička ravnoteža se opaža tokom jonizacije slabih elektrolita u vodi (odjeljak 7.2). Dakle, jonizacija slabe kiseline u vodenim rastvorima je posledica nadmetanja za proton između anjona slabe kiseline i vode, koji deluje kao baza, odnosno akceptor protona. Ovaj proces je reverzibilan i karakterizira ga konstanta ravnoteže K a:

Kada slaba baza stupi u interakciju s vodom, ova potonja, djelujući kao donor protona, potiče ionizaciju ove baze, koja je ravnotežne prirode:
za slabe elektrolite kiseline i baze karakteriziraju vrijednosti konstanti kiselosti K a i bazičnost K b shodno tome (odjeljak 7.2). Ako ove konstante karakteriziraju protolitičku interakciju vode s kiselinom ili bazom jednog konjugiranog para HA, A ili BH +, B, tada je proizvod konstanti kiselosti K a i osnovnost Kb, komponente datog para uvijek je jednak ionskom proizvodu vode Kn 2 o = 1 * 10 -14 (na 22 °C):
Ovi izrazi nam omogućavaju da zamenimo konstantu bazičnosti u slučaju vodenih rastvora Q ili indikator osnovnosti pKb slaba baza do konstante kiselosti K a ili nivo kiselosti pK a konjugirana kiselina ove baze. U praksi, za karakterizaciju protolitičkih svojstava spoja, obično se koristi vrijednost rK a. Dakle, jačina amonijaka u vodi kao baze (pKb, = 4.76) može se okarakterisati indeksom kiselosti amonijum jona NH4+, odnosno konjugirane kiseline: pK a (NH4+) = 14 - 4,76 - 9.24. Stoga, u slučaju vodenih otopina nema potrebe za posebnom tablicom konstanti ili indikatora! bazičnosti, dovoljna je jedna skala kiselosti prikazana u tabeli. 8.1, gdje su svojstva baza karakterizirana konstantom K a ili indikator kiselosti pK a njihove konjugirane kiseline. Najjača kiselina u vodenim rastvorima je vodikov kation H+ (tačnije H3O+), a najjača baza je OH- anjon. Magnituda pK a kvantitativno karakterizira snagu slabih elektrolita u vodenim otopinama.
Slaba kiselina je slabija, što je njena pKa vrijednost veća. Slaba baza je slabija, što je niža pK vrijednost njene konjugirane kiseline.
Značenje pK a jednak je pH vrijednosti vodene otopine u kojoj je dati slab elektrolit ioniziran za 50%: budući da je u ovom slučaju [A - ] = [HA], tada K a= [H + ] i pK a= pH. Dakle, za octenu kiselinu u njenom vodenom rastvoru sa pH = pK a (CH 3 COOH) = = 4,76, postoji jednakost [CH 3 COO-] = [CH 3 COOH], a za vodeni rastvor amonijaka jednakost = će se posmatrati u rastvoru sa pH = pK i (NH4+) = 9,24.
Osim toga, vrijednost pK a omogućava vam da odredite pH vrijednost vodenih otopina gdje se data slaba kiselina HA nalazi pretežno (99% ili više) u obliku aniona (A") - to će biti u otopinama s pH > pK a + 2; ili u obliku molekula (NA) - u otopinama s pH< pK a - 2. U intervalu ArH = pK a ± 2 slab elektrolit u vodenim rastvorima postoji i u jonizovanom i u nejonizovanom obliku u odnosu [A-]/[HA] od 100:1 do 1: 100 respektivno.

Date relacije dozvoljavaju, znajući vrijednost pK a biosupstrata, odredite u kakvom će on obliku biti pri određenoj pH vrijednosti u vodenim sistemima tijela. Osim toga, znanje o veličini pK a slabog elektrolita vam omogućava da izračunate pH vodenih otopina ovog elektrolita ako je poznata njegova koncentracija.
Prema Lowry-Bronstedovoj teoriji, kiseline su supstance koje mogu donirati proton, a baze su supstance koje prihvataju proton:
Ako je B jaka baza, onda je slaba kiselina. Uz pomoć se može okarakterisati stepen disocijacije kiseline ili konjugirane kiseline. Uz konstantu kiselosti postoji i koncept konstante bazičnosti i njoj odgovarajući
![]()
Prema Lewisovoj teoriji, kiseline su jedinjenja koja mogu prihvatiti, a baze mogu donirati par elektrona.
U širem smislu, kiseline su spojevi koji opskrbljuju kation, u određenom slučaju proton, ili prihvataju par elektrona s atomom ili grupom atoma, itd.).
Baze prihvataju kation, u određenom slučaju proton, ili daju par elektrona sa atomom ili grupom atoma
Kiselost ili bazičnost neke supstance se manifestuje u procesu interakcije sa drugom supstancom, posebno sa otapalom, i stoga je relativna.
Mnoge supstance imaju amfoterna svojstva. Na primjer, voda, alkoholi i kiseline su u stanju da doniraju proton u interakciji s bazama i prihvate ga s kiselinama. U nedostatku kiselina i baza, dvojna priroda takvih spojeva očituje se u autoprotolizi:
Disocijacija kiseline u rastvaraču znači prijenos protona u rastvarač:
![]()
U tom smislu, jačina kiseline se izražava konstantom disocijacije, koja je karakteristična samo za dato otapalo. Prenos protona se dešava samo u visoko jonizujućim i rastvorljivim rastvaračima, kao što je voda.
Stepen kiselinske disocijacije tokom prijelaza iz vodenog u organski medij smanjuje se za 4-6 redova veličine.
Snažno solvatirajuća i jonizujuća otapala neutraliziraju jačinu kiselina, dok nepolarna i nisko-jolarna otapala, u interakciji s njima na nivou vodoničnih veza, imaju diferencirajući učinak. U potonjem slučaju, razlike u jačini kiseline postaju značajnije.
U inertnim, nepolarnim rastvaračima vjerovatnoća apstrakcije protona je vrlo niska, iako zbog unutrašnjih elektronskih efekata veza može biti visoko polarizirana. U takvim uslovima, kisela svojstva se manifestuju u samo-asocijaciji molekula HA ili u vezi sa akceptorima protona - bazama. U potonjem slučaju, mjera kiselosti je konstanta asocijacije sa bilo kojom bazom odabranom kao standardom. Na primjer, konstanta asocijacije benzojeve kiseline i difenilgvanidina u benzenu je
Protonizirajuća moć kiseline izražava se i kroz funkciju kiselosti, koja karakterizira stanje ravnoteže pri složenom formiranju kiselina i baza u organskim rastvaračima. Kao baze najčešće se koriste indikatori koji mijenjaju boju ovisno o jačini kiseline, što omogućava proučavanje sistema spektroskopskim metodama. U ovom slučaju, važno je da se u spektru identifikuju trake pridruženih slobodnih baza.
Dakle, u uvodnom mediju kiseline i baze formiraju solvatirane ione, u organskom mediju - jonske parove i njihove saradnike.
Blizak po značenju konceptu asocijacije je koncept kompleksiranja: zbog interakcije donor-akceptor i dativ, kompleksi elektron-donor-akceptor, koji se nazivaju i kompleksi za prijenos naboja, mogu se formirati od jona i molekula
Vrste donora elektrona: I) jedinjenja sa heteroatomima. koji sadrže usamljene parove elektrona, etera, amina, sulfida, jodida, itd. Na primjer: dietil eter iz lampn. ldmetil sulfid trifenilfosfin propil jodid
2) jedinjenja koja sadrže - veze, etilene, acetilene, benzol i njegove derivate i druge aromatične sisteme;
3) jedinjenja sposobna da prenose elektrone - alkani, cikloalkani:

Vrste akceptora elektrona: 1) metalna jedinjenja koja sadrže praznu orbitalu (K-orbitala): halogenidi itd., joni metala
2) jedinjenja sposobna da prihvate par elektrona po praznom halogenu protiv vezivanja, mešani halogeni
3) spojevi sa -vezama sa jako elektronegativnim supstituentima, koji učestvuju u formiranju kompleksa zbog antivezivanja tetracijanetilen trinitrobenzena
Dakle, bilo koji donor može komunicirati sa slobodnim akceptorom, formirajući novi MO sa smanjenjem energije sistema:

U organskoj hemiji od najveće važnosti su -kompleksi, a -kompleksi se odlikuju konstantama nestabilnosti, koje su u suštini konstante njihove disocijacije.
Konstante disocijacije i asocijacije kiselina i baza još uvijek ne opisuju dovoljno u potpunosti njihova svojstva. Važnu ulogu u razumijevanju mnogih kemijskih procesa, a posebno fenomena katalize, igrao je koncept tvrdih i mekih kiselina i baza (princip
ZHMKO). U skladu s ovim konceptom, srodne kiseline i baze djeluju najefikasnije: meka kiselina s mekom bazom, tvrda s tvrdom.
Znaci tvrdih kiselina i baza (tabela 8): 1) mala veličina jona ili molekula; 2) visoka elektronegativnost; 3) lokalizovano punjenje; 4) niska polarizabilnost; 5) najniže slobodne orbitale (LVO) kiselina imaju visoku energiju; 6) najviše popunjene orbitale (HFO) baza imaju nisku energiju.
Prema Lewisu, kisela i bazična svojstva organskih jedinjenja procjenjuju se njihovom sposobnošću da prihvate ili daju elektronski par i potom formiraju vezu. Atom koji prihvata elektronski par je akceptor elektrona, a jedinjenje koje sadrži takav atom treba klasifikovati kao kiselinu. Atom koji daje elektronski par je donor elektrona, a spoj koji sadrži takav atom je baza.
Konkretno, Lewisove kiseline mogu biti atom, molekula ili kation: proton, halogenidi elemenata druge i treće grupe periodnog sistema, halogenidi prelaznih metala - BF3, ZnCl2, AlCl3, FeCl3, FeBr3, TiCl4, SnCl4, SbCl5, katjoni metala, sumporni anhidrid - SO3, karbokation. Lewisove baze uključuju amine (RNH2, R2NH, R3N), alkohole ROH, etere ROR
Prema Brønsted-Lowryju, kiseline su supstance koje mogu donirati proton, a baze su supstance koje mogu prihvatiti proton.
Konjugacija kiseline i baze:
HCN (kiseli) i CN- (bazni)
NH3 (baza) i NH4+ (kiselina)
Kiselinsko-bazna (ili protolitička) ravnoteža je ravnoteža u kojoj je uključen proton (H+).
HCOOH + H 2 O D H 3 O + + HCOO -
acid2 base1
H 2 O + NH 3 D NH 4 + + OH - .
acid1 base2 konjugat konjugat
acid2 base1
7. Vrste izomerizma u organskoj hemiji. Strukturni, prostorni i optički izomerizam. Kiralnost. Raspored i konfiguracija. R, S, Z, E – nomenklature.
Postoje dvije vrste izomerizma: strukturni i prostorni (stereoizomerizam). Strukturni izomeri se međusobno razlikuju po redoslijedu veza atoma u molekuli, stereo-izomeri - po rasporedu atoma u prostoru s istim redoslijedom veza između njih.
Strukturna izomerija: izomerija ugljeničnog skeleta, poziciona izomerija, izomerija različitih klasa organskih jedinjenja (međuklasna izomerija).
Strukturni izomerizam
Izomerizam ugljeničnog skeleta
 Poziciona izomerija nastaje zbog različitih položaja višestruke veze, supstituenta i funkcionalne grupe sa istim ugljikovim skeletom molekula:
Poziciona izomerija nastaje zbog različitih položaja višestruke veze, supstituenta i funkcionalne grupe sa istim ugljikovim skeletom molekula:
Prostorni izomerizam
Prostorni izomerizam se dijeli na dva tipa: geometrijski i optički.
Geometrijska izomerija je karakteristična za jedinjenja koja sadrže dvostruke veze i ciklička jedinjenja. Budući da je slobodna rotacija atoma oko dvostruke veze ili u prstenu nemoguća, supstituenti se mogu nalaziti ili na istoj strani ravnine dvostruke veze ili prstena (cis pozicija) ili na suprotnim stranama (trans pozicija).
 Optička izomerija se javlja kada je molekul nekompatibilan sa svojom slikom u ogledalu. To je moguće kada atom ugljika u molekuli ima četiri različita supstituenta. Ovaj atom se naziva asimetričan.
Optička izomerija se javlja kada je molekul nekompatibilan sa svojom slikom u ogledalu. To je moguće kada atom ugljika u molekuli ima četiri različita supstituenta. Ovaj atom se naziva asimetričan.
KIRALNOST, svojstvo objekta da bude nekompatibilno sa njegovom slikom u idealnom ravnom ogledalu.
Različite prostorne strukture koje nastaju rotacijom oko jednostavnih veza bez narušavanja integriteta molekula (bez prekida hemijskih veza) nazivaju se KONFORMACIJE.
Struktura alkana. Sp3 je stanje ugljika. Karakteristike C-C i C-H veza. Princip slobodne rotacije. Konformacija. Načini predstavljanja i nomenklatura. Fizička svojstva alkana.
 Svi atomi ugljika u molekulima alkana su u tom stanju sp 3 -hibridizacija, ugao između C-C veza je 109°28", stoga molekuli normalnih alkana sa velikim brojem atoma ugljika imaju cik-cak strukturu (cik-cak). Dužina C-C veze u zasićenim ugljovodonicima je 0,154 nm
Svi atomi ugljika u molekulima alkana su u tom stanju sp 3 -hibridizacija, ugao između C-C veza je 109°28", stoga molekuli normalnih alkana sa velikim brojem atoma ugljika imaju cik-cak strukturu (cik-cak). Dužina C-C veze u zasićenim ugljovodonicima je 0,154 nm
C-C veza je kovalentna nepolarna. C-H veza je kovalentna i slabo polarna, jer su C i H bliski po elektronegativnosti.
Fizička svojstva
U normalnim uslovima, prva četiri člana homolognog niza alkana su gasovi, C 5 -C 17 su tečnosti, a počev od C 18 su čvrste materije. Točke topljenja i ključanja alkana njihove gustine se povećavaju sa povećanjem molekularne težine. Svi alkani su lakši od vode i nerastvorljivi su u njoj, ali su rastvorljivi u nepolarnim otapalima (na primer, benzen) i sami su dobri rastvarači.
· Tačke topljenja i ključanja se smanjuju od manje razgranate do više razgranate.
· Gasni alkani sagorevaju bezbojnim ili blijedoplavim plamenom i oslobađaju velike količine toplote.
Rotacija atoma oko s-veze neće dovesti do njenog prekida. Kao rezultat intramolekularne rotacije duž C–C s-veza, molekuli alkana, počevši od etana C 2 H 6, mogu poprimiti različite geometrijske oblike.
Različiti prostorni oblici molekula koji se pretvaraju jedan u drugi rotacijom oko C–C s-veza nazivaju se konformacije ili rotacioni izomeri(konformeri).
Rotacijski izomeri molekula su njena energetski nejednaka stanja. Njihova interkonverzija se dešava brzo i konstantno kao rezultat termičkog kretanja. Stoga se rotacijski izomeri ne mogu izolovati u pojedinačnom obliku, već je njihovo postojanje dokazano fizičkim metodama.
alkani
.
metan, etan, propan, butan
–an
9. Ugljovodonici. Klasifikacija. Zasićeni ugljovodonici metanske serije. Homologna serija. Nomenklatura. Izomerizam. Radikali. Prirodni izvori. Fischer-Tropsch sinteza. Načini pripreme (od alkena, karboksilnih kiselina, halogenih derivata, Wurtzovom reakcijom)
Opšti (generički) naziv zasićenih ugljovodonika je alkani
.
Imena prva četiri člana homolognog niza metana su trivijalna: metan, etan, propan, butan
. Počevši od petog, imena su izvedena iz grčkih brojeva s dodatkom sufiksa –an
Radikali (ugljikovodični radikali) također imaju svoju nomenklaturu. Monovalentni radikali se nazivaju alkili
i označen je slovom R ili Alk.
Njihova opšta formula je C n H 2n+ 1 .
Imena radikala sastavljena su od imena odgovarajućih ugljikovodika zamjenom sufiksa -an na sufiks -il(metan - metil, etan - etil, propan - propil, itd.).
Dvovalentni radikali se imenuju zamjenom sufiksa -an on -iliden(izuzetak je metilenski radikal = CH 2).
Trovalentni radikali imaju sufiks -ilidin
Izomerizam. Alkane karakterizira strukturna izomerija. Ako molekula alkana sadrži više od tri atoma ugljika, redoslijed njihove veze može biti drugačiji. Jedan od izomera butana ( n-butan) sadrži nerazgranati ugljikov lanac, a drugi, izobutan, sadrži razgranati (izostruktura).
Najvažniji izvor alkana u prirodi je prirodni gas, mineralne ugljovodonične sirovine - nafta i prateći naftni gasovi.
Alkani se mogu dobiti Wurtzovom reakcijom, koja uključuje djelovanje metalnog natrijuma na monohalogene derivate ugljovodonika.
2CH 3 –CH 2 Br (etil bromid) + 2Na ––> CH 3 –CH 2 –CH 2 –CH 3 (butan) + 2NaBr
· Od alkena
C n H 2n + H 2 → C n H 2n+2
Fischer-Tropsch sinteza
nCO + (2n+1)H 2 → C n H 2n+2 + nH 2 O
Tabela pokazuje da se ovi ugljovodonici međusobno razlikuju po broju grupa - CH2-.Takav niz sličnih struktura, koji imaju slična hemijska svojstva i koji se međusobno razlikuju po broju ovih grupa naziva se homologni niz. A supstance koje ga čine zovu se homolozi.
| Formula | Ime |
| CH 4 | metan |
| C2H6 | etan |
| C 3 H 8 | propan |
| C4H10 | butan |
| C4H10 | izobutan |
| C5H12 | pentan |
| C5H12 | izopetan |
| C5H12 | neopentan |
| C6H14 | heksan |
| C 7 H 16 | heptan |
| C 10 H 22 | dekan |
10. Zasićeni ugljovodonici (alkani). Hemijska i fizička svojstva: reakcije radikalne supstitucije. Halogenacija, nitridacija, sulfokloracija, sulfoksidacija. Koncept lančanih reakcija.
Fizička svojstva
U normalnim uslovima, prva četiri člana homolognog niza alkana su gasovi, C 5 -C 17 su tečnosti, a počev od C 18 su čvrste materije. Točke topljenja i ključanja alkana njihove gustine se povećavaju sa povećanjem molekularne težine. Svi alkani su lakši od vode i nerastvorljivi su u njoj, ali su rastvorljivi u nepolarnim otapalima (na primer, benzen) i sami su dobri rastvarači.
Prema Lewisu, kisela i bazična svojstva organskih jedinjenja procjenjuju se njihovom sposobnošću da prihvate ili daju elektronski par i potom formiraju vezu. Atom koji prihvata elektronski par je akceptor elektrona, a jedinjenje koje sadrži takav atom treba klasifikovati kao kiselinu. Atom koji daje elektronski par je donor elektrona, a spoj koji sadrži takav atom je baza.
Konkretno, Lewisove kiseline mogu biti atom, molekula ili kation: proton, halogenidi elemenata druge i treće grupe periodnog sistema, halogenidi prelaznih metala - BF3, ZnCl2, AlCl3, FeCl3, FeBr3, TiCl4, SnCl4, SbCl5, katjoni metala, sumporni anhidrid - SO3, karbokation. Lewisove baze uključuju amine (RNH2, R2NH, R3N), alkohole ROH, etere ROR
Prema Brønsted-Lowryju, kiseline su supstance koje mogu donirati proton, a baze su supstance koje mogu prihvatiti proton.
Konjugacija kiseline i baze:
HCN (kiseli) i CN- (bazni)
NH3 (baza) i NH4+ (kiselina)
Kiselinsko-bazna (ili protolitička) ravnoteža je ravnoteža u kojoj je uključen proton (H+).
HCOOH + H 2 O D H 3 O + + HCOO -
acid2 base1
H 2 O + NH 3 D NH 4 + + OH - .
acid1 base2 konjugat konjugat
acid2 base1
7. Vrste izomerizma u organskoj hemiji. Strukturni, prostorni i optički izomerizam. Kiralnost. Raspored i konfiguracija. R, S, Z, E – nomenklature.
Postoje dvije vrste izomerizma: strukturni i prostorni (stereoizomerizam). Strukturni izomeri se međusobno razlikuju po redoslijedu veza atoma u molekuli, stereo-izomeri - po rasporedu atoma u prostoru s istim redoslijedom veza između njih.
Strukturna izomerija: izomerija ugljeničnog skeleta, poziciona izomerija, izomerija različitih klasa organskih jedinjenja (međuklasna izomerija).
Strukturni izomerizam
Izomerizam ugljeničnog skeleta
 Poziciona izomerija nastaje zbog različitih položaja višestruke veze, supstituenta i funkcionalne grupe sa istim ugljikovim skeletom molekula:
Poziciona izomerija nastaje zbog različitih položaja višestruke veze, supstituenta i funkcionalne grupe sa istim ugljikovim skeletom molekula:
Prostorni izomerizam
Prostorni izomerizam se dijeli na dva tipa: geometrijski i optički.
 Geometrijska izomerija je karakteristična za jedinjenja koja sadrže dvostruke veze i ciklička jedinjenja. Budući da je slobodna rotacija atoma oko dvostruke veze ili u prstenu nemoguća, supstituenti se mogu nalaziti ili na istoj strani ravnine dvostruke veze ili prstena (cis pozicija) ili na suprotnim stranama (trans pozicija).
Geometrijska izomerija je karakteristična za jedinjenja koja sadrže dvostruke veze i ciklička jedinjenja. Budući da je slobodna rotacija atoma oko dvostruke veze ili u prstenu nemoguća, supstituenti se mogu nalaziti ili na istoj strani ravnine dvostruke veze ili prstena (cis pozicija) ili na suprotnim stranama (trans pozicija).

 Optička izomerija se javlja kada je molekul nekompatibilan sa svojom slikom u ogledalu. To je moguće kada atom ugljika u molekuli ima četiri različita supstituenta. Ovaj atom se naziva asimetričan.
Optička izomerija se javlja kada je molekul nekompatibilan sa svojom slikom u ogledalu. To je moguće kada atom ugljika u molekuli ima četiri različita supstituenta. Ovaj atom se naziva asimetričan.
KIRALNOST, svojstvo objekta da bude nekompatibilno sa njegovom slikom u idealnom ravnom ogledalu.
Različite prostorne strukture koje nastaju rotacijom oko jednostavnih veza bez narušavanja integriteta molekula (bez prekida hemijskih veza) nazivaju se KONFORMACIJE.
Struktura alkana. Sp3 je stanje ugljika. Karakteristike C-C i C-H veza. Princip slobodne rotacije. Konformacija. Načini predstavljanja i nomenklatura. Fizička svojstva alkana.