روش های مهندسی ژنتیک برای تولید پروتئین پروتئین های جدید مهندسی شده ژنتیکی مبتنی بر آنتی بادی های نوترکیب علیه TNF Efimov Grigory Aleksandrovich. بررسی خواص بیولوژیکی حسگر فلورسنت Vhh41-KTNFin in vitro و in vivo
ارسال کار خوب خود در پایگاه دانش ساده است. از فرم زیر استفاده کنید
دانشجویان، دانشجویان تحصیلات تکمیلی، دانشمندان جوانی که از دانش پایه در تحصیل و کار خود استفاده می کنند از شما بسیار سپاسگزار خواهند بود.
نوشته شده در http://www.allbest.ru/
کار دوره
رشته: بیوتکنولوژی کشاورزی
با موضوع: مهندسی پروتئین
- انشا
- معرفی
- I. مهندسی پروتئین
- 1.1 مفهوم مهندسی پروتئین. تاریخ توسعه
- II. نمونه هایی از پروتئین های مهندسی شده
- 3.3 برخی از دستاوردهای مهندسی پروتئین.
- نتیجه
- کتابشناسی - فهرست کتب
موضوع: مهندسی پروتئین
کلمات کلیدی: بیوتکنولوژی، مهندسی ژنتیک، پروتئین، کد ژنتیکی، ژن، DNA، RNA، ATP، پپتیدها، اپی توپ.
هدف از کار دوره: مطالعه مفهوم "مهندسی پروتئین" و احتمالات بالقوه استفاده از آن.
فرصت های بالقوه مهندسی پروتئین:
1. با تغییر قدرت اتصال ماده در حال تبدیل - سوبسترا - به آنزیم، می توان بازده کاتالیزوری کلی واکنش آنزیمی را افزایش داد.
2. با افزایش پایداری پروتئین در طیف وسیعی از دما و اسیدیته، می توان از آن در شرایطی استفاده کرد که در آن پروتئین اصلی دناتوره شده و فعالیت خود را از دست می دهد.
3. با ایجاد پروتئین هایی که می توانند در حلال های بی آب عمل کنند، می توان واکنش های کاتالیزوری را در شرایط غیر فیزیولوژیکی انجام داد.
4. با تغییر مرکز کاتالیزوری یک آنزیم، می توان ویژگی آن را افزایش داد و تعداد واکنش های جانبی ناخواسته را کاهش داد.
5. با افزایش مقاومت پروتئین در برابر آنزیم هایی که آن را تجزیه می کنند، می توان روند خالص سازی آن را ساده کرد.
6. با تغییر یک پروتئین به طوری که بتواند بدون جزء غیر اسید آمینه معمول خود (ویتامین، اتم فلز و غیره) عمل کند، می توان از آن در برخی از فرآیندهای تکنولوژیکی مداوم استفاده کرد.
7. با تغییر ساختار مقاطع تنظیمی آنزیم می توان درجه مهار آن توسط محصول واکنش آنزیمی را با توجه به نوع بازخورد منفی کاهش داد و در نتیجه بازده محصول را افزایش داد.
8. می توان یک پروتئین هیبریدی ایجاد کرد که وظایف دو یا چند پروتئین را داشته باشد.
9. می توان پروتئین هیبریدی ایجاد کرد که یکی از بخش های آن آزادسازی پروتئین هیبریدی از سلول کشت شده یا استخراج آن از مخلوط را تسهیل می کند.
معرفی
از زمان های بسیار قدیم، بیوتکنولوژی عمدتاً در صنایع غذایی و سبک استفاده شده است: در شراب سازی، نانوایی، تخمیر محصولات لبنی، در پردازش کتان و چرم، بر اساس استفاده از میکروارگانیسم ها. در دهه های اخیر، امکانات بیوتکنولوژی به شدت گسترش یافته است. این به این دلیل است که روشهای آن نسبت به روشهای معمولی سودآورتر است، به این دلیل ساده که در موجودات زنده، واکنشهای بیوشیمیایی کاتالیز شده توسط آنزیمها در شرایط بهینه (دما و فشار) انجام میشود، مولدتر، دوستدار محیطزیست و بدون نیاز به مواد شیمیایی است. معرف هایی که محیط را مسموم می کنند.
اشیاء بیوتکنولوژی نمایندگان متعددی از گروه های موجودات زنده - میکروارگانیسم ها (ویروس ها، باکتری ها، تک یاخته ها، مخمرها)، گیاهان، حیوانات، و همچنین سلول های جدا شده از آنها و اجزای درون سلولی (ارگانل ها) و حتی آنزیم ها هستند. بیوتکنولوژی مبتنی بر فرآیندهای فیزیولوژیکی و بیوشیمیایی است که در سیستمهای زنده اتفاق میافتد که منجر به آزاد شدن انرژی، سنتز و تجزیه محصولات متابولیک و تشکیل اجزای شیمیایی و ساختاری سلول میشود.
جهت اصلی بیوتکنولوژی تولید با استفاده از میکروارگانیسم ها و سلول های یوکاریوتی کشت شده، ترکیبات فعال بیولوژیکی (آنزیم ها، ویتامین ها، هورمون ها)، داروها (آنتی بیوتیک ها، واکسن ها، سرم ها، آنتی بادی های بسیار اختصاصی و غیره) و همچنین ترکیبات ارزشمند ( افزودنی های خوراک، به عنوان مثال، اسیدهای آمینه ضروری، پروتئین های خوراک و غیره).
روش های مهندسی ژنتیک امکان سنتز در مقادیر صنعتی هورمون هایی مانند انسولین و سوماتوتروپین (هورمون رشد) را فراهم کرده است که برای درمان بیماری های ژنتیکی انسان ضروری هستند.
بیوتکنولوژی نه تنها مشکلات خاص علم و تولید را حل می کند. این وظیفه روش شناختی جهانی تری دارد - مقیاس تأثیر انسان بر طبیعت زنده را گسترش می دهد و تسریع می بخشد و انطباق سیستم های زنده را با شرایط وجود انسان، یعنی نووسفر، ترویج می کند. بنابراین، بیوتکنولوژی به عنوان یک عامل قدرتمند در تکامل تطبیقی انسانی عمل می کند.
بیوتکنولوژی، ژنتیک و مهندسی سلول چشماندازهای امیدوارکنندهای دارند. با ظهور بیشتر و بیشتر ناقل های جدید، مردم از آنها برای معرفی ژن های لازم به سلول های گیاهان، حیوانات و انسان ها استفاده می کنند. این امر باعث می شود که به تدریج از شر بسیاری از بیماری های ارثی انسان خلاص شوید، سلول ها را مجبور به سنتز داروهای لازم و ترکیبات فعال بیولوژیکی و سپس مستقیماً پروتئین ها و اسیدهای آمینه ضروری مورد استفاده در غذا کنید. بیوتکنولوژیستها امیدوارند با استفاده از روشهایی که قبلاً توسط طبیعت تسلط یافتهاند، هیدروژن را از طریق فتوسنتز به دست آورند - سازگارترین سوخت با محیط زیست آینده، الکتریسیته، و در شرایط عادی نیتروژن اتمسفر را به آمونیاک تبدیل کنند.
خواص فیزیکی و شیمیایی پروتئین های طبیعی اغلب شرایط استفاده از این پروتئین ها توسط انسان را برآورده نمی کند. تغییر در ساختار اولیه آن مورد نیاز است، که تشکیل پروتئینی با ساختار فضایی متفاوت نسبت به قبل و ویژگیهای فیزیکوشیمیایی جدید را تضمین میکند و به آن اجازه میدهد تا عملکردهای ذاتی پروتئین طبیعی را در شرایط دیگر انجام دهد. مهندسی پروتئین با ساخت پروتئین ها سر و کار دارد.
یکی دیگر از زمینه های کاربرد مهندسی پروتئین، ایجاد پروتئین هایی است که می توانند مواد و میکروارگانیسم هایی را که می توانند برای حملات شیمیایی و بیولوژیکی استفاده شوند، خنثی کنند. به عنوان مثال، آنزیم های هیدرولاز قادر به خنثی کردن گازهای عصبی و آفت کش های مورد استفاده در کشاورزی هستند. علاوه بر این، تولید، ذخیره و استفاده از آنزیم ها برای محیط زیست و سلامت انسان خطرناک نیست.
برای به دست آوردن یک پروتئین تغییر یافته، از روش های شیمی ترکیبی استفاده می شود و جهش زایی هدایت شده انجام می شود - ایجاد تغییرات خاصی در توالی های کد کننده DNA، که منجر به تغییرات خاصی در توالی های اسید آمینه می شود. برای طراحی مؤثر پروتئینی با خواص مطلوب، لازم است الگوهای تشکیل ساختار فضایی پروتئین را بدانیم که خواص و عملکردهای فیزیکوشیمیایی آن به آن بستگی دارد، یعنی باید بدانیم ساختار اولیه پروتئین چگونه است. هر یک از باقی مانده های اسید آمینه آن بر خواص و عملکرد پروتئین تأثیر می گذارد. متأسفانه، برای اکثر پروتئین ها، ساختار سوم ناشناخته است؛ همیشه مشخص نیست که کدام اسید آمینه یا دنباله ای از اسیدهای آمینه باید تغییر کند تا پروتئینی با خواص مطلوب به دست آید. در حال حاضر، دانشمندان با استفاده از تجزیه و تحلیل کامپیوتری می توانند خواص بسیاری از پروتئین ها را بر اساس توالی باقی مانده های اسید آمینه آنها پیش بینی کنند. چنین تحلیلی روند ایجاد پروتئین های مورد نظر را بسیار ساده می کند. در این بین، برای به دست آوردن یک پروتئین اصلاح شده با خواص مورد نظر، عمدتاً به روش دیگری پیش می روند: چندین ژن جهش یافته را به دست می آورند و محصول پروتئینی یکی از آنها را می یابند که دارای خواص مطلوب است.
روشهای تجربی مختلفی برای جهشزایی بهمنظور مکانیابی استفاده میشود. پس از دریافت ژن اصلاح شده، در یک ساختار ژنتیکی ادغام شده و به سلول های پروکاریوتی یا یوکاریوتی وارد می شود که پروتئین کدگذاری شده توسط این ساختار ژنتیکی را سنتز می کنند.
I. مهندسی پروتئین
1.1 مفهوم مهندسی پروتئین. تاریخ توسعه
مهندسی پروتئین شاخه ای از بیوتکنولوژی است که با توسعه پروتئین های مفید یا ارزشمند سروکار دارد. این یک رشته نسبتاً جدید است که بر مطالعه تاخوردگی پروتئین و اصول اصلاح و ایجاد پروتئین تمرکز دارد.
دو استراتژی اصلی برای مهندسی پروتئین وجود دارد: اصلاح هدایت شده پروتئین و تکامل هدایت شده. این روش ها متقابل نیستند. محققان اغلب از هر دو استفاده می کنند. در آینده، دانش دقیق تر از ساختار و عملکرد پروتئین، و همچنین پیشرفت در فن آوری بالا، ممکن است به طور قابل توجهی امکانات مهندسی پروتئین را گسترش دهد. در نتیجه، حتی اسیدهای آمینه غیرطبیعی را می توان به لطف روش جدیدی که به آمینو اسیدهای جدید در کد ژنتیکی گنجانده می شود، وارد کرد.
مهندسی پروتئین از تلاقی فیزیک پروتئین و شیمی و مهندسی ژنتیک سرچشمه گرفت. مشکل ایجاد مولکول های پروتئینی اصلاح شده یا هیبریدی با ویژگی های مشخص را حل می کند. یک راه طبیعی برای اجرای چنین کاری، پیشبینی ساختار ژن کدکننده پروتئین تغییریافته، انجام سنتز، شبیهسازی و بیان آن در سلولهای گیرنده است.
اولین اصلاح پروتئین کنترل شده در اواسط دهه 60 توسط Koshland و Bender انجام شد. برای جایگزینی گروه هیدروکسیل با یک گروه سولفیدریل در مرکز فعال پروتئاز، سوبتیلیسین، از روش اصلاح شیمیایی استفاده کردند. با این حال، همانطور که مشخص شد، چنین تیول سوبتیلیسین فعالیت پروتئاز را حفظ نمی کند.
از نظر شیمیایی، پروتئین یک نوع مولکول منفرد است که یک زنجیره پلی آمینو اسید یا پلیمر است. از توالی اسید آمینه 20 نوع تشکیل شده است. پس از یادگیری ساختار پروتئین ها، مردم این سوال را مطرح کردند: آیا می توان توالی های اسید آمینه کاملاً جدیدی را طراحی کرد تا عملکردهای مورد نیاز انسان را بسیار بهتر از پروتئین های معمولی انجام دهند؟ نام مهندسی پروتئین برای این ایده مناسب بود.
مردم در دهه 50 قرن بیستم شروع به فکر کردن در مورد چنین مهندسی کردند. این بلافاصله پس از رمزگشایی اولین توالی اسید آمینه پروتئین اتفاق افتاد. در بسیاری از آزمایشگاهها در سراسر جهان، تلاشهایی برای کپی کردن طبیعت و سنتز شیمیایی توالیهای پلی آمینو اسیدی مطلقاً دلخواه صورت گرفته است.
شیمیدان B. Merrifield بیشترین موفقیت را در این امر داشت. این آمریکایی موفق شد روش بسیار موثری برای سنتز زنجیره های پلی آمینو اسیدی ایجاد کند. به همین دلیل، مریفیلد در سال 1984 جایزه نوبل شیمی را دریافت کرد.
شکل 1. طرح چگونگی کار مهندسی پروتئین.
آمریکایی شروع به سنتز پپتیدهای کوتاه از جمله هورمون ها کرد. در همان زمان، او یک خودکار - یک "ربات شیمیایی" - ساخت که وظیفه آن تولید پروتئین های مصنوعی بود. این ربات در محافل علمی هیجان ایجاد کرد. با این حال، به زودی مشخص شد که محصولات او نمی توانند با آنچه طبیعت تولید می کند رقابت کنند.
ربات نتوانست توالی اسیدهای آمینه را به طور دقیق بازتولید کند، یعنی اشتباهاتی مرتکب شد. او یک زنجیره را با یک دنباله سنتز کرد و دیگری را با یک دنباله کمی تغییر داد. در یک سلول، تمام مولکول های یک پروتئین به طور ایده آل شبیه به یکدیگر هستند، یعنی توالی آنها کاملاً یکسان است.
مشکل دیگری وجود داشت. حتی مولکول هایی که ربات به درستی سنتز کرده بود، شکل فضایی لازم برای عملکرد آنزیم را به خود نگرفت. بنابراین، تلاش برای جایگزینی طبیعت با روشهای معمول شیمی آلی به موفقیت بسیار ناچیزی منجر شد.
دانشمندان فقط می توانستند از طبیعت بیاموزند و به دنبال تغییرات لازم در پروتئین ها بودند. نکته اینجاست که در طبیعت دائماً جهش هایی وجود دارد که منجر به تغییر در توالی اسید آمینه پروتئین ها می شود. اگر جهشیافتههایی را با ویژگیهای لازم انتخاب کنید که یک بستر خاص را کارآمدتر پردازش میکنند، میتوانید آنزیم تغییریافته را از چنین جهشیافته ای جدا کنید که به لطف آن سلول خواص جدیدی به دست میآورد. اما این فرآیند زمان بسیار طولانی را می طلبد.
با ظهور مهندسی ژنتیک همه چیز تغییر کرد. به لطف او، آنها شروع به ایجاد ژن های مصنوعی با هر توالی نوکلئوتیدی کردند. این ژن ها در مولکول های ناقل آماده شده وارد شدند و DNA به باکتری یا مخمر وارد شد. در آنجا یک کپی از RNA از ژن مصنوعی گرفته شد. در نتیجه پروتئین مورد نیاز تولید شد. خطاها در سنتز آن حذف شدند. نکته اصلی این بود که توالی DNA مناسب را انتخاب کنیم و سپس سیستم آنزیمی سلول کار خود را بدون نقص انجام داد. بنابراین، می توان نتیجه گرفت که مهندسی ژنتیک راه را برای مهندسی پروتئین در رادیکال ترین شکل آن باز کرده است.
1.2 استراتژی های مهندسی پروتئین
اصلاح هدفمند پروتئین در اصلاح هدفمند پروتئین، دانشمند از دانش دقیق ساختار و عملکرد پروتئین برای ایجاد تغییرات مورد نظر استفاده می کند. به طور کلی، این روش دارای مزیت ارزان بودن و از نظر فنی بدون عارضه است، زیرا تکنیک جهش زایی جهت دهی به سایت به خوبی توسعه یافته است. با این حال، عیب اصلی آن این است که اطلاعات در مورد ساختار دقیق یک پروتئین اغلب وجود ندارد، و حتی زمانی که ساختار آن شناخته شده باشد، پیش بینی تأثیر جهش های مختلف می تواند بسیار دشوار باشد.
الگوریتمهای نرمافزار اصلاح پروتئین تلاش میکنند تا توالیهای اسید آمینه جدیدی را شناسایی کنند که برای تشکیل یک ساختار هدف از پیش تعریفشده به انرژی کمی نیاز دارند. در حالی که توالیای که باید پیدا شود بزرگ است، سختترین نیاز برای اصلاح پروتئین، روشی سریع و در عین حال دقیق برای شناسایی و تعریف توالی بهینه، بر خلاف توالیهای زیر بهینه مشابه است.
تکامل هدایت شده در تکامل هدایتشده، جهشزایی تصادفی روی یک پروتئین اعمال میشود و برای انتخاب انواعی که کیفیتهای خاصی دارند، انتخاب میشود. بعد، دورهای بیشتری از جهش و انتخاب اعمال می شود. این روش تکامل طبیعی را تقلید می کند و به طور کلی نتایج برتری را برای اصلاح مستقیم ایجاد می کند.
یک تکنیک اضافی که به نام مخلوط کردن DNA شناخته می شود، بخش هایی از انواع موفق را با هم مخلوط کرده و شناسایی می کند تا نتایج بهتری به دست آورد. این فرآیند از نوترکیبی هایی که به طور طبیعی در طی تولید مثل جنسی رخ می دهد، تقلید می کند. مزیت تکامل هدایت شده این است که نیازی به دانش قبلی از ساختار پروتئین ندارد و همچنین لازم نیست بتوانیم پیش بینی کنیم که یک جهش معین چه تأثیری خواهد داشت. در واقع، نتایج آزمایشهای تکامل هدایتشده شگفتانگیز است زیرا تغییرات مورد نظر اغلب ناشی از جهشهایی است که نباید چنین تأثیری داشته باشند. عیب آن این است که این روش به توان عملیاتی بالایی نیاز دارد که برای همه پروتئین ها امکان پذیر نیست. مقادیر زیادی از DNA نوترکیب باید جهش یافته و محصولات باید از نظر کیفیت مطلوب غربالگری شوند. تعداد زیادی از گزینه ها اغلب نیاز به خرید رباتیک برای خودکار کردن فرآیند دارد. علاوه بر این، غربال کردن همه کیفیت های مورد علاقه همیشه آسان نیست.
II. نمونه هایی از پروتئین های مهندسی شده
مهندسی پروتئین می تواند بر اساس اصلاح شیمیایی یک پروتئین تمام شده یا بر اساس روش های مهندسی ژنتیکی باشد که امکان دستیابی به نسخه های اصلاح شده از پروتئین های طبیعی را فراهم می کند.
طراحی یک کاتالیزور بیولوژیکی خاص با در نظر گرفتن ویژگی پروتئین و فعالیت کاتالیزوری مجموعه آلی فلزی انجام می شود. در اینجا نمونه هایی از چنین اصلاحاتی وجود دارد که برای به دست آوردن "کمپلکس های بیورگانیک نیمه مصنوعی" انجام شده است. میوگلوبین نهنگ اسپرم قادر به اتصال اکسیژن است، اما فعالیت بیوکاتالیستی ندارد. در نتیجه ترکیب این مولکول زیستی با سه کمپلکس انتقال الکترون حاوی روتنیوم که به بقایای هیستیدین روی سطح مولکولهای پروتئین متصل میشوند، کمپلکسی تشکیل میشود که میتواند اکسیژن را کاهش دهد و همزمان تعدادی از سوبستراهای آلی را اکسید کند. به عنوان آسکوربات، با سرعت تقریباً مشابه آسکوربات اکسیداز طبیعی. در اصل، پروتئین ها را می توان به روش های دیگری اصلاح کرد. برای مثال پاپاین را در نظر بگیرید. این یکی از آنزیم های پروتئولیتیک به خوبی مطالعه شده است که ساختار سه بعدی برای آن تعیین شده است. در نزدیکی باقی مانده سیستئین-25 روی سطح مولکول پروتئین یک شیار گسترده وجود دارد که در آن واکنش پروتئولیز رخ می دهد. این سایت را می توان با یک مشتق فلاوین آلکیله کرد بدون اینکه دسترسی به محل اتصال بستر بالقوه را تغییر دهد. چنین فلاوپاپاین های اصلاح شده برای اکسیداسیون M-alkyl-1،4-dihydronicotinamides استفاده شد و فعالیت کاتالیزوری برخی از این پروتئین های اصلاح شده به طور قابل توجهی بالاتر از دهیدروژنازهای فلاووپروتئین-NADH طبیعی بود. بنابراین، ایجاد یک آنزیم نیمه مصنوعی بسیار موثر امکان پذیر شد. استفاده از فلاوینها با جانشینهای بسیار فعال و موقعیتیافته الکترونکشنده ممکن است ایجاد کاتالیزورهای مؤثر برای کاهش نیکوتین آمید را ممکن سازد.
پیشرفتهای عمدهای که اخیراً در سنتز شیمیایی DNA به دست آمده است، فرصتهای اساسی جدیدی را برای مهندسی پروتئین باز کرده است: طراحی پروتئینهای منحصربهفردی که در طبیعت وجود ندارند. این امر مستلزم توسعه بیشتر فناوری است، به طوری که تغییر ژنها با استفاده از روشهای مهندسی ژنتیک منجر به تغییرات قابل پیشبینی در پروتئینها، به بهبود ویژگیهای عملکردی کاملاً تعریف شده آنها میشود: تعداد گردش، کیلومتر برای یک بستر خاص، پایداری حرارتی، دمای بهینه، پایداری و فعالیت در حلال های غیر آبی، ویژگی سوبسترا و واکنش، نیاز به کوفاکتورها، pH بهینه، مقاومت پروتئاز، تنظیم آلوستریک، وزن مولکولی و ساختار زیر واحد. به طور معمول، چنین بهبودی از طریق جهش زایی و انتخاب، و اخیراً از طریق اصلاح شیمیایی و بی حرکتی به دست آمده است. برای طراحی موفقیت آمیز یک نوع خاص از مولکول پروتئین، شناسایی تعدادی الگوی اساسی که ویژگی های ساختاری پروتئین ها و خواص مورد نظر آنها را به هم متصل می کند، ضروری است. بنابراین، با دانستن ساختار بلوری دقیق مولکول پروتئین مورد مطالعه، میتوان آن قسمتهایی از آن را شناسایی کرد که باید بهطور خاص برای افزایش فعالیت کاتالیزوری آن اصلاح شوند. چنین تغییری ممکن است شامل تغییر توالی اسید آمینه پروتئین باشد.
مثال دیگر اجرای جهش زایی سایت خاص است. به صورت زیر اتفاق می افتد. ژن پروتئین مورد علاقه محقق شبیه سازی شده و در یک حامل ژنتیکی مناسب قرار داده می شود. سپس یک آغازگر الیگونوکلئوتیدی با جهش مورد نظر سنتز می شود که توالی آن متشکل از ده تا پانزده نوکلئوتید به اندازه کافی با ناحیه خاصی از ژن طبیعی همولوگ است و بنابراین قادر به تشکیل یک ساختار هیبریدی با آن است. این پرایمر مصنوعی توسط پلیمرازها برای شروع سنتز یک کپی مکمل از وکتور استفاده می شود که سپس از نسخه اصلی جدا شده و برای سنتز کنترل شده پروتئین جهش یافته استفاده می شود. یک رویکرد جایگزین مبتنی بر برش زنجیره، حذف محل تغییر و جایگزینی آن با یک آنالوگ مصنوعی با توالی نوکلئوتیدی مورد نظر است.
Tyrosyl-tRNA سنتتاز واکنش آمینواسیلاسیون تیروزین tRNA را کاتالیز می کند، که شامل فعال شدن تیروزین توسط ATP برای تشکیل تیروسیل آدنیلات است. ژن این آنزیم جدا شده از Bacillus stearothermophilus به باکتریوفاژ M13 وارد شد. خواص کاتالیزوری آنزیم، به ویژه توانایی آن برای اتصال به بستر، سپس با اصلاح سایت خاص تغییر یافت. بنابراین، ترئونین-51 با آلانین جایگزین شد. این منجر به افزایش دو برابری در اتصال سوبسترا شد، ظاهراً به دلیل ناتوانی در تشکیل پیوند هیدروژنی بین این باقیمانده و تیروسیل آدنیلات. هنگام جایگزینی آلانین با پرولین، پیکربندی مولکول آنزیم مختل می شود، اما توانایی اتصال به بستر صد برابر افزایش می یابد، زیرا تعامل آن با هیستیدین-48 تسهیل می شود. تغییرات مشابهی در محل خاص در بتالاکتاماز به دست آمده است و معمولاً با غیرفعال شدن آنزیم همراه است. جایگزینی سرین 70 با سیستئین منجر به تشکیل p-تیول لاکتاماز می شود که ثابت اتصال آن با آنزیم طبیعی تفاوتی ندارد، اما فعالیت نسبت به پنی سیلین تنها 1-2٪ است. با این وجود، فعالیت این آنزیم جهش یافته در برابر برخی از سفالوسپورین های فعال کمتر از فعالیت اولیه یا حتی بیشتر از آن نیست. این پروتئین ها همچنین در برابر پروتئازها مقاوم تر هستند.
در حال حاضر از جهشهای خاص مکان برای آزمایش کفایت مطالعات ساختاری استفاده میشود. در برخی موارد، آنها توانستند نشان دهند که پایداری ساختاری یک پروتئین و فعالیت کاتالیزوری آن را می توان جدا کرد. اطلاعات کافی در مورد رابطه بین پایداری ساختار پروتئین و عملکرد آن انباشته شده است؛ ممکن است بتوانیم فعالیت کاتالیزورهای بیولوژیکی را دقیق تنظیم کنیم و آنالوگ های کاملاً مصنوعی آنها را ایجاد کنیم. اخیراً، کاری ظاهر شد که شبیه سازی اولین ژن آنزیمی مصنوعی را گزارش کرد که قطعه فعال مولکول ریبونوکلئاز را کد می کند.
III. کاربردهای مهندسی پروتئین
فناوری مهندسی پروتئین (اغلب در ترکیب با روش DNA نوترکیب) برای بهبود خواص پروتئینهای موجود (آنزیمها، آنتیبادیها، گیرندههای سلولی) و ایجاد پروتئینهای جدیدی که در طبیعت وجود ندارند، استفاده میشود. چنین پروتئین هایی برای تولید دارو، در فرآوری مواد غذایی و در تولید صنعتی استفاده می شود.
در حال حاضر، محبوب ترین کاربرد مهندسی پروتئین، اصلاح خواص کاتالیزوری آنزیم ها برای توسعه فرآیندهای صنعتی "دوستانه با محیط زیست" است. از دیدگاه زیست محیطی، آنزیم ها قابل قبول ترین کاتالیزورهای مورد استفاده در صنعت هستند. این توسط توانایی بیوکاتالیست ها برای حل شدن در آب و عملکرد کامل در محیطی با pH خنثی و در دماهای نسبتا پایین تضمین می شود. علاوه بر این، به دلیل ویژگی بالای آنها، استفاده از بیوکاتالیست ها منجر به تولید محصولات جانبی ناخواسته بسیار کمی می شود. فرآیندهای صنعتی سازگار با محیط زیست و صرفه جویی در انرژی با استفاده از کاتالیزورهای زیستی مدت هاست که به طور فعال در صنایع شیمیایی، نساجی، دارویی، خمیر و کاغذ، غذا، انرژی و سایر زمینه های صنعت مدرن معرفی شده اند.
با این حال، برخی از ویژگی های بیوکاتالیست ها استفاده از آنها را در برخی موارد غیرقابل قبول می کند. به عنوان مثال، بیشتر آنزیم ها با افزایش دما تجزیه می شوند. دانشمندان در تلاش هستند تا با استفاده از تکنیک های مهندسی پروتئین بر چنین موانعی غلبه کنند و پایداری آنزیم ها را در شرایط سخت تولید افزایش دهند.
علاوه بر کاربردهای صنعتی، مهندسی پروتئین جایگاه شایسته ای در پیشرفت های پزشکی پیدا کرده است. محققان پروتئین هایی را سنتز می کنند که می توانند به ویروس ها و ژن های جهش یافته ای که باعث ایجاد تومور می شوند متصل شوند و آنها را خنثی کنند. ایجاد واکسنهای بسیار مؤثر و مطالعه پروتئینهای گیرنده سطح سلول، که اغلب هدف داروها هستند. دانشمندان علوم غذایی از مهندسی پروتئین برای بهبود خواص حفاظتی پروتئین های گیاهی و عوامل ژل کننده یا عوامل غلیظ کننده استفاده می کنند.
3.1 کتابخانه های پپتید و اپی توپ
در یک موجود زنده، بیشتر فرآیندهای بیولوژیکی از طریق فعل و انفعالات خاص پروتئین- پروتئین یا پروتئین- اسید نوکلئیک کنترل می شوند. چنین فرآیندهایی شامل تنظیم رونویسی ژن تحت تأثیر عوامل مختلف پروتئینی، برهمکنش لیگاندهای پروتئینی با گیرندههای روی سطح سلولها و همچنین اتصال اختصاصی آنتیژنها توسط آنتیبادیهای مربوطه است. درک مکانیسمهای مولکولی برهمکنش لیگاندهای پروتئین با گیرندهها از اهمیت اساسی و کاربردی بالایی برخوردار است. به طور خاص، توسعه داروهای پروتئینی جدید معمولاً با شناسایی توالی اسید آمینه اولیه که دارای فعالیت بیولوژیکی مورد نیاز است (به اصطلاح توالی "سرب") شروع می شود. با این حال، پپتیدهایی با یک توالی اسید آمینه پایه نیز ممکن است دارای خواص بیولوژیکی نامطلوب باشند: فعالیت کم، سمیت، پایداری کم در بدن و غیره.
قبل از ظهور کتابخانه های پپتیدی، بهبود خواص بیولوژیکی آنها با سنتز متوالی تعداد زیادی آنالوگ و آزمایش فعالیت بیولوژیکی آنها انجام می شد که به زمان و هزینه زیادی نیاز داشت. در سال های اخیر، ایجاد هزاران پپتید مختلف در مدت زمان کوتاه با استفاده از سینت سایزرهای خودکار امکان پذیر شده است. روشهای توسعهیافته جهشزایی هدفمند همچنین امکان افزایش چشمگیر تعداد پروتئینهای بهدستآمده بهطور همزمان و بهطور متوالی برای فعالیت بیولوژیکی را فراهم کرده است. با این حال، رویکردهای اخیراً توسعه یافته برای ایجاد کتابخانههای پپتیدی، میلیونها توالی اسید آمینه مورد نیاز برای غربالگری مؤثر پپتیدهایی را تولید کردهاند که بهترین معیارها را برآورده میکنند. چنین کتابخانه هایی برای مطالعه برهمکنش آنتی بادی ها با آنتی ژن ها، به دست آوردن بازدارنده های آنزیم و عوامل ضد میکروبی جدید، طراحی مولکول هایی با فعالیت بیولوژیکی مورد نظر، یا دادن خواص جدید به پروتئین ها، مانند آنتی بادی ها، استفاده می شوند.
بر اساس روش های تهیه، کتابخانه های پپتیدی به سه گروه تقسیم می شوند. گروه اول شامل کتابخانه های به دست آمده با استفاده از سنتز شیمیایی پپتیدها است که در آن پپتیدهای منفرد روی ریزحامل ها بی حرکت می شوند. با این رویکرد، پس از افزودن اسیدهای آمینه متوالی در مخلوطهای واکنش منفرد به پپتیدهای تثبیت شده روی ریزحاملها، محتویات تمام مخلوطهای واکنش ترکیب شده و به بخشهای جدیدی تقسیم میشوند که در مرحله بعدی افزودن بقایای اسید آمینه جدید استفاده میشود. پس از یک سری از این مراحل، پپتیدهای حاوی توالی اسیدهای آمینه مورد استفاده در سنتز در انواع ترکیبات تصادفی سنتز می شوند.
کتابخانههای پپتیدهای تثبیتشده روی ریزحاملها یک اشکال مهم دارند: آنها نیاز به استفاده از گیرندههای خالص شده به شکل محلول در طول غربالگری دارند. در عین حال، در بیشتر موارد، گیرندههای مرتبط با غشاء اغلب در آزمایشهای بیولوژیکی که برای تحقیقات پایه و دارویی انجام میشوند، استفاده میشوند. طبق روش دوم، کتابخانههای پپتیدی با استفاده از سنتز پپتید فاز جامد بهدست میآیند که در هر مرحله از افزودن شیمیایی اسید آمینه بعدی به زنجیرههای پپتیدی در حال رشد، از مخلوطهای هممولاری از همه یا برخی اسیدهای آمینه پیشساز استفاده میشود. در مرحله نهایی سنتز، پپتیدها از حامل جدا می شوند، یعنی. تبدیل آنها به شکل محلول رویکرد سوم برای ساخت کتابخانههای پپتیدی، که اکنون در حال توصیف آن هستیم، دقیقاً به لطف توسعه روشهای مهندسی ژنتیک امکانپذیر شد. این به خوبی توانایی های چنین روش هایی را نشان می دهد و بدون شک پیشرفت بزرگی در کاربرد آنها است. در این راستا، نتایج استفاده از کتابخانه های پپتیدی در مطالعه اپی توپ ها (تعیین کننده های آنتی ژنی) پروتئین ها را با جزئیات بیشتری بررسی خواهیم کرد.
فناوری مهندسی ژنتیک برای تولید پروتئینهای هیبریدی، ایجاد روشی مؤثر برای تولید پپتیدهای کوتاه برای تجزیه و تحلیل فعالیت بیولوژیکی آنها را ممکن ساخته است. همانطور که در مورد کتابخانه های ژنی، کتابخانه های پپتیدی به دست آمده با روش های مهندسی ژنتیک، مجموعه بزرگی (اغلب جامع) از پپتیدهای کوتاه را نشان می دهد. دو مشاهدات اخیر این امکان را فراهم می کند که کتابخانه ای از پپتیدها را به طور همزمان و به عنوان کتابخانه ای از اپی توپ های پروتئین در نظر بگیریم. اولاً، پپتیدهای کوتاه میتوانند شامل تمام باقی ماندههای اسید آمینه ضروری باشند که نقش عمدهای در برهمکنش آنتیبادی بازی میکنند، و میتوانند عوامل تعیینکننده آنتی ژنی بزرگ پروتئینها را تقلید کنند. دوم، در بیشتر موارد، پیوندهای غیرکووالانسی که بین معدود مهمترین باقی ماندههای اسید آمینه لیگاندهای پروتئین و گیرندههای آنها تشکیل میشوند، سهم عمدهای در انرژی کل تعامل لیگاند-گیرنده دارند. با در نظر گرفتن این موضوع، هر پپتید را می توان یک لیگاند بالقوه، هاپتن یا بخشی از تعیین کننده آنتی ژنی پلی پپتیدهای بزرگتر در نظر گرفت و هر کتابخانه پپتیدی را می توان کتابخانه ای از اپی توپ های پروتئین یا لیگاندهای بالقوه برای گیرنده های پروتئین مربوطه در نظر گرفت.
کتابخانه پپتید به دست آمده در نتیجه اجرای رویکرد سوم، در شکل مدرن آن، مجموعه ای از ده ها یا حتی صدها میلیون توالی اسیدهای آمینه مختلف کوتاه است که بر روی سطح ویریون های باکتریوفاژ به عنوان بخشی از خود بیان می شوند. پروتئین های ساختاری این به لطف معرفی ژنهای نوترکیب هیبریدی که پروتئینهای ساختاری تغییر یافته ویریونهای آن را رمزگذاری میکنند در ژنوم باکتریوفاژها با استفاده از روشهای مهندسی ژنتیک امکانپذیر میشود. (این روش به عنوان نمایش فاژ شناخته می شود.) در نتیجه بیان چنین ژن هایی، پروتئین های هیبریدی تشکیل می شوند که در انتهای N یا C، توالی های اسید آمینه اضافی وجود دارد.
کتابخانههای پپتیدها و اپی توپها نیز در مطالعات مکانیسمهای پاسخ ایمنی هومورال و همچنین بیماریهای سیستم ایمنی مورد استفاده قرار میگیرند. به طور خاص، بیشتر بیماری های خودایمنی با تشکیل اتوآنتی بادی علیه آنتی ژن های خود بدن همراه است. این آنتی بادی ها در بسیاری از موارد به عنوان نشانگرهای خاص یک بیماری خودایمنی خاص عمل می کنند. با استفاده از کتابخانه ای از اپی توپ ها، در اصل، می توان نشانگرهای پپتیدی را به دست آورد، که با کمک آنها می توان ویژگی اتوآنتی بادی ها را در طول توسعه یک فرآیند پاتولوژیک هم در یک ارگانیسم فردی و هم در گروهی از بیماران نظارت کرد. و علاوه بر این، برای تعیین ویژگی اتوآنتی بادی ها در بیماری های با علت ناشناخته.
کتابخانههای پپتیدها و اپی توپها نیز میتوانند به طور بالقوه برای غربالگری سرمهای ایمنی برای شناسایی پپتیدهایی که به طور خاص با آنتیبادیهای محافظ تعامل دارند، استفاده شوند. چنین پپتیدهایی از عوامل آنتی ژنی ارگانیسم های بیماری زا تقلید می کنند و به عنوان هدف برای آنتی بادی های محافظ بدن عمل می کنند. این امر امکان استفاده از چنین پپتیدهایی را برای واکسیناسیون بیمارانی که فاقد آنتی بادی علیه پاتوژن های مربوطه هستند، می دهد. مطالعه اپی توپ ها با استفاده از کتابخانه های پپتیدی مورد خاصی از یکی از حوزه های متعدد استفاده از آنها در مطالعات کاربردی و بنیادی برهمکنش لیگاندها و گیرنده ها است. بهبود بیشتر این رویکرد باید ایجاد داروهای جدید مبتنی بر پپتیدهای کوتاه را تسهیل کند و در مطالعات بنیادی مکانیسمهای برهمکنش پروتئین-پروتئین مفید باشد.
3.2 پروتئین های گزارشگر در پروتئین های همجوشی
در مورد دیگر، پروتئین های فیوژن برای به دست آوردن سطوح بالای بیان پپتیدهای کوتاه در سلول های باکتریایی به دلیل تثبیت این پپتیدها در پروتئین های همجوشی استفاده می شوند. پروتئین های هیبریدی اغلب برای شناسایی و خالص سازی پروتئین های نوترکیب که به سختی قابل تشخیص هستند استفاده می شود. به عنوان مثال، با اتصال گالاکتوزیداز به انتهای C پروتئین مورد مطالعه به عنوان یک پروتئین گزارشگر، می توان پروتئین نوترکیب را بر اساس فعالیت گالاکتوزیداز خالص کرد و عوامل آنتی ژنی آن را با روش های ایمونوشیمیایی تعیین کرد. با ترکیب قطعات DNA حاوی چارچوب های خواندن باز (ORFs) با ژن های پروتئین های گزارشگر، می توان چنین پروتئین های ترکیبی را بر اساس فعالیت پروتئین گزارشگر خالص کرد و از آنها برای ایمن سازی حیوانات آزمایشگاهی استفاده کرد. سپس آنتیبادیهای بهدستآمده برای خالصسازی پروتئین بومی، که شامل پلی پپتید نوترکیب کد شده توسط ORF است، استفاده میشود و در نتیجه قطعه ژن کلون شده را شناسایی میکند.
با کمک پروتئین های هیبریدی، مشکل معکوس شبیه سازی یک ژن ناشناخته، که به محصول پروتئینی آن آنتی بادی وجود دارد، نیز حل می شود. در این مورد، یک کتابخانه کلون از توالیهای نوکلئوتیدی که نشاندهنده ORFهای ژنهای ناشناخته هستند در وکتورهایی ساخته میشوند که به ORF اجازه میدهند تا در همان چارچوب خواندن با ژن گزارشگر کلون شود. پروتئین های هیبریدی تشکیل شده در نتیجه بیان این ژن های نوترکیب با استفاده از آنتی بادی ها با استفاده از روش های ایمونواسی آنزیمی شناسایی می شوند. ژنهای ترکیبی ترکیبی از پروتئینهای ترشحشده و پروتئینهای گزارشگر، مطالعه مکانیسمهای ترشح و همچنین مکانیابی و حرکت پروتئینهای ترشح شده در بافتها را به روشهای جدید ممکن میسازد.
3.3 برخی از دستاوردهای مهندسی پروتئین
1. با جایگزینی چند باقیمانده اسید آمینه لیزوزیم باکتریوفاژ T4 با سیستئین، آنزیمی با تعداد زیادی پیوند دی سولفید به دست آمد که به دلیل آن این آنزیم در دمای بالاتر فعالیت خود را حفظ کرد.
2. جایگزینی یک باقیمانده سیستئین با یک باقیمانده سرین در مولکول بتا اینترفرون انسانی، سنتز شده توسط اشریشیا کلی، از تشکیل کمپلکس های بین مولکولی جلوگیری کرد که فعالیت ضد ویروسی این دارو را تقریبا 10 برابر کاهش داد.
3. جایگزینی باقی مانده ترئونین با باقی مانده پرولین در مولکول آنزیم tyrosyl-tRNA synthetase فعالیت کاتالیزوری این آنزیم را ده برابر افزایش داد: شروع به اتصال سریع تیروزین به tRNA کرد که این اسید آمینه را در طول ترجمه به ریبوزوم منتقل می کند.
4. سوبتیلیسین ها آنزیم های غنی از سرین هستند که پروتئین ها را تجزیه می کنند. آنها توسط بسیاری از باکتری ها ترشح می شوند و به طور گسترده توسط انسان برای تجزیه زیستی استفاده می شوند. آنها محکم به اتم های کلسیم متصل می شوند و پایداری آنها را افزایش می دهند. با این حال، در فرآیندهای صنعتی، ترکیبات شیمیایی وجود دارد که کلسیم را به هم متصل می کند، پس از آن سوبتیلیسین ها فعالیت خود را از دست می دهند. دانشمندان با تغییر ژن، اسیدهای آمینه را از آنزیمی که در اتصال کلسیم نقش دارند حذف کردند و یک اسید آمینه را با دیگری جایگزین کردند تا پایداری سوبتیلیسین افزایش یابد. مشخص شد که آنزیم اصلاح شده در شرایط نزدیک به شرایط صنعتی پایدار و از نظر عملکردی فعال است.
5. امکان ایجاد آنزیمی که مانند یک آنزیم محدود کننده عمل می کند که DNA را در مکان های کاملاً مشخص می شکافد نشان داده شد. دانشمندان یک پروتئین ترکیبی ایجاد کردند که یک قطعه آن توالی خاصی از بقایای نوکلئوتیدی را در یک مولکول DNA شناسایی کرد و قطعه دیگر DNA تکه تکه شده را در این ناحیه تشخیص داد.
6. فعال کننده پلاسمینوژن بافتی آنزیمی است که از نظر بالینی برای حل کردن لخته های خون استفاده می شود. متأسفانه، به سرعت از سیستم گردش خون حذف می شود و باید به طور مکرر یا در دوزهای زیاد تجویز شود که منجر به عوارض جانبی می شود. با معرفی سه جهش هدفمند در ژن این آنزیم، آنزیمی با عمر طولانی با میل ترکیبی افزایش یافته برای فیبرین تجزیه شده و با فعالیت فیبرینولیتیک مشابه با آنزیم اصلی به دست آوردیم.
7. با جایگزینی یک اسید آمینه در مولکول انسولین، دانشمندان اطمینان حاصل کردند که وقتی این هورمون به صورت زیر جلدی در بیماران دیابتی تجویز می شود، تغییر غلظت این هورمون در خون نزدیک به غلظت فیزیولوژیکی است که پس از خوردن غذا رخ می دهد.
8. سه دسته از اینترفرون ها وجود دارد که دارای فعالیت ضد ویروسی و ضد سرطانی هستند، اما ویژگی های متفاوتی از خود نشان می دهند. ایجاد یک اینترفرون هیبریدی که خواص سه نوع اینترفرون را داشته باشد وسوسه انگیز بود. ژن های ترکیبی ایجاد شد که شامل قطعاتی از ژن های طبیعی اینترفرون از چندین نوع بود. برخی از این ژنها که در سلولهای باکتریایی ادغام میشوند، سنتز اینترفرونهای هیبریدی را با فعالیت ضد سرطانی بیشتر نسبت به مولکولهای مادر تضمین میکنند.
9. هورمون رشد طبیعی انسان نه تنها به گیرنده این هورمون، بلکه به گیرنده هورمون دیگر - پرولاکتین نیز متصل می شود. به منظور جلوگیری از عوارض جانبی ناخواسته در طول درمان، دانشمندان تصمیم گرفتند امکان اتصال هورمون رشد به گیرنده پرولاکتین را از بین ببرند. آنها با جایگزینی برخی اسیدهای آمینه در ساختار اولیه هورمون رشد با استفاده از مهندسی ژنتیک به این امر دست یافتند.
10. دانشمندان در حین ساخت داروهای ضد عفونت HIV، پروتئینی ترکیبی به دست آوردند که یک قطعه آن اتصال اختصاصی این پروتئین را فقط به لنفوسیت های تحت تأثیر ویروس تضمین می کرد، قطعه دیگری نفوذ پروتئین هیبریدی را به سلول آسیب دیده انجام می داد. قطعه دیگری سنتز پروتئین را در سلول آسیب دیده مختل کرد که منجر به مرگ او شد.
پروتئین ها هدف اصلی داروها هستند. در حال حاضر، حدود 500 هدف برای اقدام دارویی شناخته شده است. در سال های آینده تعداد آنها به 10000 افزایش می یابد که امکان ایجاد داروهای جدید، مؤثرتر و ایمن تر را فراهم می کند. اخیراً رویکردهای اساساً جدیدی برای کشف دارو ایجاد شده است: نه پروتئین های منفرد، بلکه مجتمع های آنها، برهم کنش های پروتئین-پروتئین و تاخوردگی پروتئین به عنوان هدف در نظر گرفته می شوند.
نتیجه
فناوری مهندسی پروتئین (اغلب در ترکیب با روش DNA نوترکیب) برای بهبود خواص پروتئینهای موجود (آنزیمها، آنتیبادیها، گیرندههای سلولی) و ایجاد پروتئینهای جدیدی که در طبیعت وجود ندارند، استفاده میشود. چنین پروتئین هایی برای تولید دارو، در فرآوری مواد غذایی و در تولید صنعتی استفاده می شود.
در حال حاضر، محبوب ترین کاربرد مهندسی پروتئین، اصلاح خواص کاتالیزوری آنزیم ها برای توسعه فرآیندهای صنعتی "دوستانه با محیط زیست" است. از دیدگاه زیست محیطی، آنزیم ها قابل قبول ترین کاتالیزورهای مورد استفاده در صنعت هستند. این توسط توانایی بیوکاتالیست ها برای حل شدن در آب و عملکرد کامل در محیطی با pH خنثی و در دماهای نسبتا پایین تضمین می شود. علاوه بر این، به دلیل ویژگی بالای آنها، استفاده از بیوکاتالیست ها منجر به تولید محصولات جانبی ناخواسته بسیار کمی می شود. فرآیندهای صنعتی سازگار با محیط زیست و صرفه جویی در انرژی با استفاده از کاتالیزورهای زیستی مدت هاست که به طور فعال در صنایع شیمیایی، نساجی، دارویی، خمیر و کاغذ، غذا، انرژی و سایر زمینه های صنعت مدرن معرفی شده اند.
با این حال، برخی از ویژگی های بیوکاتالیست ها استفاده از آنها را در برخی موارد غیرقابل قبول می کند. به عنوان مثال، بیشتر آنزیم ها با افزایش دما تجزیه می شوند. دانشمندان در تلاش هستند تا با استفاده از تکنیک های مهندسی پروتئین بر چنین موانعی غلبه کنند و پایداری آنزیم ها را در شرایط سخت تولید افزایش دهند.
علاوه بر کاربردهای صنعتی، مهندسی پروتئین جایگاه شایسته ای در پیشرفت های پزشکی پیدا کرده است. محققان پروتئین هایی را سنتز می کنند که می توانند به ویروس ها و ژن های جهش یافته ای که باعث ایجاد تومور می شوند متصل شوند و آنها را خنثی کنند. ایجاد واکسنهای بسیار مؤثر و مطالعه پروتئینهای گیرنده سطح سلول، که اغلب هدف داروها هستند. دانشمندان علوم غذایی از مهندسی پروتئین برای بهبود خواص حفاظتی پروتئین های گیاهی و عوامل ژل کننده یا عوامل غلیظ کننده استفاده می کنند.
یکی دیگر از زمینه های کاربرد مهندسی پروتئین، ایجاد پروتئین هایی است که می توانند مواد و میکروارگانیسم هایی را که می توانند برای حملات شیمیایی و بیولوژیکی استفاده شوند، خنثی کنند. به عنوان مثال، آنزیم های هیدرولاز قادر به خنثی کردن گازهای عصبی و آفت کش های مورد استفاده در کشاورزی هستند. علاوه بر این، تولید، ذخیره و استفاده از آنزیم ها برای محیط زیست و سلامت انسان خطرناک نیست.
جهش زایی مهندسی پروتئین اصلاح شده است
کتابشناسی - فهرست کتب
1. مهندسی پروتئین.
2. مهندسی پروتئین. اسرار ژنتیک /ویاچسلاو مارکین // اسرار، معماها، حقایق.
3. مهندسی پروتئین. // دایره المعارف بزرگ روسیه.
4. مهندسی پروتئین. // کتاب راهنمای شیمیدان 21.
5. مهندسی پروتئین و اثربخشی دارو.
6. مهندسی پروتئین. / A.I. کورنلیوک // پلیمرهای زیستی و سلولی.
7. مهندسی پروتئین باعث بهبود اثربخشی داروها می شود. // مکانیک محبوب.
8. مهندسی پروتئین. دریافت انسولین // بیوفایل - مجله علمی و اطلاع رسانی.
9. بیوتکنولوژی. جهت گیری ها و دستاوردهای اصلی // زیست شناسی برای متقاضیان و معلمان.
10. بوگدانوف A.A., Mednikov B.M. قدرت بر ژن / A. A. Bogdanov، B. M. Mednikov - M.: آموزش و پرورش، 1989 - p.208
11. مهندسی ژنتیک. // سلامتی.
12. ژن ها و شیمیدان ها. // ژنتیک
13. گلیک بی.، پاسترناک جی. بیوتکنولوژی مولکولی. اصول و کاربرد / بی. گلیک، جی پاسترناک. - م.: میر، 1381.
14. سایر زمینه های کاربردی مهندسی ژنتیک. / L.V. تیموشنکو، ام.و. چوبیک // پزشکی - اخبار و فناوری ها.
15. Egorova T.A.، Klunova S.M.، Zhivukhin E.A. مبانی بیوتکنولوژی. / ت.ا. اگورووا، اس.ام. کلونوا، E.A. Zhivukhin - M.، 2003.
16. مهندسی پروتئین. // شیمی و بیوتکنولوژی.
17. پاتروشف L.I. بیان ژن / L.I. پاتروشف - م.: ناوکا، 2000. - 496 ص.
18. پاتروشف L.I. سیستم های ژنتیکی مصنوعی T. 1: مهندسی ژنتیک و پروتئین. /L.I. پاتروشف - م.: ناوکا، 2004. - 526 ص.
19. ریبچین وی.ن. مبانی مهندسی ژنتیک: کتاب درسی برای دانشگاه ها/V.N. Rybchin - سنت پترزبورگ: انتشارات دانشگاه فنی دولتی سنت پترزبورگ، 2002. - 522 p.
20. استپانوف وی.ام. زیست شناسی مولکولی. ساختار و عملکرد پروتئین ها / V.M. استپانوف - M.: مدرسه عالی، 1996.
21. فن آوری های بیوتکنولوژی: مهندسی پروتئین، نانوبیوتکنولوژی، حسگرهای زیستی و تراشه های زیستی. / Evgenia Ryabtseva // "بیوتکنولوژی تجاری" - مجله آنلاین.
22. Chernavsky D.S., Chernavskaya N.M. پروتئین یک ماشین است. ساختارهای ماکرومولکولی بیولوژیکی / D.S. Chernavsky، N. M. Chernavskaya - M.: انتشارات دانشگاه دولتی مسکو، 1999.
23. شولتز G.E., Schirmer R.H. اصول سازماندهی ساختاری پروتئین ها. / GE. شولتز، آر.اچ. Schirmer - M.: Mir, 1982.
24. برانیگان جی.ای.، ویلکینسون ای.جی. مهندسی پروتئین 20 سال در // بررسی های طبیعت. زیست شناسی سلولی مولکولی. 2002. جلد. 3. شماره 12;
25. مهندسی پروتئین. // ویکی پدیا، دانشنامه آزاد.
ارسال شده در Allbest.ru
اسناد مشابه
ماهیت و وظایف مهندسی ژنتیک، تاریخچه توسعه آن. اهداف ایجاد موجودات اصلاح شده ژنتیکی آلودگی شیمیایی در نتیجه GMOs دریافت انسولین انسانی به عنوان مهمترین دستاورد در زمینه موجودات دستکاری شده ژنتیکی.
چکیده، اضافه شده در 1392/04/18
ظهور بیوتکنولوژی. مسیرهای اصلی بیوتکنولوژی انرژی زیستی به عنوان شاخه ای از بیوتکنولوژی دستاوردهای عملی بیوتکنولوژی تاریخچه مهندسی ژنتیک. اهداف، روش ها و آنزیم های مهندسی ژنتیک. دستاوردهای مهندسی ژنتیک
چکیده، اضافه شده در 2008/07/23
امکانات مهندسی ژنتیک گیاهی ایجاد گیاهان مقاوم به علف کش. افزایش کارایی فتوسنتز و تثبیت بیولوژیکی نیتروژن. بهبود کیفیت پروتئین های ذخیره سازی خطرات زیست محیطی، پزشکی و اجتماعی-اقتصادی مهندسی ژنتیک
تست، اضافه شده در 12/15/2011
جوهر مهندسی ژنتیک، روش های شناسایی موجودات تراریخته؛ تولید و فناوری GMOs، تفاوت با پرورش سنتی، مزایا و معایب. وضعیت و چشم انداز توسعه بازار کالاهای اصلاح شده ژنتیکی در جهان.
کار دوره، اضافه شده در 2010/11/20
مهندسی ژنتیک روشی از بیوتکنولوژی است که به تحقیق در مورد بازسازی ژنوتیپ ها می پردازد. امکانات مهندسی ژنتیک چشم انداز مهندسی ژنتیک کاهش خطرات مرتبط با فناوری های ژنتیکی.
چکیده، اضافه شده در 2007/09/04
مهندسی ژنتیک: تاریخچه پیدایش، خصوصیات کلی، مزایا و معایب. آشنایی با جدیدترین روش های مهندسی ژنتیک و کاربرد آنها در پزشکی. توسعه مهندسی ژنتیک در حوزه دام و طیور. آزمایش روی موش ها
کار دوره، اضافه شده در 07/11/2012
دنباله ای از تکنیک های مهندسی ژنتیک که برای ایجاد موجودات اصلاح شده ژنتیکی استفاده می شود. طبقه بندی انواع اصلی آنزیم های محدود کننده مورد استفاده برای تکه تکه شدن DNA. آنزیم هایی که DNA را روی یک الگوی DNA یا RNA سنتز می کنند.
ارائه، اضافه شده در 2014/04/27
ماهیت مهندسی ژنتیک و سلولی. وظایف اصلی اصلاح ژنتیکی گیاهان، تجزیه و تحلیل مضرات مصرف آنها به عنوان غذا. ویژگی های هیبریداسیون سلول های گیاهی و حیوانی. مکانیسم به دست آوردن مواد دارویی با استفاده از مهندسی ژنتیک.
ارائه، اضافه شده در 2014/01/26
کار دوره، اضافه شده در 05/10/2011
مبانی و تکنیک های شبیه سازی DNA مراحل مهندسی ژنتیک باکتری ها توسعه مهندسی ژنتیک گیاهان. تبدیل ژنتیکی و اصلاح گیاهان با استفاده از اگروباکتری ها، منابع ژن. ایمنی گیاهان اصلاح شده ژنتیکی
از نظر شیمیایی، پروتئین یک نوع مولکول منفرد است که یک زنجیره پلی آمینو اسید یا پلیمر است. از توالی اسید آمینه 20 نوع تشکیل شده است. پس از یادگیری ساختار پروتئین ها، مردم این سوال را مطرح کردند: آیا می توان توالی های اسید آمینه کاملاً جدیدی را طراحی کرد تا عملکردهای مورد نیاز انسان را بسیار بهتر از پروتئین های معمولی انجام دهند؟ بهترین نام برای این ایده جسورانه بود مهندسی پروتئین.
مردم در دهه 50 قرن بیستم شروع به فکر کردن در مورد چنین مهندسی کردند. این بلافاصله پس از رمزگشایی اولین توالی اسید آمینه پروتئین اتفاق افتاد. در بسیاری از آزمایشگاهها در سراسر جهان، تلاشهایی برای کپی کردن طبیعت و سنتز شیمیایی توالیهای پلی آمینو اسیدی مطلقاً دلخواه صورت گرفته است.
شیمیدان B. Merrifield بیشترین موفقیت را در این امر داشت. این آمریکایی موفق شد روش بسیار موثری برای سنتز زنجیره های پلی آمینو اسیدی ایجاد کند. به همین دلیل، مریفیلد در سال 1984 جایزه نوبل شیمی را دریافت کرد.
آمریکایی شروع به سنتز پپتیدهای کوتاه از جمله هورمون ها کرد. در همان زمان، او یک خودکار - یک "ربات شیمیایی" - ساخت که وظیفه آن تولید پروتئین های مصنوعی بود. این ربات در محافل علمی هیجان ایجاد کرد. با این حال، به زودی مشخص شد که محصولات او نمی توانند با آنچه طبیعت تولید می کند رقابت کنند.
ربات نتوانست توالی اسیدهای آمینه را به طور دقیق بازتولید کند، یعنی اشتباهاتی مرتکب شد. او یک زنجیره را با یک دنباله و دیگری را با یک دنباله کمی متفاوت سنتز کرد. در یک سلول، تمام مولکول های یک پروتئین به طور ایده آل شبیه به یکدیگر هستند، یعنی توالی آنها کاملاً یکسان است.
مشکل دیگری وجود داشت. حتی مولکول هایی که ربات به درستی سنتز کرده بود، شکل فضایی لازم برای عملکرد آنزیم را به خود نگرفت. بنابراین، تلاش برای جایگزینی طبیعت با روشهای معمول شیمی آلی به موفقیت بسیار ناچیزی منجر شد.
دانشمندان فقط می توانستند از طبیعت بیاموزند و به دنبال تغییرات لازم در پروتئین ها بودند. نکته اینجاست که در طبیعت دائماً جهش هایی وجود دارد که منجر به تغییر در توالی اسید آمینه پروتئین ها می شود.
اگر جهشیافتههایی را با ویژگیهای لازم انتخاب کنید، مثلاً آنهایی که یک سوبسترا خاص را کارآمدتر پردازش میکنند، میتوانید آنزیم تغییریافته را از چنین جهشیافتهای جدا کنید که به لطف آن سلول خواص جدیدی به دست میآورد. اما این فرآیند زمان بسیار طولانی را می طلبد.
با ظهور مهندسی ژنتیک همه چیز تغییر کرد. به لطف او، آنها شروع به ایجاد ژن های مصنوعی با هر توالی نوکلئوتیدی کردند. این ژن ها در مولکول های ناقل آماده شده وارد شدند و DNA به باکتری یا مخمر وارد شد. در آنجا یک کپی از RNA از ژن مصنوعی گرفته شد. در نتیجه پروتئین مورد نیاز تولید شد. خطاها در سنتز آن حذف شدند. نکته اصلی این بود که توالی DNA مناسب را انتخاب کنیم و سپس سیستم آنزیمی سلول کار خود را بدون نقص انجام داد.
بنابراین، می توان نتیجه گرفت که مهندسی ژنتیک راه را برای مهندسی پروتئین در رادیکال ترین شکل آن باز کرده است. به عنوان مثال، ما پروتئینی را انتخاب کردیم و میخواستیم یک اسید آمینه را با دیگری جایگزین کنیم.
قبل از شروع کار جایگزینی، باید یک وکتور DNA را تهیه کنید. این DNA ویروسی یا پلاسمیدی است که ژن پروتئین مورد علاقه ما در آن ساخته شده است. همچنین باید توالی نوکلئوتیدی ژن و توالی اسید آمینه پروتئین کدگذاری شده را بدانید. دومی با استفاده از جدول کد ژنتیکی از اولی تعیین می شود.
با استفاده از جدول، تعیین اینکه حداقل چه تغییراتی باید در ترکیب ژن ایجاد شود، آسان است تا شروع به رمزگذاری نه اصلی، بلکه یک پروتئین اصلاح شده به درخواست ما کند. بیایید بگوییم که در وسط یک ژن باید گوانین را با تیمین جایگزین کنید.
به دلیل چنین چیز کوچکی، نیازی به سنتز مجدد کل ژن نیست. تنها یک قطعه کوچک از نوکلئوتیدها سنتز می شود که مکمل ناحیه ای است که نوکلئوتید گوانین انتخاب شده برای جایگزینی در وسط آن قرار دارد.
قطعه به دست آمده با یک ناقل DNA (DNA دایره ای) مخلوط می شود که حاوی ژن مورد نیاز ما است. حلقه DNA و قطعه سنتز شده بخشی از مارپیچ دوگانه Watson-Crick را ایجاد می کند. در آن، جفت مرکزی از مارپیچ دوگانه "بیرون رانده می شود"، زیرا توسط نوکلئوتیدهای متقابل غیر مکمل تشکیل شده است.
چهار dNTP و DNA پلیمراز را به محلول اضافه کنید. دومی با استفاده از یک قطعه چسبیده به یک حلقه، آن را به یک حلقه کامل مطابق با اصل مکمل بودن کامل می کند.
در نتیجه، DNA ناقل تقریباً طبیعی را دریافت می کنیم. می توان آن را برای تولید مثل به سلول مخمر یا باکتری وارد کرد. تنها چیزی که وجود دارد این است که این DNA با ناقل اصلی در یک جفت غیر مکمل متفاوت است. به عبارت دیگر، مارپیچ ناقل DNA کاملاً کامل نیست.
در اولین اقدام دوبرابر کردن ناقل حاصل همراه با باکتری های حامل آن، هر یک از مولکول های DNA دختر به یک مارپیچ دوگانه کامل در تمام طول خود تبدیل می شوند. با این حال، یکی از مولکول های دختر حامل جفت نوکلئوتیدی اصلی است و دیگری یک ناقل جهش یافته در این مکان دارد که بر اساس آن پروتئین جهش یافته مورد علاقه ما به دست می آید.
بنابراین، مهندسی پروتئین ترکیبی از سلول ها را ایجاد می کند. برخی از آنها حامل ناقل اصلی با یک ژن غیر جهش یافته هستند، در حالی که سلول های دیگر حامل ژن جهش یافته هستند. باقی مانده است که از این مخلوط دقیقاً سلول هایی را انتخاب کنید که ژن جهش یافته در آنها قرار دارد.
روشهای مهندسی ژنتیک، بهویژه شبیهسازی ژنها یا بخشهایی از آنها، و همچنین توالییابی DNA، بهبود قابلتوجهی روششناسی جهشزایی را ممکن کرده است و معایب اصلی روشهای کلاسیک برای القای جهش در ژنومها را از بین میبرد. تجزیه و تحلیل ژنتیکی کلاسیک شامل تأثیر یک عامل جهش زا در داخل بدن بر روی کل ژنوم است، در نتیجه جهش های تصادفی در آن ایجاد می شود، اغلب متعدد، که شناسایی جهش یافته ها را بسیار پیچیده می کند. افراد جهش یافته با ویژگی های فنوتیپی تغییر یافته شناسایی می شوند و ماهیت جهش را می توان پس از تعیین توالی DNA تعیین کرد. جهش زایی موضعی مدرن، در واقع، شامل اقدامات معکوس می شود: ابتدا ژن مورد نظر یا بخش آن کلون می شود، ساختار آن در طول توالی یابی تعیین می شود و سپس تغییرات مورد نیاز در ترکیب آن در شرایط آزمایشگاهی ایجاد می شود. پیامدهای جهش القا شده پس از معرفی ژن جهش یافته به ارگانیسم اصلی مشخص می شود.
ساده ترین نسخه جهش زایی موضعی شامل درمان یک قطعه DNA کلون شده با یکی از عوامل جهش زایی است، اما نتیجه چنین مواجهه ای نیز تغییرات تصادفی در ساختار قطعه خواهد بود. روش های قابل اعتمادتر و بیشتر مورد استفاده جهش زایی موضعی بدون استفاده از عوامل جهش زا انجام می شود. در میان انواع جهش، حذف، درج و جایگزینی نوکلئوتیدی غالب است.
حذف هااین نوع جهش ها در جهش زایی موضعی با استفاده از اندونوکلئازها به دست می آیند. هر دو اندونوکلئاز محدود و غیر اختصاصی استفاده می شود. سادهترین مورد استفاده از آنزیمهای محدودکننده، شکافتن یک ژنوم با استفاده از آنزیم محدودکننده است که چندین شکستگی ایجاد میکند تا انتهای چسبناک ایجاد شود. قطعات به دست آمده دوباره با استفاده از DNA لیگاز به حلقه ای بسته می شوند که می تواند منجر به تشکیل مولکول هایی شود که حاوی یکی از بخش های DNA نیستند. این رویکرد حذف های گسترده ای را ایجاد می کند و معمولاً در آزمایش های اولیه برای تعیین عملکرد بخش های نسبتاً بزرگ DNA شبیه سازی شده استفاده می شود.
حذف های کوچک به شرح زیر بدست می آید. قطعه کلون شده در داخل ناقل در محل مناسب با استفاده از یک آنزیم محدود شکافته می شود (شکل 21.1). مولکول خطی حاصل با اگزونوکلئاز III که یک رشته DNA را هیدرولیز می کند، تیمار می شود.
از انتهای 3 شروع می شود. نتیجه مجموعه ای از مولکول ها با دم های 5 اینچی تک رشته ای با طول های مختلف است. این دمها توسط نوکلئاز S1 مخصوص ssDNA هیدرولیز میشوند و حذفهایی در DNA ایجاد میشوند. شما همچنین می توانید از اگزونوکلئاز Bal 31 استفاده کنید که تجزیه هر دو رشته را کاتالیز می کند، که از انتهای مولکول های DNA خطی شروع می شود. سیر واکنش های نوکلئوتیک با تغییر زمان انکوباسیون، دما و غلظت آنزیم تنظیم می شود و باعث ایجاد حذف با طول های مختلف می شود. واریانت های حذف حاصل از DNA خطی اغلب با پیوند دهنده ها قبل از چرخه سازی ارائه می شوند تا مکان های محدودیت در ناحیه حذف وجود داشته باشند. اصلاحات دیگری در روش های توصیف شده وجود دارد.
درج ها (درج ها).برای به دست آوردن درج، DNA شبیه سازی شده با یک آنزیم محدود کننده یا اندونوکلئاز غیر اختصاصی هضم می شود و سپس قطعات به دست آمده در حضور بخشی که می خواهیم به DNA وارد شود، پیوند داده می شود. اغلب، پلیلینکرهای سنتز شده شیمیایی به عنوان چنین بخشهایی استفاده میشوند (فصل 20).
درجها، مانند حذفها، میتوانند یکپارچگی یک ژن یا ساختار نواحی تنظیمکننده آن را مختل کنند و منجر به سنتز یک پروتئین معیوب (در مورد حذفهای طولانی یا تغییر چارچوب، معمولاً غیرفعال) یا تغییر در روند رونویسی ژن شوند. مورد علاقه. به این ترتیب، جهشهای تنظیمی اغلب به دست میآیند و بردارهای بیانی ساخته میشوند (فصل 20).
جهش های نقطه ای . این جهش ها جایگزین نوکلئوتیدی هستند. برای به دست آوردن آنها می توان از چندین روش استفاده کرد: دآمیناسیون سیتوزین، ترکیب آنالوگ های نوکلئوتیدی، ترکیب نادرست نوکلئوتیدها در طول ترمیم شکاف و غیره.
روش اول بر این واقعیت استوار است که باقیماندههای سیتوزین در DNA تک رشتهای را میتوان با تصفیه با یونهای بی سولفیت برای تشکیل اوراسیل دآمینه کرد. نواحی تک رشتهای در DNA معمولاً در نزدیکی مکانهای محدود بهدست میآیند، به عنوان مثال، با عمل اگزونوکلئاز III. پس از تصفیه بی سولفیت، شکاف های تک رشته ای با استفاده از DNA پلیمراز پر شده و انتهای آن بسته می شود. در مکان هایی که در حین دآمیناسیون به جای سیتیدیلات یوریدیلات تشکیل شد، آدنیلات جایگاه مکمل را اشغال می کند و در حین تکثیر چنین مولکولی جفت GC با یک جفت AT جایگزین می شود.
روش دیگر برای القای جایگزینی، درمان DNA کلون شده با آنزیم محدود کننده در حضور اتیدیوم بروماید است که بین صفحات جفت باز قرار می گیرد و ساختار دوبلکس را مختل می کند. در نتیجه، تنها یک شکست DNA تک رشته ای تشکیل می شود. شکاف کوچکی در محل شکستگی تک رشته ایجاد می شود و سپس در حضور DNA پلیمراز، dATP، dGTP، dCTP و N-4-هیدروکسی سیتوزین تری فسفات به جای dTTP ترمیم می شود. هیدروکسی سیتوزین تری فسفات به جای تیمیدیلات در زنجیره قرار می گیرد، اما در طول تکثیر DNA به خوبی با آدنیلات و گوانیلات جفت می شود. در نتیجه گنجاندن گوانیلات پس از یک دور اضافی تکرار، جایگزینی AT→GC در این مکان رخ خواهد داد (شکل 21.2). از آنجایی که در این روش جایگزینی نوکلئوتید به صورت داخلی انجام می شود
در سایت محدودیت، تشخیص بردارها با توالی اصلی و بردارهای جهش یافته به راحتی امکان پذیر می شود. برای انجام این کار، کافی است آنها را با آنزیم محدود کننده مورد استفاده در آزمایش درمان کنید: مولکول های جهش یافته دچار شکاف نخواهند شد.
روش مشابهی مبتنی بر استفاده از تنها سه نوکلئوتید از چهار نوکلئوتید ممکن هنگام پر کردن شکاف تک رشتهای با DNA پلیمراز است. در بیشتر موارد، آنزیم در نقطه ای از مولکول متوقف می شود که نوکلئوتید مکمل نوکلئوتید از دست رفته رخ می دهد. با این حال، گاهی اوقات DNA پلیمراز اشتباه می کند و یکی از سه نوکلئوتید موجود را روشن می کند. این منجر به تشکیل مولکول های حلقه ای می شود که حاوی بازهای نیتروژنی غیر مکمل جفت نشده هستند. هنگامی که چنین ناقل هایی به سلول های باکتری وارد می شوند، برخی از مولکول ها تحت ترمیم چنین آسیب هایی قرار می گیرند. در نتیجه، در نیمی از مولکول ها پس از همانندسازی، توالی اصلی بازیابی می شود و در نیمی دیگر جهش ثابت می شود. مولکول های جهش یافته را می توان با استفاده از روشی که در بالا توضیح دادیم تشخیص داد.
جهش زایی سایت خاص روشهای مشخصشده جهشزایی موضعی از این جهت متفاوت است که مکانهایی که جهشها رخ میدهند بهطور تصادفی انتخاب میشوند. در عین حال، تکنیک جهش زایی سایت خاص این امکان را فراهم می کند که جهش ها را به یک منطقه دقیقاً تعریف شده از ژن وارد کند. این کار با استفاده از الیگونوکلئوتیدهای مصنوعی (به دست آمده از سنتز شیمیایی) با یک توالی مشخص انجام می شود. این روش از این جهت راحت است که نیازی به وجود سایت های محدود کننده مناسب ندارد. این روش بر اساس تشکیل هترودپلکس بین یک الیگونوکلئوتید مصنوعی حاوی جهش و DNA تک رشتهای مکمل در ناقل است.
به صورت زیر عمل کنید. یک اولیگونوکلئوتید کوچک (20-8 مونومر) ساخته می شود که مکمل بخشی از ژن است که در آن می خواهند جهش به دست آورند. یک یا چند جایگزین نوکلئوتید در ناحیه مرکزی اولیگونوکلئوتید مجاز است. ژن مورد مطالعه یا قطعه آن به عنوان بخشی از یک ناقل بر اساس فاژ M13 برای بدست آوردن DNA نوترکیب تک رشته ای حلقوی کلون می شود. وکتورهای نوترکیب با الیگونوکلئوتیدها مخلوط و بازپخت می شوند. هیبریداسیون الیگونوکلئوتید با ناحیه مکمل اتفاق می افتد، در حالی که نوکلئوتیدهای غیر مکمل جفت نشده باقی می مانند. الیگونوکلئوتید به عنوان یک آغازگر در واکنش پلیمراز شامل DNA پلیمراز در شرایط آزمایشگاهی عمل می کند. حلقه توسط لیگازها بسته می شود. مولکول دایره ای حاصل به سلول های E. coli وارد می شود، جایی که ترمیم نسبی مکان های تکثیر جهش یافته رخ می دهد. فراوانی جهش ها معمولاً از 1 تا 50 درصد متغیر است. انتخاب سلولهای حاوی مولکولهای DNA جهش یافته میتواند به روشهای مختلفی انجام شود، از جمله مزیت آن، روش استفاده از یک الیگونوکلئوتید نشاندار شده رادیواکتیو است که برای جهشزایی استفاده میشود. در این مورد، این نوکلئوتید به عنوان یک کاوشگر عمل می کند. اصل استفاده از چنین کاوشگری مبتنی بر این واقعیت است که کاملاً مکمل DNA جهش یافته و تا حدی مکمل DNA نوع وحشی است. امکان انتخاب چنین شرایط هیبریداسیون (در درجه اول دما) وجود دارد که هیبریداسیون کاوشگر نشاندار شده تنها با توالی DNA جهش یافته پایدار باشد، که می تواند توسط اتورادیوگرافی شناسایی شود.
روش جهش زایی سایت خاص بسیار ارزشمند است زیرا به شما امکان می دهد جهش ها را بدون کنترل تظاهرات فنوتیپی آنها جدا کنید. این روش فرصت های جدیدی را برای مطالعه عملکرد عناصر تنظیم کننده ژن باز می کند، به شما امکان می دهد "قدرت" پروموترها را تغییر دهید، مکان های اتصال ریبوزوم را بهینه کنید و غیره. یکی از کاربردهای اصلی این روش است. مهندسی پروتئین
مهندسی پروتئین این عبارت مجموعهای از تکنیکهای روششناختی را نشان میدهد که بازسازی یک مولکول پروتئین را با وارد کردن هدفمند جهشهای مناسب به یک ژن ساختاری (جهشزایی خاص مکان) و در نتیجه، جایگزینی اسید آمینه مورد نظر در ساختار اولیه پروتئین ممکن میسازد.
یک مثال گویا از ساخت پروتئینهای فعالتر، آزمایشهای فرشت و همکارانش با آنزیم tyrosyl-tRNA سنتتاز از باکتری Bacillus stearothermophilus است. تجزیه و تحلیل پیامدهای جایگزینی اسیدهای آمینه در محل فعال این آنزیم منجر به این نتیجه شد که حذف گروه هایی که پیوندهای هیدروژنی ضعیفی را با سوبسترا تشکیل می دهند می تواند میل ترکیبی آن را با سوبسترا بهبود بخشد. مشخص شد که ترئونین-51 (موقعیت 51 را در پپتید اشغال می کند) یک پیوند هیدروژنی طولانی و ضعیف با اکسیژن حلقه ریبوز هنگام اتصال تیروسیل آدنیلات تشکیل می دهد. در همان زمان، مشخص شد که پرولین در باکتری E. coli همان موقعیت را اشغال می کند. جهش زایی اختصاصی ژنی که ساختار B.stearothermophilus tyrosyl-tRNA synthetase را تعیین می کند، جایگزینی آن را ممکن کرد. thr-51→pro -51در پپتید در نتیجه، اتصال ATP در مرکز فعال آنزیم به شدت بهبود یافت و فعالیت کاتالیزوری آن 25 برابر افزایش یافت.
یکی دیگر از نمونه های مهم بازسازی پروتئین که اهمیت عملی دارد، اصلاح سوبتیلیسین از Bacillus amyloliquefaciens است که توسط استل و همکاران انجام شد. سوبتیلیسین ها پروتئینازهای سرینی هستند که توسط باسیل ها در محیط خارجی ترشح می شوند. این آنزیم ها در مقیاس وسیع توسط صنعت بیوتکنولوژی تولید می شوند و به طور گسترده در مواد شوینده استفاده می شوند. مضرات سوبتیلیسین کاهش شدید فعالیت پروتئولیتیک تحت تأثیر عوامل اکسید کننده، از جمله موارد موجود در پودرهای شستشو است. هدف از بازسازی مولکول سوبتیلیسین BPN تثبیت آن در برابر اکسیداسیون شیمیایی بود.
در آزمایشات اولیه، مشخص شد که در حضور پراکسید هیدروژن، سوبتیلیسین به دلیل اکسیداسیون باقیمانده متیونین-222 که به سولفوکسید مربوطه تبدیل می شود، به سرعت فعالیت را کاهش می دهد. با استفاده از روش های جهش زایی سایت خاص، این باقی مانده متیونین با تمام 19 اسید آمینه پروتئین دیگر جایگزین شد. پلاسمیدهایی با ژنهای جهش یافته به سویههایی با حذف در ژنهای مربوطه وارد شدند و خواص سوبتیلیسینهای تولید شده مورد تجزیه و تحلیل قرار گرفتند. جهش یافته ها با سرین و آلانین 222 در برابر عملکرد پراکسید کاملاً پایدار بودند. فعال ترین جهش، جهش حاوی باقیمانده سیستئین-222 بود؛ فعالیت ویژه آن 38 درصد بیشتر از سویه نوع وحشی بود.
به روشی مشابه، امکان افزایش فعالیت B-اینترفرون وجود داشت. از دیگر دستاوردهای مهندسی پروتئین می توان به مطالعاتی در زمینه روشن کردن فعالیت تبدیلی انکوپروتئین ها اشاره کرد. تغییر پایداری آنزیم ها در برابر حرارت، به عنوان مثال، به دست آوردن رنین حرارت پذیر و a-amylase مقاوم در برابر حرارت. افزایش کارایی اتصال انسولین توسط گیرنده غشای پلاسمایی مربوطه به دلیل جایگزینی هیستیدین با آسپارتات در موقعیت 10 زنجیره b هورمون، و همچنین بسیاری از نمونه های دیگر. تعداد زیادی از محصولات مهندسی پروتئین قبلاً کاربرد عملی در فرآیندهای تولید پیدا کرده اند.
1.1 مفهوم مهندسی پروتئین. تاریخ توسعه
مهندسی پروتئین شاخه ای از بیوتکنولوژی است که با توسعه پروتئین های مفید یا ارزشمند سروکار دارد. این یک رشته نسبتاً جدید است که بر مطالعه تاخوردگی پروتئین و اصول اصلاح و ایجاد پروتئین تمرکز دارد.
دو استراتژی اصلی برای مهندسی پروتئین وجود دارد: اصلاح هدایت شده پروتئین و تکامل هدایت شده. این روش ها متقابل نیستند. محققان اغلب از هر دو استفاده می کنند. در آینده، دانش دقیق تر از ساختار و عملکرد پروتئین، و همچنین پیشرفت در فن آوری بالا، ممکن است به طور قابل توجهی امکانات مهندسی پروتئین را گسترش دهد. در نتیجه، حتی اسیدهای آمینه غیرطبیعی را می توان به لطف روش جدیدی که به آمینو اسیدهای جدید در کد ژنتیکی گنجانده می شود، وارد کرد.
مهندسی پروتئین از تلاقی فیزیک پروتئین و شیمی و مهندسی ژنتیک سرچشمه گرفت. مشکل ایجاد مولکول های پروتئینی اصلاح شده یا هیبریدی با ویژگی های مشخص را حل می کند. یک راه طبیعی برای اجرای چنین کاری، پیشبینی ساختار ژن کدکننده پروتئین تغییریافته، انجام سنتز، شبیهسازی و بیان آن در سلولهای گیرنده است.
اولین اصلاح پروتئین کنترل شده در اواسط دهه 60 توسط Koshland و Bender انجام شد. برای جایگزینی گروه هیدروکسیل با یک گروه سولفیدریل در مرکز فعال پروتئاز، سوبتیلیسین، از روش اصلاح شیمیایی استفاده کردند. با این حال، همانطور که مشخص شد، چنین تیول سوبتیلیسین فعالیت پروتئاز را حفظ نمی کند.
از نظر شیمیایی، پروتئین یک نوع مولکول منفرد است که یک زنجیره پلی آمینو اسید یا پلیمر است. از توالی اسید آمینه 20 نوع تشکیل شده است. پس از یادگیری ساختار پروتئین ها، مردم این سوال را مطرح کردند: آیا می توان توالی های اسید آمینه کاملاً جدیدی را طراحی کرد تا عملکردهای مورد نیاز انسان را بسیار بهتر از پروتئین های معمولی انجام دهند؟ نام مهندسی پروتئین برای این ایده مناسب بود.
مردم در دهه 50 قرن بیستم شروع به فکر کردن در مورد چنین مهندسی کردند. این بلافاصله پس از رمزگشایی اولین توالی اسید آمینه پروتئین اتفاق افتاد. در بسیاری از آزمایشگاهها در سراسر جهان، تلاشهایی برای کپی کردن طبیعت و سنتز شیمیایی توالیهای پلی آمینو اسیدی مطلقاً دلخواه صورت گرفته است.
شیمیدان B. Merrifield بیشترین موفقیت را در این امر داشت. این آمریکایی موفق شد روش بسیار موثری برای سنتز زنجیره های پلی آمینو اسیدی ایجاد کند. به همین دلیل، مریفیلد در سال 1984 جایزه نوبل شیمی را دریافت کرد.
شکل 1. طرح چگونگی کار مهندسی پروتئین.
آمریکایی شروع به سنتز پپتیدهای کوتاه از جمله هورمون ها کرد. در همان زمان، او یک خودکار - یک "ربات شیمیایی" - ساخت که وظیفه آن تولید پروتئین های مصنوعی بود. این ربات در محافل علمی هیجان ایجاد کرد. با این حال، به زودی مشخص شد که محصولات او نمی توانند با آنچه طبیعت تولید می کند رقابت کنند.
ربات نتوانست توالی اسیدهای آمینه را به طور دقیق بازتولید کند، یعنی اشتباهاتی مرتکب شد. او یک زنجیره را با یک دنباله سنتز کرد و دیگری را با یک دنباله کمی تغییر داد. در یک سلول، تمام مولکول های یک پروتئین به طور ایده آل شبیه به یکدیگر هستند، یعنی توالی آنها کاملاً یکسان است.
مشکل دیگری وجود داشت. حتی مولکول هایی که ربات به درستی سنتز کرده بود، شکل فضایی لازم برای عملکرد آنزیم را به خود نگرفت. بنابراین، تلاش برای جایگزینی طبیعت با روشهای معمول شیمی آلی به موفقیت بسیار ناچیزی منجر شد.
دانشمندان فقط می توانستند از طبیعت بیاموزند و به دنبال تغییرات لازم در پروتئین ها بودند. نکته اینجاست که در طبیعت دائماً جهش هایی وجود دارد که منجر به تغییر در توالی اسید آمینه پروتئین ها می شود. اگر جهشیافتههایی را با ویژگیهای لازم انتخاب کنید که یک بستر خاص را کارآمدتر پردازش میکنند، میتوانید آنزیم تغییریافته را از چنین جهشیافته ای جدا کنید که به لطف آن سلول خواص جدیدی به دست میآورد. اما این فرآیند زمان بسیار طولانی را می طلبد.
با ظهور مهندسی ژنتیک همه چیز تغییر کرد. به لطف او، آنها شروع به ایجاد ژن های مصنوعی با هر توالی نوکلئوتیدی کردند. این ژن ها در مولکول های ناقل آماده شده وارد شدند و DNA به باکتری یا مخمر وارد شد. در آنجا یک کپی از RNA از ژن مصنوعی گرفته شد. در نتیجه پروتئین مورد نیاز تولید شد. خطاها در سنتز آن حذف شدند. نکته اصلی این بود که توالی DNA مناسب را انتخاب کنیم و سپس سیستم آنزیمی سلول کار خود را بدون نقص انجام داد. بنابراین، می توان نتیجه گرفت که مهندسی ژنتیک راه را برای مهندسی پروتئین در رادیکال ترین شکل آن باز کرده است.
مهندسی پروتئین
اصلاح هدفمند پروتئین در اصلاح هدفمند پروتئین، دانشمند از دانش دقیق ساختار و عملکرد پروتئین برای ایجاد تغییرات مورد نظر استفاده می کند. به طور کلی این روش دارای مزیت ...
مهندسی پروتئین
فناوری مهندسی پروتئین (اغلب در ترکیب با روش DNA نوترکیب) برای بهبود خواص پروتئین های موجود (آنزیم ها، آنتی بادی ها، گیرنده های سلولی) و ایجاد پروتئین های جدیدی که در طبیعت وجود ندارند استفاده می شود.
مهندسی پروتئین
1. با جایگزینی چند باقیمانده اسید آمینه لیزوزیم باکتریوفاژ T4 با سیستئین، آنزیمی با تعداد زیادی پیوند دی سولفید به دست آمد که به دلیل آن این آنزیم در دمای بالاتر فعالیت خود را حفظ کرد. 2...
گونه ها و گونه زایی
ارسطو از اصطلاح «گونه» برای توصیف حیوانات مشابه استفاده کرد. پس از ظهور آثار D. Ray (1686) و به ویژه C. Linnaeus (1751-1762)، مفهوم گونه در زیست شناسی به عنوان اصلی ترین ...
فعالیت عصبی بالاتر در بزرگسالی
عملکرد مغز برای سالیان متمادی برای بشریت یک معمای حل نشده باقی مانده بود. نه تنها روحانیون، بلکه دانشمندانی که مدعی ایده آلیسم بودند، تمام فرآیندهای ذهنی در بدن را با روحی اسرارآمیز مرتبط کردند...
الگوریتم های ژنتیک در مسئله بهینه سازی پارامترهای واقعی
آنچه که الگوریتم ژنتیک استاندارد نامیده می شود، ابتدا در کار دی یونگ به تفصیل شرح و بررسی شد.
مهندسی ژنتیک
مهندسی ژنتیک به لطف کار بسیاری از محققان در شاخه های مختلف بیوشیمی و ژنتیک مولکولی ظاهر شد. برای سالها، پروتئینها به عنوان کلاس اصلی درشت مولکولها در نظر گرفته میشدند. حتی یک فرض هم وجود داشت ...
استفاده از مهندسی ژنتیک در درمان بیماری ها و ایجاد دارو
مهندسی ژنتیک به لطف کار بسیاری از محققان در شاخه های مختلف بیوشیمی و ژنتیک مولکولی ظاهر شد.
تاریخچه ژنتیک
پس از انتشار گسترده آموزه های چارلز داروین، یکی از اولین منتقدانی که به نقطه ضعف این نظریه اشاره کرد، محقق اسکاتلندی F. Jenkins بود. در سال 1867، او اشاره کرد که در نظریه داروین هیچ وضوحی در مورد مسئله وجود ندارد.
مفاهیم توسعه فن آوری های مدرن و انرژی
برای تسهیل کار فیزیکی، از زمان های قدیم، دستگاه ها، مکانیسم ها و ماشین های مختلفی اختراع شده اند که توانایی های مکانیکی انسان را افزایش می دهند. اما تنها چند مکانیسم به فرد کمک می کند تا کار را انجام دهد ...
ویژگی های شبیه سازی
نژادهای جوجه و توزیع مدرن آنها
پرورش طیور در اکثر کشورهای جهان جایگاه پیشرو در میان سایر شاخه های تولید کشاورزی را به خود اختصاص داده و محصولات غذایی بسیار با ارزش غذایی (تخم مرغ، گوشت، جگر چرب خوشمزه) را برای مردم فراهم می کند.
مشکل وجود بشریت در پرتو نظریه نوکره ورنادسکی
بر اساس مشاهدات پدیدههای طبیعی، این ایده که موجودات زنده با محیط خارجی تعامل دارند و بر تغییرات آن تأثیر میگذارند، مدتها پیش مطرح شد...
سیتوژنتیک به عنوان یک علم
سیتوژنتیک علم پایه مادی وراثت است. او ویژگی های ساختار، تولید مثل، نوترکیب، تغییرات و عملکرد ساختارهای ژنتیکی سلول، توزیع آنها در میتوز را مطالعه می کند.
تکامل گروه های موجودات
نظریه تکاملی دکترین الگوهای کلی و نیروهای محرکه توسعه تاریخی طبیعت زنده است. هدف از این آموزش: شناسایی الگوهای توسعه دنیای ارگانیک برای مدیریت بعدی این فرآیند...

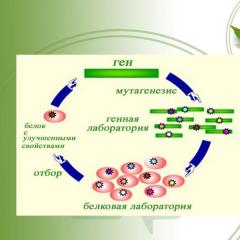
مهندسی پروتئین 6 مجموعه ای از روش ها و رویکردها برای مطالعه پروتئین ها و به دست آوردن پروتئین هایی با ویژگی های جدید وظایف اصلی ایجاد یک کتابخانه کلون از توالی های نوکلئوتیدی و آمینو اسیدی بررسی اثرات جایگزینی تکی بقایای اسید آمینه بر تاخوردگی و عملکردهای پروتئین توسعه روش هایی برای اصلاح موثر پروتئین ها برای دادن خواص لازم به آنها روش ها و رویکردهایی را برای غربالگری و انتخاب پروتئین های دارای خواص مورد نیاز توسعه دهید


طراحی منطقی طراحی منطقی نیاز به دانش در مورد سازمان فضایی پروتئین نیاز به دانش در مورد برهمکنش های درون و بین مولکولی نقص روش ها و تجهیزات جهتی با هدف ایجاد پروتئین های جدید از طریق طراحی فضایی آنها

تکامل مستقیم مولکول های پروتئین جهتی است با هدف ایجاد پروتئین های جدید از طریق انتخاب 1 با به دست آوردن کتابخانه ای از توالی های اسید آمینه تصادفی 2 انتخاب زنجیره های پلی پپتیدی که حداقل درجه کمی از خواص مورد نیاز را دارند 3 با استفاده از جهش زایی تصادفی و به دست آوردن کتابخانه جدیدی از پروتئین ها در دور بعدی انتخاب یا استفاده از ساختارهای مهندسی ژنتیکی که پروتئینهای جدید را بیان میکنند، استفاده میشود

تکامل هدایتشده مولکولهای پروتئین (گزینهها) طراحی مجدد منطقی با استفاده از جهشزایی هدایتشده جایگزین باقیماندههای اسید آمینه خاص در مرکز فعال مهندسی آنزیم سطوح پروتئینی با استفاده از جهشها، بخشهایی از زنجیره پلیپپتیدی را در مجاورت باقیماندههای اسید آمینه که نزدیک به هم هستند، تغییر میدهد. سطح گلبول پروتئین، اما در فاصله قابل توجهی در زنجیره پلی پپتیدی جدا از یکدیگر قرار دارد.

غربالگری و انتخاب پروتئینها با ویژگیهای مشخص غربالگری تصادفی انتخاب غربالگری بهبود یافته هر پروتئین برای وجود ویژگیهای مورد نیاز بررسی میشود. انتخاب پروتئین ها از کتابخانه به طور تصادفی انجام می شود؛ هر پروتئین برای وجود خواص مورد نیاز بررسی می شود. انتخاب پروتئین ها از کتابخانه به طور تصادفی رخ می دهد؛ اگر اشیاء تشکیل دهنده کتابخانه از نظر فنوتیپی متفاوت باشند (مثلاً در حضور فعالیت آنزیمی) امکان پذیر است؛ شرایطی برای حفظ انتخابی اجزای کتابخانه ایجاد می شود که دارای آن هستند. خواص معین (فاژ، نمایش سلول)؛ شرایطی برای حفظ انتخابی اجزای کتابخانه ایجاد می شود؛ که دارای ویژگی های خاصی هستند (فاژ، نمایش سلولی) تشخیص پروتئین با خواص مورد نیاز در بین تعداد زیادی از ماکرومولکول های تشکیل دهنده کتابخانه کلون حاصل


نمایش فاژ هدف نمایش پروتئین های خارجی روی سطح فاژ است.این روش در سال 1985 برای باکتریوفاژ رشته ای M13 توسعه یافت. (ژنهای pIII و pVIII مکانهای هدف مناسبی برای وارد کردن قطعه cDNA خارجی هستند) هدف افشای پروتئینهای خارجی در سطح فاژ است.این روش در سال 1985 برای باکتریوفاژ رشتهای M13 توسعه یافت. (ژنهای pIII و pVIII مکانهای هدف مناسبی برای درج یک قطعه cDNA خارجی هستند) یک ژن هیبریدی متشکل از توالیهای کدکننده پروتئین هدف و یکی از پروتئینهای پوشش فاژ توسط باکتریوفاژ ساخته میشود؛ E. coli در طول فاژ آلوده میشود. مونتاژ؛ پروتئین های هیبریدی در ذره فاژ گنجانده شده است

فاگمید کمکی فاژ ژنوم فاژ عفونت E.coli با فاژ کمکی سلول های E.coli که با یک کتابخانه پلاسمید/فاژمید تبدیل شده اند با یک فاژ کمکی آلوده می شوند تا ذرات فاژی به دست آید که روی سطح آن انواع مختلفی از پروتئین هدف قرار می گیرد. سلولهای کولی که با یک کتابخانه پلاسمید/فاژمید تبدیل شدهاند، با فاژ کمکی آلوده میشوند تا ذرات فاژی را به دست آورند که روی سطح آن انواع مختلفی از پروتئین هدف قرار میگیرد.


چشم انداز استفاده عملی از مهندسی پروتئین پزشکی: *برای تولید داروهای جدید. برای ایجاد ابزارهای تشخیصی و تولید واکسن؛ *برای مطالعه مکانیسم های پاسخ ایمنی، و همچنین بیماری های سیستم ایمنی اکولوژی: *برای به دست آوردن کاتالیزورهای زیستی به شکل سلول های کامل با آنزیم های بی حرکت در سطح آنها. *برای به دست آوردن حسگرهای زیستی برای تشخیص و پایش محیطی؛ *برای ایجاد جاذب های زیستی برای حذف مواد سمی و یون های فلزات سنگین از محیط

اندازه گیری گلوکز با استفاده از الکترود آنزیمی (نمایش شماتیک آزمایش ال. کلارک). اکسیداسیون گلوکز توسط آنزیم گلوکز اکسیداز در حضور اکسیژن: گلوکز + O 2 H 2 O 2 + گلوکونو-1،5-لاکتون. H 2 O 2 روی الکترود پلاتین با پتانسیل +700 میلی ولت کاهش می یابد. جریان جریان در مدار با غلظت پراکسید هیدروژن (یعنی به طور غیر مستقیم گلوکز) متناسب است.