فارماکوپه دولتی xiii. تعیین گروه های اصلی مواد فعال بیولوژیکی. احراز هویت برگهای کامل
داروها یک محصول تولیدی خاص هستند که مصرف کننده نمی تواند به طور مستقل کیفیت آن را ارزیابی کند. تضمین کیفیت هر دو داروی تولید شده در روسیه و وارداتی از خارج از کشور یکی از وظایف اصلی دولت در زمینه حفاظت از سلامت عمومی است. ورونیکا اسکورتسوا، وزیر بهداشت در سخنان مقدماتی خود خاطرنشان کرد: مهمترین وظایف نه تنها شامل اشباع بازار دارویی داخلی از این داروها، بلکه ورود به بازار دارویی بین المللی است که می توان با اطمینان از انطباق داروهای داخلی با الزامات استانداردهای جهانی به آن دست یافت. نشریه
ویرایش جدید فارماکوپه دولتی، ویرایش سیزدهم، این مشکلات استراتژیک را حل می کند.
اولین فارماکوپه، که در سال 1765 منتشر شد، به زبان لاتین بود و برای اطمینان از کیفیت داروهای مورد استفاده توسط جراحان در بیمارستان های نظامی طراحی شد. مدیر گروه داروسازی گفت: در سالها، دههها و قرنهای بعد، فارماکوپه داخلی بارها بازنشر شد و محتوای آن مطابق با وضعیت و سطح پیشرفت صنعت داروسازی و سیستم کنترل و صدور مجوز در داخل و خارج از کشور بهروزرسانی شد. تنظیم مقررات دولتی گردش دارو در مقدمه خود. وجوه ارسلان سیندیمیف.
فارماکوپه دولتی ویرایش سیزدهم شامل 229 مقاله عمومی داروسازی و 179 مقاله داروسازی بود.
برای اولین بار، 99 مقاله عمومی داروسازی به فارماکوپه ایالتی ویرایش سیزدهم معرفی شدند که شامل 30 مقاله در مورد روش های تجزیه و تحلیل، 5 مورد در مورد اشکال دارویی و 12 مقاله در مورد روش های تعیین پارامترهای دارویی و تکنولوژیکی اشکال دارویی است. علاوه بر این، 2 مقاله داروسازی عمومی - در مورد مواد خام گیاهی دارویی و 3 - در مورد روش های تجزیه و تحلیل آن، 7 - در مورد گروه های داروهای ایمونوبیولوژیک و 31 - در مورد روش های آزمایش آنها، 3 - در مورد گروه های دارو از خون و پلاسمای خون انسان و حیوان، 9 - در مورد روش های تجزیه و تحلیل فرآورده های دارویی به دست آمده از خون و پلاسمای خون انسان و حیوان.
النا ساکانیان، مدیر مرکز فارمکوپه و همکاری بینالمللی مؤسسه بودجه دولتی فدرال «NTsESMP» خاطرنشان میکند که هدف اصلی که توسط فارماکوپه دولتی فدراسیون روسیه دنبال میشود استانداردسازی کیفیت داروهای در گردش در بازار دارویی داخلی است.
انتشار به موقع فارماکوپه دولتی فدراسیون روسیه، که مطابق با قانون فدرال "در مورد گردش داروها" باید با فرکانس بیش از 1 بار در 5 سال انجام شود، کلید حل مشکل خواهد بود. تضمین مراقبت های پزشکی با کیفیت بالا برای جمعیت کشورمان.
دستور وزارت بهداشت فدراسیون روسیه به شماره 771 مورخ 29 اکتبر 2015، اجرای تک نگاری های عمومی داروسازی و تک نگاری های دارویی موجود در فارماکوپه ایالتی نسخه سیزدهم را از 1 ژانویه 2016 به اجرا درآورد.
مشخص شده است که تک نگاری های عمومی داروسازی و تک نگاری های فارمکوپه تایید شده توسط این دستور، تک نگاری های عمومی داروسازی و تک نگاری های فارمکوپه تایید شده به دستور وزارت بهداشت فدراسیون روسیه در تاریخ 21 نوامبر 2014 شماره 768 "در مورد تایید تک نگاری های عمومی داروسازی و تک نگاری های داروسازی» انتشارات ایالتی فارمکوپه سیزدهم را تشکیل می دهد
تعیین کرد که:
اسناد نظارتی برای محصولات دارویی ثبت شده برای استفاده پزشکی، و همچنین برای محصولات دارویی برای استفاده پزشکی، درخواست های ثبت دولتی که قبل از لازم الاجرا شدن تک نگاری های داروسازی مصوب این دستور، به وزارت بهداشت فدراسیون روسیه ارسال می شود. ، باید قبل از 1 ژانویه 2018 با این تک نگاری های داروسازی مطابقت داده شود.
اسناد نظارتی برای محصولات دارویی ثبت شده برای استفاده پزشکی، و همچنین برای محصولات دارویی برای استفاده پزشکی، درخواست های ثبت دولتی که قبل از لازم الاجرا شدن تک نگاری های عمومی داروسازی تایید شده توسط این، به وزارت بهداشت فدراسیون روسیه ارسال می شود. سفارش، باید تا 1 ژانویه 2019 با این مقالات تک نگاری عمومی داروسازی مطابقت داشته باشد.
فارماکوپه دولتی جدید را می توان در آدرس ایمیل زیر یافت:
تک نگاری های عمومی داروسازی و تک نگاری های فارمکوپه ای فارماکوپه ایالتی فدراسیون روسیه
چاپ سیزدهم
V.A. مرکولوف، E.I. ساکانیان، تی.ب. شمریانکینا، O.A. موچیکینا، N.D. بنیاتیان
موسسه بودجه ای فدرال "مرکز علمی برای تخصص محصولات پزشکی" وزارت بهداشت فدراسیون روسیه، 127051، مسکو، روسیه
خلاصه: فارماکوپه دولتی فدراسیون روسیه مجموعه ای از مقالات عمومی داروسازی و مقالات داروسازی است و حداقل هر 5 سال یک بار قابل انتشار است. نسخه بعدی فارماکوپه دولتی فدراسیون روسیه که برای انتشار در سال 2015 برنامه ریزی شده است، شامل تک نگاری های عمومی داروسازی و تک نگاری های داروسازی است که برای اولین بار در عمل تجزیه و تحلیل فارمکوپه داخلی و در برخی موارد جهانی و همچنین مقالات ایجاد شده اند. که نسخه های به روز شده و اصلاح شده تک نگاری های عمومی داروسازی و تک نگاری های فارمکوپه است. معرفی تک نگاری های فارمکوپه عمومی و تک نگاری های فارمکوپه این نسخه از فارماکوپه دولتی فدراسیون روسیه به طور قابل توجهی سطح تجزیه و تحلیل داروسازی داخلی را افزایش می دهد و از انطباق آن با الزامات استانداردهای جهانی اطمینان حاصل می کند.
کلیدواژه: داروسازی دولتی تک نگاری عمومی فارمکوپه; تک نگاری فارمکوپه; کیفیت داروها؛ تجزیه و تحلیل فارمکوپه
شرح کتابشناختی: Merkulov VA، Sakanyan EI، Shemeryankina TB، Mochikina OA، Bunyatyan ND. مقالات فارمکوپه عمومی و مقالات فارمکوپه ایالتی فارماکوپه فدراسیون روسیه ویرایش سیزدهم. روزنامه مرکز علمی تخصصی فرآورده های پزشکی 2015; (2): 54-58.
تک نگاری های عمومی و تک نگاری های دارویی داروسازی دولتی فدراسیون روسیه، نسخه xIII v.A. مرکولوف، E.I. ساکانیان، تی.ب. شمریانکینا، O.A. موچیکینا، N.D. بنیاتیان
موسسه بودجه دولت فدرال "مرکز علمی ارزیابی تخصصی محصولات دارویی" وزارت بهداشت فدراسیون روسیه، 127051، مسکو، روسیه
چکیده: فارماکوپه دولتی فدراسیون روسیه مجموعه ای از تک نگاری های عمومی و تک نگاری های داروسازی است. حداقل هر 5 سال یکبار باید دوباره منتشر شود. نسخه برنامهریزیشده بعدی فارماکوپه دولتی فدراسیون روسیه برای انتشار در سال 2015 برنامهریزی شده است. این نسخه شامل اولین بار در تجزیه و تحلیل ملی و در برخی موارد، تک نگاریهای کلی و دارویی جهانی آنالیز داروسازی و تکنگنگاریهای اصلاحشده عمومی و دارویی بهروز شده است. اجرای تک نگاری های عمومی و دارویی نسخه ذکر شده از فارماکوپه دولتی فدراسیون روسیه به طور قابل توجهی سطح تجزیه و تحلیل ملی داروسازی را افزایش می دهد و از انطباق آن با استانداردهای بین المللی اطمینان حاصل می کند.
واژههای کلیدی: فارماکوپه دولتی. تک نگاری عمومی; تک نگاری فارمکوپه; کیفیت دارو؛ تجزیه و تحلیل فارمکوپه
شرح کتابشناختی: Merkulov VA، Sakanyan EI، Shemeryankina TB، Mochikina OA، Bunyatyan ND. تک نگاری های عمومی و تک نگاری های فارمکوپه ای فارماکوپه دولتی فدراسیون روسیه، ویرایش سیزدهم. بولتن مرکز علمی ارزیابی تخصصی فرآورده های دارویی 1394; (2): 54-58.
هدف اصلی که توسط فارماکوپه دولتی فدراسیون روسیه (SF RF) دنبال می شود، استانداردسازی کیفیت داروهای در گردش در بازار دارویی داخلی است.
در حال حاضر، صندوق دولتی نسخه X (1968)، صندوق دولتی نسخه XI (بخش 1 - 1987، قسمت 2 - 1989)، و همچنین صندوق دولتی نسخه XII (قسمت 1 - 2007) در حال فعالیت هستند. قلمرو فدراسیون روسیه. تاریخ انتشار مشخص شده برای این انتشارات صندوق جهانی نشان می دهد که آنها با الزامات قانون فدرال فعلی مورخ 12 آوریل 2010 "در مورد گردش داروها" شماره 61-FZ در مورد زمان صدور مجدد نسخه مطابقت ندارند. فارماکوپه دولتی
با وجود این، تک نگاری های فارمکوپه عمومی (GPM) و تک نگاری های فارمکوپه (PS) موجود در نسخه های دولتی فارماکوپه X-X11 لغو نشده اند. برخی از آنها نیاز به بازبینی دارند، برخی از مقالات قبلاً به دلیل کمبود تقاضا ارتباط خود را از دست داده اند. اینها شامل GPM هایی مانند "روش بیولوژیکی برای تعیین فعالیت محلول 0.1٪ آدرنالین هیدروکلراید"، "تست بیولوژیکی" است.
نووارسنول و میارسنول، "تعیین درجه سفیدی داروهای پودری" و غیره. همچنین لازم است FS برای داروهایی که از گردش خارج شده اند لغو شود. علاوه بر این، مواد دارویی تایید شده در طول دوره بین انتشار فارماکوپه ها، که طبق آن شرکت های فردی داروها را تولید می کنند و کیفیت آنها را نظارت می کنند، نیاز به تجدید نظر دارند، زیرا روش های تجزیه و تحلیل فارمکوپه دائما در حال بهبود است.
در حال حاضر، 229 OFS و 179 FS برای گنجاندن در ویرایش سیزدهم بعدی صندوق دولتی فدراسیون روسیه آماده شده است. آنها را می توان به بخش های مناسب تقسیم کرد.
بخش "مقالات عمومی داروسازی" شامل: مقالاتی در مورد روش های عمومی، مونوگرافی های عمومی فارمکوپه در مورد روش های تجزیه و تحلیل، معرف ها، اشکال دارویی و روش های تجزیه و تحلیل آنها. مواد اولیه گیاهان دارویی و روشهای ارزیابی کیفیت آنها؛ گروه های داروهای ایمونوبیولوژیکی و روش های تجزیه و تحلیل آنها؛ فرآورده های دارویی از خون انسان و حیوان و پلاسمای خون و روش های تحلیلی مورد استفاده در ارزیابی کیفیت آنها. رادیوداروها
تک نگاری های فارمکوپه در بخش های "مواد دارویی" و "داروها" ارائه شده است. بخش "مواد دارویی" توسط مقالات داروسازی در مورد مواد دارویی با منشاء مصنوعی یا معدنی ارائه شده است که به عنوان فعال و/یا مواد کمکی استفاده می شود. علاوه بر این، تک نگاری های داروسازی برای مواد خام گیاهی دارویی مورد استفاده در تولید دارو، از جمله فرآورده های گیاهی دارویی، به عنوان یک بخش فرعی جداگانه ارائه شده است. بخش "داروها" شامل دو بخش فرعی است: داروهای ایمونوبیولوژیکی و داروهایی که از خون و پلاسمای انسان به دست می آیند.
ضمائم صندوق دولتی فدراسیون روسیه، ویرایش سیزدهم، با جداول مرجع ارائه شده است: جدول جرم اتمی، جداول الکل-هولومتریک، جدول معادل های ایزوتونیک مواد دارویی برای کلرید سدیم، جدول تعداد قطره ها. در 1 گرم و 1 میلی لیتر و جرم 1 قطره داروی مایع در دمای 20 درجه سانتیگراد با استفاده از قطره سنج استاندارد، نقشه های طیف IR نمونه های استاندارد مواد دارویی.
از این تعداد، برای اولین بار برای فارماکوپه دولتی فدراسیون روسیه، ویرایش سیزدهم، 102 مونوگراف فارماکوپه عمومی تهیه و برای تایید توصیه شد، از جمله 30 مونوگراف فارماکوپه عمومی برای روش های تجزیه و تحلیل، 5 مونوگراف فارماکوپه عمومی برای اشکال دارویی، و 12 مونوگراف فارماکوپه عمومی برای روشهای تعیین پارامترهای دارویی و تکنولوژیک اشکال دارویی، 2 مونوگراف فارمکوپه عمومی برای مواد خام گیاهی دارویی، و 3 مونوگراف فارمکوپه عمومی برای روشهای آنالیز آن، 7 مونوگراف فارمکوپه عمومی، 7 مونوگراف عمومی فارماکوپه ایمونوگراف و 3 گروههای تکنگار immunal immunobilogue. مونوگراف فارمکوپه عمومی برای روش های آزمایش آنها، 3 مونوگراف فارمکوپه عمومی برای گروه های فرآورده های دارویی از خون و پلاسمای انسان و حیوان، 9 مونوگراف فارمکوپه عمومی برای روش های تجزیه و تحلیل فرآورده های دارویی به دست آمده از خون و پلاسمای خون انسان و حیوان.
علاوه بر این، برای گنجاندن در فارماکوپه دولتی فدراسیون روسیه از نسخه سیزدهم، 17 مقاله فارماکوپه برای اولین بار تهیه شد، از جمله 4 FS برای مواد دارویی، 4 FS برای مواد خام گیاهی دارویی، 5 FS برای محصولات دارویی ایمونوبیولوژیک و 4 FS برای محصولات دارویی از خون انسان و پلاسمای خون.
تعدادی از مواد دارویی عمومی که قبلاً در فارماکوپه دولتی اتحاد جماهیر شوروی در نسخه های X و XI ارائه شده بودند (نسخه X و نسخه XI ایالتی فارماکوپه اتحاد جماهیر شوروی، نسخه XI ایالتی فارماکوپه اتحاد جماهیر شوروی) از عمل تجزیه و تحلیل داروسازی مدرن مستثنی شده اند. سایر فارماکوپه های دولتی فعلی OFS و FS نسخه X اتحاد جماهیر شوروی، فارماکوپه ایالتی نسخه XI اتحاد جماهیر شوروی (مسأله 1، 2) و فارماکوپه ایالتی فدراسیون روسیه نسخه دوازدهم (نسخه SF RF XII) تجدید نظر شده و با مصرف مواد تکمیل شده است. الزامات مدرن، دستاوردهای علمی و عملی در زمینه تجزیه و تحلیل فارمکوپه را در نظر بگیرید.
مونوگراف عمومی فارماکوپه "قوانین استفاده از تک نگاری های فارمکوپه" با بخش های "رطوبت" و "ذخیره سازی" تکمیل شده است. علاوه بر این، توضیحات مناسب در بخشهای «توضیحات»، «جرم»، «حجم»، «دما»، «توزین دقیق»، «حلالها»، «شاخصها»، «محدودیتهای محتوا»، «فیلتراسیون» ارائه شده است.
OFS "Sampling" شامل تعاریف اصطلاحات، مقررات کلی است و بخش "Sampling Rules" اضافه شده است. بخش های جدیدی نیز معرفی شده است: «نمونه برداری از داروها و مواد فله
ماهیگیری»، «نمونه برداری از فرآورده های دارویی در بسته بندی مصرف کننده»، «بسته بندی، برچسب گذاری، نگهداری نمونه های انتخابی»، «الزامات محل، تجهیزات و پرسنل نمونه برداری».
OFS "Sieve Analysis" برای جایگزینی نسخه OFS GF XI "تعیین آسیاب پودرها و الک ها" توسعه یافته است و هدف از تجزیه و تحلیل غربال، شرایط و روش های اجرای آن، طبقه بندی اندازه های غربال معمولی مطابق با نیازهای جهان را نشان می دهد. استانداردها
ویرایش جدید مونوگراف عمومی فارمکوپه "عقیم سازی" شامل روش ها و شرایط مدرن فعلی برای عقیم سازی مواد دارویی، داروها، مواد کمکی و غیره، معیاری برای سطح عقیم سازی و شرح شاخص های بیولوژیکی استریلیزاسیون است.
مطابق با دادههای سمیت اضافی، توضیحهایی به مونوگراف عمومی فارمکوپه «حلالهای آلی باقیمانده» داده شده است و اطلاعاتی درباره حلالهایی با سمیت ناکافی اثبات شده اضافه شده است.
در مونوگراف فارمکوپه عمومی «رادیوداروها»، بخش «فهرست شاخصهای کیفی که رادیوداروهای تولید صنعتی و تولید غیرمجاز باید رعایت کنند» گسترش یافته است و بخش «نیمهعمر» با معادلهای برای نیمهعمر تکمیل شده است. منحنی.
مونوگراف عمومی فارماکوپه "مواد دارویی" افزوده های قابل توجهی را به بخش مشخص کننده الزامات کیفیت مواد دارویی (به عنوان مثال، "حلال های آلی باقیمانده"، "اندوتوکسین های باکتریایی یا تب زایی" و غیره اضافه کرده است. تعریف ویرایش شده ای از اصطلاح "مواد دارویی" ارائه شده است. مونوگراف عمومی فارمکوپه با بخشهایی درباره روشهای آنالیز بیولوژیکی تکمیل شده است: «سمیت غیرطبیعی» و «مواد هیستامین و/یا کاهشدهنده». این جدول شامل جداول «محدودیت کنترل، شناسایی و صلاحیت ناخالصیهای مرتبط برای مواد دارویی»، «محدودیتهای کنترل، شناسایی و صلاحیت ناخالصیهای مرتبط در پپتیدهای بهدستآمده مصنوعی» و «معیارهای استانداردسازی محتوای مجاز فلزات سنگین» است.
مونوگراف عمومی فارمکوپه «مدت ماندگاری فرآوردههای دارویی» با بخش «آزمایشهای پایداری با استفاده از روش «پیری تسریعشده» تکمیل شده است.
در مونوگراف عمومی فارماکوپه "واکنش های عمومی به اصالت" بخش "آلومینیوم" اضافه شده است و در مونوگراف عمومی فارمکوپه "روش احتراق در فلاسک با اکسیژن" بخش "سلنیوم" اضافه شده است.
شرح آزمایشات خلوص و حدود مجاز ناخالصی در داروها ادامه دارد. بدین ترتیب برای اولین بار روش هایی برای تعیین ناخالصی های آلومینیوم، فسفات، جیوه و سلنیوم ارائه شده است. روش های تعیین ناخالصی های آمونیوم، کلسیم، آرسنیک، سولفات ها، کلریدها و روی و الزامات نظارتی برای محتوای آنها با الزامات استانداردهای جهانی هماهنگ شده است. مونوگراف فارمکوپه عمومی "فلزات سنگین" علاوه بر این روشهایی را برای تعیین کمی یونهای فردی مشخص میکند، و مونوگراف فارمکوپه عمومی "آهن" حاوی توضیحاتی در مورد غلظت معرفها است.
تعیین فلوئور در داروها به سه روش تیتریمتری، اسپکتروفتومتری و یونومتری توصیه می شود.
علاوه بر تعیین تعداد صابون سازی، تعداد اسید، اتر و ید، ویرایش سیزدهم فارماکوپه دولتی فدراسیون روسیه شامل تک نگاری های دارویی عمومی است که به تعیین تعداد پراکسید، هیدروکسیل و آنیسیدین اختصاص دارد. برخلاف مقدار پراکسید، عدد آنیسیدین محتوای محصولات اکسیداسیون ثانویه (آلدئیدها، کتونها) را در ماده دارویی و/یا محصول دارویی آزمایششده مشخص میکند و بنابراین تصویر کاملی از کیفیت داروی مورد تجزیه و تحلیل ارائه میدهد.
مونوگراف فارمکوپه عمومی "تعیین پروتئین" به طور قابل توجهی تجدید نظر شده است: ساختار مقاله تغییر کرده است، در مورد تعیین مواد تداخلی توضیح داده شده است، شرح روش های اسپکتروفتومتری و رنگ سنجی برای تعیین پروتئین گسترش یافته است، و یک روش فلورمتری برای تعیین پروتئین با استفاده از o-phthalaldehyde معرفی شده است. روشی مانند تعیین پروتئین با معرف نسلر مستثنی است - این روش در یک مونوگراف فارماکوپه عمومی جداگانه "تعیین نیتروژن پروتئین با معرف نسلر با رسوب اولیه مواد پروتئینی در محصولات دارویی ایمونوبیولوژیک" گنجانده شده است.
برای توصیف شاخص اصلی کیفیت داروهای ضد اسید، ویرایش سیزدهم فارماکوپه دولتی فدراسیون روسیه برای اولین بار شامل مونوگراف عمومی فارمکوپه "تعیین توانایی خنثی کننده اسید" بود.
روش های طیف سنجی مدرن برای مطالعه ساختار و کیفیت داروها عبارتند از: طیف سنجی رامان، طیف سنجی فلورسانس اشعه ایکس، طیف سنجی مادون قرمز نزدیک، طیف سنجی مادون قرمز، طیف سنجی فرابنفش و مرئی، طیف سنجی نشر اتمی، فلورمتری، طیف سنجی جرمی مغناطیسی هسته ای، طیف سنجی جرمی مغناطیسی هسته ای، و غیره. با در نظر گرفتن قابلیت های مدرن روش های طیف سنجی، برای اولین بار OFS مانند "طیف سنجی رامان"، "طیف سنجی فلورسانس اشعه ایکس"، "طیف سنجی جرمی" و "طیف سنجی مادون قرمز نزدیک" توسعه یافت.
نیاز به معرفی OFS "Polymorphism" و "Crystallinity" به دلیل ارتباط ارزیابی چندشکلی و درجه بلورینگی یا محتوای بخش آمورف در مواد دارویی است که متعاقباً اثر درمانی داروها را تعیین می کند و به طور قابل توجهی بر پارامترها تأثیر می گذارد. فراهمی زیستی آنها
مونوگراف فارماکوپه عمومی "طیف سنجی گسیل اتمی و طیف سنجی جذب اتمی" ویرایش دوازدهم فارماکوپه دولتی (قسمت 1) به دو تک نگاره فارمکوپه عمومی تقسیم می شود: "طیف سنجی انتشار اتمی" و "طیف سنجی جذب اتمی". نسخه بعدی صندوق دولتی فدراسیون روسیه نسخه اصلاح شده و توسعه یافته مونوگراف فارمکوپه عمومی "طیف سنجی انتشار اتمی" را ارائه خواهد داد.
در ویرایش جدید مونوگراف عمومی فارمکوپه "فلوریمتری"، عبارت تعریف روش به اختصار و تطبیق پذیری بیشتر تغییر یافته است، مواد دارویی که این روش تعیین برای آنها در دسترس است آورده شده است، منابع تشعشعات هیجان انگیز شرح داده شده است. مفهوم تغییر استوکس با توجیه مختصری از علت این پدیده، گروههایی از ترکیبات با خواص فلورسنت ارائه شده است.
ما فهرستی از عوامل موثر بر شدت فلورسانس را اضافه کرده ایم.
برای اولین بار، فارماکوپه دولتی شامل مقالات دارویی عمومی "میکروسکوپ نوری" و "تعیین توزیع اندازه ذرات با پراش نور لیزر" است. بر خلاف روش میکروسکوپی، روش مطالعه سیستم های پراکنده مبتنی بر پراکندگی نور لیزر امکان ارزیابی همه ذرات را فراهم می کند، غیر مخرب است و به شما امکان می دهد اندازه ذرات را در محدوده 0.1 میکرومتر تا 3 میلی متر بر خلاف میکروسکوپ نوری اندازه گیری کنید. ، که برای مشخص کردن ذرات با اندازه های 1 میکرون یا بیشتر استفاده می شود.
دو مقاله جداگانه به کاهش وزن در طول خشک کردن و تعیین آب اختصاص داده شده است. علاوه بر روش نیمه ریز K. Fischer، یک روش کولومتری (micromethod) توضیح داده شده است که امکان کمی سازی ریزمقدارهای آب در داروها را فراهم می کند.
در مونوگراف فارمکوپه عمومی "ویسکوزیته" تعریف مایعات غیر نیوتنی تغییر کرده و شرایط تعیین ویسکوزیته در ویسکومتر چرخشی مشخص شده است. زیر بخش های زیر به عنوان جدید اضافه شده است: "ویسکومتر با یک استوانه متحدالمرکز (ویسکومتر مطلق)"، "ویسکومتر با سیستم مخروطی صفحه (ویسکومتر مطلق)" و "ویسکومتر با یک دوک (ویسکومترهای نسبی)".
توسعه OFS "رسانایی الکتریکی" به دلیل نیاز به گنجاندن این شاخص کیفیت و روش تعیین آن در FS "آب تصفیه شده" و "آب برای تزریق" ایجاد شد.
یک روش جایگزین یا اضافی برای روش های آزمایش کروماتوگرافی، روش الکتروفورز است. هنگام بازنگری مونوگراف فارماکوپه عمومی "الکتروفورز"، توجه ویژه ای به توصیف پرکاربردترین روش در تجزیه و تحلیل دارویی الکتروفورز پروتئین در ژل پلی آکریل آمید با سدیم دودسیل سولفات شد. در مقایسه با الکتروفورز سنتی، معرفی الکتروفورز مویرگی امکان تعیین کمیت خودکار نه تنها مولکولها یا ریزذرات بزرگ باردار، بلکه کاتیونها، آنیونها و ترکیبات خنثی را فراهم کرد.
روش الکتروفورز ژل پلی آکریل آمید به طور گسترده ای در جداسازی پروتئین های مختلف و تخمین وزن مولکولی آنها استفاده می شود. با تغییر غلظت پلی آکریل آمید در ژل، می توانید محدوده وزن مولکولی پروتئین های جدا شده را کنترل کنید که برای به دست آوردن نتایج دقیق بسیار راحت است. تکه تکه کردن مولکول های پروتئین با استفاده از این روش به طور گسترده ای برای کنترل کیفیت داروهای پروتئینی استفاده می شود.
برای اولین بار، تجزیه و تحلیل عنصری خودکار در عمل تجزیه و تحلیل فارمکوپه داخلی معرفی می شود، که این امکان را به طور قابل توجهی ساده می کند تجزیه و تحلیل ترکیبات آلی حاوی نیتروژن، گوگرد، کلر، برم، اکسیژن و سایر عناصر. این تعیین بر اساس تجزیه اکسیداتیو در دمای بالا مواد مورد مطالعه و تعیین انتخابی بعدی محصولات تجزیه مربوط به این عناصر با استفاده از کروماتوگرافی گازی است. یکی از مزایای آنالیز عنصری خودکار، امکان استفاده از یک نمونه استاندارد با محتوای مشخص عنصر تعیین شده برای ارزیابی کیفیت داروهای مختلف برای این عنصر است.
تعیین فعالیت جذبی انتروسوربنت ها شاخص خاصی از کیفیت این دسته از داروها است. فعالیت جذب برای توصیف ظرفیت جذب انتروجاذب ها استفاده می شود؛ روش های تعیین آن در این مونوگراف فارمکوپه عمومی منعکس شده است.
مقالاتی که روشهای بیولوژیکی برای کنترل کیفیت داروها را توصیف میکنند در ویرایش سیزدهم صندوق دولتی فدراسیون روسیه با رویکرد مدرن آزمایش بیولوژیکی مطابقت دارد. مونوگراف فارمکوپه عمومی "اندوتوکسین های باکتریایی" برای اولین بار شرحی از روش های فتومتریک برای تعیین اندوتوکسین های باکتریایی را معرفی می کند: کدورت سنجی و کروموژنیک.
از مونوگراف عمومی فارمکوپه "روش های بیولوژیکی برای ارزیابی فعالیت مواد خام گیاهی دارویی و آماده سازی های دارویی حاوی گلیکوزیدهای قلبی"، در طی بازبینی آن، روش ارزیابی بیولوژیکی محتوای گلیکوزیدهای قلبی انجام شده بر روی گربه ها حذف شد.
مونوگراف عمومی فارمکوپه "خلوص میکروبیولوژیکی" به طور قابل توجهی بهبود یافته و با بخش های جدید، از جمله مواردی که در مورد الزامات محصولات دارویی ایمونوبیولوژیکی هستند، تکمیل شده است.
بازنگری مونوگراف عمومی فارمکوپه "تعیین اثربخشی نگهدارنده های ضد میکروبی" این امکان را فراهم کرد تا اضافات و توضیحات مناسبی را در مورد دسته بندی داروهای حاوی مواد نگهدارنده و معیارهای ارزیابی اثربخشی نگهدارنده های ضد میکروبی در داروها معرفی کنیم.
بازنگری مونوگراف فارمکوپه عمومی “Reagents. اندیکاتورها منجر به افزایش قابل توجهی در فهرست معرف ها و شاخص های مورد استفاده در تجزیه و تحلیل داروسازی شد. نام شیمیایی معرف ها و شاخص ها مطابق با الزامات اتحادیه بین المللی شیمی محض و کاربردی (IUPAC) ارائه شده است. شماره های ثبت CAS (خدمات چکیده های شیمیایی) مواد شیمیایی موجود در ثبت خدمات خلاصه های شیمیایی نشان داده شده است. توضیحات و اضافات به فرمول های شیمیایی و پارامترهای فیزیکی معرف ها و نشانگرها داده شده است.
هنگام تجدید نظر در فارماکوپه عمومی، "پردازش آماری نتایج آزمایش های شیمیایی و آزمایش های بیولوژیکی" به دو فارماکوپه عمومی تقسیم شد: "پردازش آماری نتایج یک آزمایش شیمیایی" و "پردازش آماری نتایج تعیین فعالیت دارویی خاص". داروها با روش های بیولوژیکی.
برای اولین بار، ویرایش سیزدهم صندوق دولتی فدراسیون روسیه مواد دارویی عمومی مانند "اشکال دارویی"، "اشکال دوز برای استنشاق"، "لکه های ترانس درمال"، "محلول ها" و "گرانول های فشرده شده" را توسعه داد و گنجاند. ".
مونوگراف فارمکوپه عمومی "اشکال دوز" شامل اصطلاحات و تعاریف اساسی، طبقه بندی اشکال دارویی، الزامات عمومی برای تولید/ساخت، ارزیابی کیفیت، بسته بندی، برچسب زدن و نگهداری داروها در اشکال دوز مناسب است. این مونوگراف عمومی فارماکوپه حاوی شاخصهای کیفی است که برای ارزیابی کیفیت یک فرآورده دارویی در هر شکل دارویی و همچنین شاخصهای کیفیتی که ویژگیهای تولید/تولید محصول دارویی و مواد فعال و کمکی آن را مشخص میکند، اجباری است.
17 مونوگراف فارمکوپه عمومی برای اشکال دارویی برای جایگزینی مقالات مربوطه از صندوق دولتی اتحاد جماهیر شوروی، ویرایش XI، با اضافات و تغییرات ایجاد شده در آنها معرفی شد.
اکثر مونوگراف های فارمکوپه عمومی برای روش های ارزیابی شاخص های دارویی و تکنولوژیکی کیفیت فرم های دارویی برای اولین بار در نسخه سیزدهم فارماکوپه دولتی فدراسیون روسیه گنجانده شده است. OFS جداگانه برای روش های تجزیه و تحلیل که قبلاً در مقالات ایالت فارماکوپه XI برای اشکال دارویی توضیح داده شده بود (روش هایی برای تعیین حجم قابل استخراج اشکال دارویی برای استفاده تزریقی، ساییدگی قرص ها، زمان تغییر شکل کامل شیاف های مبتنی بر چربی دوست، تجزیه قرص و کپسول).
برای اولین بار در صندوق دولتی فدراسیون روسیه در نسخه سیزدهم مونوگراف فارمکوپه عمومی برای روش هایی برای تعیین شاخص های کیفیت دارویی و تکنولوژیکی فرم های دارویی به عنوان "شاخص های مکانیکی قابل مشاهده در فرم های دارویی برای استفاده تزریقی و چشمی" توسعه یافته و گنجانده شده است. اشکال دارویی، "ادخال های مکانیکی نامرئی در فرم های دارویی برای استفاده تزریقی"، "وزن (حجم) محتویات بسته، "یکنواختی دوز"، "یکنواختی توده اشکال دارویی"، "قدرت له شدن قرص، «تجزیه شیاف ها و قرص های واژینال»، «انحلال برای شیاف های لیپوفیلیک»، «درجه روان پذیری پودرها»، «انحلال برای چسب های ترانس درمال».
بخش فرعی "مواد خام گیاهی دارویی و روش های تجزیه و تحلیل آن" شامل 23 فارماکوپه عمومی و 55 FS است. الزامات مربوط به نمونهبرداری، ذخیرهسازی، بستهبندی، برچسبگذاری و حمل و نقل مواد خام گیاهی دارویی و فرآوردههای گیاهی دارویی در بخش فرعی «مقالات عمومی» در مونوگراف عمومی فارمکوپه «نمونهبرداری از مواد خام گیاهی دارویی و فرآوردههای گیاهی دارویی»، General Pharmacopoeiano ارائه شده است. «نگهداری مواد اولیه گیاهان دارویی و فرآوردههای گیاهی دارویی» و مونوگراف عمومی فارمکوپه «بستهبندی، برچسبگذاری و حمل و نقل مواد اولیه گیاهی دارویی و فرآوردههای گیاهی دارویی».
الزامات عمومی برای مواد اولیه گیاهان دارویی در مونوگراف عمومی فارمکوپه "مواد خام گیاهی دارویی" آمده است. 12 OFS به روش های تجزیه و تحلیل مواد گیاهی دارویی و فرآورده های گیاهی دارویی اختصاص دارد. 8 مونوگراف های فارمکوپه عمومی الزامات روش های تجزیه و تحلیل مواد گیاهی دارویی را بسته به گروه های مورفولوژیکی توصیف می کنند: گل ها، میوه ها، دانه ها، جوانه ها، گیاهان، برگ ها، پوست و اندام های زیرزمینی. این بخش همچنین 2 مونوگراف عمومی فارمکوپه برای فرآورده های دارویی با منشاء گیاهی را ارائه می دهد: مونوگراف عمومی فارمکوپه "روغن های چرب گیاهی" و "روغن های ضروری".
مونوگراف عمومی فارمکوپه "مواد خام گیاهی دارویی" برای اولین بار در صندوق دولتی فدراسیون روسیه ایجاد و گنجانده شد. این مقاله طبقه بندی مواد اولیه گیاهان دارویی را بسته به گروه های مورفولوژیکی، آسیاب کردن، محتوای یک یا گروه دیگر از مواد فعال بیولوژیکی ارائه می دهد، شاخص های اصلی کیفیت مواد خام گیاهی دارویی و الزامات عمومی برای ذخیره سازی و بسته بندی را ارائه می دهد.
از 12 مونوگراف عمومی فارماکوپه برای روش های تجزیه و تحلیل مواد خام گیاهی دارویی، 3 مونوگراف فارماکوپه عمومی برای اولین بار در صندوق دولتی فدراسیون روسیه در ویرایش سیزدهم گنجانده شده است، 9 مونوگراف فارماکوپه عمومی تجدید نظر شده و برای جایگزینی معرفی شده اند. مقالات صندوق دولتی اتحاد جماهیر شوروی در چاپ یازدهم. برای اولین بار در عمل تجزیه و تحلیل فارمکوپه داخلی گنجانده شد: مونوگرافی عمومی فارمکوپه "تعیین محتوای فلزات سنگین و آرسنیک در مواد اولیه گیاهان دارویی و گیاهان دارویی"
فرآوردههای دارویی، مونوگراف عمومی فارمکوپه «تعیین محتوای باقیمانده آفتکشها در مواد خام گیاهی دارویی و فرآوردههای گیاهی دارویی»، مونوگراف عمومی فارمکوپه «تعیین ضریب جذب آب و ضریب مصرف مواد خام گیاهی دارویی».
ویرایش سیزدهم صندوق دولتی فدراسیون روسیه شامل انواع جدیدی از مواد خام گیاهی دارویی است که برای مصارف پزشکی تأیید شده است، مانند میوه های خشک chokeberry، برگ های جینکو بیلوبا، علف شبدر شیرین و جوانه های صنوبر. ساختار تک نگاری های داروسازی مواد اولیه گیاهان دارویی با الزامات استانداردهای جهانی فارماکوپه برای مواد اولیه گیاهان دارویی هماهنگ شده است.
بخش فرعی "گروه های محصولات دارویی ایمونوبیولوژیکی و روش های تجزیه و تحلیل آنها" شامل 43 مونوگراف فارمکوپه عمومی و 48 FS برای داروهای ایمونوبیولوژیکی است.
IMP ها شامل واکسن ها، سموم، سرم ها و آلرژن ها هستند.
برای اولین بار، عمل تجزیه و تحلیل دارویی داخلی OFS را برای گروه های فردی ILP، مانند "باکتریوفاژهای درمانی و پیشگیری کننده"، "پروبیوتیک ها"، "پروبیوتیک های حاوی بیفید"، "پروبیوتیک های حاوی کولاکس"، "لاکتوز" معرفی کرد. - حاوی پروبیوتیکها، «پروبیوتیکهای حاوی اسپور» و «داروهای بهدستآمده از روشهای DNA نوترکیب».
از 48 FS برای IMP موجود در ویرایش سیزدهم صندوق دولتی فدراسیون روسیه، 5 FS برای اولین بار در عمل تجزیه و تحلیل فارمکوپه داخلی ایجاد شد: "واکسن اسهال خونی علیه لیپوپلی ساکارید شیگلا سون"، "واکسن سرخجه کشت شده زنده". "، "واکسن غیرفعال آبله"، "ایمونوگلوبولین آبله انسانی" " FS "شیافهای پیروژنال، رکتوم" برای اولین بار در عمل تجزیه و تحلیل دارویی داخلی و جهانی توسعه یافت.
داروهای خون و پلاسمای خون انسان و حیوانات با 13 OFS و 8 FS نشان داده می شود.
فرآورده های دارویی از خون و پلاسمای خون انسان شامل آماده سازی آلبومین انسانی است
کا، فرآورده های ایمونوگلوبولین انسانی و فرآورده های فاکتور انعقاد خون حاوی یکی از فاکتورهای انعقاد خون یا ترکیبی از آنها.
12 مونوگراف فارماکوپه عمومی برای محصولات دارویی از خون انسان و حیوان و پلاسمای خون در ویرایش سیزدهم فارماکوپه دولتی فدراسیون روسیه برای اولین بار ارائه شده است.
تک نگاری های داروسازی برای مواد دارویی با منشاء مصنوعی و معدنی حاوی نام های شیمیایی مواد دارویی مطابق با الزامات اتحادیه بین المللی شیمی خالص و کاربردی (IUP)، شاخص های کیفیت، مقادیر استاندارد شده آنها و روش های مربوطه برای تجزیه و تحلیل این شاخص ها است. .
روش طیف سنجی مادون قرمز که مطمئن ترین نتیجه را می دهد، به عنوان روش اصلی شناسایی در نظر گرفته می شود. برای تعدادی از مواد، ویرایش سیزدهم ضمیمه صندوق دولتی فدراسیون روسیه شامل نقشه هایی از طیف IR نمونه های استاندارد این مواد دارویی است.
برای تعیین کمی، اولویت به روش های کلاسیک تیترومتری آنالیز داده می شود. در کنار این، روشهای مدرن آنالیز فیزیکی و شیمیایی، مانند طیفسنجی در ناحیه فرابنفش، گاز و کروماتوگرافی مایع با کارایی بالا که شامل استفاده از نمونههای استاندارد میشود، به طور گسترده مورد استفاده قرار میگیرد. محتوای ماده فعال به صورت خشک (اگر کاهش وزن در هنگام خشک کردن مشخص شود)، بی آب (در صورت تعیین آب) یا یک ماده بی آب که حاوی حلال های آلی باقیمانده نیست داده می شود.
بنابراین، معرفی مونوگراف فارمکوپه عمومی و FS تهیه شده برای ویرایش سیزدهم بعدی صندوق دولتی فدراسیون روسیه نه تنها مقالات منسوخ شده صندوق دولتی فدراسیون روسیه نسخه های قبلی را لغو یا جایگزین می کند، بلکه همچنین اطمینان حاصل خواهد کرد که سطح تجزیه و تحلیل دارویی داخلی با الزامات استانداردهای جهانی مطابقت دارد.
ادبیات
1. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش دهم م.: پزشکی; 1968.
2. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش یازدهم جلد 1. م.: طب; 1987.
3. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش یازدهم جلد 2. م.: طب; 1989.
4. فارماکوپه دولتی فدراسیون روسیه. ویرایش دوازدهم بخش 1. م.: مرکز علمی تخصصی محصولات پزشکی; 2007.
موسسه بودجه ای فدرال "مرکز علمی تخصصی محصولات پزشکی" وزارت بهداشت فدراسیون روسیه. فدراسیون روسیه، 127051، مسکو، بلوار پتروفسکی، 8.
مرکولوف وادیم آناتولیویچ. معاون اول مدیر کل، دکتر med. علوم، استاد
ساکانیان النا ایوانونا. مدیر مرکز فارمکوپه و همکاری های بین المللی دکتر فارم. علوم، استاد
شمریانکینا تاتیانا بوریسوونا. رئیس بخش فارمکوپه و تجزیه و تحلیل فارمکوپه ایالتی، Ph.D. داروخانه علمی موچیکینا اولگا آلکسیونا. محقق دپارتمان فارماکوپه و آنالیز فارمکوپه ایالتی.
بونیاتیان ناتالیا دمیتریونا. معاون پژوهشی مدیر کل، دکتر فارم. علوم، استاد
1. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش دهم مسکو: مدیتسینا; 1968 (به روسی).
2. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش یازدهم V. 1. مسکو: مدیتسینا; 1987 (به روسی).
3. فارماکوپه دولتی اتحاد جماهیر شوروی. ویرایش یازدهم V. 2. مسکو: مدیتسینا; 1989 (به روسی).
4. فارماکوپه دولتی فدراسیون روسیه. چاپ دوازدهم V. 1. مسکو: موسسه بودجه دولت فدرال "مرکز علمی ارزیابی تخصصی محصولات دارویی" وزارت بهداشت فدراسیون روسیه. 2007 (به روسی).
موسسه بودجه ای فدرال "مرکز علمی ارزیابی تخصصی محصولات دارویی" وزارت بهداشت فدراسیون روسیه، بلوار پتروفسکی 8، مسکو، 127051، فدراسیون روسیه.
مرکولوف V.A. معاون اول مدیرکل. دکترای علوم پزشکی، استاد. ساکانیان EI. مدیر مرکز فارمکوپه و همکاری های بین المللی. دکترای علوم دارویی، استاد.
شمریانکینا سل. رئیس بخش فارمکوپه و تجزیه و تحلیل فارمکوپه ایالتی. کاندیدای علوم دارویی.
موچیکینا O.A. محقق دپارتمان دولتی فارماکوپه و تجزیه و تحلیل فارمکوپه.
بونیاتیان ND. معاون مدیرکل امور علمی. دکترای علوم دارویی، استاد.
وزارت بهداشت فدراسیون روسیه
مقاله داروسازی
جینسینگحاضرریشه هاFS.2.5.0013.15
پاناسیس جینسینگ رادیک ها در ازای صندوق جهانیXI، جلد 2، هنر 66
جمع آوری شده در اواخر اوت - اوایل سپتامبر و ریشه های خشک شده گیاه علفی و چند ساله جینسنگ واقعی - پاناکس جینسینگ سی. آ. می، سم. Araliaceae – Araliaceae.
اعتبار
نشانه های بیرونی مواد اولیه کامل.ریشه ها تا 25 سانتی متر طول، 0.7-2.5 سانتی متر ضخامت، با 2-5 شاخه بزرگ، کمتر بدون آنها. ریشه ها ریشه دار، طولی، کمتر چروکیده مارپیچی، شکننده، با شکستگی یکنواخت هستند. "بدن" ریشه ضخیم است، تقریباً استوانه ای، با ضخامت های حلقوی به وضوح مشخص در بالا. در قسمت بالایی ریشه یک ریزوم عرضی چروکیده باریک وجود دارد - "گردن". ریزوم کوتاه با چندین زخم از ساقه های افتاده است؛ در بالا یک "سر" را تشکیل می دهد که باقیمانده منبسط شده ساقه و یک جوانه آپیکال است (گاهی 2-3). گاهی اوقات یک یا چند ریشه فرعی از "گردن" خارج می شود. ممکن است "گردن" و "سر" وجود نداشته باشد. رنگ ریشه ها در سطح و روی برش زرد مایل به سفید است، در یک شکستگی تازه سفید است. بو خاص است. طعم عصاره آب شیرین، تند و سپس تند و تلخ است.
مواد خام خرد شده.هنگام بررسی مواد خام خرد شده در زیر ذره بین (10×) یا میکروسکوپ استریو (16×)، تکه هایی از ریشه ها با اشکال مختلف قابل مشاهده هستند که از غربال با سوراخ های 7 میلی متری عبور می کنند. رنگ روی سطح و روی شکستگی زرد مایل به سفید است. بو خاص است. طعم عصاره آب شیرین، تند و سپس تند و تلخ است.
پودر. هنگام بررسی پودر زیر ذره بین (10×) یا میکروسکوپ استریو (16×)، مخلوطی از ذرات خرد شده ریشه با اشکال مختلف به رنگ زرد مایل به سفید قابل مشاهده است که از غربال با سوراخ های 2 میلی متری عبور می کند. بو خاص است. طعم عصاره آب شیرین، تند و سپس تند و تلخ است.
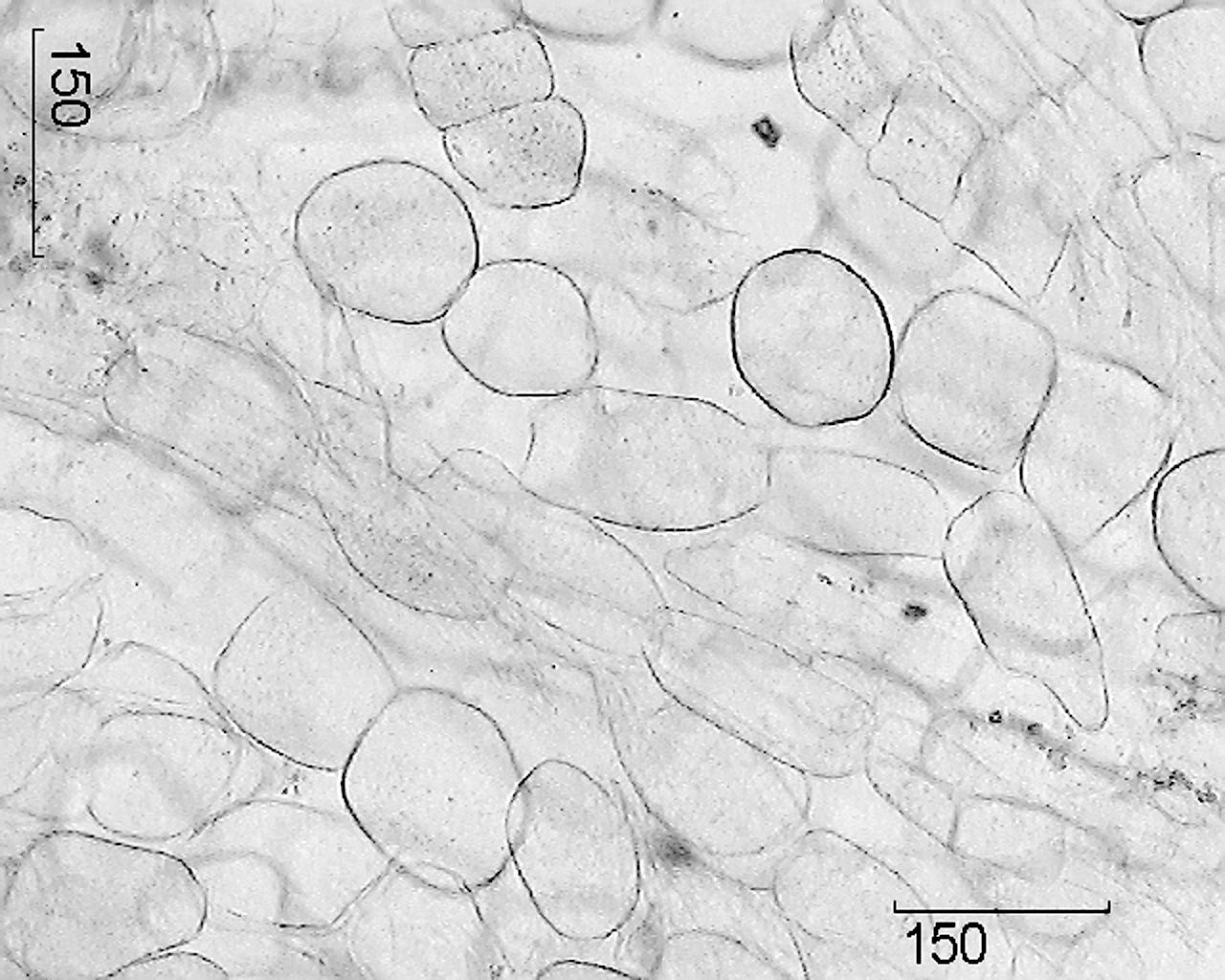
علائم میکروسکوپی مواد اولیه کامل.برش عرضی ریشه اصلی یک لایه باریک از پلاگین قهوه ای روشن، پوست پهن، خط کامبیوم شفاف و چوب را نشان می دهد.
ریشه اصلی با پریدرم پوشیده شده است که سلول های آن جدار نازک و lignified و غیر ساب می باشد. آبکش و آوند چوبی توسط ناحیه کامبیال از هم جدا می شوند که تقریباً از وسط شعاع ریشه می گذرد و
گاهی دیده نمی شود پرتوهای شعاعی اولیه بافت پارانشیم با سلول های بزرگ از آوند چوبی اولیه که بین آن آوند چوبی ثانویه وجود دارد که توسط پرتوهای شعاعی ثانویه متعددی از پارانشیم اصلی قطع می شود، به سمت حاشیه گسترش می یابد. آوند چوبی از سلول های پارانشیم جدار نازک حاوی دانه های نشاسته تشکیل شده است. رگ های پرتوهای مدولاری دارای دیواره های ضخیم و صاف هستند و به صورت مجزا یا در گروه های 3-6 جمع آوری شده اند. سلول های حاوی رنگدانه های زرد گاهی در پارانشیم چوب یافت می شوند. در مرکز ریشه بقایای آوند چوبی اولیه به شکل 2 پرتو به طور مبهم قابل تشخیص است. آبکش عمدتاً از عناصر کوچک سلولی تشکیل شده است؛ حاوی ظروف اسکیزوژنیک به وضوح قابل مشاهده است که حاوی قطرات ترشح از زرد روشن تا قرمز مایل به قهوه ای است. دانه های نشاسته کوچک، گرد، ساده هستند. سلول های پارانشیم منفرد حاوی دروسن اگزالات کلسیم هستند. قسمت بیرونی قشر ثانویه با ناحیه ای از چندین ردیف (4 تا 6) از سلول های پارانشیم دراز مماس بزرگ فلودرم، گرد یا بیضی شکل، با پوسته ای کمی ضخیم، هم مرز است.
|
|
||
|
|
|
|
|
|
|
|
تصویر – ریشه های واقعی جینسینگ.
1 - قطعه ای از مقطع ریشه اصلی (100×)؛ 2 – قطعه چوب پنبه (400×)؛ 3 – قطعه مقطع ریشه فرعی: الف – آوند چوبی، ب – دانه های نشاسته (400×). 4 – قطعه مقطع ریشه اصلی با کانال ترشحی: الف – سلولهای پوششی کانال، ب – حفره کانال (400×). 5 – قطعه پارانشیم پرتوهای مدولاری: الف – دروسن اگزالات کلسیم، ب – دانه های نشاسته (400×). 6- سلول های پارانشیم پرتو مدولاری (100×).
بر روی مقطعی از یک ریشه فرعی، در مرکز، پرتوی از رگهای آوند چوبی اولیه، بقایای دسته آوندی دیارشیک در ساختار اولیه است. دو بخش آوند چوبی ثانویه توسط پرتوهای شعاعی پارانشیم اصلی از هم جدا می شوند. سلول های پارانشیم گرد یا بیضی شکل هستند که تا حدی یا به طور کامل با دانه های نشاسته پر شده اند. چوب پنبه از 5 تا 7 لایه سلول های مستطیلی با دیواره نازک تشکیل شده است که به طور ضعیفی چسبیده اند.
مواد خام خرد شده. هنگام بررسی یک نمونه فشرده، قطعاتی از مقاطع عرضی و طولی ریشه های اصلی و فرعی باید قابل مشاهده باشند.
قطعات ریشه اصلی با پرتوهای آوند چوبی و عروق، پر کردن سلولهای پارانشیم پرتوهای مدولاری با دانههای نشاسته، حفرههای کانال و سلولهای پوششی، سلولهای پارانشیم با رنگدانهها و سلولهای کامبیوم نشان داده میشوند.
قطعات ریشه ناخواسته توسط سلول های پلاگین، پارانشیم با دانه های نشاسته، مخازن، قشر اولیه و ثانویه، عروق، پرتوهای مدولاری نشان داده می شود.
پودر.هنگام بررسی میکرو اسلاید، قطعاتی از اپیدرم، چوب پنبه، چوب، پارانشیم و همچنین دروسن اگزالات کلسیم قابل مشاهده است.
تعیین گروه های اصلی مواد فعال بیولوژیکی
کروماتوگرافی لایه نازک
در خط شروع یک صفحه کروماتوگرافی تحلیلی با لایه ای از سیلیکاژل با یک نشانگر فلورسنت به اندازه 10 × 15 سانتی متر بر روی یک بستر آلومینیومی، 20 میکرولیتر از محلول آزمایش را اعمال کنید (به بخش "تعیین کمی" مراجعه کنید، آماده سازی محلول A محلول آزمایش) و 50 میکرولیتر از محلول نمونه استاندارد (SS) پاناکسوزید Rg 1 (به بخش "تعیین کمی" تهیه محلول A CO پاناکسوسید Rg 1 مراجعه کنید). صفحه با نمونه های اعمال شده در هوا خشک می شود، در یک محفظه قرار می گیرد، حداقل 2 ساعت با مخلوط حلال کلروفرم - متانول - آب (26:14:3) از قبل اشباع می شود و با استفاده از روش صعودی کروماتوگرافی می شود. هنگامی که قسمت جلوی حلال حدود 80 تا 90 درصد طول صفحه را از خط شروع عبور می دهد، از محفظه خارج می شود، خشک می شود تا اثری از حلال ها از بین برود، با اسید فسفو تنگستیک با محلول الکل 20 درصد درمان می شود و در یک محفظه گرم می شود. فر با دمای 100 تا 105 درجه سانتیگراد به مدت 3 دقیقه و پس از آن در نور روز مشاهده می شود.
کروماتوگرام محلول آزمایش باید حداقل 6 ناحیه جذب را از صورتی روشن تا صورتی تیره نشان دهد. منطقه غالب در سطح منطقه در کروماتوگرام محلول CO پاناکسوزید Rg 1 است. تشخیص سایر مناطق جذب مجاز است.
هنگامی که یک قطره اسید سولفوریک غلیظ بعد از 1 تا 2 دقیقه روی پودر ریشه جینسنگ ریخته می شود، رنگ قرمز آجری ظاهر می شود که به قرمز-بنفش و سپس بنفش (پاناکسوزیدها) تبدیل می شود.
تست ها
رطوبت. مواد اولیه کامل مواد خام خرد شده، پودر –بیش از 13٪ نیست.
خاکستر معمولی مواد اولیه کامل مواد خام خرد شده، پودر –بیش از 5٪ نیست.
خاکستر، نامحلول در اسید هیدروکلریک. مواد اولیه کامل مواد خام خرد شده، پودر –بیش از 2٪ نیست.
آسیاب کردن مواد اولیه.مواد اولیه کامل:ذرات عبوری از یک غربال با سوراخ هایی به اندازه 3 میلی متر - حداکثر 5٪. مواد خام خرد شده:ذراتی که از غربال با سوراخ هایی به اندازه 7 میلی متر عبور نمی کنند - بیش از 5٪. ذرات عبور از یک غربال با سوراخ های اندازه گیری 0.5 میلی متر - بیش از 5٪. پودر:ذراتی که از غربال با سوراخ هایی به اندازه 2 میلی متر عبور نمی کنند - بیش از 5٪. ذرات عبوری از یک غربال با سوراخ هایی به اندازه 0.18 میلی متر - حداکثر 5٪.
ماده خارجی
ریشه ها از سطح تیره شده اند . مواد اولیه کامل مواد خام خرد شده -بیش از 3٪ نیست.
ناخالصی آلی مواد اولیه کامل مواد خام خرد شده -بیش از 0.5٪ نیست.
ناخالصی معدنی . مواد خام کامل، مواد خام خرد شده، پودر –بیش از 1٪ نیست.
فلزات سنگین. مطابق با الزامات مونوگراف عمومی فارمکوپه «تعیین محتوای فلزات سنگین و آرسنیک در مواد گیاهی دارویی و فرآوردههای گیاهی دارویی».
رادیونوکلئیدهامطابق با الزامات مونوگراف عمومی فارمکوپه "تعیین محتوای رادیونوکلئید در مواد گیاهی دارویی و فرآورده های گیاهی دارویی".
بقایای آفت کش ها. مطابق با الزامات مونوگراف عمومی فارمکوپه "تعیین محتوای باقیمانده آفت کش ها در مواد گیاهی دارویی و فرآورده های گیاهی دارویی".
خلوص میکروبیولوژیکیمطابق با الزامات مونوگراف عمومی فارمکوپه "خلوص میکروبیولوژیکی".
کمی سازی. مواد اولیه کامل مواد خام خرد شده، پودر:مقدار پاناکسوزیدها از نظر پاناکسوزید Rg 1 - حداقل 2٪. مواد استخراجی استخراج شده با 70٪ الکل - حداقل 20٪.
("فارماکوپه دولتی فدراسیون روسیه. ویرایش سیزدهم. جلد اول")
این مقاله عمومی داروسازی الزامات عمومی را برای ذخیره سازی مواد دارویی، مواد کمکی و فرآورده های دارویی تعیین می کند و با در نظر گرفتن نوع فعالیت سازمان، برای کلیه سازمان هایی که در آنها ذخیره سازی فرآورده های دارویی انجام می شود، اعمال می شود.
ذخیره سازی مواد خام گیاهی دارویی و فرآورده های گیاهی دارویی مطابق با مونوگراف عمومی فارمکوپه "ذخیره سازی مواد خام گیاهی دارویی و فرآورده های گیاهی دارویی" انجام می شود.
ذخیره سازی- فرآیند نگهداری داروها تا زمان مصرف آنها در تاریخ انقضای تعیین شده، که بخشی جدایی ناپذیر از گردش داروها است.
الزامات عمومی برای تأسیسات ذخیره سازی
داروها و سازماندهی نگهداری آنها
نگهداری داروها باید در محل هایی که برای این منظور در نظر گرفته شده است انجام شود. طراحی، ترکیب، ابعاد مناطق نگهداری، عملکرد و تجهیزات آنها باید شرایط نگهداری مناسب را برای گروه های مختلف دارو تضمین کند.
مجموعه انبارها باید شامل موارد زیر باشد:
- اتاق پذیرش (منطقه) در نظر گرفته شده برای باز کردن و دریافت بسته های داروها و بازرسی اولیه آنها.
- اتاق (منطقه) برای نمونه برداری از محصولات دارویی مطابق با الزامات مونوگراف عمومی فارمکوپه "نمونه برداری"؛
- اتاق (منطقه) برای نگهداری داروها در قرنطینه؛
- محل برای داروهایی که به شرایط نگهداری خاص نیاز دارند.
- اتاق (منطقه) برای نگهداری داروهای رد شده، بازگردانده شده، فراخوان شده و/یا تاریخ مصرف گذشته داروهای مشخص شده و محل نگهداری آنها باید به وضوح مشخص شود.
فضای ذخیره سازی در یک انبار مشترک در صورت عدم وجود یک اتاق مجزا اختصاص داده شده است.
تکمیل محل نگهداری داروها باید الزامات بهداشتی و بهداشتی فعلی را برآورده کند؛ سطوح داخلی دیوارها و سقف ها باید صاف باشد و امکان تمیز کردن مرطوب را فراهم کند.
در هر اتاق ذخیره سازی، حفظ شرایط آب و هوایی، رعایت دما و رطوبت تعیین شده توسط مونوگراف داروسازی یا اسناد نظارتی برای داروها ضروری است.
تبادل هوای لازم در اتاق های انبار با استفاده از تهویه مطبوع، تهویه تامین و اگزوز یا سایر تجهیزات ایجاد می شود. نورپردازی طبیعی و مصنوعی در اتاق های انبار باید اجرای دقیق و ایمن کلیه عملیات انجام شده در اتاق را تضمین کند. در صورت لزوم، محافظت از محصولات دارویی در برابر تشعشعات خورشیدی باید ارائه شود.
محل نگهداری داروها باید به تعداد مورد نیاز ابزار اندازه گیری تایید شده (دما سنج، رطوبت سنج، روان سنج و غیره) برای نظارت و ثبت دما و رطوبت، حداقل یک بار در روز مجهز باشد.
ابزارهای اندازه گیری در فاصله حداقل 3 متری از درها، پنجره ها و وسایل گرمایشی در مکانی قابل دسترسی برای خواندن در ارتفاع 1.5-1.7 متر از کف قرار می گیرند. در عین حال، توصیه می شود آنها را در مکان هایی قرار دهید که بیشترین احتمال نوسانات دما و رطوبت وجود دارد یا انحراف از پارامترهای مورد نیاز اغلب مشاهده می شود.
سوابق ثبت باید شرایط دما و رطوبت ایجاد شده برای محل و در صورت عدم رعایت آنها، اقدامات اصلاحی را نشان دهد.
محل نگهداری باید به تعداد کافی کابینت، گاوصندوق، قفسه، واحد ذخیره سازی و پالت مجهز باشد. تجهیزات باید سالم و تمیز باشند.
قفسه ها، کابینت ها و سایر تجهیزات باید به گونه ای نصب شوند که دسترسی به داروها، عبور آزادانه پرسنل و در صورت لزوم دسترسی به عملیات بارگیری و تخلیه و همچنین دسترسی به تجهیزات، دیوارها و کف اتاق تضمین شود. برای تمیز کردن
شرایط بهداشتی مناسب در محل نگهداری داروها باید رعایت شود. فرکانس و روش های تمیز کردن محل باید با الزامات اسناد نظارتی مطابقت داشته باشد. ضدعفونی کننده های بهداشتی مورد استفاده باید ایمن باشند، خطر آلودگی داروهای ذخیره شده با این محصولات باید از بین برود.
دستورالعمل های خاصی برای تمیز کردن محصولات دارویی ریخته شده یا پراکنده باید تهیه شود تا از حذف کامل و جلوگیری از آلودگی سایر محصولات دارویی اطمینان حاصل شود.
هنگام انجام کار در محل نگهداری داروها، کارکنان باید لباس و کفش مخصوص بپوشند و قوانین بهداشت فردی را رعایت کنند.
در اتاقهای نگهداری، فرآوردههای دارویی مطابق با شرایط نگهداری مشخص شده در مقاله داروسازی یا مستندات نظارتی فرآوردههای دارویی، با در نظر گرفتن خواص فیزیکی و شیمیایی و خطرناک، اثرات فارماکولوژیک و سمشناسی، نوع شکل دارویی فرآوردههای دارویی و روش استفاده از آن، وضعیت کل دارو. هنگام استفاده از فناوری رایانه، امکان قرار دادن داروها بر اساس حروف الفبا، با کد مجاز است.
قفسه ها، کابینت ها و قفسه های در نظر گرفته شده برای نگهداری داروها باید مشخص شوند. همچنین شناسایی داروهای ذخیره شده با استفاده از کارت رک یا در هنگام استفاده از فناوری رایانه ای با استفاده از کدها و دستگاه های الکترونیکی ضروری است.
هنگامی که عملیات تخلیه و بارگیری به صورت دستی انجام می شود، ارتفاع انباشته شدن داروها نباید از 1.5 متر تجاوز کند. هنگام استفاده از دستگاه های مکانیزه در حین عملیات تخلیه و بارگیری، داروها باید در چند طبقه نگهداری شوند. در عین حال، ارتفاع کل قرار دادن داروها روی قفسه ها نباید از قابلیت های مکانیسم های بارگیری و تخلیه تجاوز کند.
داروها در اتاق های نگهداری باید در کابینت، قفسه، قفسه، پالت و ... قرار داده شوند، قرار دادن داروها روی زمین بدون پالت مجاز نیست.
پالت ها را می توان بسته به ارتفاع قفسه در یک ردیف یا روی قفسه های چند طبقه روی زمین قرار داد. قرار دادن پالت با دارو در چند ردیف در ارتفاع بدون استفاده از قفسه مجاز نیست.
هنگام ایجاد شرایط نگهداری برای یک فرآورده دارویی خاص، لازم است الزامات مشخص شده در مونوگراف داروسازی یا اسناد نظارتی برای این محصول دارویی که توسط سازنده (توسعه دهنده) فرآورده دارویی بر اساس نتایج پایداری تعیین شده است، هدایت شود. مطالعه مطابق با مونوگراف عمومی فارماکوپی "مدت ماندگاری محصولات دارویی".
داروها در بسته بندی (مصرف کننده، گروه) ذخیره می شوند که الزامات اسناد نظارتی این دارو را برآورده می کند.
داروها بسته به منطقه آب و هوایی مربوطه (I، II، III، IVA، IVB) در رطوبت نسبی حداکثر 60٪ +/-5٪ ذخیره می شوند، مگر اینکه شرایط نگهداری خاص در اسناد نظارتی مشخص شده باشد.
داروها باید برای جلوگیری از آلودگی، اختلاط و آلودگی متقاطع نگهداری شوند. لازم است از بوهای خارجی در محل نگهداری پرهیز شود.
سامانه ثبت داروهای با تاریخ انقضا محدود باید در سازمان اجرا شود. اگر چندین دسته با همان نام دارویی در انبار نگهداری می شوند، باید ابتدا دارویی که تاریخ انقضا آن زودتر از بقیه منقضی می شود برای استفاده مصرف شود.
فرآورده های دارویی رد شده باید شناسایی شده و در یک اتاق (منطقه) مناسب تحت شرایطی نگهداری شوند که اجازه استفاده غیرمجاز آنها را ندهد.
ویژگی های نگهداری گروه های خاصی از داروها
داروهای با خواص خطرناک (قابل اشتعال، انفجار، رادیودارو، گازهای سوز آور، خورنده، فشرده و مایع شده و غیره) باید در اتاق هایی با طراحی خاص و مجهز به تجهیزات ایمنی و امنیتی اضافی نگهداری شوند.
در طول نگهداری، اطمینان از ایمنی و کیفیت اعلام شده داروها، جلوگیری از امکان نمایش خواص خطرناک داروها و ایجاد شرایط کار ایمن برای کارکنانی که با این گونه داروها کار می کنند، ضروری است.
هنگام تنظیم محل و سازماندهی ذخیره سازی داروهای خطرناک، لازم است که طبق الزامات قوانین فدرال و اقدامات قانونی نظارتی فدراسیون روسیه هدایت شود.
ذخیره سازی داروهای مخدر و روانگردان باید مطابق با قوانین و مقررات فدرال فدراسیون روسیه انجام شود.
هنگام نگهداری داروهایی که نیاز به محافظت در برابر تأثیر عوامل محیطی (نور، دما، ترکیب جوی هوا و غیره) دارند، باید از رژیم ذخیره سازی مشخص شده در مونوگراف داروسازی یا اسناد نظارتی اطمینان حاصل شود. انحراف از شرایط تنظیم شده فقط یک بار برای مدت کوتاه (حداکثر 24 ساعت) مجاز است، مگر اینکه شرایط خاص، به عنوان مثال، نگهداری دائمی در یک مکان سرد، به طور جداگانه مشخص شود.
داروهایی که تحت تأثیر انرژی نور می توانند خواص خود را تغییر دهند (اکسید، کاهش، تجزیه، تغییر رنگ و غیره) حساس به نور یا نور هستند. داروهایی که در برابر نور مقاوم هستند، قابلیت عکسبرداری دارند. تأثیر انرژی نور می تواند خود را در قرار گرفتن در معرض نور مستقیم خورشید، نور پراکنده در ناحیه مرئی طیف نور و تابش در ناحیه فرابنفش نشان دهد.
برچسب داروهای حساس به نور معمولاً حاوی این دستورالعمل است: "در مکانی محافظت شده از نور نگهداری شود." داروهایی که نیاز به محافظت در برابر نور دارند باید در اتاق ها یا مکان های مجهزی نگهداری شوند که از نور طبیعی و مصنوعی محافظت می کنند.
مواد دارویی که نیاز به محافظت در برابر نور دارند باید در بسته بندی های ساخته شده از مواد محافظ نور یا در اتاق یا کابینت تاریک نگهداری شوند. اگر از ظروف شیشه ای دارو برای بسته بندی مواد دارویی که به نور حساس هستند استفاده می شود، ظرف باید با کاغذ ضد نور سیاه پوشانده شود.
فرآورده های دارویی حساس به نور باید در بسته بندی ثانویه محافظ نور (مصرف کننده) بسته بندی شوند و/یا باید در مکانی محافظت شده از نور نگهداری شوند.
داروهایی که در تماس با آب، رطوبت می توانند گازها و غیره را آزاد کنند، به رطوبت حساس هستند. برچسب داروهای حساس به رطوبت معمولاً حاوی این دستورالعمل است: "در جای خشک نگهداری شود."
هنگام نگهداری چنین محصولات دارویی، باید اطمینان حاصل شود که رطوبت نسبی در دمای اتاق (در شرایط نگهداری عادی) یا فشار بخار معادل آن در دمای دیگر از 50٪ تجاوز نکند. برآورده کردن الزامات همچنین امکان ذخیره سازی یک محصول دارویی حساس به رطوبت را در بسته بندی مصرف کننده محفوظ (مقاوم در برابر رطوبت) فراهم می کند که حفاظت مشخص شده و رعایت شرایط نگهداری را در طول گردش محصول دارویی فراهم می کند.
برای حفظ رطوبت کم در حین نگهداری فرآورده های دارویی، در موارد تجویز شده از مواد خشک کننده استفاده می شود، مشروط بر اینکه از تماس مستقیم آنها با فرآورده دارویی خودداری شود.
داروهایی که خاصیت رطوبت سنجی دارند باید در رطوبت نسبی حداکثر 50 درصد در بسته بندی، که یک ظرف شیشه ای برای داروها است، بسته بندی شده و یا در بسته بندی هایی با محافظ اضافی، به عنوان مثال، در یک کیسه فیلم پلاستیکی، مطابق با الزامات تک نگاری داروسازی یا اسناد نظارتی.
برخی از گروه های داروها تحت تأثیر گازهای جوی مانند اکسیژن یا دی اکسید کربن خواص خود را تغییر می دهند. برای اطمینان از محافظت از داروها در برابر اثرات گازها، توصیه می شود داروها در بسته بندی های مهر و موم شده از مواد غیر قابل نفوذ در برابر گازها نگهداری شوند. در صورت امکان، بسته بندی باید تا بالا پر شده و محکم بسته شود.
داروهایی که در واقع داروهای فرار یا داروهای حاوی حلال فرار هستند. محلول ها و مخلوط های مواد فرار؛ داروهایی که با تشکیل محصولات فرار تجزیه می شوند نیاز به شرایط نگهداری دارند که آنها را از تبخیر و خشک شدن محافظت کند. توصیه می شود فرآورده های دارویی را در یک مکان خنک، در بسته بندی های بسته بندی شده از مواد غیر قابل نفوذ در برابر مواد فرار یا در بسته بندی های اولیه و ثانویه (مصرف کننده) مطابق با الزامات مشخص شده در مونوگراف داروسازی یا اسناد نظارتی نگهداری کنید.
داروها که مواد دارویی حاوی آب کریستالیزاسیون (کریستال هیدرات) هستند، خواص مواد رطوبت سنجی را نشان می دهند. توصیه می شود هیدرات های کریستالی را در بسته بندی های مهر و موم شده مطابق با الزامات مشخص شده در مونوگراف داروسازی یا اسناد نظارتی نگهداری کنید. به عنوان یک قاعده، هیدرات های کریستالی در دمای 8 تا 15 درجه سانتیگراد و رطوبت نسبی هوا بیش از 60٪ ذخیره می شوند.
داروهایی که تحت تأثیر دمای محیط، خواص خود را تغییر می دهند، حساس به حرارت هستند. داروها وقتی در معرض دمای اتاق یا بالاتر قرار می گیرند (داروهای حساس به گرما) یا زمانی که در معرض دماهای پایین از جمله انجماد قرار می گیرند، می توانند خواص خود را تغییر دهند.
هنگام نگهداری داروهای حساس به گرما، لازم است از رژیم درجه حرارت تنظیم شده توسط الزامات مونوگراف داروسازی یا اسناد نظارتی که در بسته بندی اولیه و/یا ثانویه (مصرف کننده) دارو مشخص شده است اطمینان حاصل شود.
داروهای حساس به حرارت باید در اتاقهای مجهز (یخچال) یا در اتاقهای نگهداری مجهز به تعداد کافی کابینت و یخچال نگهداری شوند. برای نگهداری داروهای حساس به حرارت باید از یخچال های دارویی یا یخچال های خون و فرآورده های خونی استفاده شود.
کیفیت مناسب داروهای ایمونوبیولوژیکی، ایمنی و اثربخشی استفاده از آنها توسط سیستم "زنجیره سرد" تضمین می شود که باید در هر چهار سطح اجرا شود.
قطعنامه دکتر ارشد دولتی بهداشتی فدراسیون روسیه شماره 15 مورخ 10 آوریل 2002 "در مورد اجرای قوانین بهداشتی و اپیدمیولوژیک SP 3.3.2.1120-02".
یخچال ها (محفظه ها، کابینت ها) باید در دمایی تنظیم شوند که مطابق با شرایط دمایی برای نگهداری داروهای موجود در آنها باشد. فرآورده های دارویی ایمونوبیولوژیک باید در دمایی که بیش از 8 درجه سانتیگراد نباشد نگهداری شود. هر بسته فرآورده دارویی ایمونوبیولوژیک در یخچال باید دارای دسترسی به هوای خنک باشد. فرآورده های دارویی ایمونوبیولوژیک نباید همراه با سایر فرآورده های دارویی در یخچال نگهداری شوند.
برای نظارت بر شرایط دمایی نگهداری داروهای حرارت پذیر، تمام یخچال ها (محفظه ها، کابینت ها) باید مجهز به دماسنج باشند. نظارت مداوم بر رژیم دما با استفاده از ترموگراف ها و ضبط کننده های دما انجام می شود که قرائت آنها حداقل دو بار در روز ثبت می شود.
رژیم دما در قفسه های یخچال متفاوت است: درجه حرارت در نزدیکی محفظه فریزر کمتر است، در نزدیکی پانل درب بازشو بالاتر است.
تهیه مکان سرد به معنای نگهداری داروها در یخچال در دمای 2 تا 8 درجه سانتیگراد و جلوگیری از یخ زدن است. نگهداری سرد به معنای نگهداری داروها در دمای 8 تا 15 درجه سانتی گراد است. در این حالت، نگهداری داروها در یخچال مجاز است، به استثنای داروهایی که در دمای کمتر از 8 درجه سانتیگراد نگهداری می شوند، می توانند ویژگی های فیزیکی و شیمیایی خود را تغییر دهند، به عنوان مثال تنتور، عصاره مایع و غیره.
نگهداری در دمای اتاق شامل محدوده دمایی 15 تا 25 درجه سانتیگراد یا بسته به شرایط آب و هوایی تا 30 درجه سانتیگراد است. نگهداری در فریزر دمای داروها را از -5 تا -18 درجه سانتیگراد تضمین می کند. نگهداری در انجماد عمیق به دمای زیر 18- درجه سانتیگراد نیاز دارد.
توصیه می شود داروها را در مناطق و قفسه های یخچال قرار دهید که با شرایط نگهداری دمای آنها مطابقت دارد. نگهداری داروهای ایمونوبیولوژیک روی پانل درب یخچال ممنوع است.
در اتاقهای نگهداری، لازم است شرایط نگهداری برای محصولات دارویی که نیاز به محافظت در برابر قرار گرفتن در معرض دماهای پایین دارند، فراهم شود، که برای آنها مونوگراف داروسازی یا اسناد نظارتی محدودیت دمای پایینتری برای نگهداری تعیین میکند.
فریز کردن فرآورده های دارویی که دارای الزامات مناسب در مونوگراف داروسازی یا اسناد نظارتی هستند و روی بسته بندی اولیه یا ثانویه ذکر شده اند، از جمله آماده سازی انسولین، آماده سازی ایمونوبیولوژیکی جذب شده و غیره مجاز نیست.
منجمد کردن داروهایی که در بستهبندیهایی که با انجماد از بین میروند، ممنوع است، مثلاً داروهای داخل آمپول، بطریهای شیشهای و غیره.
تعاریف استفاده شده در فارمکوپه که شرایط دمایی برای نگهداری داروها را مشخص می کند در جدول آورده شده است.
لازم است از رعایت شرایط نگهداری داروها و حفظ یکپارچگی آنها در طول حمل و نقل اطمینان حاصل شود.
برای فرآوردههای دارویی که بهویژه به تغییرات دما حساس هستند (واکسنها، سرمها و سایر محصولات دارویی ایمونوبیولوژیک، محصولات دارویی انسولین و غیره)، رژیم دمایی تنظیمشده توسط مونوگراف داروسازی یا اسناد نظارتی باید در طول حمل و نقل رعایت شود.
تعاریف مشخص کننده حالت های ذخیره سازی دارو