Բյուրեղային դաշտի տեսության հայեցակարգ. Քիմիական կապի մոդելներ. Բյուրեղային դաշտի տեսություն. Ցածր և բարձր պտտվող համալիրներ
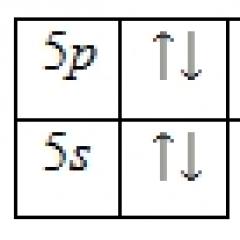
Թույլ դաշտ ուժեղ դաշտ
Միջին դաշտ
Frac34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
Թույլ դաշտային լիգանդները 3d շարքի տարրերով կազմում են բարձր պտտվող կոմպլեքսներ, իսկ ուժեղ դաշտի լիգանները՝ ցածր պտտվող կոմպլեքսներ։ Նրանց միջև տարբերությունը ազդում է համալիրների էլեկտրոնային կառուցվածքի վրա միայն d 4 – d 7 կոնֆիգուրացիաների համար.
3+ դ 5 3– դ 5
բարձր պտտվող համալիր ցածր պտտվող համալիր
H 2 O – թույլ դաշտային լիգան CN – – ուժեղ դաշտային լիգան
Ցածր պտտվող համալիրները միշտ ավելի կայուն են, քան բարձր պտտվող համալիրները: Միջին դաշտի լիգանդները, կախված պայմաններից (կենտրոնական ատոմի լիցքավորումը և բնույթը), կարող են ձևավորել ինչպես բարձր պտույտի, այնպես էլ ցածր պտույտի բարդույթներ։
Օրինակ. TCP-ի հիման վրա ենթադրություն արեք հեքսաամմին կոբալտ(II) (Δo = 21600 սմ–1, P = 21000 սմ–1) և հեքսաամմին կոբալտ (III) իոնների (Δo = 9500 սմ–1, P = 22500) էլեկտրոնային կառուցվածքի մասին։ սմ–1):
Ամոնիակը միջին դաշտի լիգանդ է և, կախված մետաղի օքսիդացման աստիճանից, կարող է ձևավորել ինչպես բարձր պտտվող, այնպես էլ ցածր պտտվող բարդույթներ։ Եկեք պարզենք, թե որ համալիրներն են էներգետիկ առումով ավելի կայուն կոբալտի (II) և կոբալտի (III) համար: Դա անելու համար համեմատեք յուրաքանչյուր իոնի ESC-ն ուժեղ և թույլ դաշտում.
(ա) 3+, դ 6

ուժեղ դաշտ թույլ դաշտ
ESKP (ուժեղ դաշտ) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 սմ –1
ESKP (թույլ դաշտ) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 սմ – 1
Էներգիայի շահույթն ավելի մեծ է ցածր պտտվող համալիրի դեպքում:
(բ) 2+, դ 7

ուժեղ դաշտ թույլ դաշտ
ESKP (ուժեղ դաշտ) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 սմ–1
ESKP (թույլ դաշտ) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 սմ – 1
Էներգիայի շահույթն ավելի մեծ է բարձր պտտվող համալիրի դեպքում։
Այսպիսով, 3+ իոնը ցածր սպին է, իսկ 2+ իոնը՝ բարձր սպին։
ESC-ն աճում է Δo-ի ավելացման հետ, սակայն այն տարբերվում է բարձր պտույտի և ցածր պտտվող վիճակների դեպքում (նկ. 1.28. ESC-ի կախվածությունը բարձր պտտվող և ցածր պտտվող համալիրների համար d 6 կոնֆիգուրացիայով Δo = 10Dq արժեքից: Տարածաշրջանը, որտեղ հնարավոր է երկու պետությունների գոյությունը, ստվերված է): Այս երկու գծերի հատման կետին մոտ գտնվող շրջանը համապատասխանում է այնպիսի բարդույթների, որոնք կարող են գոյություն ունենալ ինչպես բարձր պտույտի, այնպես էլ ցածր պտույտի վիճակում:
Օրինակ՝ երկաթի (II) թիոցիանատ կոմպլեքսը 1,10-ֆենանտրոլինով, որը ցածր ջերմաստիճանում բարձր պտտվող (պարամագնիսական) է, իսկ բարձր ջերմաստիճանի դեպքում ցածր պտտվող (դիամագնիսական) (M. Marchivie, P. Guionneau, J. A. K. Howard): , G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, հ. 124, էջ 194): Բազմապատկության փոփոխությունն ուղեկցվում է միջատոմային հեռավորությունների և կոորդինացիոն միջավայրի երկրաչափության փոփոխությամբ. ցածր պտույտի համալիրը կանոնավոր ութանիստ է, իսկ բարձր պտույտի համալիրը՝ աղավաղված։ Հակադարձ անցումը բարձր պտույտի վիճակին հնարավոր է բարձր ճնշման կամ ճառագայթման ազդեցության տակ։ Ներկայումս հայտնի են մի քանի տասնյակ նման համակարգեր։
Խոսելով լիգանդի σ-դոնոր և π-ընդունիչ հատկությունների մասին՝ մենք դուրս եկանք TCP-ից՝ օգտագործելով բարդ միացությունների նկատմամբ կիրառվող մոլեկուլային ուղեծրային մեթոդի մոտեցումները (հատոր 1): Հիշենք, որ d-օրբիտալների տրոհման պատկերը ութանիստ կոմպլեքսի մոլեկուլային ուղեծրերի ընդհանուր սխեմայի մի հատված է, որտեղ t 2g ուղեծրերը համարվում են չկապող, իսկ eg-ն՝ որպես հակակապող (նկ. հատոր 1): .
Ութանիստ կոմպլեքսում առանց π-կապման կապերի առաջացումը ներառում է մետաղի s-, p- և d- ուղեծրերը և յուրաքանչյուր լիգանդից մեկ ուղեծր: 15 ատոմային օրբիտալներից ձևավորվում է 15 մոլեկուլային օրբիտալ, որոնցից վեցը (a 1 g, t 1 u, e g (ծանոթագրություն. ուղեծրերի նշանակման տառը ցույց է տալիս դրանց այլասերվածության աստիճանը. t - երեք անգամ այլասերված, e - կրկնակի այլասերված, ա - ոչ այլասերված, և համաչափության կենտրոնի առկայություն՝ g - սիմետրիկ, u - ասիմետրիկ)) σ-կապող, երեք (t 2 g) - ոչ կապող և վեց (e g *, t 1 u): *, ա 1 գ *) σ-թուլացում. Կապող օրբիտալները էներգիայով ավելի մոտ են լիգանդի օրբիտալներին, մինչդեռ ոչ կապող օրբիտալները տեղայնացված են հիմնականում մետաղի ատոմի վրա: Մետաղական ուղեծրերի d xy, d xz, d yz (t 2 g) էներգիան համալիրի առաջացման ընթացքում գործնականում չի փոխվում։
Լիգանդում ցածր էներգիայի թափուր ուղեծրի առկայությունը, որը համաչափությամբ նման է մետաղական ուղեծրերին, հանգեցնում է t 2g օրբիտալների էներգիայի նվազմանը, գործնականում առանց ազդելու, օրինակ. Կոբալտ (III) համալիրի դիագրամ σ-դոնոր լիգանդի (ա) և σ-դոնորի, π-ընդունիչ լիգանդի (բ) հետ):
Յան-Թելերի էֆեկտ. 1937 թվականին Յանգը և Թելլերը ապացուցեցին այն թեորեմը, ըստ որի՝ այլասերված էլեկտրոնային վիճակում գտնվող ցանկացած ոչ գծային մոլեկուլ անկայուն է և ինքնաբերաբար ենթարկվում է աղավաղման, որը նվազեցնում է իր համաչափությունը և հանգեցնում է այլասերվածության վերացմանը: Թեորեմը կանխատեսում է միայն այլասերվածությունը վերացնելու փաստը, բայց չի նշում, թե ինչպես է այն վերացվելու: Այս թեորեմի հիման վրա բացատրվել է մի շարք բարդույթների ութանիստ երկրաչափության աղավաղումը, և հենց այդպիսի խեղաթյուրման առկայության փաստն անվանվել է Յան-Թելլերի էֆեկտ։ Դիտարկենք մի օրինակ։ Պղնձի(II) կոմպլեքսները d9 կոնֆիգուրացիայով, որպես կանոն, չեն ներկայացնում կանոնավոր ութանիստ, այլ երկարացվում կամ սեղմվում են առանցքներից մեկի երկայնքով (նկ. 1.30. Ութանիստ երկրաչափության աղավաղումը պղնձի(II) կոմպլեքսներում): Դիտարկենք պրոլատ ութանիստի դեպքը։ Z առանցքի երկայնքով տեղակայված լիգանդների հեռացումը հանգեցնում է դեգեներացիայի հեռացմանը ուղեծրերի էներգիաների փոփոխության պատճառով: Z առանցքի երկայնքով ուղղված ուղեծրերը (d xz, d yz, d z 2) ավելի թույլ են փոխազդում լիգանդների ուղեծրերի հետ՝ համեմատած այն ուղեծրերի հետ, որոնք չունեն z բաղադրիչ (d xy, d x 2 -y 2) և, հետևաբար, նվազեցնում են դրանց էներգիան։ Նույն սիմետրիայի ուղեծրերի զույգը, որն ունի z բաղադրիչ (d xz, d yz), մնում է այլասերված և ձեռք է բերում ավելացած էներգիա։ (նկ. 1.31. d-ուղղծրերի էներգիաների փոփոխություն, երբ ութանիստը աղավաղված է): Յան-Թելերի էֆեկտն առավել ուժեղ դրսևորվում է անհավասար լցված eg օրբիտալներով բարդույթներում, այսինքն՝ t 2g 3 e g 1 կոնֆիգուրացիաներով (համապատասխանում է թույլ դաշտում d 4 իոնին՝ CrCl 2, K 3 MnF 6) և t 2g։ 6 e g 3 (համապատասխանում է d 9 իոնին. գրեթե բոլոր պղնձի (II) կոմպլեքսները) և t 2g 6 e g 1 (համապատասխանում է d 7 իոնին ուժեղ դաշտում, հազվադեպ, K 3 NiF 6): Jahn-Teller-ի աննշան էֆեկտը բնորոշ է անհավասար լցված t 2g օրբիտալներով բարդույթների համար, այսինքն՝ t 2g 1 (d 1), t 2g 2 (d 2), t 2g 4 (d 4 ուժեղ դաշտում) , t 2g 5 (d 5 ուժեղ դաշտում), t 2g 5 e g 1 (d 6 թույլ դաշտում), t 2g 5 e g 2 (d 7 թույլ դաշտում): d 3 և d 5 կոնֆիգուրացիաներով իոնները թույլ դաշտում, d 3 և d 6 ուժեղ դաշտում, d 8 և d 10 ոչ մի դեպքում Jahn-Teller չեն:
Յան-Թելերի էֆեկտը դրսևորվում է բազմաթիվ պղնձի (II) և մանգանի (III) կոմպլեքսներում կապի երկարությունների անհավասարությամբ և բարդությունների կայունության աստիճանական հաստատունների ոչ միապաղաղ փոփոխությամբ: Օրինակ՝ անջուր պղնձի (II) քլորիդում պղնձի ատոմը շրջապատված է քլորի վեց ատոմներով, որոնցից չորսը գտնվում են 0,230 նմ հեռավորության վրա, իսկ մյուս երկուսը գտնվում են նրանից 0,295 նմ հեռավորության վրա։
Հայտնի են պղնձի (II) կոմպլեքսներ (Cl 2, (C 6 H 5 SO 3) 2 և այլն), որոնք բաղկացած են մի քանի բյուրեղագրական առումով ոչ համարժեք Jahn-Teller իոններից, որոնցից յուրաքանչյուրն ունի իր տեսակի աղավաղում, որոնք փոխակերպվում են միմյանց՝ փոխվելով։ մետաղ-լիգանդ հեռավորությունն այնքան արագ է, որ ընդհանուր առմամբ մետաղ-լիգանդի բոլոր հեռավորությունները նույնն են թվում: Այս գործը կոչվում էր դինամիկ կամ զարկերակային Jahn-Teller էֆեկտ(P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214):
Ջան-Թելերի էֆեկտը, սակայն, համընդհանուր օրենք չէ: Ներկայումս հայտնի են Jahn-Teller կոնֆիգուրացիայով բարդ իոններ, որոնք չաղավաղված ութանիստներ են՝ 4–, 3+։
Պառակտում ութանիստից տարբեր սիմետրիա ունեցող դաշտերում.
Ի հավելումն ութանիստների, հայտնի են բազմաթիվ այլ երկրաչափական բարդույթներ՝ քառակուսի հարթություն, քառանկյուն, եռանկյուն-բուրգ, քառակուսի-բրգաձև, գծային և այլն: Այս դաշտերից յուրաքանչյուրում պառակտումը տարբեր է, քան ութանիստում. որոշվում է կոորդինացիոն պոլիէդրոնի համաչափությամբ։
Քառակուսի հարթ կոմպլեքսները կարելի է համարել որպես ութանիստ երկրաչափության քառանկյուն աղավաղման ծայրահեղ դեպք, երբ կոորդինատային առանցքներից մեկի երկայնքով տեղակայված լիգանդները հեռացվում են մինչև անսահմանություն (նկ. 1.27բ): Օրբիտալների նշանակումները ներկայացված են նկարում: Հարթ քառակուսի կոմպլեքսներն առավել բնորոշ են d 8 – Ni 2+, Pd 2+, Pt 2+, Au 3+ էլեկտրոնային կոնֆիգուրացիայով իոնների համար: Դրանց կայունությունը կտրուկ աճում է Δ-ի մեծացման հետ, այսինքն՝ 3d շարքի տարրերից ծանր անցումային տարրեր տեղափոխելիս։ Այսպիսով, օրինակ, եթե պալադիումը, պլատինը և ոսկին ունեն գրեթե բոլոր կոմպլեքսները՝ չորս քառակուսի կոորդինացիոն թվով, ապա նիկելը հարթ քառակուսի կոմպլեքսներ է կազմում միայն բարձր դաշտի լիգանդների հետ՝ 2–, Ni(dmg) 2։ Նիկելի (II) կոմպլեքսները ցածր դաշտային լիգանդներով, ինչպիսիք են հալոգենները, ունեն քառաեդրային երկրաչափություն։
Որոշ քառակուսի հարթ անցումային մետաղների կոմպլեքսներ պինդ ձևով շղթաներ են կազմում կամրջող լիգանդներով, օրինակ՝ Pt-CN-Pt K 2 Br 0.3-ում, որտեղ պլատինի ատոմները մասամբ գտնվում են +4 օքսիդացման վիճակում: 5d ուղեծրերի բարձր թափանցելիությունը ապահովում է դրանց համընկնումը մեկ էներգիայի գոտու ձևավորման հետ և, հետևաբար, մետաղական հաղորդունակությունը շղթայի ուղղությամբ: Նման մոլեկուլային համալիրներն ունակ են էլեկտրական հոսանք անցկացնելու և ներկայումս ինտենսիվ ուսումնասիրվում են։
Չորսանկյուն համաչափության դաշտում d xy, d yz, d xz ուղեծրերն ունեն առավելագույն էներգիա, դրանք կոչվում են t 2 -օրբիտալներ, իսկ նվազագույն էներգիան d x 2 –y 2 և d z 2 ուղեծրերն են, դրանք նշանակվում են e. . Ավելի փոքր թվով լիգանդների առկայության և դրանց տարբեր դասավորության պատճառով քառաեդրային դաշտը (նկ. 1.32. Չորսանկյուն և ութանիստ դաշտերում ճեղքվածքների համեմատություն) պարզվում է, որ ութանիստից 2,25 անգամ ավելի թույլ է.
Քառաեզրային համալիրների մեծ մասը բարձր սպին է (Ծանոթագրություն – Հայտնի են ցածր պտտվող քառաեզրային համալիրների մի քանի օրինակներ, օրինակ՝ Cr(N(Si(CH 3) 3) 2 ) 3 NO (քրոմ (II), d 4 ; D. C: Բրեդլի, քիմ. , 1491))։ Բյուրեղային դաշտի կողմից քառանիստ միջավայրի առավելագույն կայունացումը ձեռք է բերվում d 2 (FeO 4 2–, MnO 4 3–) և d 7 (2–) կոնֆիգուրացիաներով։ Համեմատաբար ցածր կայունացման էներգիայի շնորհիվ քառաեդրային համալիրներն ավելի հաճախ ձևավորվում են d 0 (TiCl 4, MnO 4 –, CrO 4 2–), d 5 թույլ դաշտում (FeCl 4 –) և d 10 (ZnCl) կոնֆիգուրացիաներով իոններով։ 4 2–) զրոյական ESKP-ով, ինչպես նաև ոչ անցումային մետաղի իոններով (AlCl 4 –): Ութանիստների համեմատ քառանիստ բարդույթների առաջացումը հաճախ նպաստում է ստերիկ գործոնին, օրինակ՝ իոնն ավելի կայուն է, քան 3–ը։
Օգտագործելով TCP համալիրների կայունությունը բացատրելու համար: Իրվինգ-Ուիլիամս շարք.Բյուրեղային դաշտի տեսությունը հնարավորություն է տալիս բացատրել օքսիդների և հալոգենների բյուրեղային ցանցի էներգիաների փոփոխությունների ոչ միապաղաղ բնույթը, կոմպլեքսների կայունության հաստատունները և այլն։ 3d մետաղների կրկնակի լիցքավորված կատիոնների հիդրացիոն էներգիաների փոփոխության կարգը։ ընդհանուր առմամբ համընկնում է բարձր պտտվող կոմպլեքսներում ESC-ի փոփոխությունների բնույթին (նկ. 1.33. 3d շարքի կրկնակի լիցքավորված կատիոնների մետաղների հիդրացիոն էներգիայի փոփոխություն և բարձր պտտվող կոմպլեքսներում ESC-ի փոփոխություն (b) ), որքան ուժեղ է կայունացումը բյուրեղային դաշտի կողմից, այնքան ավելի մեծ է խոնավացումը: Հայտնի է, որ ջրի մոլեկուլի փոխարինման հաստատունները թույլ դաշտի լիգանդ Լ
2+ + L x– = (2-x)+ + H 2 O
հնազանդվեք Իրվինգ-Ուիլիամս շարքին. Mn 2+< Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ < Zn 2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Նեֆելոաքսետիկ ազդեցություն.Հայտնաբերվել է, որ d-էլեկտրոնների փոխադարձ վանումը թուլանում է, երբ ատոմը տեղադրվում է լիգանդների դաշտում։ Լիգանդի այս ազդեցությունը մետաղի ատոմի d-էլեկտրոնների վրա կոչվում է նեֆելոաքսետիկ ազդեցություն հունարեն νεφελη - ամպ և αυξανω - աճ բառերից: Մետաղական ուղեծրերի վրա իրենց ազդեցությունը մեծացնելու կարգով դասավորված լիգանդների շարքը գրեթե ամբողջությամբ համապատասխանում է սպեկտրոքիմիական շարքին։ Նեֆելոաքսետիկ էֆեկտի պատճառը մետաղի d-օրբիտալների համընկնումն է լիգանդների ուղեծրերի հետ, ինչի պատճառով d-ամպը տարածվում է տարածության մեջ։ Այս էֆեկտի առկայությունը հստակ ցույց է տալիս ամենապարզ էլեկտրաստատիկ մոդելի սահմանափակումները՝ դաշտի բյուրեղային տեսությունը, որը ենթադրում է, որ լիգնադները կետային բացասական լիցքեր են:
Լիգանդի դաշտի տեսություն.Բյուրեղային դաշտի տեսությունը մշակվել է Բեթեի կողմից 1929 թվականին: Ներկայումս այն լայնորեն օգտագործվում է փոփոխված ձևով՝ մետաղ-լիգանդ կապի որոշակի կովալենտության ուղղումներով: Այս տեսությունը կոչվում է լիգանդի դաշտի տեսություն։ Կովալենտային ներդրման առկայությունը փոխում է մետաղական ուղեծրերի էներգիան՝ համեմատած TCP-ով հաշվարկված էներգիայի հետ։ Կովալենտության համամասնությունը հաշվի է առնվում ուղղիչ գործոնների ներդրմամբ, որոնք հնարավորություն են տալիս փորձարարական արժեքները հավասարեցնել հաշվարկվածների հետ:
Համալիրների գունավորում.
D-անցումային տարրերի կոմպլեքսների գույնը կապված է էլեկտրոնների անցումների հետ մեկ d- ուղեծրից մյուսը: Դա պարզորոշ երևում է դասագրքի առաջին հատորում քննարկված Ti 3+ իոնի օրինակով։ Տեսանելի սպեկտրի կապույտ և կանաչ մասերին համապատասխանող էներգիան կլանելով Ti 3+ իոնում միակ d-էլեկտրոնը շարժվում է դեպի eg ուղեծր (նկ. 1.35. 3+ իոնի սպեկտր)։ Իոնի գույնը պայմանավորված է լրացուցիչ գույներով՝ կարմիր և մանուշակագույն։ (Ծանոթագրություն - Ուշադիր ընթերցողը կնկատի կլանման գոտու որոշակի անհամաչափություն: Դա հետևանք է t 2g մակարդակի աննշան պառակտման, որն առաջացել է Jahn-Teller էֆեկտից): Դասագրքի երկրորդ թերթիկի վրա ներկայացված է գծապատկեր, որը ցույց է տալիս լրացնող գույները և որը քաջ հայտնի է յուրաքանչյուր նկարչի: Անցումային էներգիան, որն արտահայտված է փոխադարձ սանտիմետրերով (1000 սմ –1 = 12 կՋ), համապատասխանում է պառակտման Δο պարամետրին - այն առավել հաճախ որոշվում է էլեկտրոնային սպեկտրներից: Ալիքի երկարությունը հակադարձ համեմատական է էներգիային.
 .
.
Մեծ թվով էլեկտրոններով կոմպլեքսների դեպքում սպեկտրի պատկերն ավելի է բարդանում, և դրանում առաջանում են լրացուցիչ շերտեր։ Դա պայմանավորված է նրանով, որ գրգռված վիճակը t 2g 1 e g 1 կարող է իրականացվել մի քանի ձևով, կախված նրանից, թե որ երկու d-օրբիտալներում են գտնվում էլեկտրոնները։ Օրինակ, վիճակը, երբ էլեկտրոնները զբաղեցնում են d xy և d x 2 –y 2 ուղեծրեր, էներգիայով ավելի բարձր կլինի, քան d xy 1 d z 2 1 վիճակը՝ x առանցքի երկայնքով էլեկտրոնների ավելի մեծ վանման պատճառով: Ամենացածր էներգիա ունեցող գոտուն համապատասխանող էներգիան հավասար է պառակտման Δo պարամետրին։
Էլեկտրոնային սպեկտրները ավելի մանրամասն նկարագրելու համար անհրաժեշտ է ներկայացնել որոշ հասկացություններ։ Ենթամակարդակում գտնվող էլեկտրոնների ցանկացած դասավորություն անվանենք միկրովիճակ։ N միկրովիճակների թիվը, որոնցում n էլեկտրոններ զբաղեցնում են x ուղեծրեր, հավասար է

Յուրաքանչյուր միկրովիճակ բնութագրվում է պտույտի և անկյունային իմպուլսի իր արժեքներով: Նույնական էներգիաներով միկրովիճակների մի շարք կոչվում է ժամկետը, օրինակ, 3 P, 5 D, 1 S. Թվային ցուցանիշը ցույց է տալիս բազմակիությունը, որը հաշվարկվում է հետևյալ կերպ.
բազմապատկություն = չզույգված էլեկտրոնների թիվը հիմնական վիճակում + 1:
Տերմինների անվանումներն ընթերցվում են բազմակի նշումով՝ «եռյակ P», «հնգյակ D», «մեկական S»: Տառը նշանակում է ատոմի կամ իոնի L ընդհանուր անկյունային իմպուլսը, որը հավասար է էլեկտրոնների զբաղեցրած առանձին օրբիտալների անկյունային մոմենտների գումարի մլ առավելագույն արժեքին։ Օրինակ, Ti 3+ իոնը պարունակում է մեկ d-էլեկտրոն, միկրովիճակների թիվը N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (քանի որ d-ուղեծրի համար m l = –2, –1, 0, 1, 2, էլեկտրոնների թիվը 1 է, հետևաբար, առավելագույն գումարը m l հավասար է ամենամեծ արժեքին. մ լ), բազմապատկություն 1 + 1 = 2: Հետևաբար, հիմնական վիճակի անդամը (ամենացածր էներգիայով) 2 D է: Էլեկտրոնային կոնֆիգուրացիա ունեցող իոնի դեպքում d 2 N = (2´5)!/2!( 2'5 – 2) = 45, L = 3(F) (քանի որ d- ուղեծրի համար m l = –2, –1, 0, 1, 2, էլեկտրոնների թիվը 2 է, հետևաբար, երկու ամենամեծ արժեքների առավելագույն գումարը. հավասար է մ լ), բազմապատկություն 2 + 1 = 3: Հետևաբար, հիմքի միկրո վիճակի տերմինը 3 F է: d-ենթամակարդակի վրա երկու էլեկտրոնների տարբեր դասավորությամբ ձեռք են բերվում այլ տերմիններով նկարագրված վիճակներ՝ 3 P, 1 G: , 1 D, 1 S և այլն: L-ի թվային արժեքների և այբբենական նշանների միջև կապը տրված է ստորև.
L = 0 1 2 3 4 5 6 7
Նմանապես, մենք կարող ենք դուրս բերել հիմնական և գրգռված վիճակների պայմանները d-տարրերի այլ իոնների համար (Աղյուսակ 1.5.): Խնդրում ենք նկատի ունենալ, որ d n և d 10-n կոնֆիգուրացիայով իոնների պայմանները նույնն են:
Աղյուսակ. 1.5.
Հողի և մոտակա գրգռված վիճակների պայմանները d-էլեկտրոնների տարբեր կոնֆիգուրացիաների համար:
Տերմինները բաժանված են ութանիստ դաշտում, ինչպես ուղեծրերը, որոնք նշվում են նմանատիպ տառերով: D տերմինները բաժանվում են T 2g և Eg բաղադրիչների, ինչպիսիք են d-օրբիտալները, F տերմինները՝ T 1g, T 2g և A 2g, ինչպես f-օրբիտալները: S և P տերմիններն ընդհանրապես չեն բաժանվում: Տարբեր վիճակների միջև էլեկտրոնների անցումների հնարավորությունները սահմանափակված են ընտրության կանոններով։ Այսպիսով, կոմպլեքսներում թույլատրվում են միայն անցումներ նույն բազմապատկությամբ վիճակների միջև։ Յուրաքանչյուր նման անցում համապատասխանում է կլանման սպեկտրի շերտին: Որպես օրինակ դիտարկենք 3+ համալիրի էլեկտրոնային սպեկտրը (նկ. 1.36. 3+ համալիրի էլեկտրոնային սպեկտր): Երեք ժապավենները պայմանավորված են երեք էլեկտրոնային անցումներով՝ 4 A 2 g ® 4 T 2 g, 4 A 2 g ® 4 T 1 g, 4 A 2 g ® 4 T 1 g (P): Ամենացածր էներգիայով անցումը համապատասխանում է տրոհման պարամետրի արժեքին՝ Δo = 17400 սմ–1։ Համալիրը լույս է կլանում տեսանելի սպեկտրի կարմիր (17400 սմ–1) և կապույտ (23000 սմ–1) և մոտ ուլտրամանուշակագույն մասերում (37800 սմ–1), հետևաբար ունի մանուշակագույն գույն։
Ըստ Լապորտի կանոնի՝ նույն պարիտետ ունեցող վիճակների միջև անցումները, որոնք ներառում են s-s, p-p, d-d, f-f անցումներ, քիչ հավանական են կամ, սպեկտրոսկոպիայի լեզվով ասած, արգելված են ութանիստ բարդույթներում։ Արգելված անցումները հնարավոր են, բայց տեղի են ունենում ցածր ինտենսիվությամբ: Ահա թե ինչու անցումային մետաղների աղերը նկատելի գույն ունեն միայն խտացված լուծույթներում։ Այն շատ անգամ թույլ է պերմանգանատի կամ երկքրոմատի գույնից, որոնց իոնները չեն պարունակում d-էլեկտրոններ։
Լապորտի կանոնը կիրառելի է միայն այն բարդույթների դեպքում, որոնք ունեն համաչափության կենտրոն։ Երբ ութանիստը աղավաղվում է, համաչափության կենտրոնը անհետանում է, Լապորտյան արգելքը հանվում է, և գույնը հայտնվում է: Օրինակ, 3+ իոնը անգույն է, սակայն երկաթի (III) աղերի լուծույթները հաճախ դեղին-նարնջագույն են՝ հիդրոլիզի պատճառով, ինչը հանգեցնում է աղավաղված ութանիստ միջավայրով ասիմետրիկ մասնիկների ձևավորմանը:
Կոմպլեքսների գույնը, ի լրումն d-d անցումների մեկ մետաղական d- ուղեծրից մյուսը (t 2g-ից մինչև eg ութանիստ կոմպլեքսներում), որոշվում է ևս երկու գործոնով. ) և անցումներ լիգանդի ուղեծրերի ներսում: Այս անցումները չեն ընկնում Լապորտի իշխանության տակ և, հետևաբար, ունեն բարձր ինտենսիվություն։
Լիցքի փոխանցման գոտին առկա է ցանկացած միացության էլեկտրոնային սպեկտրում, սակայն որոշ դեպքերում այն գտնվում է սպեկտրի ուլտրամանուշակագույն մասում և մեր կողմից չի ընկալվում որպես գույն: Եթե լիգանդի օրբիտալների և մետաղական ուղեծրերի էներգիաների տարբերությունը կրճատվում է, լիցքի փոխանցման գոտին ընկնում է սպեկտրի տեսանելի մասում: Հենց լիցքի փոխանցումն է բացատրում պերմանգանատի, երկքրոմատի, սնդիկի սուլֆիդի, տիտանի (IV) պերօքսո համալիրների և դատարկ d-օրբիտալներով բազմաթիվ այլ միացությունների ինտենսիվ գույնը: Որոշ դեպքերում լույսի ազդեցությամբ լիցքի փոխանցումը լիգանդի ուղեծրերից մետաղի ուղեծրեր տեղի է ունենում անդառնալիորեն, այսինքն՝ ուղեկցվում է քիմիական գործընթացով։ Օրինակ՝ արծաթի հալոգենիդների ֆոտոքիմիական տարրալուծումը, որը սև և սպիտակ լուսանկարչության հիմքն է. Ag + Br – ¾® Ag 0 + Br 0:
Կալիումի պերմանգանատի էլեկտրոնային սպեկտրում նկատվում են չորս ժապավեններ, որոնք համապատասխանում են էլեկտրոնների անցումներին ոչ կապող ուղեծրերից, որոնք տեղայնացված են հիմնականում լիգանդի վրա (a 1, t 2 σ օրբիտալներ և e, t 1, t 2 π օրբիտալներ) դեպի e*, t2։ '' հակակապակցման ուղեծրեր, որոնք տեղայնացված են մետաղի ատոմի վրա ((նկ. 1.37. MnO 4 քառասյուն իոնի էներգետիկ դիագրամ - π-կապով: Էլեկտրոնների անցումները ցույց են տրված սլաքներով):
ν 1, Mn(e*) ¾ O(t 1) 17700 սմ –1
ν 2 , Mn(t 2 '') ¾ O(t 1) 29500 սմ –1
ν 3, Mn(e*) ¾ O(t 2) 30300 սմ –1
ν 4 , Mn(t 2 '') ¾ O(t 2) 44400 սմ –1
Ամենացածր էներգիա ունեցող գոտին ընկնում է սպեկտրի տեսանելի մասում (λ = 107/17700 = 565 նմ), որը համապատասխանում է կանաչ լույսի կլանմանը և բոսորագույն-կարմիր լույսի հաղորդմանը։
3. Բարդ միացություններ պարունակող ռեակցիաների մեխանիզմներ.
Քիմիական գործընթացների ճնշող մեծամասնությունը տեղի է ունենում որպես որոշ տարրական փուլերի հաջորդական շղթա, և ռեակցիայի հավասարումը կրում է միայն տեղեկատվություն ռեակցիայի հիմնական վերջնական արտադրանքի մասին: Տարրական փոխակերպումների այս հաջորդականությունը սկզբնական նյութերից մինչև ապրանքներ ճանապարհին կոչվում է մեխանիզմ։ Միջանկյալ, սովորաբար անկայուն միացությունները, որոնց միջով անցնում է ռեակտիվներից մինչև ապրանքներ, կոչվում են միջանկյալներ: Ցանկացած միջանկյալ նյութ ունի որոշակի ժամկետ, սովորաբար չափազանց կարճ, մինչև 10 -14 վրկ: Ռեակցիայի էներգետիկ պրոֆիլում այն համապատասխանում է նվազագույնին (նկ. ա) (նկ. 1.38. Ա) միջանկյալ, բ) անցումային վիճակով ընթացող ռեակցիայի էներգետիկ պրոֆիլներ։ Որպես կանոն, միջանկյալ նյութերը կարող են հայտնաբերվել ռեակցիայի խառնուրդում սպեկտրային մեթոդներով, և միայն հազվադեպ դեպքերում դրանք կարող են մեկուսացվել առանձին ձևով: Հետևաբար, ռեակցիայի մեխանիզմի մասին հիմնական տեղեկատվությունը սովորաբար ստացվում է նրա կինետիկայի ուսումնասիրությամբ՝ արագության հաստատունների որոշմամբ և ակտիվացման պարամետրերի (էնթալպիա, էնտրոպիա, ծավալ) հաշվարկով։ Այս դեպքում մեխանիզմը մոդել է, որը համապատասխանում է կինետիկ տվյալներին, մոդել, որը կարելի է կատարելագործել, փոփոխել, վերանայել։
Որոշ ռեակցիաներում միջանկյալ նյութեր չեն ձևավորվում, և ռեակտիվներից անցումը արտադրանքի տեղի է ունենում հաջորդաբար՝ ատոմներից մեկն աստիճանաբար հեռացվում է, իսկ մյուսը մոտենում է։ Այս դեպքում, ասվում է, որ արձագանքը շարունակվում է անցումային վիճակկամ ակտիվացված համալիր: Այն համապատասխանում է ռեակցիայի էներգետիկ պրոֆիլում առավելագույնին (նկ. Բ):
Հավելում` լաբիլ և իներտ կոմպլեքսներ
Մասնիկի թերմոդինամիկական կայունությունը որոշվում է Գիբսի էներգիայի փոփոխությամբ նրա տարանջատման ռեակցիայի համար կամ այս գործընթացի կայունության հաստատունի արժեքով։ Կինետիկ կայունությունը ցույց է տալիս, թե որքան արագ է տվյալ մասնիկը փոխազդում այլ մասնիկների հետ կամ ենթարկվում քայքայման։ Քիմիական մասնիկ է համարվում իներտ, եթե այն արձագանքում է 1 րոպեից ավելի կիսամյակի հետ: Ավելի բարձր արագությամբ արձագանքող մասնիկները կոչվում են անկայուն. Պետք է հիշել, որ կինետիկ և թերմոդինամիկ կայունությունը միմյանցից կախված չեն, այսինքն՝ նույն նյութը կարող է ունենալ բարձր կայունության հաստատուն և միևնույն ժամանակ լինել իներտ կամ, ընդհակառակը, անկայուն։ Նման որոշ օրինակներ բերված են Աղյուսակ 1.6-ում:
Աղյուսակ 1.6. Կայունության հաստատունները և լիգանդի փոխարինման արագությունները որոշ մետաղների ցիանո-համալիրներում:
Հենրի Տոբեն ցույց տվեց կապը ութանիստ համալիրների կինետիկ կայունության և ութանիստ դաշտում կենտրոնական իոնի էլեկտրոնային կազմաձևման միջև։ Ըստ Taube-ի, հետևյալ բարդույթները անկայուն են.
Ունենալով առնվազն մեկ թափուր t 2g ուղեծր. նրանք կարող են այն օգտագործել ռեակցիաներում՝ համաձայն ասոցիատիվ (A, I a) մեխանիզմի, կամ
· Ունենալով առնվազն մեկ էլեկտրոն eg ուղեծրում - սա խթանում է ռեակցիան դիսոցիատիվ (D, I d) մեխանիզմով, քանի որ E g ուղեծրից էլեկտրոնի հեռացումը նվազեցնում է անցումային վիճակի էներգիան:
Այսպիսով, քրոմի (III) ութանիստ կոմպլեքսները (t 2g 3), ցածր պտտվող երկաթի (II) (t 2g 6) և երկաթի (III) (t 2g 5), ինչպես նաև 4d-, 5d- համալիրները: Անցումային տարրերը դասակարգվում են որպես իներտ՝ երկուսից ավելի d-էլեկտրոնների քանակով:
ԼՐԱՑՄԱՆ ՎԵՐՋ
Անօրգանական ռեակցիաների միասնական դասակարգում դեռևս չի մշակվել։ Պայմանականորեն մենք կարող ենք առաջարկել հետևյալ սխեման (նկ. 1.39. Անօրգանական ռեակցիաների դասակարգումը պատկերող սխեմա).
1) Լիգանդների փոխարինման, ավելացման կամ վերացման ռեակցիաները ազդում են մետաղի կոորդինացիոն ոլորտի փոփոխության վրա.
2) Redox ռեակցիաները կապված են մետաղի էլեկտրոնային կոնֆիգուրացիայի փոփոխության հետ, բայց չեն ազդում դրա համակարգման միջավայրի վրա,
3) Համակարգված լիգանդների ռեակցիաները ներառում են լիգանդի փոփոխություն՝ առանց համալիրի կոորդինացիոն ոլորտը փոխելու։
Փոխարինման ռեակցիաներ.Լայն իմաստով փոխարինման ռեակցիաները նշանակում են մետաղի կոորդինացիոն ոլորտում որոշ լիգանների փոխարինման գործընթացներ։ Նման ռեակցիաները կարող են առաջանալ օքսիդացման վիճակի փոփոխությամբ կամ առանց դրա: Հետևելով վերը նշված դասակարգմանը, մենք կօգտագործենք այս տերմինը միայն այն ռեակցիաների առնչությամբ, որոնք տեղի են ունենում առանց օքսիդացման վիճակների փոփոխության:
Անօրգանական քիմիայում փոխարինող ռեակցիաների դասակարգումը մշակվել է Լենգֆորդի և Գրեյի կողմից։ Այն հիմնված է այսպես կոչված սահմանափակող մեխանիզմի սահմանման վրա, այլ ոչ թե կոնկրետ մեխանիզմի նկարագրության վրա։ Նախ որոշվում է ստոյխիոմետրիկ մեխանիզմը, իսկ հետո՝ ներքինը։ Ստոյխիոմետրիկ մեխանիզմսկզբնական նյութերից արտադրանքի անցման տարրական փուլերի հաջորդականություն է։ Այն կարող է լինել դիսոցիատիվ (D), ասոցիատիվ (A) և փոխանակում (փոխադարձ փոխանակում, I): Դիսոցիատիվ և ասոցիատիվ գործընթացները ներկայացնում են, կարծես, երկու սահմանափակող դեպքեր, որոնք ուղղակիորեն հակադիր են միմյանց: Երկու գործընթացներն էլ տեղի են ունենում երկու փուլով` միջանկյալի ձևավորման միջոցով:
Դիսոցիատիվ (D)
Գործընթացը երկփուլ է, սահմանափակման դեպքում այն ընթանում է նվազեցված կոնցենտրացիայով միջանկյալ միջանկյալով.
ML 6 + L, + Y ¾® ML 5 Y
Ասոցիատիվ (A)
Գործընթացը երկփուլ է, որը բնութագրվում է բարձրացված կոնցենտրացիայով միջանկյալի ձևավորմամբ.
ML 6 + Y, ¾® ML 5 Y + L
Փոխադարձ փոխանակում (I)
Փոխանակման ռեակցիաների մեծ մասն ընթանում է այս մեխանիզմով: Գործընթացը միաստիճան է և չի ուղեկցվում միջանկյալի ձևավորմամբ։ Անցումային վիճակում ռեագենտը և հեռացող խումբը կապված են ռեակցիայի կենտրոնի հետ, մտնում են նրա մոտակա կոորդինացիոն ոլորտը, և ռեակցիայի ընթացքում մի խումբը տեղափոխվում է մյուսով, տեղի է ունենում երկու լիգանների փոխանակում.
ML 6 + Y ML 5 Y + L.
Անցումային վիճակը կա՛մ արտաքին գնդային բարդույթ է, կա՛մ լիցքավորված լիգանդների դեպքում՝ MX 5 L + Y - իոնային զույգ։
Ներքին մեխանիզմ (ակամ դ) բնութագրում է լիգանդի փոխարինման գործընթացը մոլեկուլային մակարդակում։ Այն ցույց է տալիս, թե երկու գործընթացներից որն է` անցումային վիճակում կապի ձևավորումը կամ խզումը սահմանափակող: Եթե ռեակցիայի արագությունը որոշվում է ռեակցիայի կենտրոնի և ռեագենտի միջև կապի ձևավորմամբ, մենք խոսում ենք ասոցիատիվ ակտիվացման մասին։ Հակառակ դեպքում, երբ սահմանափակող գործոնը ռեակցիայի կենտրոնի և հեռացող խմբի միջև կապի խզումն է, գործընթացն ընթանում է դիսոցիատիվ ակտիվացմամբ։ Անդրադառնալով ստոյխիոմետրիկ մեխանիզմին՝ հեշտ է նկատել, որ դիսոցիատիվ գործընթացը միշտ համապատասխանում է դիսոցիատիվ ակտիվացմանը, իսկ ասոցիատիվ պրոցեսը միշտ համապատասխանում է ասոցիատիվ ակտիվացմանը, այսինքն՝ ներքին մեխանիզմի հայեցակարգը տեղեկատվական է դառնում միայն այն դեպքում, երբ փոխադարձ փոխանակման մեխանիզմ - այն կարող է առաջանալ ինչպես դիսոցիատիվ (I d) և այնպես էլ ասոցիատիվ (I a) ակտիվացումով: Ասոցիատիվ ակտիվացմամբ (Ia) փոխադարձ փոխանակման մեխանիզմի դեպքում ռեակցիայի արագությունը կախված է Y-ի բնույթից: Անցումային վիճակում մետաղի ատոմը սերտորեն կապված է և՛ հեռացող խմբի, և՛ հարձակվող նուկլեոֆիլի հետ: Օրինակ՝ քլորի ատոմը բրոմով և յոդով փոխարինելու գործընթացը պլատինե համալիրում դիէթիլենտրիամինով (dien):
Y - ¾¾® + + Cl -
Y = Br, I արագությունները մեծապես տարբերվում են:
Դիսոցատիվ ակտիվացմամբ (I d) փոխադարձ փոխանակման մեխանիզմի դեպքում ռեակցիայի արագությունը կախված չէ Y ռեագենտի բնույթից: Անցումային վիճակում գտնվող հարձակվող և հեռացող խմբերը թույլ կապված են կենտրոնական իոնի հետ: Այս մեխանիզմը օգտագործվում է ջուրը ամինով փոխարինելու համար բազմաթիվ անցումային մետաղների ջրային համալիրներում, օրինակ՝ նիկել.
2+ + Y ¾¾® 2+ + H 2 O
Y = NH 3, py արագությունները մոտ են:
Շատ մետաղների կոմպլեքսներում փոխարինման ռեակցիաների մեխանիզմների ուսումնասիրությունը միայն սկզբնական փուլում է։ Համապարփակ տեղեկատվություն է ձեռք բերվել միայն քրոմի(III) և կոբալտի(III) պլատինե և ութանիստ կոմպլեքսների քառակուսի հարթությունների համար: Կարելի է հաստատապես հաստատված համարել, որ պլատինի(II) կոմպլեքսներում փոխարինումը տեղի է ունենում ասոցիատիվ մեխանիզմի համաձայն (A, Ia) միջանկյալ կամ անցումային վիճակի միջոցով՝ եռանկյուն երկպիրամիդի տեսքով։ Ութանիստ կոբալտ (III) համալիրները արձագանքում են դիսոցիատիվ (D, I d մեխանիզմներ): Նման ռեակցիաների կոնկրետ օրինակներ կքննարկվեն այս տարրերի քիմիան նկարագրելիս:
Redox ռեակցիաներ.Ռեդոքս պրոցեսների մեծ մասը առանձին տարրական փուլերի բարդ համակցություն է, որոնցից յուրաքանչյուրը ներառում է մեկ կամ, շատ ավելի քիչ հաճախ, երկու էլեկտրոնի փոխանցում: Ավելի մեծ թվով էլեկտրոնների միաժամանակյա փոխանցում լուծույթներում անհնար է։
Մեկ էլեկտրոնի փոխանցումը կարող է տեղի ունենալ երկու մեխանիզմներից մեկի միջոցով՝ արտաքին ոլորտ, այսինքն՝ թունելավորման միջոցով, կամ ներքին ոլորտ՝ կամրջող լիգանդի միջոցով: Ինտրասֆերային մեխանիզմն իրականացվում է հալոգենիդներ, հիդրօքսիդ իոններ և կարբոքսիլ խմբեր պարունակող համալիրներում, որոնք կարող են կամուրջներ լինել մետաղների միջև։ Օրինակ՝ պենտամին քլորոկոբալտ (III) և հեքսաակուախրոմ (II) իոնների ռեակցիան է։ Գործընթացը կարելի է մոտավորապես բաժանել երեք փուլի՝ կամրջող քլորիդ իոնով հետերմետաղային համալիրի ձևավորում, էլեկտրոնների փոխանցում և կամրջող համալիրի տարրալուծում։ Ստացված 2+ իոնը, լինելով անկայուն, ակնթարթորեն վերածվում է ջրային համալիրի, իսկ իներտ [(H 2 O) 5 CrCl] 2+-ը չի փոխազդում ջրի հետ.

Եթե համակարգում չկան մասնիկներ, որոնք կարող են կամուրջների դեր կատարել, գործընթացը շարունակվում է արտաքին ոլորտում.
2+ + 3+ = 3+ + 2+ .
Հատկապես անհրաժեշտ է ընդգծել 6-րդ գլխում քննարկված օքսիդատիվ ավելացման և վերականգնողական վերացման ռեակցիաները։
Համակարգված լիգանների ռեակցիաները.Ռեակցիաների այս խումբը ներառում է մետաղական իոնի կողմից համակարգված լիգանդների փոփոխման գործընթացները։ Օրինակ, դիկետոնատային համալիրները, ինչպես ազատ դիկետոնները, կարող են լինել նիտրացված, ացիլացված կամ հալոգենացված: Համակարգված լիգանների ռեակցիաների ամենահետաքրքիր և անսովոր օրինակն է կաղապարի սինթեզ– մետաղական իոնի վրա լիգանդի «հավաքման» եզակի մեթոդ: Օրինակ՝ ֆտալաթթվի նիտրիլից ֆտալոցիանիների սինթեզը, որը տեղի է ունենում պղնձի (II) իոնների առկայության դեպքում, և մակրոցիկլային Շիֆի բազայի սինթեզը 2-ամինոբենզալդեհիդից, որը տեղի է ունենում նիկելի (II) իոնների առկայության դեպքում.

Մետաղի բացակայության դեպքում գործընթացը ընթանում է այլ ճանապարհով, և ցանկալի արտադրանքը առկա է միայն փոքր քանակությամբ ռեակցիայի խառնուրդում: Մետաղական իոնը կաղապարի սինթեզում գործում է որպես մատրիցա («կաղապար»)՝ կայունացնելով միմյանց հետ հավասարակշռության մեջ գտնվող արտադրանքներից մեկը և տեղափոխելով հավասարակշռությունը դեպի դրա ձևավորում։ Օրինակ, X + Y ¾® ռեակցիայում առաջանում է A և B արտադրանքների խառնուրդ, որում գերակշռում է B-ն, որն ունի ավելի ցածր էներգիա։ Մետաղական իոնի առկայության դեպքում ռեակցիայի արտադրանքներում A նյութը գերակշռում է M-ի հետ կոմպլեքսի տեսքով (նկ. 1.40. X-ի և Y-ի փոխազդեցության էներգետիկ դիագրամ մետաղի իոնի բացակայության դեպքում (ձախ) և նրա ներկայություն (բ)):
Հարցեր և առաջադրանքներ
1. Հետևյալ միացություններից ո՞րն ունի պերովսկիտային կառուցվածք. BaTiO 3, LiNbO 3, LaCrO 3, FeTiO 3, Na 2 WO 4, CuLa 2 O 4, La 2 MgRuO 6: Իոնային շառավիղների աղյուսակը տրված է Հավելվածում: Հիշեք, որ բարդ օքսիդային փուլերում B դիրքերը կարող են պարունակել երկու տարբեր մետաղների կատիոններ:
2. Օգտագործելով TCP-ը, որոշեք, թե արդյոք հետևյալ սպինելները կլինեն ուղիղ, թե շրջված՝ ZnFe 2 O 4, CoFe 2 O 4, Co 3 O 4, Mn 3 O 4, CuRh 2 O 4:
3. Thiocyanate ion SCN - ունի երկու դոնոր կենտրոններ՝ կոշտ և փափուկ: Գուշակիր, թե ինչ կառուցվածք կունենան կալցիումի և պղնձի (I) թիոցիանատային համալիրները: Ինչու՞ հնարավոր չէ ստանալ պղնձի (II) թիոցիանատ:
4. Cr 2+ ակվա իոնի սպեկտրը (հիմնական վիճակի տերմին 5 D) ունի երկու գոտի (նկ. 1.41. Cr 2+ ակվա իոնի սպեկտրը), թեև մոտակա գրգռված վիճակների մեջ չկա մեկը նույն բազմապատկությունը. Ինչո՞վ է սա բացատրվում: Ի՞նչ գույն ունի այս իոնը:
5. Օգտագործելով ստորև բերված Δο արժեքները, հաշվարկեք ESC-ը հետևյալ կոմպլեքսների համար kJ/mol-ով.
ա) 2–, Δο = 15000 սմ–1,
(բ) 2+, Δο = 13000 սմ–1,
(գ) 2–, Δο (4–ի համար)= 21000 սմ–1,
Վերցրեք զուգակցման էներգիան հավասար է 19000 սմ –1, 1 կՋ/մոլ = 83 սմ –1: Հաշվե՛ք դրանց մագնիսական մոմենտները (սպին բաղադրիչ):
6. Օգտագործելով TCP, բացատրեք, թե ինչու CN – իոնը փոխազդում է hexaaquanickel(III) իոնի հետ՝ առաջացնելով hexacyanoferrate (II), իսկ hexaaquanickel (II) իոնի հետ՝ առաջացնելով տետրացիանիկելատ (II):
7. Ստորև բերված են պղնձի(II) ջրային համալիրի ջրի հաջորդական փոխարինման ռեակցիայի հաստատունները ամոնիակով. K 1 = 2´10 4, K 2 = 4´10 3, K 3 = 1´10 3, K 4. = 2´10 2, K5 = 3´10 –1, K6<< 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. Ինչպե՞ս է փոխվում կատիոնների կոշտությունը 3d շարքով շարժվելիս: Արդյո՞ք սա համահունչ է համալիրների կայունության հաստատունների փոփոխության կարգին (Իրվինգ-Ուիլիամսի շարք, նկ. 1.34):
9. Բացատրեք, թե ինչու է վեցակվային երկաթի (III) իոնը անգույն, իսկ երկաթի (III) աղերի լուծույթները՝ գունավոր:
10. Առաջարկեք 3– + 3– = 4– + 2– ռեակցիայի մեխանիզմ, եթե հայտնի է, որ տիոցիանատ իոնի ներմուծումը լուծույթ հանգեցնում է ռեակցիայի արագության փոփոխության, և արագությունը գործնականում անկախ է. ամոնիակի առկայությունը. Տվեք այս փաստերի բացատրությունը:
Անցումային մետաղների իոնների էլեկտրոնային կառուցվածքի փոփոխությունների հայեցակարգը նրանց շրջապատող լիցքավորված մասնիկների էլեկտրական դաշտի ազդեցության ներքո առաջարկվել է Բեքերելի կողմից և հետագայում մշակվել Հ.Ա. Բեթեն և Ջ.Վան Վլեքը սկզբում XX Վ. Այս հասկացությունները կիրառվել են բարդ միացությունների էլեկտրոնային կառուցվածքի և հատկությունների նկարագրության համար միայն մեջտեղում XX դարում Հ. Հարթմանի կողմից և մոդելը կոչվեց «բյուրեղային դաշտի տեսություն» (CFT):
TCH-ի հիմնական դրույթները անցումային համալիրների համարդ մետաղներ Նկ. 24):
1. - Համալիրը գոյություն ունի և կայուն է կոմպլեքսացնող նյութի էլեկտրաստատիկ փոխազդեցության շնորհիվ լիգանդների հետ:
2. - Լիգանդները համարվում են առանց դրանց էլեկտրոնային կառուցվածքը հաշվի առնելու որպես կետային լիցքեր կամ դիպոլներ:
3. - Լիգանդների էլեկտրական դաշտի ազդեցության տակ վալենտական հնգապատիկ այլասերված է ( n -1) դ ուղեծրերը բաժանվում են՝ կախված լիգանդի միջավայրի համաչափությունից:
4. - Մետաղական վալենտային էլեկտրոնների բաշխումը պառակտումների միջև ( n -1) դ ուղեծրերը կախված են պտույտի զուգավորման էներգիայի և տրոհման էներգիայի հարաբերակցությունից:
Դիտարկենք, օրինակ, հնգապատիկ դեգեներատի էներգիայի փոփոխությունը ( n -1) դ կենտրոնական մետաղական իոնի ուղեծրեր Մ n+ , գտնվում է կոորդինատների կենտրոնում՝ բացասական լիցքավորված լիգանդների ութանիստ դաշտի ազդեցության տակ [ՄԼ 6] զ , գտնվում է կոորդինատային առանցքների վրա (նկ. 25): Մետաղի շուրջը բացասական լիցքի միատեսակ բաշխմամբ բացասական լիցք ունեցող լիգաններից մետաղի վալենտային էլեկտրոնների վանման արդյունքում (գնդաձև սիմետրիկ էլեկտրական դաշտ) բոլոր հինգի էներգիանդ ուղեծրերը կավելանան E 0-ով ազատ M-ի համեմատ n+ իոն. Քանի որդ ուղեծրերն ունեն տարածական տարբեր կողմնորոշումներ, այնուհետև կոորդինատային առանցքների վրա տեղակայված լիգանդների վրա բացասական լիցքերի խտությամբ տարբերվում է դրանց էներգիայի աճը: Էներգիայի խթանում d z 2 և d x 2- y 2 Կոորդինատային առանցքների վրա գտնվող լիգանդներին ուղղված ուղեծրերն ունեն էներգիայի ավելի մեծ աճ dxy, dxz և dyz ուղեծրեր, որոնք ուղղված են կոորդինատային առանցքների միջև:
տրոհման էներգիահնգապատիկ այլասերված ( n -1) ուղեծրերը կրկնակի դեգեներացված են d x 2- y 2, z 2 ուղեծրեր և եռակի այլասերված d xy, xz, yz ուղեծրերը կոչվում են (նկ. 26) բյուրեղային դաշտի բաժանման պարամետր:Քանի որ պառակտման էներգիանդ Լիգանդների ութանիստ դաշտում ուղեծրերը չեն փոխվում գնդաձև սիմետրիկ էլեկտրական դաշտի համեմատ, այնուհետև երկուսի էներգիայի աճը d x 2- y 2, z 2 ուղեծրերը տեղի են ունենում 0.6-ումԴ 0 և երեքի էներգիայի նվազում d xy , xz , yz ուղեծրերը 0,4-ով Դ 0 .
Լիգանդների էլեկտրական դաշտի ազդեցության տակ ճեղքված մետաղական ուղեծրերի այլասերվածության և համաչափության աստիճանը նշելու համար օգտագործվում են հատուկ նշաններ։ Եռակի այլասերված և սիմետրիկ՝ կապված սիմետրիայի կենտրոնի և կոորդինատային առանցքների շուրջ պտույտի հետ d xy, xz, yz t 2 գ «, մինչդեռ կրկնակի այլասերված է և նաև սիմետրիկ՝ համաչափության կենտրոնի նկատմամբ d x 2- y 2, z 2 ուղեծրերը նշանակվում են նշանով « eg « Այսպիսով, լիգանդների ութանիստ էլեկտրական դաշտի ազդեցությամբ հնգապատիկ դեգեներացվում է ( n -1) դ Կոմպլեքսավորող գործակալի ուղեծրերը բաժանվում են եռակի և կրկնակի այլասերված տարբեր էներգիաների t 2 g և e g օրբիտալներ:
Նմանատիպ դիտարկում հնգապատիկ դեգեներատի էներգիայի փոփոխության վերաբերյալ ( n -1) դ Ազատ մետաղական իոնի ուղեծրերը լիգանների քառանիստ միջավայրում [ՄԼ 4 ]զ կոմպլեքսները ցույց են տալիս (նկ. 27) դրանց պառակտումը նաև երկակի (e) և եռակի (տ ) այլասերված ուղեծրեր, սակայն հակառակ էներգիայի դիրքով։ Բաժանորդագրություն»է երբ նշանակվում է «ե» և «տ » ուղեծրերը նշված չեն, քանի որ քառանիստ համալիրը չունի համաչափության կենտրոն: Քառաեդրային համալիրի լիգանների քանակի նվազումը ութանիստ համալիրի համեմատ հանգեցնում է բյուրեղային դաշտի պառակտման պարամետրի բնական նվազմանը.Դ T = 4/9 ԴՄԱՍԻՆ .
Մետաղի լիգանդի միջավայրի համաչափության նվազեցում, օրինակ, ութանիստի քառանկյուն աղավաղում [ՄԼ 6] զ համալիրներ, որոնք կապված են առանցքային լիգանդների հետ մետաղ-լիգանդ կապերի ընդլայնման հետ [ ML 4 X 2 ] z և հարթության քառակուսու ձևավորումը սահմանափակող դեպքում [ՄԼ 4 ]զ կոմպլեքսներ, տանում է (նկ. 28) դեպի վալենտության լրացուցիչ պառակտում ( n -1) դ մետաղական ուղեծրեր.
Պառակտման լցնում ( n -1) դ մետաղական ուղեծրերը տեղի են ունենում Պաուլիի սկզբունքների և նվազագույն էներգիայի համաձայն: Ութանիստ համալիրների համարդ 1, դ 2 և դ 3 մետաղի էլեկտրոնային կոնֆիգուրացիան, վալենտային էլեկտրոնները, համաձայն Հունդի կանոնի, բնակեցվում ենտ 2 գ ուղեծրեր զուգահեռ պտույտներով, որոնք տանում են դեպի t 2 g 1, t 2 g 2 և t 2 g 3 Համալիրների էլեկտրոնային կառուցվածքը.
d 4-ով մետաղների համար էլեկտրոնային կոնֆիգուրացիա, երեք էլեկտրոններ նույնպես բնակվում ենտ 2 գ ուղեծրեր զուգահեռ պտույտներով: Չորրորդ էլեկտրոնի պոպուլյացիան կախված է պոպուլյացիայի ընթացքում սպինի զուգավորման էներգիայի արժեքից (E sp.-sp.) էներգիայի ծախսերից։տ 2 գ ուղեծրեր հակազուգահեռ սպինով և Հունդի կանոնի խախտմամբ կամ բյուրեղային դաշտի կողմից տրոհվելու էներգիայի հաղթահարմամբԴ o գրանցման ժամանակ, օր Հունդի կանոնին համապատասխան զուգահեռ պտույտ ունեցող ուղեծրեր։ Առաջին դեպքում ձևավորվում է բարդույթ t 2 գ 4 էլեկտրոնային կառուցվածք և կրճատված պտույտների բազմակիություն՝ համեմատած ազատ մետաղի հետ 2 S +1 = 3 (S - ընդհանուր պտույտ), որը կոչվում է ցածր պտույտ. Երբ Հունդի կանոնը կատարվի, և չորրորդ էլեկտրոնը բնակեցվի eg ուղեծրերի հետ կազմվում է բարդույթտ 2 գ 3 էգ 1 էլեկտրոնային կառուցվածք և ազատ մետաղի նման պտտվող մուլտիպլետ 2Ս +1 = 5. Այդպիսի կոմպլեքսները կոչվում են բարձր պտույտ.
Նմանապես, երբ բաշխում է վալենտ d5, d6 և d7 մետաղական էլեկտրոններ t 2 գ և էլ Octadric համալիրների ուղեծրերը կախված E sp.-sp հարաբերակցությունից: ԵվԴՕ Հնարավոր է երկու տեսակի համալիրների ձևավորում.
E sp.-sp.-ում: > ԴՕ ձևավորվում են մետաղի էլեկտրոնային կառուցվածքով բարձր պտտվող համալիրներ t 2 g 3 e g 2, t 2 g 4 e g 2, t 2 g 5 e g 2 ըստ Հունդի կանոնի և ազատ մետաղի նման պտույտի բազմակիության՝ 2 S +1 = 6, 5, 4;
E sp.-sp.< ԴՕ ձևավորվում են մետաղի էլեկտրոնային կառուցվածքով ցածր պտտվող կոմպլեքսներ t 2 g 5 e g 0, t 2 g 6 e g 0, t 2 g 6 e g 1 և ավելի ցածր պտույտի բազմակիությունը՝ համեմատած ազատ մետաղի հետ 2 S +1 = 2, 1, 2:
Մետաղական համալիրներ հետդ 8, դ 9 և դ 10 էլեկտրոնային կոնֆիգուրացիան բնութագրվում է էլեկտրոնի բաշխման մեկ տեսակով. t 2 g 6 e g 2, t 2 g 6 e g 3, t 2 g 6 e g 4 ազատ մետաղի նման պտույտի բազմակիությամբ՝ 2 S +1 = 3, 2 և 0:
Այսպիսով, պարամետրըԴ, բնութագրելով պառակտումը ( n -1) դ Լիգանդների էլեկտրական դաշտի ազդեցության տակ գտնվող մետաղական ուղեծրերը կոմպլեքսների հատկությունների փոփոխությունների հիմնական բնութագրիչներից մեկն է՝ համեմատած ազատ մետաղական իոնի հետ։ Դա պարամետրի արժեքն էԴորոշում է մետաղի մի շարք էլեկտրոնային կոնֆիգուրացիաների համար, որոշում է բարձր կամ ցածր պտտվող կոմպլեքսների ձևավորման հնարավորությունը՝ էլեկտրոնների տարբեր բաշխումներով պառակտված օրբիտալների և տարբեր հատկությունների վրա:
Բյուրեղային դաշտի բաժանման պարամետրի արժեքըԴկախված է կոմպլեքսավորող նյութի մետաղի բնույթից, այն շրջապատող լիգանդներից և կոմպլեքսավորող նյութի շուրջ նրանց տարածական դիրքից.
1. Լիգանդները պարամետրի մեծացման կարգովԴնույն մետաղի և համանման երկրաչափական կառուցվածքի համալիրների համար գտնվում են այսպես կոչված սպեկտրոքիմիական շարքերում.Ես -< Br - < Cl - < F - < OH - < C 2 O 4 2- ~ H 2 O < NCS - < NH 3 ~ En < NO 2 - < CN - < CO . Շարքի սկզբում կան «թույլ դաշտի» լիգանդներ՝ հալոգեն իոններ, հիդրօքսիդ և օքսալատ իոններ, ջուր, որոնք կազմում են գերակշռող բարձր սպինային համալիրներ։ Շարքի աջ կողմի լիգանդները՝ ածխածնի մոնօքսիդը, ցիանիդը և նիտրիտ իոնները կոչվում են «բարձր դաշտի» լիգանդներ և սովորաբար բնութագրվում են ցածր պտտվող կոմպլեքսների ձևավորմամբ: Շարքի միջնամասում գտնվող լիգանդների համար՝ թիոցիանատ իոն, ամոնիակ, էթիլենդիամին, կախված մետաղի բնույթից, ձևավորվում են բարձր կամ ցածր սպինային համալիրներ։
2. Լիգանդների էլեկտրական դաշտի արդյունավետության բարձրացումդ մետաղական ուղեծրեր 3-րդ շարքում դրանց չափի մեծացմամբդ<< 4 d < 5 d , ինչպես նաև մետաղի օքսիդացման աստիճանի բարձրացումը հանգեցնում է պարամետրի բարձրացմանԴշարքում՝ Mn(II)< Ni (II ) < Co (II ) < Fe (II ) < V (II ) < Fe (III ) < Co (III ) < Mn (IV ) < Mo (III ) < Rh (III ) < Ru (III ) < Pd (IV ) < Ir (III ) < Pt (IV ).
3. Պարամետր Դքառաեդրային համալիրների համար պարամետրի միայն 4/9-ն էԴութանիստ համալիրներ.
«Ծանր» համալիրներ 4դ և 5 դ մետաղները, գրեթե անկախ լիգանդների բնույթից, ձևավորում են հիմնականում ցածր պտտվող կոմպլեքսներ, մինչդեռ ցածր կամ բարձր պտտվող բարդույթների առաջացումը «թեթև» է 3դ մետաղները հիմնականում որոշվում են լիգանդի դաշտի ուժով։
Ի տարբերություն MMS-ի, բյուրեղային դաշտի տեսությունը հիմնավորելու է նույն մետաղի իոնի համալիրների մագնիսական հատկությունների տարբերությունը տարբեր լիգանդի միջավայրերով, օրինակ՝ դիամագնիսական [ Fe (CN ) 6 ] 4- և պարամագնիսական [ Fe (H2O ) 6 ] 2+-ը չի օգտագործում իրենց ներօրբիտալի վարկածը ( d 2 sp 3 հիբրիդացում) և արտաքին ուղեծրային ( sp 3 d 2 հիբրիդացում) կառուցվածքը: Մագնիսական հատկությունների տարբերությունը որոշվում է 6-վալենտ էլեկտրոնների բաշխման ցածր և բարձր սպինով։ Fe (II ) պառակտմամբ t 2 գ և էլ ուղեծրեր (նկ. 29): Լինելով ուժեղ և թույլ դաշտային լիգանդներ՝ ձևավորվում են ցիանիդ իոններ և ջրի մոլեկուլներ Fe (II ) ցածր և բարձր սպինային համալիրներ հետ t 2 g 6 e g 0 և t 2 g 4 e g 2 էլեկտրոնների բաշխումը, որը որոշում է դիամագնիսականությունը [ Fe (CN ) 6 ] 4- և պարամագնիսականություն [ Fe (H2O ) 6 ] 2+ կոմպլեքսներ.
Հնգապատիկ այլասերվածների բաժանում ( n -1) դ մետաղական ուղեծրերը համալիրներում և պարամետրերի փոփոխություններըԴկախված լիգանդների բնույթից՝ որոշում է բարդույթների բնորոշ գույնը ինչպես պինդ վիճակում, այնպես էլ լուծույթներում։ Երբ համալիրը կլանում է էլեկտրամագնիսական ճառագայթումը սպեկտրի տեսանելի հատվածում (400-750) նմ, որի քվանտի էներգիան կազմում է E.արժեքին հավասար Դ, էլեկտրոնի փոխանցումը տեղի է ունենում t 2 գ eg ուղեծրեր. Սպեկտրի տեսանելի շրջանի չներծծված էլեկտրամագնիսական ճառագայթումն է, որը որոշում է համալիրի գույնը՝ համաձայն «Նյուտոնի գունային շրջանակի» (նկ. 30), ցույց տալով տեսանելի ճառագայթման առաջնային և երկրորդային գույները։
Aquacomplex տիտան ( III) [Ti (H 2 O) 6] 3+ c t 2 g 1 e g 0 էլեկտրոնային բաշխումը ֆոտոգրգռման արդյունքում, որը համապատասխանում է էլեկտրոնի անցմանը դեպի ավելի բարձր էներգիա e g ուղեծրեր.
3+ (t 2g 1 e g 0) + ժn= * 3+ (t 2g 0 eg 1)
կլանում է լույսի քվանտաները սպեկտրի դեղին շրջանում, ինչը հանգեցնում է նրա մանուշակագույն գույնի: Մետաղական իոնի լիգանդի միջավայրի փոփոխությունը սպեկտրոքիմիական շարքում լիգանդի դիրքին համապատասխան հանգեցնում է պարամետրի փոփոխության.Դև, որպես հետևանք, բարդի կողմից կլանված քվանտների էներգիայի և ալիքի երկարության փոփոխության և համալիրի բնորոշ գույնի, օրինակ, շարքի [ CuCl 4 ] 2-, [ Cu (H 2 O ) 4 ] 2+, [ Cu (NH 3 ) 4 ] 2+ կոմպլեքսների գույնը կանաչից փոխվում է կապույտ և մանուշակագույն։
Բյուրեղային դաշտի պառակտող էներգիայի հետ միասինԴ, նույնպես կարևոր դեր է խաղում TCH-ում բյուրեղային դաշտի կայունացման էներգիա(ESKP) - էներգիայի ստացում, երբ էլեկտրոնները բաշխվում են համալիրում պառակտվածների միջև ( n -1) դ մետաղական ուղեծրեր՝ համեմատած հնգապատիկ դեգեներացիայի էներգիայի հետ ( n -1) դ մետաղական ուղեծրեր համարժեք գնդաձև էլեկտրական դաշտում (նկ. 31, 32):
Ութանիստ և քառաեզրային համալիրների ESCP:|
Mn+ |
Ութանիստ համալիրներ |
Տետրաեդրային համալիրներ |
|
|
Ցածր պտտում |
Բարձր պտույտ |
Բարձր պտույտ |
|
|
0.4 Դ o |
0.6 ԴՏ |
||
|
0.8 Դ o |
1.2 ԴՏ |
||
|
1.2 Դ o |
0.8 ԴՏ |
||
|
դ 4 |
1.6 Դ o |
0.6 Դ o |
0.4 ԴՏ |
|
դ 5 |
2.0 Դ o |
0 Դ o |
0 ԴՏ |
|
դ 6 |
2.4 Դ o |
0.4 Դ o |
0.6 ԴՏ |
|
դ 7 |
1.8 Դ o |
0.8 Դ o |
1.2 ԴՏ |
|
դ 8 |
1.2 Դ o |
0.8 ԴՏ |
|
|
դ 9 |
0.6 Դ o |
0.4 ԴՏ |
|
|
դ 10 |
0 Դ o |
||
Համալիրի EXP արժեքի գնահատումը ստացվում է բաժանման դիագրամների հիման վրա ( n -1) դ մետաղական ուղեծրեր լիգանների էլեկտրական դաշտում, որոնք ցույց են տալիս համակարգի էներգիայի նվազում կամ աճ՝ համեմատած գնդաձև էլեկտրական դաշտի հետ, երբ էլեկտրոնները բաժանվում են ( n -1) դ ուղեծրեր. Ութանիստի համար [ՄԼ 6] զ համալիրներ (նկ. 32) յուրաքանչյուր էլեկտրոնի պոպուլյացիատ 2 գ ուղեծրերը հանգեցնում են համակարգի էներգիայի ավելացմանը 0,4-ովԴախ, գրանցում eg պահանջում է էներգիայի ծախս 0.6ԴՕ . Չորսանկյունի համար [ՄԼ 4 ]զ հակադիր էներգիայի դիրքերով բարդույթներ e և t մետաղական ուղեծրեր - յուրաքանչյուր էլեկտրոնի զբաղեցում պառակտմամբ e և t ուղեծրերն ուղեկցվում են համակարգի էներգիայի 0,6-ով նվազումով և ավելացմամբԴտ և 0.4 ԴՏ .
Լինելով համալիրների թերմոդինամիկական կայունության արտացոլում, դրանց ESCR արժեքների գնահատումները համահունչ են բարձր պտտվող հեքսաֆտորիդային համալիրների համար բյուրեղային ցանցի էներգիայի փոփոխության փորձարարական տվյալներին:դ մետաղներ (նկ. 33):
ESC արժեքները մեզ թույլ են տալիս որոշել առավել նախընտրելի կոորդինացիոն իզոմերը (Նկար 34), օրինակ՝ [ Cu (NH 3 ) 6 ][ NiCl 4 ] կամ [ Ni (NH 3 ) 6 ][ CuCl 4 ]։ Դա անելու համար հաշվարկեք ESC-ի տարբերությունը իզոմերների բարդ կատիոնի և անիոնի համար: ESCR արժեքը [ Cu (NH 3 ) 6 ] 2+ և [NiCl 4 ] 2 - 0,6 է Դ o և 0.8 ԴՏ համապատասխանաբար. Հաշվի առնելով դաԴ t = 4/9 Դ o ESCP արժեքների տարբերությունը [ Cu (NH 3 ) 6 ] 2+ և [NiCl 4 ] 2- կլինի 19/45Դ o . Նմանապես, ESKP-ի արժեքները [ Ni (NH 3 ) 6 ] 2+ և [CuCl 4 ] 2- 1,2 է Դ o և 0.4 ԴՏ , և նրանց միջև տարբերությունը 28/45 էԴ o . Մեծ տարբերություն ESCP համալիր կատիոն [ Ni (NH 3 ) 6 ] 2+ և անիոն [CuCl 4 ] 2- համեմատ [ Cu (NH 3 ) 6 ] 2+ և [NiCl 4 ] 2- ցույց է տալիս կազմի իզոմերի ավելի նախընտրելի ձևավորում [ Ni (NH 3 ) 6 ][ CuCl 4 ]:
Մետաղի էլեկտրոնային կառուցվածքի ազդեցության մագնիսական և օպտիկական հատկությունների հետ միասին համալիրների թերմոդինամիկական կայունության վրա, TKP-ն կանխատեսում է բարդույթների երկրաչափական կառուցվածքի աղավաղում էլեկտրոնների անհավասար բաշխմամբ: n -1) դ մետաղական ուղեծրեր (նկ. 35): Ի տարբերություն կանոնավոր ութանիստ կառուցվածքի [ Co (CN) 6 ] 3- s t 2 g 6 e g 0 էլեկտրոնային բաշխում, նմանատիպ համալիրի քառանկյուն աղավաղում [ Cu (CN) 6 ] 4- s t 2 g 6 e g 3 Էլեկտրոնային բաշխում, որը պարունակում է 3 էլեկտրոն 2 անգամ դեգեներացիայի վրա eg ուղեծրեր, հանգեցնում է ութանիստի արդյունավետ վերափոխմանը քառակուսի հարթության համալիրի.
4- = 2- + 2CN - .
Վերոհիշյալ բոլորը ցույց են տալիս, որ համալիրների ֆիզիկաքիմիական հատկությունները բացատրելու և կանխատեսելու TCT-ի հարաբերական պարզությունն ու լայն հնարավորությունները որոշում են այս մոդելի մեծ ժողովրդականությունը բարդ միացություններում քիմիական կապերը նկարագրելու համար: Միևնույն ժամանակ, կենտրոնանալով կոմպլեքս առաջացման ժամանակ մետաղի էլեկտրոնային կառուցվածքի փոփոխությունների վրա՝ TCP-ն հաշվի չի առնում լիգանդների էլեկտրոնային կառուցվածքը՝ դրանք դիտարկելով որպես կետային բացասական լիցքեր կամ դիպոլներ։ Սա հանգեցնում է TCP-ի մի շարք սահմանափակումների՝ համալիրների էլեկտրոնային կառուցվածքը նկարագրելիս: Օրինակ, TCP-ի շրջանակներում դժվար է բացատրել մի շարք լիգանների և մետաղների դիրքը սպեկտրոքիմիական շարքերում, ինչը կապված է որոշակի աստիճանի կովալենտության և բազմաթիվ մետաղ-լիգանդ կապերի առաջացման հնարավորության հետ։ Այս սահմանափակումները վերացվում են բարդ միացությունների էլեկտրոնային կառուցվածքը դիտարկելիս՝ օգտագործելով մոլեկուլային օրբիտալների ավելի բարդ և պակաս տեսողական մեթոդը:
Վալենտական կապի տեսություն Քվանտային մեխանիկական տեսություններից առաջինն էր, որն օգտագործվում էր բարդ միացություններում քիմիական կապերի բնույթը մոտավորապես բացատրելու համար։ Դրա կիրառումը հիմնված էր գաղափարի վրա դոնոր-ընդունող մեխանիզմլիգանդի և կոմպլեքսավորող նյութի միջև կովալենտային կապերի ձևավորում: Լիգանդհաշվում է դոնոր մասնիկ, ունակ է փոխանցել զույգ էլեկտրոններ ընդունող – բարդացնող միջոց, որն ապահովում է իր էներգիայի մակարդակների ազատ քվանտային բջիջներ (ատոմային օրբիտալներ) կապերի ձևավորման համար։
Կովալենտային կապերի ձևավորման համար կոմպլեքսավորող նյութի և լիգանդների միջև անհրաժեշտ է, որ թափուր ս-, էջ- կամ դ- ենթարկվել են կոմպլեքսավորող նյութի ատոմային ուղեծրերին հիբրիդացումորոշակի տեսակ. Հիբրիդային ուղեծրերը տարածության մեջ որոշակի դիրք են զբաղեցնում, և դրանց թիվը համապատասխանում է համակարգման համարըբարդացնող միջոց.
Սա հաճախ է պատահում միավորելով չզույգված էլեկտրոններըկոմպլեքսավորող նյութը զույգերով, որը թույլ է տալիս որոշակի քանակությամբ քվանտային բջիջներ՝ ատոմային օրբիտալներ, որոնք հետագայում մասնակցում են հիբրիդացմանը և քիմիական կապերի ձևավորմանը:
Լիգանդների էլեկտրոնների միայնակ զույգերը փոխազդում են կոմպլեքսավորող նյութի հիբրիդային օրբիտալների հետ, և համընկնումըԿոմպլեքսավորող նյութի և լիգանդի համապատասխան ուղեծրեր՝ միջմիջուկային տարածությունում էլեկտրոնային խտության աճով: Կոմպլեքսավորող նյութի էլեկտրոնային զույգերն իրենց հերթին փոխազդում են լիգանդի դատարկ ատոմային օրբիտալների հետ, կապի ամրապնդում դատիվ մեխանիզմի միջոցով. Այսպիսով, բարդ միացություններում քիմիական կապը տարածված է կովալենտբավարար կապ դիմացկունԵվ էներգետիկ առումով բարենպաստ.
Էլեկտրոնային զույգերը, որոնք տեղակայված են կոմպլեքսավորող նյութի հիբրիդային ուղեծրերում, հակված են տարածության մեջ զբաղեցնել այնպիսի դիրք, որտեղ նրանց փոխադարձ վանումը նվազագույն է։ Սա հանգեցնում է կառուցվածքըբարդ իոնները և մոլեկուլները, ըստ երևույթին, որոշակի կախվածության մեջ են հիբրիդացման տեսակը.
Դիտարկենք որոշ բարդույթների առաջացումը վալենտային կապերի տեսության տեսանկյունից։ Նախևառաջ, մենք նշում ենք, որ բարդացնող նյութերի ատոմների վալենտային ուղեծրերը էներգիայով մոտ են.
Ե (n- 1)դ » Ե ns » Ե n.p. » Ե րդ
|
Հիբրիդացման տեսակը |
Համալիրի երկրաչափություն |
||
|
գծային |
-
|
||
|
եռանկյունաձեւ |
- |
||
|
քառաեդրոն |
2-
|
||
|
2-
|
|||
|
sp 3 դ(զ 2) |
եռանկյուն երկպիրամիդ |
||
|
sp 3 դ(x 2 - y 2) |
քառակուսի բուրգ |
3-
|
|
|
sp 3 դ 2 , |
3+ |
||
|
sp 3 դ 3 |
հնգանկյուն երկպիրամիդ |
4-
|
Օրինակ, 2+ կատիոնը ներառում է ցինկ(II) կոմպլեքսավորող նյութը: Այս պայմանական իոնի էլեկտրոնային թաղանթն ունի 3 բանաձևը դ 10 4ս 0 4էջ 0 և պայմանականորեն կարելի է պատկերել հետևյալ կերպ.
թափուր 4 ս- և 4 էջ- Ցինկի (II) ատոմի ուղեծրերը կազմում են չորս sp 3-հիբրիդային ուղեծրեր՝ ուղղված դեպի քառանիստ գագաթները։
Ամոնիակի յուրաքանչյուր մոլեկուլ ազոտի ատոմի վրա ունի մեկ զույգ էլեկտրոն: Էլեկտրոնների միայնակ զույգ պարունակող ազոտի ատոմների ուղեծրերը համընկնում են spՑինկի (II) 3-հիբրիդային ուղեծրեր, որոնք կազմում են տետրամին ցինկի (II) 2+ քառաեդրային համալիր կատիոն.
Քանի որ 2+ իոնը չունի չզույգված էլեկտրոններ, այն դրսևորվում է դիամագնիսականհատկությունները.
Տետրաքլորմանգանատ (II) իոն 2- պարունակում է հինգ չզույգված էլեկտրոն 3-ում դ- ուղեծրեր և դատարկ 4 ս- և 4 էջ- ուղեծրեր. Ձևավորվում են դատարկ ուղեծրեր sp 3-հիբրիդային ուղեծրեր, որոնք համընկնում են էջ-քլորիդ իոնների ատոմային ուղեծրեր. 
Այսպես ստացված քառանիստ իոնը 2-ն է պարամագնիսական, քանի որ այն պարունակում է հինգ չզույգված էլեկտրոններ։
Օգտագործելով սովորական կանխատեսման ալգորիթմ ատոմային ուղեծրերի հիբրիդացման տեսակըՎալենտային կապի մեթոդի շրջանակներում կարելի է որոշել համալիրների երկրաչափությունտարբեր կազմի. Դրա համար առաջին հերթին անհրաժեշտ է գրել վալենտական մակարդակի էլեկտրոնային բանաձեւը և կառուցել քվանտային բջիջների վրա էլեկտրոնների բաշխման դիագրամ։ Օրինակ, չեզոք նիկելի ատոմի համար.

Անցում 4 ս-էլեկտրոններ 3-ի համար դ- ենթամակարդակի փոխակերպումներ պարամագնիսական Ni ատոմ 0 դյույմ դիամագնիսականմասնիկ Ni*: 
Ստացված դատարկ ուղեծրերը ենթարկվում են հիբրիդացման՝ ձևավորելով քառանիստ կոնֆիգուրացիա։ Այդպես կառուցված քառանիստ դիամագնիսական tetracarbonylnickel համալիր (CN = 4), որը բնութագրվում է զգալի կայունությամբ:
Եթե կոմպլեքսավորող նյութը նիկելն է (II)՝ էլեկտրոնային կոնֆիգուրացիայով 3 դ 8 4ս 0 4էջ 0, ապա 4-ից էլեկտրոնները տեղափոխելու անհրաժեշտություն ս- մինչև հիբրիդացումը անհետանում է ենթամակարդակը, քանի որ կա բավարար թվով դատարկ ուղեծրեր՝ 4-րդ կոորդինացիոն համակարգն իրականացնելու համար. 
Այս կառույցն ունի անկայուն պարամագնիսական tetrabromoniccolate (II) -ion 2- համալիր. Այնուամենայնիվ, երկու էլեկտրոններ միավորելիս 3 դ- Ենթամակարդակը զույգի մեջ է, և այս ենթամակարդակի քվանտային բջիջներից մեկի վերածումը թափուրի փոխում է և՛ հիբրիդացման տեսակը, և՛ ստացված համալիրի բնութագրերը. 
Հիբրիդացման տեսակը dsp 2 և համալիրի հարթ քառակուսի ձևն իրականացվում է ախոռի ձևավորման վրա դիամագնիսականհամալիր tetracyanoniccolate (II) -ion 2- (CN = 4): 
Եթե ցիանիդային համալիրի սինթեզն իրականացվում է լիգանդի ավելցուկի պայմաններում, կարող է ստացվել 5 կոորդինացիոն թիվը. 
Կայուն դիամագնիսական Pentacyanoniccolate(II)-ion 3- համալիրն ունի քառակուսի բուրգի ձև. 
Octahedral nickel(II) 2+ համալիր, չնայած պարամագնիսական, բայց բավականին կայուն։ Նրա կրթությունը պայմանավորված է sp 3 դ 2 - Նիկելի ատոմային ուղեծրերի հիբրիդացում. 
Եթե արտաքինի ատոմային ուղեծրերը դ-ենթամակարդակ, բարդ, որպես կանոն, մեծ չափով պարամագնիսականև կոչվում է արտաքին ուղեծրայինկամ բարձր պտույտ. Նման համալիրների կառուցվածքը կարող է համապատասխանել հիբրիդացման տեսակին, օրինակ. sp 3 դ 2 .
Այնպիսի կոմպլեքսներ, որոնց առաջացման ժամանակ տեղի է ունենում հիբրիդացում՝ արտաքինի ատոմային ուղեծրերի մասնակցությամբ. դ- ենթամակարդակները կոչվում են ներօրբիտալկամ ցածր պտույտև, որպես կանոն, դիամագնիսականկամ թույլ պարամագնիսական(Կոմպլեքսավորող նյութի բոլոր կամ գրեթե բոլոր էլեկտրոնները զուգակցված են, և հիբրիդացման տեսակը, օրինակ. դ 2 sp 3 կամ dsp 2).
Երկաթի(II) կոմպլեքսները հետազոտելիս հայտնաբերվում են ինչպես արտաքին ուղեծրային, այնպես էլ ներուղղծրային բարդույթներ։


Ստորև բերված դիագրամը ցույց է տալիս, թե ինչպես են դրանք ձևավորվում պարամագնիսական բարձր պտույտ hexafluoroferrate (II) -ion 4- և diamagnetic low-spin hexacyanoferrate (II) ion 4-.
Վալենտային կապերի տեսությունն ինքնին չի պատասխանում այն հարցին, թե ինչ տեսակի համալիր է ձևավորվում յուրաքանչյուր կոնկրետ դեպքում, քանի որ այս մեթոդը հաշվի չի առնում լիգանդի բնույթի ազդեցությունը: Հետևաբար, վալենտային կապի մեթոդը պետք է անպայմանորեն համալրվի համալիրի մագնիսական հատկությունների վերաբերյալ տվյալներով կամ ձևավորված համալիրի բնույթի վրա լիգանդի ազդեցության վերաբերյալ տեղեկություններով:
.Բյուրեղային դաշտի տեսություն փոխարինել է վալենտային կապերի տեսությանը 20-րդ դարի 40-ական թթ. Իր մաքուր ձևով այն ներկայումս չի օգտագործվում, քանի որ այն չի կարող բացատրել բարդ միացություններում կովալենտային կապերի ձևավորումը և հաշվի չի առնում լիգանդների իրական վիճակը (օրինակ՝ դրանց իրական չափերը) նույնիսկ փակ փոխազդեցության դեպքում։ դեպի զուտ էլեկտրաստատիկ:
Արդեն 50-ականների կեսերին պարզեցված բյուրեղային դաշտի տեսությունը փոխարինվեց բարելավվածով. լիգանդի դաշտի տեսություն, հաշվի առնելով բարդացնող նյութի և լիգանդի միջև քիմիական կապերի կովալենտային բնույթը։
Այնուամենայնիվ, բարդ միացությունների առաջացումը բացատրելու ամենաընդհանուր մոտեցումը տրված է մոլեկուլային ուղեծրի տեսություն(MO), որը ներկայումս գերակշռում է բոլոր մյուսների նկատմամբ: Մոլեկուլային ուղեծրային մեթոդը նախատեսում է և՛ զուտ էլեկտրաստատիկ փոխազդեցություն՝ համընկնող ատոմային ուղեծրերի բացակայության դեպքում, և՛ համընկնման միջանկյալ աստիճանների ամբողջ հավաքածուն:
Եկեք նայենք հիմնական հասկացություններին բյուրեղային դաշտի տեսություն, որը, ինչպես վալենտային կապերի տեսությունը, իր մեծ պարզության և պարզության շնորհիվ դեռևս պահպանում է իր կարևորությունը բարդ միացություններում քիմիական կապերի որակական նկարագրության համար։
Բյուրեղային դաշտի տեսության մեջ դիտարկվում է բարդացնող նյութի և լիգանդի միջև քիմիական կապը էլեկտրաստատիկ. Համաձայն այս տեսության՝ լիգանդները տեղակայված են կոմպլեքսավորող նյութի շուրջ՝ կանոնավոր պոլիեդրների գագաթներում ( պոլիեդրա) ինչպես կետային վճարներ. Տեսությունը հաշվի չի առնում լիգանդի իրական ծավալը։
Լիգանդները, ինչպես կետային լիցքերը, ստեղծում են բարդացնող նյութի շուրջ էլեկտրաստատիկ դաշտ(«բյուրեղային դաշտ», եթե դիտարկենք բարդ միացության բյուրեղ, կամ լիգանդի դաշտ), որտեղ բարդացնող նյութի էներգիայի մակարդակները և, առաջին հերթին, դ- ենթամակարդակներ բաժանվում են, և նրանց էներգիան փոխվում է: Պառակտման բնույթը, էներգիայի նոր մակարդակների էներգիան կախված է համաչափությունլիգանդների դասավորությունը (ութանիստ, քառանիստ կամ այլ բյուրեղային դաշտ): Երբ H 2 O, NH 3, CO և այլ մոլեկուլները կոորդինացվում են որպես լիգանդներ, դրանք համարվում են դիպոլներ, կողմնորոշված բացասական լիցքով դեպի կոմպլեքսավորող նյութը։
Դիտարկենք լիգանների ութանիստ դասավորության դեպքը (օրինակ՝ 3- կամ 3+)։ Ութանիստի կենտրոնում կա M(+n) կոմպլեքսավորվող ատոմ, որի վրա էլեկտրոններ են դ-ատոմային ուղեծրեր, և դրա գագաթներում կան լիգաններ՝ կետային բացասական լիցքերի տեսքով (օրինակ՝ F-իոններ կամ բևեռային մոլեկուլներ, ինչպիսիք են NH 3): Պայմանական M(+n) իոնում, որը կապված չէ լիգանդների հետ, բոլոր հինգի էներգիաները դ-AO-ն նույնն են (այսինքն՝ ատոմային ուղեծրերը այլասերված).
Այնուամենայնիվ, լիգանների ութանիստ դաշտում դ- Կոմպլեքսավորող նյութի AO-ները ընկնում են անհավասարդիրք. Ատոմային ուղեծրեր դ(զ 2) և դ(x 2 -
y 2), կոորդինատային առանցքների երկայնքով ձգված, ամենամոտն են լիգանդներին: Այս ուղեծրերի և ութանիստի գագաթներում տեղակայված լիգանդների միջև առաջանում են զգալի տարբերություններ վանող ուժեր, ինչը հանգեցնում է ուղեծրի էներգիայի ավելացմանը։ Այլ կերպ ասած, այս ատոմային ուղեծրերը ենթակա են լիգանդի դաշտի առավելագույն ազդեցությունը. Նման փոխազդեցության ֆիզիկական մոդել կարող է ծառայել ուժեղ սեղմված զսպանակը: 

Մնացած երեքը դ-ԱՕ – դ(xy), դ(xz) Եվ դ(yz), գտնվում են կոորդինատային առանցքների և լիգանդների միջև, նրանցից ավելի մեծ հեռավորության վրա են։ Այդպիսիների փոխազդեցությունը դ-Լիգանդներով AO-ն նվազագույն է, և հետևաբար էներգիան դ(xy), դ(xz) Եվ դ(yz)-ԱՕ-ն սկզբնականի համեմատ նվազում է։ 

Այսպիսով, հինգ անգամ այլասերված դ-AO կոմպլեքսավորող, ներս մտնելով ութանիստ լիգանդի դաշտ, բացահայտված պառակտումնոր ուղեծրերի երկու խմբի՝ եռակի այլասերված ուղեծրերցածր էներգիայով, դ(xy), դ(xz) Եվ դ(yz), Եվ կրկնակի այլասերված ուղեծրերավելի բարձր էներգիայով դ(զ 2) և դ(x 2 -
y 2). Այս նոր խմբերը դ- ուղեծրեր հետ ավելի ցածրԵվ ավելի բարձր էներգիանշանակել դե և դ g: 
Էներգիայի տարբերություներկու նոր ենթամակարդակ դե և դ g ստացել է անունը բաժանման պարամետր D0:
Ե 2 – Ե 1 = D0
Երկու նորերի գտնվելու վայրը էներգիայի ենթամակարդակներ դե և դգ բնօրինակի համեմատ ( դ-AO) էներգետիկ դիագրամի վրա ասիմետրիկ:
(Ե 2 – Ե 0) > (Ե 0 – Ե 1).
Քվանտային մեխանիկական տեսությունդա է պահանջում երբ էներգիայի նոր մակարդակները ամբողջությամբ լցված են էլեկտրոններով, ընդհանուր էներգիան մնում է անփոփոխ, այսինքն. նա պետք է մնա հավասար է Ե 0 .
Այսինքն՝ հավասարությունը պետք է բավարարվի
4(Ե 2 – Ե 0) = 6(Ե 0 – Ե 1),
որտեղ 4 և 6 - առավելագույնըէլեկտրոնների թիվը մեկ դգ - և դե -ԱՕ. Այս հավասարությունից բխում է, որ
(Ե 2 – Ե 0) / (Ե 0 – Ե 1) = 3/2 և
(Ե 2 – Ե 1) / (Ե 0 – Ե 1 >) = 5/2, կամ
D0/( Ե 0 – Ե 1) = 5/2, որտեղից ( Ե 0 – Ե 1) = 2/5 ´ D 0 >. Տեղադրելով յուրաքանչյուր էլեկտրոն առավելագույն վեց հնարավորից դ e-orbitals-ի պատճառները նվազում (շահումներ) էներգիա 2/5 D 0-ով: Ընդհակառակը, չորս հնարավորից յուրաքանչյուր էլեկտրոնի տեղադրումը վրա դ g ուղեծրերը առաջացնում են աճ (արժեքը) էներգիա 3/5 D 0-ով: Եթե բնակեցված է էլեկտրոններով դե - և դ g - orbitals ամբողջությամբ, ապա ոչ հաղթելովէներգիա չի լինի(ինչպես չի լինի լրացուցիչ էներգիայի սպառում): 4 ´ 3/5 ´ D 0 - 6 ´ 2/5 ´ D 0 = 0: Բայց եթե բնօրինակը դ-ԱՕ-ն միայն բնակեցված է մասամբև պարունակում է 1-ից մինչև 6 էլեկտրոն, և այդ էլեկտրոնները տեղադրվում են միայն վրա դ e -AO, ապա մենք ստանում ենք զգալի էներգիայի շահույթ. Յուրաքանչյուր լիգանդի առանձնահատկությունն ազդում է այս լիգանդի ստեղծած դաշտի վրա. ուժեղկամ թույլ. Ինչպես ավելի ուժեղ դաշտլիգանդներ քան ավելինիմաստը բաժանման պարամետր D0. Պառակտման պարամետրի ուսումնասիրությունը սովորաբար հիմնված է սպեկտրոսկոպիկհետազոտություն. Ալիքի երկարություններ կլանման գոտիներկոմպլեքսներ l բյուրեղային վիճակում կամ լուծույթում, էլեկտրոնների անցման պատճառով դ e - միացված դ g-AO, կապված բաժանման պարամետր D 0 հետևյալ կերպ. n = 1 / լ; Դ որտեղ է Պլանկի հաստատունը հհավասար է 6,626 ´ 10 - 34 J. s; Պառակտման պարամետր, բացի լիգանդի տեսակից, կախված է օքսիդացման աստիճանի վրաԵվ բնությունըբարդացնող միջոց. ժամը միջուկային լիցքի ավելացումԿոմպլեքս առաջացնող ատոմի D 0-ը նույնպես մեծանում է: Hexaamminiridium (III) 3+, hexaamminiridium (III) 3+, և hexaamminiridium (III) 3+ կատիոններ ( Զ= 27, 45 և 77) բնութագրվում են բաժանման պարամետրերով, որոնք հավասար են 22900, 34100 և 41000 սմ -1: D0-ի կախվածությունը լիգանդների բնույթից առավել բազմազան է։ Բազմաթիվ բարդ միացությունների ուսումնասիրության արդյունքում պարզվել է, որ իրենց սովորական օքսիդացման վիճակում գտնվող կոմպլեքսավորվող մետաղների տրոհման պարամետրը մեծացնելու ունակության առումով, ամենատարածված լիգանները կարելի է դասավորել հետևյալ կերպ. սպեկտրաքիմիական շարք, որի երկայնքով D 0-ի արժեքը միապաղաղ մեծանում է. Այսպիսով, ամենաուժեղ էլեկտրաստատիկ դաշտը բարդացնող նյութի շուրջ և ամենաուժեղ ճեղքումը դ-AO-ն առաջանում է NO 2 - լիգանդներով, CN -
և CO. Եկեք դիտարկենք էլեկտրոնների բաշխումը ավարտված վիճակում դե - և դ g-օրբիտալներ լիգանդների ութանիստ դաշտում: Գրանցվել դե - և դ g-orbitals-ը տեղի է ունենում լիովին համապատասխան Հունդի կանոնԵվ Պաուլիի սկզբունքը. Այս դեպքում, անկախ պառակտման պարամետրի արժեքից, առաջին երեք էլեկտրոնները զբաղեցնում են քվանտային բջիջները. դէլեկտրոնային ենթամակարդակ: Եթե էլեկտրոնների թիվը մեկ դ- կոմպլեքսավորող նյութի երեքից ավելի ենթամակարդակներ կան, դրանք բաժանված ենթամակարդակների վրա տեղադրելու երկու հնարավորություն կա: Պառակտման պարամետրի ցածր արժեքի դեպքում (լիգանդների թույլ դաշտը) էլեկտրոնները հաղթահարում են անջատող էներգետիկ արգելքը. դե - և դ g-օրբիտալներ; չորրորդ, ապա հինգերորդ էլեկտրոնները բնակեցնում են քվանտային բջիջները դ g-ենթամակարդակ. Ուժեղ լիգանդի դաշտով և բարձր D0 արժեքով բնակչությունը բնակեցված է չորրորդ և հինգերորդ էլեկտրոններով դ g-ենթամակարդակը բացառված է; լրացումն ընթացքի մեջ է դէլեկտրոնային ուղեծրեր. ժամը թույլ դաշտային լիգաններքվանտային բջիջները բնակեցնելով 4 կամ 5 էլեկտրոններով զուգահեռ պտույտներ, այնպես որ ստացված բարդույթը ուժեղ է ստացվում պարամագնիսական. Ուժեղ լիգանդի դաշտումմեկ, ապա երկու էլեկտրոնային զույգ է ձևավորվում դ e -ենթամակարդակ, այսպես պարամագնիսականությունբարդույթը շատ ավելի թույլ է ստացվում։ Վեցերորդ, յոթերորդ և ութերորդ էլեկտրոնները թույլ դաշտի դեպքում ետ են հայտնվում դ e-ենթամակարդակ, որը լրացնում է կոնֆիգուրացիաները էլեկտրոնային զույգերին (դեպքում մեկը դ 6, երկու - դ 7 և երեք - դ 8): Ուժեղ լիգանդի դաշտի դեպքում բնակվում է վեցերորդ էլեկտրոնը դ e -AO, տանող դեպի դիամագնիսականությունհամալիր, որից հետո գնում են յոթերորդ և ութերորդ էլեկտրոնները դ g-ենթամակարդակ: Ակնհայտ է, որ ութ էլեկտրոնային կոնֆիգուրացիայով կառուցվածքի տարբերություններլիգանների հետ բարդույթների միջև թույլԵվ ուժեղ դաշտերը անհետանում են. Օրբիտալների զբաղեցումը իններորդ և տասներորդ էլեկտրոնի կողմից նույնպես չի տարբերվում երկու տեսակի բարդույթների համար. Եկեք վերադառնանք 3+ և 3- ութանիստ բարդ իոնների էլեկտրոնային կառուցվածքի քննարկմանը: Ըստ գտնվելու վայրի սպեկտրաքիմիական շարք, ամոնիակ NH 3-ը լիգանդներից է ուժեղ դաշտ
և ֆտորիդ իոն F-– թույլ դաշտ
. Հետևաբար, ատոմային ուղեծրերի զբաղեցումը էլեկտրոնների կողմից այս համալիրներում տեղի կունենա հետևյալ սխեմայի համաձայն. 3- անիոնում F - լիգանդները ստեղծում են թույլ բյուրեղային դաշտ (D 0 = 13000 սմ - 1), իսկ սկզբնական 3-ի բոլոր էլեկտրոնները. դ 6 - ԲԲԸ գտնվում են դե - և դ g ուղեծրեր առանց որևէ զուգավորման: Բարդ իոն է բարձր պտույտև պարունակում է չորս չզույգված էլեկտրոններ, ուստի այն պարամագնիսական. 3+ իոնում NH 3 լիգանդները ստեղծում են ուժեղ բյուրեղային դաշտ (D 0 = 22900 սմ - 1), բոլոր 3-ը դ 6 -էլեկտրոնները տեղադրվում են ավելի էներգետիկ բարենպաստ վրա դէլեկտրոնային ուղեծրեր. Էլեկտրոնների փոխանցումը դ e - միացված դ g-օրբիտալներ անհնարինքանի որ նույնպես բարձր էներգիայի արգելք. Հետևաբար, այս բարդ կատիոնն է ցածր պտույտ, այն չի պարունակում չզույգված էլեկտրոններ և դիամագնիսական. Նմանապես, կարելի է ներկայացնել 2+ և 4- իոնների համար ութանիստ դաշտում էլեկտրոնների բաշխման սխեմաներ. H 2 O լիգանդները թույլ դաշտ են ստեղծում; միջև էլեկտրոնների փոխանակում դե - և դ g-orbitals-ը որևէ դժվարություն չի առաջացնում, հետևաբար բարդ իոնում չզույգված էլեկտրոնների թիվը նույնն է, ինչ սովորական Fe + II իոնում: Ստացված ջրային համալիրն է բարձր պտտվող, պարամագնիսական. Շատ բարդ միացություններ բյուրեղային վիճակում և ջրային լուծույթում վառ գունավորված են։ Այսպիսով, 2+ կատիոն պարունակող ջրային լուծույթը գունավորվում է ինտենսիվ կապույտ, 3+ կատիոնը լուծույթին տալիս է մանուշակագույն գույն, իսկ 2+ կատիոնը՝ կարմիր։ Բյուրեղային դաշտի տեսությունը հնարավորություն է տալիս բացատրել բարդ միացություններում այս կամ այն գույնի տեսքը։ Եթե լույսն անցնում է նյութի լուծույթով կամ բյուրեղային նմուշով սպեկտրի տեսանելի մասը, ապա, սկզբունքորեն, նմուշի ֆիզիկական վարքագծի երեք տարբերակ հնարավոր է. լույսի կլանման բացակայությունցանկացած ալիքի երկարություն (նյութի նմուշ անգույն, չնայած այն կարող է ունենալ կլանման գոտիներ սպեկտրի ուլտրամանուշակագույն շրջանում); լույսի ամբողջական կլանումըամբողջ ալիքի երկարության միջակայքում (նմուշը կհայտնվի Սեվ); վերջապես, լույսի կլանումըմիայն որոշակի ալիքի երկարություն(այդ դեպքում նմուշը կունենա գույնը լրացնում է կլանվածինսպեկտրի նեղ մասը): Այսպիսով, որոշվում է լուծույթի կամ բյուրեղների գույնը կլանման գոտիների հաճախականությունըտեսանելի լույս. Լույսի քվանտների կլանումը կոմպլեքսներով (օրինակ՝ ութանիստ կառուցվածք ունեցողների) բացատրվում է լույսի փոխազդեցությամբ էլեկտրոնների հետ, որոնք գտնվում են վրա. դ e - ենթամակարդակ, ուղեկցվում է դրանց անցումով դեպի դատարկ ուղեծրեր դ g-ենթամակարդակ. Օրինակ, հեքսաակվատիտան (III) 3+ կատիոններ պարունակող ջրային լուծույթով լույսն անցնելիս սպեկտրի դեղնականաչավուն հատվածում հայտնաբերվում է լույսի կլանման գոտի (20300 սմ - 1, լ » 500 նմ): Դա պայմանավորված է կոմպլեքսավորող նյութի մեկ էլեկտրոնի անցումից դ e-AO միացված դ g-ենթամակարդակ: Ուստի 3+ պարունակող լուծույթը ձեռք է բերում մանուշակագույն երանգ (ի լրումն ներծծվող դեղնականաչի)։ Վանադիումի աղի Cl 3 լուծույթը կանաչ է: Դա պայմանավորված է նաև էլեկտրոնների համապատասխան անցումներով, երբ նրանք կլանում են լույսի ճառագայթի էներգիայի մի մասը։ Հիմնական վիճակում՝ վանադիումի (III) էլեկտրոնային կոնֆիգուրացիայով 3 դ 2, երկու չզույգված էլեկտրոններ են զբաղված դէլեկտրոնային ենթամակարդակ: Կա միայն երկու էլեկտրոնների անցման երկու տարբերակվրա դ g -ենթամակարդակ. կամ երկուսն էլէլեկտրոնները զբաղված են դ g -AO, կամ միայն մեկնրանցից. Էլեկտրոնների ցանկացած այլ անցում, որը կապված է ընդհանուր սպինի նվազման հետ, արգելված է: Եթե կոմպլեքսավորող նյութն ունի էլեկտրոնային կոնֆիգուրացիա դ 0 կամ դ 10 ապա էլեկտրոնների անցումներՀետ դ e - միացված դ g - ենթամակարդակ կամ հակառակը անհնարինկամ այն պատճառով, որ էլեկտրոնների բացակայություն, կամ այն պատճառով, որ դատարկ ուղեծրերի բացակայություն. Հետևաբար, այնպիսի կոմպլեքսավորող նյութերով բարդույթների լուծույթները, ինչպիսիք են Sc(III), Cu(I), Zn(II), Cd(II) և այլն, էներգիա չեն կլանում սպեկտրի տեսանելի մասում և առաջանում են. անգույն: Լույսի կլանման ընտրողականությունը կախված է ոչ միայն բարդացնող միջոցԵվ դրա օքսիդացման վիճակը, այլեւ ից լիգանների տեսակը. Սպեկտրոքիմիական շարքի ձախ կողմում գտնվող լիգանները բարդ միացության մեջ փոխարինելիս լիգանդներով, որոնք ստեղծում են. ուժեղնկատվել է էլեկտրաստատիկ դաշտ աճփոխանցվող լույսից էլեկտրոնների կողմից կլանված էներգիայի մասնաբաժինը և, որպես հետևանք, նվազումհամապատասխան կլանման գոտու ալիքի երկարությունը: Այսպիսով, տետրաակվապղինձ (II) 2+ կատիոններ պարունակող ջրային լուծույթը կապույտ է, իսկ տետրամին պղնձի (II) 2+ սուլֆատի լուծույթը՝ ինտենսիվ կապույտ։ ________________________ Կրկնել՝ >>> Դիմումներ
Էներգիայի ձեռքբերումը պայմանավորված է առաջնահերթ կարգավորումէլեկտրոններ դէլեկտրոնային ատոմային ուղեծրերը կոչվում են լիգանդի դաշտով համալիրի կայունացման էներգիան.
լույսի արագություն Հետ
= 3 ´ 10 10 սմ/վ:
Միավոր D 0-ը նույնն է, ինչ n ալիքի համարը՝ սմ - 1, որը մոտավորապես համապատասխանում է 12 Ջ/մոլի։
Բարդ միացություններում, որոնք ներառում են միևնույն ժամանակաշրջանի և նույն օքսիդացման վիճակում գտնվող կոմպլեքսացնող նյութերը, նույն լիգանդներով, ճեղքման պարամետրը մոտավորապես նույնն է։ Կոմպլեքսացնող նյութի օքսիդացման աստիճանի աճով D 0 արժեքը ավելանում է. Այսպիսով, 2+ և 2+ ջրային համալիրների համար տրոհման պարամետրի արժեքը կազմում է 7800 և 10400 սմ՝ 1, իսկ 3+ և 3+ համար՝ համապատասխանաբար 13700 և 21000 սմ:
I-Br - Կլ - » NCS - NO 3 - Ֆ -Օհ - H2O » Հ - ՆՀ 3 NO 2 -CN - «ՉԻ» ԿՈ. 









Ընդհակառակը, CN - լիգանդները առաջացնում են զգալի ճեղքվածք դ-ԱՕ, 33000 սմ-ի չափով - 1. Սա նշանակում է, որ կա ուժեղ բոլոր էլեկտրոնները տեղաբաշխելու միտումվրա դէլեկտրոնային ուղեծրեր. Էներգիայի ձեռքբերում, որը ստացվում է ուղեծրերի նման պոպուլյացիայով, շատ ավելի մեծ է, քան էլեկտրոնների զուգակցման պատճառով էներգիայի ծախսերը։


Ավելորդ էներգիա ստացած էլեկտրոնների նշված անցումները համապատասխանում են կլանման գոտիմոտ 400 նմ հեքսաակավանադիումի (III) քլորիդի լուծույթի կլանման սպեկտրում: Սպեկտրի մանուշակագույն-մանուշակագույն շրջանի կլանումը լուծույթին լրացուցիչ գույն է տալիս. վառ կանաչ.

Իսկ Ջոն Վան Վլեքը նկարագրելու է անցումային մետաղների կատիոնների ստորին վիճակները, որոնք շրջապատված են լիգանդներով՝ և՛ անիոններով, և՛ չեզոք մոլեկուլներով: Բյուրեղային դաշտի տեսությունը հետագայում զուգակցվեց [և զտվեց] (դելոկալիզացված) մոլեկուլային ուղեծրային տեսության հետ՝ դառնալով ավելի ընդհանուր տեսություն, որը հաշվի է առնում կոորդինացիոն միացություններում մետաղ-լիգանդ կապի մասնակի համարժեքությունը:
Բյուրեղային դաշտի տեսությունը թույլ է տալիս կանխատեսել կամ մեկնաբանել բյուրեղների և բարդ միացությունների օպտիկական կլանման սպեկտրները և էլեկտրոնային պարամագնիսական ռեզոնանսային սպեկտրները, ինչպես նաև անցումային մետաղների համալիրների լուծույթներում խոնավացման և կայունության էթալպիաները:
Բյուրեղային դաշտի տեսության վերանայում[ | ]
Ըստ TCP-ի, անցումային մետաղի և լիգանդների փոխազդեցությունը առաջանում է դրական լիցքավորված մետաղի կատիոնի և լիգանդի ոչ կապող ուղեծրերում էլեկտրոնների բացասական լիցքի ներգրավումից: Տեսությունը հինգի էներգիայի փոփոխությունը համարում է այլասերված դ- ուղեծրեր, որոնք շրջապատված են լիգանդների կետային լիցքերով: Երբ լիգանդը մոտենում է մետաղի իոնին, լիգանդի էլեկտրոնները մոտենում են որոշներին դ- ուղեծրեր, քան մյուսները, պատճառելով դեգեներացիայի կորուստ: Էլեկտրոններ դ- ուղեծրերը և լիգանդները միմյանց վանում են որպես նույն նշանով լիցքեր: Այսպիսով, դրանց էներգիան դ- էլեկտրոնները, որոնք ավելի մոտ են լիգանդներին, դառնում են ավելի բարձր, քան նրանք, որոնք ավելի հեռու են, ինչը հանգեցնում է էներգիայի մակարդակների պառակտման դ- ուղեծրեր.
Հետևյալ գործոնները ազդում են պառակտման վրա.
- Մետաղական իոնի բնույթը.
- Մետաղի օքսիդացման աստիճանը. Որքան բարձր է օքսիդացման վիճակը, այնքան բարձր է տրոհման էներգիան:
- Լիգանդների դասավորությունը մետաղական իոնի շուրջ:
- Մետաղական իոնը շրջապատող լիգանդների բնույթը: Որքան ուժեղ է լիգանդների ազդեցությունը, այնքան մեծ է տարբերությունը բարձր և ցածր էներգիայի մակարդակների միջև:
Լիգանդի կոորդինացման ամենատարածված տեսակն է ութանիստ, որում վեց լիգանդներ մետաղի իոնի շուրջ ստեղծում են ութանիստ համաչափության բյուրեղային դաշտ։ Արտաքին թաղանթում մեկ էլեկտրոն ունեցող մետաղական իոնի ութանիստ միջավայրում d-օրբիտալները բաժանվում են երկու խմբի՝ էներգիայի մակարդակների տարբերությամբ Δ oct ( տրոհման էներգիա), մինչդեռ ուղեծրերի էներգիան dxy, dxzԵվ դ իզավելի ցածր կլինի, քան դ զ 2 և դ x 2 -y 2, քանի որ առաջին խմբի ուղեծրերը գտնվում են լիգանդներից ավելի հեռու և ավելի քիչ վանողություն են զգում: Երեք ցածր էներգիայի ուղեծրերը նշանակված են որպես տ 2 գ, և երկու բարձր նմանությամբ eg.
Հաջորդ ամենատարածվածներն են քառանիստհամալիրներ, որոնցում չորս լիգանդները մետաղական իոնի շուրջ քառաեդրոն են կազմում: Այս դեպքում դ-օրբիտալները նույնպես բաժանվում են երկու խմբի՝ էներգիայի մակարդակների տարբերությամբ Δ tetr: Ի տարբերություն ութանիստ կոորդինացիայի՝ ուղեծրերը կունենան ցածր էներգիա դ զ 2 և դ x 2 -y 2 և բարձր - դ xy , դ xzԵվ դ yz. Բացի այդ, քանի որ լիգանդների էլեկտրոնները ուղիղ ուղղությամբ չեն գտնվում դ- ուղեծրեր, պառակտման էներգիան ավելի ցածր կլինի, քան ութանիստ կոորդինացիայի դեպքում: Օգտագործելով TCP կարող եք նաև նկարագրել հարթ-քառակուսիև բարդույթների այլ երկրաչափություններ։
Օրբիտալների երկու կամ ավելի խմբերի միջև Δ էներգիայի մակարդակների տարբերությունը կախված է նաև լիգանդների բնույթից։ Որոշ լիգանդներ ավելի քիչ ճեղքվածք են առաջացնում, քան մյուսները, որոնց պատճառները բացատրվում են: Սպեկտրոքիմիական շարք- փորձնականորեն ստացված լիգանդների ցանկը, որը դասավորված է աճման կարգով Δ.
Մետաղի օքսիդացման վիճակը նույնպես ազդում է Δ-ի վրա։ Ավելի բարձր օքսիդացման վիճակ ունեցող մետաղը ավելի մոտ է ձգում լիգանդներին լիցքի ավելի մեծ տարբերության պատճառով: Մետաղական իոնին ավելի մոտ գտնվող լիգանդներն ավելի շատ ճեղքվածք են առաջացնում:
Ցածր և բարձր պտտվող համալիրներ[ | ]
Լիգանդներ, որոնք առաջացնում են խոշոր ճեղքվածք դ- մակարդակները, ինչպիսիք են CN−-ն և CO-ն, կոչվում են լիգանդներ ուժեղ դաշտ. Նման լիգանդներով բարդույթներում էլեկտրոնների համար անբարենպաստ է բարձր էներգիայի ուղեծրեր զբաղեցնելը։ Հետևաբար, ցածր էներգիայի ուղեծրերը ամբողջությամբ լցվում են, մինչև բարձր էներգիայի ուղեծրերը սկսեն լցվել: Նման համալիրները կոչվում են ցածր պտույտ. Օրինակ, NO 2 --ը բարձր դաշտային լիգանդ է, որն առաջացնում է մեծ ճեղքվածք: Բոլորը 5 դ-ութանիստ իոնի էլեկտրոնները 3− կտեղակայվեն ստորին մակարդակում տ 2է .
Ի հակադրություն, լիգանները, որոնք առաջացնում են փոքր ճեղքվածք, ինչպիսիք են I− և Br−, կոչվում են լիգանդներ։ թույլ դաշտ. Այս դեպքում ավելի հեշտ է էլեկտրոններ տեղադրել բարձր էներգիայի ուղեծրերում, քան երկու էլեկտրոններ տեղադրել նույն ցածր էներգիայի ուղեծրում, քանի որ նույն ուղեծրի երկու էլեկտրոնները վանում են միմյանց, իսկ երկրորդ էլեկտրոնը ուղեծրում տեղադրելու էներգիայի արժեքը կազմում է. ավելի բարձր, քան Δ. Այսպիսով, նախքան զույգ էլեկտրոնների հայտնվելը, հինգից յուրաքանչյուրում դ-Օրբիտալները պետք է տեղադրվեն մեկ էլեկտրոնով` համաձայն Հունդի կանոնի: Նման համալիրները կոչվում են բարձր պտույտ. Օրինակ, Br−-ը թույլ դաշտի լիգանդ է, որը փոքր ճեղքում է առաջացնում: Բոլորը 5 դ-3− իոնի ուղեծրեր, որն ունի նաև 5 դ-էլեկտրոնները կզբաղեցնեն մեկ էլեկտրոն:
Դ tetr քառանիստ կոմպլեքսների տրոհման էներգիան մոտավորապես հավասար է 4/9Δ oct-ի (նույն մետաղի և լիգանդների համար): Արդյունքում, էներգիայի մակարդակների տարբերությունը դ-Օրբիտալները սովորաբար ցածր են էլեկտրոնների զուգակցման էներգիայից, իսկ քառաեզրային համալիրները սովորաբար բարձր սպին են:
Բաշխման դիագրամներ դ-էլեկտրոնները հնարավորություն են տալիս կանխատեսել կոորդինացիոն միացությունների մագնիսական հատկությունները: Չզույգված էլեկտրոններով կոմպլեքսները պարամագնիսական են և ձգվում են մագնիսական դաշտով, մինչդեռ առանց էլեկտրոնների կոմպլեքսները դիամագնիսական են և թույլ են վանում։
Բյուրեղային դաշտի կայունացման էներգիա[ | ]
Բյուրեղային դաշտի կայունացման էներգիան (CFE) անցումային մետաղի իոնի էլեկտրոնային կոնֆիգուրացիայի էներգիան է՝ ուղեծրերի միջին էներգիայի համեմատ։ Կայունացումը տեղի է ունենում այն պատճառով, որ լիգանդի դաշտում որոշ ուղեծրերի էներգիայի մակարդակն ավելի ցածր է, քան հիպոթետիկ գնդային դաշտում, որտեղ բոլոր հինգը դ-օրբիտալներն ունեն նույն վանող ուժը, և բոլորը դ-օրբիտալները դեգեներատ են: Օրինակ, ութանիստ դեպքում մակարդակը տ 2 գցածր միջին մակարդակից գնդաձև դաշտում: Հետևաբար, եթե այս ուղեծրերը պարունակում են էլեկտրոններ, ապա մետաղի իոնը գնդաձև դաշտի համեմատ ավելի կայուն է լիգանդի դաշտում։ Ընդհակառակը, ուղեծրերի էներգիայի մակարդակը egմիջինից բարձր, իսկ դրանցում պարունակվող էլեկտրոնները նվազեցնում են կայունացումը։
Ութանիստ դաշտի կողմից կայունացման էներգիա
Ութանիստ դաշտում կան երեք ուղեծրեր տ 2 գկայունացել է միջին էներգիայի մակարդակի համեմատ 2/5 Δ օկտավայով, և երկու ուղեծրերով egապակայունացվել է 3/5 Δ հոկտ. Վերևում ներկայացված էին երկու էլեկտրոնային կոնֆիգուրացիաների օրինակներ դ 5 . Առաջին օրինակում կա ցածր պտույտի 3− կոմպլեքս՝ հինգ էլեկտրոններով տ 2 գ. Դրա ESP-ն 5 × 2 / 5 Δ հոկտ = 2Δ հոկտ. Երկրորդ օրինակում բարձր պտտվող կոմպլեքս 3− ESKP-ով (3 × 2 / 5 Δ oct) − (2 × 3 / 5 Δ oct) = 0: Այս դեպքում էլեկտրոնների կայունացնող ազդեցությունը ցածր մակարդակի օրբիտալներում չեզոքացվում է բարձր մակարդակի ուղեծրերում էլեկտրոնների ապակայունացնող ազդեցությամբ։
Բյուրեղային դաշտով d-մակարդակի պառակտման դիագրամներ[ | ]
| ութանիստ | հնգանկյուն-բիպիրամիդային | քառակուսի-անտիպրիզմատիկ |
|---|---|---|
Բյուրեղային դաշտի տեսությունփոխարինել է վալենտային կապերի տեսությանը 20-րդ դարի 40-ական թթ. Իր մաքուր ձևով այն ներկայումս չի օգտագործվում, քանի որ այն չի կարող բացատրել բարդ միացություններում կովալենտային կապերի ձևավորումը և հաշվի չի առնում լիգանդների իրական վիճակը (օրինակ՝ դրանց իրական չափերը) նույնիսկ փակ փոխազդեցության դեպքում։ դեպի զուտ էլեկտրաստատիկ:
Արդեն 50-ականների կեսերին պարզեցված բյուրեղային դաշտի տեսությունը փոխարինվեց բարելավվածով. լիգանդի դաշտի տեսություն, հաշվի առնելով բարդացնող նյութի և լիգանդի միջև քիմիական կապերի կովալենտային բնույթը։
Այնուամենայնիվ, բարդ միացությունների առաջացումը բացատրելու ամենաընդհանուր մոտեցումը տրված է մոլեկուլային ուղեծրի տեսություն(MO), որը ներկայումս գերակշռում է բոլոր մյուսների նկատմամբ: Մոլեկուլային ուղեծրային մեթոդը նախատեսում է և՛ զուտ էլեկտրաստատիկ փոխազդեցություն՝ համընկնող ատոմային ուղեծրերի բացակայության դեպքում, և՛ համընկնման միջանկյալ աստիճանների ամբողջ հավաքածուն:
Եկեք նայենք հիմնական հասկացություններին բյուրեղային դաշտի տեսություն, որը, ինչպես վալենտային կապերի տեսությունը, իր մեծ պարզության և պարզության շնորհիվ դեռևս պահպանում է իր կարևորությունը բարդ միացություններում քիմիական կապերի որակական նկարագրության համար։
Բյուրեղային դաշտի տեսության մեջ դիտարկվում է բարդացնող նյութի և լիգանդի միջև քիմիական կապը էլեկտրաստատիկ. Համաձայն այս տեսության՝ լիգանդները տեղակայված են կոմպլեքսավորող նյութի շուրջ՝ կանոնավոր պոլիեդրների գագաթներում ( պոլիեդրա) ինչպես կետային վճարներ. Տեսությունը հաշվի չի առնում լիգանդի իրական ծավալը։
Լիգանդները, ինչպես կետային լիցքերը, ստեղծում են բարդացնող նյութի շուրջ էլեկտրաստատիկ դաշտ(«բյուրեղային դաշտ», եթե դիտարկենք բարդ միացության բյուրեղ, կամ լիգանդի դաշտ), որտեղ բարդացնող նյութի էներգիայի մակարդակները և, առաջին հերթին, դ- ենթամակարդակներ բաժանվում են, և նրանց էներգիան փոխվում է: Պառակտման բնույթը, էներգիայի նոր մակարդակների էներգիան կախված է համաչափությունլիգանդների դասավորությունը (ութանիստ, քառանիստ կամ այլ բյուրեղային դաշտ): Երբ H 2 O, NH 3, CO և այլ մոլեկուլները կոորդինացվում են որպես լիգանդներ, դրանք համարվում են դիպոլներ, կողմնորոշված բացասական լիցքով դեպի կոմպլեքսավորող նյութը։
Դիտարկենք լիգանների ութանիստ դասավորության դեպքը (օրինակ՝ -3 կամ 3+): Ութանիստի կենտրոնում կա կոմպլեքսավորվող իոն M(+ n) էլեկտրոնների վրա դ-ատոմային ուղեծրեր, և դրա գագաթներում կան լիգաններ՝ կետային բացասական լիցքերի տեսքով (օրինակ՝ F-իոններ կամ բևեռային մոլեկուլներ, ինչպիսիք են NH 3): Պայմանական M(+ n) իոնում, որը կապված չէ լիգանդների հետ, բոլոր հինգի էներգիաները դ-AO-ն նույնն են (այսինքն՝ ատոմային ուղեծրերը այլասերված).
Այնուամենայնիվ, լիգանների ութանիստ դաշտում դ- Կոմպլեքսավորող նյութի AO-ները ընկնում են անհավասարդիրք. Ատոմային ուղեծրեր դ(զ 2) և d (x 2 -y 2)Կոորդինատային առանցքների երկայնքով ձգված, ամենամոտն են լիգանդներին։ Այս ուղեծրերի և ութանիստի գագաթներում տեղակայված լիգանդների միջև առաջանում են զգալի տարբերություններ վանող ուժեր, ինչը հանգեցնում է ուղեծրի էներգիայի ավելացմանը։ Այլ կերպ ասած, այս ատոմային ուղեծրերը ենթակա են լիգանդի դաշտի առավելագույն ազդեցությունը. Նման փոխազդեցության ֆիզիկական մոդել կարող է ծառայել ուժեղ սեղմված զսպանակը:
Մնացած երեքը դ-ԱՕ – դ(xy), դ(xz) Եվ դ(yz), գտնվում են կոորդինատային առանցքների և լիգանդների միջև, նրանցից ավելի մեծ հեռավորության վրա են։ Այդպիսիների փոխազդեցությունը դ-Լիգանդներով AO-ն նվազագույն է, և հետևաբար էներգիան դ(xy), դ(xz) Եվ դ(yz)-ԱՕ-ն սկզբնականի համեմատ նվազում է։
Այսպիսով, հինգ անգամ այլասերված դ-AO կոմպլեքսավորող, ներս մտնելով ութանիստ լիգանդի դաշտ, բացահայտված պառակտումնոր ուղեծրերի երկու խմբի՝ եռակի այլասերված ուղեծրերցածր էներգիայով, դ(xy), դ(xz) Եվ դ(yz), Եվ կրկնակի այլասերված ուղեծրերավելի բարձր էներգիայով դ(զ 2) և d (x 2 -y 2). Այս նոր խմբերը դ- ուղեծրեր հետ ավելի ցածրԵվ ավելի բարձր էներգիանշանակել դէ և դγ:
դ(զ 2) և d (x 2 -y 2)
դ(xy), դ(xz),դ(yz)
Էներգիայի տարբերություներկու նոր ենթամակարդակ դէ և դγ անվանվել է բաժանման պարամետր Δ 0:
Ե 2 – Ե 1 = Δ 0 ≈ 0
Երկու նորերի գտնվելու վայրը էներգիայի ենթամակարդակներ դէ և դγ՝ բնօրինակի համեմատ ( դ-AO) էներգետիկ դիագրամի վրա ասիմետրիկ:
(Ե 2 – Ե 0) > (Ե 0 – Ե 1).
Քվանտային մեխանիկական տեսությունդա է պահանջում երբ էներգիայի նոր մակարդակները ամբողջությամբ լցված են էլեկտրոններով, ընդհանուր էներգիան մնում է անփոփոխ, այսինքն. նա պետք է մնա հավասար է Ե 0 .
Այսինքն՝ հավասարությունը պետք է բավարարվի
4(Ե 2 – Ե 0) = 6(Ե 0 – Ե 1),
որտեղ 4 և 6 - առավելագույնըէլեկտրոնների թիվը մեկ դγ- և դε-AO. Այս հավասարությունից բխում է, որ
(Ե 2 – Ե 0) / (Ե 0 – Ե 1) = 3/2 և
(Ե 2 – Ե 1) / (Ե 0 – Ե 1) = 5/2, կամ
Δ 0 / ( Ե 0 – Ե 1) = 5/2, որտեղից ( Ե 0 – Ե 1) = 2/5Δ 0:
Տեղադրելով յուրաքանչյուր էլեկտրոն առավելագույն վեց հնարավորից դε ուղեծրերը առաջացնում են նվազում (շահումներ) էներգիա 2/5 Δ 0-ով:
Ընդհակառակը, չորս հնարավորից յուրաքանչյուր էլեկտրոնի տեղադրումը վրա դγ ուղեծրերը առաջացնում են աճ (արժեքը) էներգիա 3/5 Δ 0-ով:
Եթե բնակեցված է էլեկտրոններով դէ- եւ դγ-օրբիտալները ամբողջությամբ, ապա ոչ հաղթելովէներգիա չի լինի(ինչպես չի լինի լրացուցիչ էներգիայի սպառում).
Բայց եթե բնօրինակը դ-ԱՕ-ն միայն բնակեցված է մասամբև պարունակում է 1-ից մինչև 6 էլեկտրոն, և այդ էլեկտրոնները տեղադրվում են միայն վրա դε-AO, ապա մենք ստանում ենք զգալի էներգիայի շահույթ.
Էներգիայի ձեռքբերումը պայմանավորված է առաջնահերթ կարգավորումէլեկտրոններ դε-ատոմային ուղեծրերը կոչվում են լիգանդի դաշտով համալիրի կայունացման էներգիան.
Յուրաքանչյուր լիգանդի առանձնահատկությունն ազդում է այս լիգանդի ստեղծած դաշտի վրա. ուժեղկամ թույլ. Ինչպես ավելի ուժեղ դաշտլիգանդներ քան ավելինիմաստը բաժանման պարամետր Δ 0 .
Պառակտման պարամետրի ուսումնասիրությունը սովորաբար հիմնված է սպեկտրոսկոպիկհետազոտություն. Ալիքի երկարություններ կլանման գոտիներկոմպլեքսները բյուրեղային վիճակում կամ լուծույթում, էլեկտրոնների փոխանցման պատճառով դε- միացված դγ-AO, կապված բաժանման պարամետրΔ 0 հետևյալ կերպ.
λ = գ / ν; Δ 0 = Ե 2 – Ե 1 = հ ν = հ · ( գ / λ),
որտեղ է Պլանկի հաստատունը հհավասար է 6,6260693 ∙ 10 -34 J վրկ;
լույսի արագություն Հետ
= 3 · 10 10 սմ/վ:
ՄիավորΔ 0 նույնն է, ինչ ալիքի թիվը՝ սմ -1, որը մոտավորապես համապատասխանում է 12 Ջ/մոլի։ Պառակտման պարամետր, բացի լիգանդի տեսակից, կախված է օքսիդացման աստիճանի վրաԵվ բնությունըբարդացնող միջոց.
Բարդ միացություններում, որոնք ներառում են միևնույն ժամանակաշրջանի և նույն օքսիդացման վիճակում գտնվող կոմպլեքսացնող նյութերը, նույն լիգանդներով, ճեղքման պարամետրը մոտավորապես նույնն է։ Կոմպլեքսացնող նյութի օքսիդացման աստիճանի աճով, Δ 0 արժեքը ավելանում է. Այսպիսով, 2+ և 2+ ջրային համալիրների համար տրոհման պարամետրի արժեքը կազմում է 7800 և 10400 սմ -1, իսկ 3+ և +3-ի համար՝ համապատասխանաբար 13700 և 21000 սմ -1: ժամը միջուկային լիցքի ավելացումԿոմպլեքս առաջացնող ատոմի Δ 0 նույնպես մեծանում է: Hexaamminiridium (III) 3+, hexaamminiridium (III) 3+, և hexaamminiridium (III) 3+ կատիոններ ( Զ= 27, 45 և 77) բնութագրվում են բաժանման պարամետրերով, որոնք հավասար են 22900, 34100 և 41000 սմ -1:
Δ 0-ի կախվածությունը լիգանդների բնույթից ավելի բազմազան է։ Բազմաթիվ բարդ միացությունների ուսումնասիրության արդյունքում պարզվել է, որ իրենց սովորական օքսիդացման վիճակում գտնվող կոմպլեքսավորվող մետաղների տրոհման պարամետրը մեծացնելու ունակության առումով, ամենատարածված լիգանները կարելի է դասավորել հետևյալ կերպ. սպեկտրաքիմիական շարք, որի երկայնքով Δ 0 արժեքը միապաղաղ մեծանում է.
I > Br > Cl > NCS - ≈ NO 3 - > F - > OH - > H 2 O > H - > NH 3 > NO 2 - > CN - > NO > CO.
Այսպիսով, ամենաուժեղ էլեկտրաստատիկ դաշտը բարդացնող նյութի շուրջ և ամենաուժեղ ճեղքումը դ-AO-ն առաջանում է CN-, NO և CO լիգանների կողմից: Եկեք դիտարկենք էլեկտրոնների բաշխումը ավարտված վիճակում դէ- եւ դγ-օրբիտալներ լիգանդների ութանիստ դաշտում: Գրանցվել դէ- եւ դγ-օրբիտալները տեղի են ունենում լիովին համապատասխան Հունդի կանոնԵվ Պաուլիի սկզբունքը. Այս դեպքում, անկախ պառակտման պարամետրի արժեքից, առաջին երեք էլեկտրոնները զբաղեցնում են քվանտային բջիջները. դε-ենթամակարդակ:
![]() dε
dε
Եթե էլեկտրոնների թիվը մեկ դ- կոմպլեքսավորող նյութի երեքից ավելի ենթամակարդակներ կան, դրանք բաժանված ենթամակարդակների վրա տեղադրելու երկու հնարավորություն կա: Պառակտման պարամետրի ցածր արժեքի դեպքում (լիգանդների թույլ դաշտը) էլեկտրոնները հաղթահարում են անջատող էներգետիկ արգելքը. դէ- եւ դγ-օրբիտալներ; չորրորդ, ապա հինգերորդ էլեկտրոնները բնակեցնում են քվանտային բջիջները դγ-ենթամակարդակ.
![]() dε
dε
Ուժեղ լիգանդի դաշտով և Δ 0-ի բարձր արժեքով չորրորդ և հինգերորդ էլեկտրոնների պոպուլյացիան դγ-ենթամակարդակը բացառված է; լրացումն ընթացքի մեջ է դε-օրբիտալներ.
![]() dε
dε
ժամը թույլ դաշտային լիգաններքվանտային բջիջները բնակեցնելով 4 կամ 5 էլեկտրոններով զուգահեռ պտույտներ, այնպես որ ստացված բարդույթը ուժեղ է ստացվում պարամագնիսական. Ուժեղ լիգանդի դաշտումմեկ, ապա երկու էլեկտրոնային զույգ է ձևավորվում դε-ենթամակարդակ, այսպես պարամագնիսականությունբարդույթը շատ ավելի թույլ է ստացվում։ Վեցերորդ, յոթերորդ և ութերորդ էլեկտրոնները թույլ դաշտի դեպքում ետ են հայտնվում դγ-ենթամակարդակ, որը լրացնում է կոնֆիգուրացիաները էլեկտրոնային զույգերին (դեպքում մեկը դ 6, երկու - դ 7 և երեք - դ 8):
![]() dε
dε
Ուժեղ լիգանդի դաշտի դեպքում բնակվում է վեցերորդ էլեկտրոնը dε-ԱՕ, տանող դեպի դիամագնիսականությունհամալիր, որից հետո գնում են յոթերորդ և ութերորդ էլեկտրոնները դγ-ենթամակարդակ:
![]() dε
dε
Ակնհայտ է, որ ութ էլեկտրոնային կոնֆիգուրացիայով կառուցվածքի տարբերություններլիգանների հետ բարդույթների միջև թույլԵվ ուժեղ դաշտերը անհետանում են. Օրբիտալների զբաղեցումը իններորդ և տասներորդ էլեկտրոնի կողմից նույնպես չի տարբերվում երկու տեսակի բարդույթների համար.
![]() dε
dε
Վերադառնանք 3+ և -3 ութանիստ բարդ իոնների էլեկտրոնային կառուցվածքի քննարկմանը։ Ըստ գտնվելու վայրի սպեկտրաքիմիական շարք, ամոնիակ NH 3-ը լիգանդներից է ուժեղ դաշտև ֆտորիդ իոն F-– թույլ դաշտ. -3 անիոնում F - լիգանդները ստեղծում են թույլ բյուրեղային դաշտ (Δ 0 = 13000 սմ -1), իսկ սկզբնական 3-ի բոլոր էլեկտրոնները դ 6 - ԲԲԸ գտնվում են դէ- եւ դγ ուղեծրեր առանց որևէ զուգավորման: Բարդ իոն է բարձր պտույտև պարունակում է չորս չզույգված էլեկտրոններ, ուստի այն պարամագնիսական:

3+ իոնում NH 3 լիգանդները ստեղծում են ուժեղ բյուրեղային դաշտ (Δ 0 = 22900 սմ -1), բոլոր 3-ը դ 6 -էլեկտրոնները տեղադրվում են ավելի էներգետիկ բարենպաստ վրա դε-օրբիտալներ. Էլեկտրոնների փոխանցումը դε- միացված դγ ուղեծրեր անհնարինքանի որ նույնպես բարձր էներգիայի արգելք. Հետևաբար, այս բարդ կատիոնն է ցածր պտույտ, այն չի պարունակում չզույգված էլեկտրոններ և դիամագնիսական:

Նմանապես, կարելի է ներկայացնել 2+ և -4 իոնների համար ութանիստ դաշտում էլեկտրոնների բաշխման սխեմաներ.


H 2 O լիգանդները թույլ դաշտ են ստեղծում; միջև էլեկտրոնների փոխանակում դէ- եւ դγ-օրբիտալները դժվարություններ չեն առաջացնում, և, հետևաբար, բարդ իոնում չզույգված էլեկտրոնների թիվը նույնն է, ինչ սովորական իոնում Fe + II: Ստացված ջրային համալիրն է բարձր պտտվող, պարամագնիսական.
Ընդհակառակը, CN - լիգանդները առաջացնում են զգալի ճեղքվածք դ-ԱՕ, 33000 սմ -1. Սա նշանակում է, որ կա ուժեղ բոլոր էլեկտրոնները տեղաբաշխելու միտումվրա դε-օրբիտալներ. Էներգիայի ձեռքբերում, որը ստացվում է ուղեծրերի նման պոպուլյացիայով, շատ ավելի մեծ է, քան էլեկտրոնների զուգակցման պատճառով էներգիայի ծախսերը։
Վալենտային կապի մեթոդի տեսանկյունից վալենտային ուղեծրերի հիբրիդացումը, որոնք կապ են կազմում ջրային համալիրում ներառում է. դ-AO արտաքին ենթամակարդակ (4 sp 3 դ 2), իսկ ցածր պտույտով - դ- ԲԸ ներքին ենթամակարդակ (3 դ 2 4sp 3).
Այսպիսով, թույլ դաշտային լիգանդներով բարձր սպինային համալիրներում մասնակցությամբ տեղի է ունենում հիբրիդացում դ- Արտաքին ենթամակարդակի AO, և ցածր պտույտ բարձր դաշտային լիգանդներով. դ- Ներքին ենթամակարդակի ԲԸ. Համալիրում չզույգված էլեկտրոնների թիվը կարող է որոշվել էլեկտրոնային պարամագնիսական ռեզոնանսով (EPR): Օգտագործելով այս մեթոդի գործիքները, որոնք կոչվում են EPR սպեկտրոմետրեր, ուսումնասիրվում են պարամագնիսական նյութերը:
Բյուրեղային դաշտի տեսությունը հնարավորություն է տալիս բացատրել բարդ միացություններում այս կամ այն գույնի տեսքը։ Բարդ միացություններից բյուրեղային վիճակում և ջրային լուծույթում զգալի թիվն առանձնանում է վառ գույնով։ Այսպիսով, 2+ կատիոն պարունակող ջրային լուծույթը գունավորվում է ինտենսիվ կապույտ, 3+ կատիոնը լուծույթին տալիս է մանուշակագույն, իսկ 2+ կատիոնը՝ կարմիր։ Եթե լույսն անցնում է նյութի լուծույթով կամ բյուրեղային նմուշով սպեկտրի տեսանելի մասը, ապա, սկզբունքորեն, նմուշի ֆիզիկական վարքագծի երեք տարբերակ հնարավոր է. լույսի կլանման բացակայությունցանկացած ալիքի երկարություն (նյութի նմուշ անգույն, չնայած այն կարող է ունենալ կլանման գոտիներ սպեկտրի ուլտրամանուշակագույն շրջանում); լույսի ամբողջական կլանումըամբողջ ալիքի երկարության միջակայքում (նմուշը կհայտնվի Սեվ); վերջապես, լույսի կլանումըմիայն որոշակի ալիքի երկարություն(այդ դեպքում նմուշը կունենա գույնը լրացնում է կլանվածինսպեկտրի նեղ մասը):

Այսպիսով, որոշվում է լուծույթի կամ բյուրեղների գույնը կլանման գոտիների հաճախականությունըտեսանելի լույս. Լույսի քվանտների կլանումը կոմպլեքսներով (օրինակ՝ ութանիստ կառուցվածք ունեցողների) բացատրվում է լույսի փոխազդեցությամբ էլեկտրոնների հետ, որոնք գտնվում են վրա. դε-ենթամակարդակ, որն ուղեկցվում է դրանց անցումով դեպի դատարկ ուղեծրեր դγ-ենթամակարդակ. Օրինակ՝ հեքսաակվատիտան (III) 3+ կատիոններ պարունակող ջրային լուծույթով լույսն անցնելիս սպեկտրի դեղնականաչավուն հատվածում հայտնաբերվում է լույսի կլանման գոտի (20300 սմ -1, λ=500 նմ)։ Դա պայմանավորված է կոմպլեքսավորող նյութի մեկ էլեկտրոնի անցումից դε-AO վրա դγ-ենթամակարդակ:

Ուստի 3+ պարունակող լուծույթը ձեռք է բերում մանուշակագույն երանգ (ի լրումն ներծծվող դեղնականաչի)։ Վանադիումի աղի Cl 3 լուծույթը կանաչ է: Դա պայմանավորված է նաև էլեկտրոնների համապատասխան անցումներով, երբ նրանք կլանում են լույսի ճառագայթի էներգիայի մի մասը։ Հիմնական վիճակում՝ վանադիումի (III) էլեկտրոնային կոնֆիգուրացիայով 3 դ 2, երկու չզույգված էլեկտրոններ են զբաղված դε-ենթամակարդակ:

Կա միայն երկու էլեկտրոնների անցման երկու տարբերակվրա դγ-ենթամակարդակ՝ կամ երկուսն էլէլեկտրոնները զբաղված են դγ-AO, կամ միայն մեկնրանցից. Էլեկտրոնների ցանկացած այլ անցում, որը կապված է ընդհանուր սպինի նվազման հետ, արգելված է:
Ավելորդ էներգիա ստացած էլեկտրոնների նշված անցումները համապատասխանում են կլանման գոտիմոտ 400 նմ հեքսաակավանադիումի (III) քլորիդի լուծույթի կլանման սպեկտրում: Սպեկտրի մանուշակագույն-մանուշակագույն շրջանի կլանումը լուծույթին լրացուցիչ գույն է տալիս. վառ կանաչ. Եթե կոմպլեքսավորող նյութն ունի էլեկտրոնային կոնֆիգուրացիա դ 0 կամ դ 10 ապա էլեկտրոնների անցումներՀետ դε- միացված դγ-ենթամակարդակ կամ հակառակը անհնարինկամ այն պատճառով, որ էլեկտրոնների բացակայություն, կամ այն պատճառով, որ դատարկ ուղեծրերի բացակայություն. Հետևաբար, համալիրների լուծույթները կոմպլեքսավորող նյութերով, ինչպիսիք են Sc(III) (3 դ 0), Cu (I) (3 դ 10), Zn(II) (3 դ 10), Cd(II) (4 դ 10) և այլն, էներգիա չեն կլանում սպեկտրի տեսանելի մասում և հայտնվում են անգույն. Լույսի կլանման ընտրողականությունը կախված է ոչ միայն բարդացնող միջոցԵվ դրա օքսիդացման վիճակը, այլեւ ից լիգանների տեսակը. Սպեկտրոքիմիական շարքի ձախ կողմում գտնվող լիգանները բարդ միացության մեջ փոխարինելիս լիգանդներով, որոնք ստեղծում են. ուժեղնկատվել է էլեկտրաստատիկ դաշտ աճփոխանցվող լույսից էլեկտրոնների կողմից կլանված էներգիայի մասնաբաժինը և, որպես հետևանք, նվազումհամապատասխան կլանման գոտու ալիքի երկարությունը: Այսպիսով, տետրաակվապղինձ (II) 2+ կատիոններ պարունակող ջրային լուծույթը կապույտ է, իսկ տետրամին պղնձի (II) 2+ սուլֆատի լուծույթը՝ ինտենսիվ կապույտ։
Առնչվող տեղեկություններ.