Farmacopea statale xiii. Determinazione dei principali gruppi di sostanze biologicamente attive. Autenticazione delle foglie intere
I medicinali sono un prodotto di produzione specifico, la cui qualità il consumatore non può valutare in modo indipendente. Garantire la qualità sia dei medicinali prodotti in Russia che di quelli importati dall'estero è uno dei compiti principali dello Stato nel campo della tutela della salute pubblica. Tra i compiti più importanti c'è non solo la saturazione del mercato farmaceutico nazionale con questi medicinali, ma anche l'ingresso nel mercato farmaceutico internazionale, cosa che può essere raggiunta garantendo che i medicinali nazionali rispettino i requisiti degli standard mondiali, ha osservato la Ministra Veronika Skvortsova nel suo discorso introduttivo alla la pubblicazione.
La nuova edizione della Farmacopea di Stato, XIII edizione, risolve questi problemi strategici.
La prima farmacopea, pubblicata nel 1765, era in latino e aveva lo scopo di garantire la qualità dei medicinali utilizzati dai chirurghi negli ospedali militari. Negli anni, decenni e secoli successivi, la farmacopea nazionale è stata più volte ripubblicata, aggiornando il suo contenuto in conformità con lo stato e il livello di sviluppo dell'industria farmaceutica e del sistema di controllo e di licenza sia nel nostro Paese che all'estero, ha affermato il direttore del Dipartimento della regolamentazione statale della circolazione dei medicinali nella sua introduzione finanzia Arsalan Tsyndymeev.
La Farmacopea di Stato della XIII edizione comprendeva 229 articoli di farmacopea generale e 179 articoli di farmacopea.
Per la prima volta nella Farmacopea di Stato della XIII edizione vengono introdotti 99 articoli di farmacopea generale, di cui 30 sui metodi di analisi, 5 sulle forme di dosaggio e 12 sui metodi per determinare i parametri farmaceutici e tecnologici delle forme di dosaggio. Inoltre, 2 articoli generali di farmacopea - sulle materie prime delle piante medicinali e 3 - sui metodi della sua analisi, 7 - sui gruppi di farmaci immunobiologici e 31 - sui metodi del loro test, 3 - sui gruppi di farmaci dal sangue e plasma sanguigno di esseri umani e animali, 9 - sui metodi di analisi dei medicinali ottenuti dal sangue e dal plasma sanguigno di esseri umani e animali.
L'obiettivo principale perseguito dalla Farmacopea statale della Federazione Russa è standardizzare la qualità dei medicinali in circolazione sul mercato farmaceutico nazionale, osserva Elena Sakanyan, direttrice del Centro per la farmacopea e la cooperazione internazionale dell'Istituto di bilancio dello Stato federale “NTsESMP”.
La chiave per risolvere il problema sarà il rilascio tempestivo della Farmacopea statale della Federazione Russa, che, in conformità con la legge federale “Sulla circolazione dei medicinali” dovrebbe essere effettuata con una frequenza non superiore a 1 volta in 5 anni garantire un’assistenza medica di alta qualità alla popolazione del nostro Paese.
L'ordinanza del Ministero della Salute della Federazione Russa del 29 ottobre 2015 n. 771 prevede l'introduzione in vigore delle monografie generali della farmacopea e delle monografie della farmacopea incluse nella Farmacopea statale della XIII edizione dal 1 gennaio 2016.
È stato stabilito che le monografie della farmacopea generale e le monografie della farmacopea approvate da questa ordinanza, le monografie della farmacopea generale e le monografie della farmacopea approvate con ordinanza del Ministero della Salute della Federazione Russa del 21 novembre 2014 n. 768 “Sull'approvazione delle monografie e delle monografie della farmacopea generale monografie farmacopee” costituiscono le pubblicazioni della Farmacopea di Stato XIII
Determinato che:
documentazione normativa per i medicinali registrati per uso medico, nonché per i medicinali per uso medico, le cui domande di registrazione statale sono presentate al Ministero della Salute della Federazione Russa prima dell'entrata in vigore delle monografie della farmacopea approvate dal presente ordine , saranno resi conformi alle presenti monografie farmacopee prima del 1° gennaio 2018;
documentazione normativa per i medicinali registrati per uso medico, nonché per i medicinali per uso medico, le cui domande di registrazione statale sono presentate al Ministero della Salute della Federazione Russa prima dell'entrata in vigore delle monografie farmacopeiche generali approvate da questo dell'ordinanza, saranno resi conformi ai presenti articoli delle monografie generali della farmacopea fino al 1° gennaio 2019.
La nuova Farmacopea di Stato è reperibile al seguente indirizzo email:
Monografie farmacopee generali e monografie farmacopee della Farmacopea statale della Federazione Russa
XIII edizione
V.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, ND Bunyatyan
Istituzione di bilancio dello Stato federale "Centro scientifico per la competenza dei prodotti medici" del Ministero della sanità della Federazione Russa, 127051, Mosca, Russia
Sommario: La Farmacopea di Stato della Federazione Russa è un insieme di articoli di farmacopea generale e di articoli di farmacopea ed è soggetta a ristampa almeno una volta ogni 5 anni. La prossima edizione della Farmacopea di Stato della Federazione Russa, la cui pubblicazione è prevista per il 2015, includerà sia monografie farmacopeiche generali che monografie farmacopeiche sviluppate per la prima volta nella pratica dell'analisi farmacopea nazionale e, in alcuni casi, globale, nonché articoli che sono versioni aggiornate e riviste delle monografie della farmacopea generale e delle monografie della farmacopea. L'introduzione di monografie farmacopeiche generali e monografie farmacopee di questa edizione della Farmacopea di Stato della Federazione Russa aumenterà significativamente il livello di analisi della farmacopea nazionale e ne garantirà la conformità ai requisiti degli standard mondiali.
Parole chiave: farmacopea statale; monografia generale della farmacopea; monografia farmacopea; qualità dei medicinali; analisi farmacopea.
Descrizione bibliografica: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Articoli di farmacopea generale e articoli di farmacopea della Farmacopea di Stato della Federazione Russa XIII edizione. Gazzetta ufficiale del Centro scientifico per la competenza dei prodotti medici 2015; (2): 54-58.
MONOGRAFIE GENERALI E MONOGRAFIE FARMACOPEIALI DELLA FARMACOPOEIA STATALE DELLA FEDERAZIONE RUSSA, xIII Edizione v.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, ND Bunyatyan
Istituzione di bilancio dello Stato federale "Centro scientifico per la valutazione esperta dei prodotti medicinali" del Ministero della sanità della Federazione Russa, 127051, Mosca, Russia
Riassunto: La Farmacopea di Stato della Federazione Russa è una raccolta di monografie generali e monografie di farmacopea. Dovrebbe essere ristampato almeno una volta ogni 5 anni. La prossima edizione della Farmacopea di Stato della Federazione Russa è prevista per la pubblicazione nel 2015. Comprenderà sia le monografie generali e della farmacopea sviluppate inizialmente a livello nazionale e, in alcuni casi, globale, sia le monografie generali e della farmacopea riviste e aggiornate. L'implementazione delle monografie generali e della farmacopea della menzionata edizione della Farmacopea di Stato della Federazione Russa aumenterà significativamente il livello dell'analisi della farmacopea nazionale e ne garantirà la conformità agli standard internazionali.
Parole chiave: Farmacopea di Stato; monografia generale; monografia farmacopea; qualità del farmaco; analisi farmacopea.
Descrizione bibliografica: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Monografie generali e monografie farmacopee della Farmacopea di Stato della Federazione Russa, XIII edizione. Centro scientifico per la valutazione esperta del bollettino dei medicinali 2015; (2): 54-58.
L'obiettivo principale perseguito dalla Farmacopea statale della Federazione Russa (SF RF) è standardizzare la qualità dei medicinali in circolazione sul mercato farmaceutico nazionale.
Attualmente, il Fondo statale della X edizione (1968), il Fondo statale dell'edizione XI (parte 1 - 1987, parte 2 - 1989), nonché il Fondo statale della XII edizione (parte 1 - 2007) operano su il territorio della Federazione Russa. Le date di uscita indicate per queste pubblicazioni del Fondo globale indicano che non sono conformi ai requisiti dell'attuale legge federale del 12 aprile 2010 "Sulla circolazione dei medicinali" n. 61-FZ relativa ai tempi della ristampa del Farmacopea di Stato.
Nonostante ciò, le monografie di farmacopea generale (GPM) e le monografie di farmacopea (PS) incluse nelle edizioni X-X11 della Farmacopea di Stato non sono state cancellate. Alcuni di essi necessitano di revisione, alcuni articoli hanno già perso la loro rilevanza a causa della mancanza di domanda. Questi includono GPM come “Metodo biologico per determinare l'attività di una soluzione allo 0,1% di adrenalina cloridrato”, “Test biologici
zione di novarsenol e miarsenol”, “Determinazione del grado di bianco dei medicinali in polvere” e altri. Occorre anche abolire le FS per i medicinali ritirati dalla circolazione. Inoltre, le sostanze farmaceutiche approvate nel periodo tra le pubblicazioni delle farmacopee, secondo le quali le singole imprese producono farmaci e ne controllano la qualità, devono essere riviste, poiché i metodi di analisi farmacopea vengono costantemente migliorati.
Attualmente sono stati preparati 229 OFS e 179 FS per l'inclusione nella prossima XIII edizione del Fondo statale della Federazione Russa. Possono essere suddivisi in apposite sezioni.
La sezione “Articoli di farmacopea generale” contiene: articoli sui metodi generali, monografie di farmacopea generale su metodi di analisi, reagenti, forme di dosaggio e metodi della loro analisi; materie prime vegetali medicinali e metodi per valutarne la qualità; gruppi di farmaci immunobiologici e metodi della loro analisi; medicinali ottenuti da sangue e plasma sanguigno umano e animale e metodi analitici utilizzati per valutarne la qualità; radiofarmaci.
Le monografie della farmacopea sono presentate nelle sezioni “Sostanze farmaceutiche” e “Farmaci”. La sezione “Sostanze farmaceutiche” è presentata da articoli di farmacopea su sostanze farmaceutiche di origine sintetica o minerale, utilizzate come principi attivi e/o eccipienti. Inoltre, le monografie della farmacopea sulle materie prime vegetali medicinali utilizzate nella produzione farmaceutica, compresi i preparati a base di erbe medicinali, sono presentate in una sottosezione separata. La sezione “Farmaci” è composta da due sottosezioni: farmaci immunobiologici e farmaci ottenuti da sangue e plasma umani.
Le appendici al Fondo statale della Federazione Russa, XIII edizione, sono presentate con tabelle di riferimento: una tabella delle masse atomiche, tabelle alcol-olometriche, una tabella degli equivalenti isotonici delle sostanze medicinali per il cloruro di sodio, una tabella del numero di gocce in 1 g e 1 ml e la massa di 1 goccia di farmaci liquidi a una temperatura di 20 ° C utilizzando un misuratore di gocce standard, disegni di spettri IR di campioni standard di sostanze farmaceutiche.
Di queste, per la prima volta per la Farmacopea di Stato della Federazione Russa, la XIII edizione, sono state sviluppate e raccomandate per l'approvazione 102 monografie della Farmacopea generale, comprese 30 monografie della Farmacopea generale per i metodi di analisi, 5 monografie della Farmacopea generale per le forme di dosaggio, e 12 monografie della Farmacopea generale per i metodi per determinare i parametri farmaceutici e tecnologici delle forme di dosaggio, 2 monografie della Farmacopea generale per le materie prime delle piante medicinali e 3 monografie della Farmacopea generale per i metodi della sua analisi, 7 monografie della Farmacopea generale per gruppi di medicinali immunobiologici e 31 Monografia della Farmacopea Generale per i loro metodi di analisi, 3 Monografia della Farmacopea Generale per gruppi di medicinali ottenuti da sangue e plasma umano e animale, 9 Monografia della Farmacopea Generale per metodi di analisi dei medicinali ottenuti dal sangue e dal plasma sanguigno di esseri umani e animali.
Inoltre, per l'inclusione nella Farmacopea Statale della Federazione Russa della XIII edizione, sono stati preparati per la prima volta 17 articoli di farmacopea, di cui 4 FS per sostanze farmaceutiche, 4 FS per materie prime vegetali, 5 FS per medicinali immunobiologici e 4 FS per medicamenti provenienti da sangue e plasma umano .
Un certo numero di sostanze farmaceutiche generali precedentemente presentate nella Farmacopea statale dell'URSS nelle edizioni X e XI (edizione X della Farmacopea statale dell'URSS, edizione XI della Farmacopea statale dell'URSS) sono escluse dalla pratica dell'analisi moderna della farmacopea in quanto non reclamate. Sono state riviste le altre attuali Farmacopea statale dell'URSS X edizione dell'OFS e FS, XI edizione della Farmacopea statale dell'URSS (edizione 1, 2) e Farmacopea statale della Federazione Russa XII edizione (Farmacopea statale della Federazione Russa SF XII edizione) e integrato con materiali che tengono conto dei requisiti moderni, dei risultati scientifici e pratici nel campo dell'analisi farmacopea.
La Monografia della Farmacopea Generale “Norme per l'uso delle monografie della farmacopea” è stata integrata con le sezioni “Umidità” e “Conservazione”. Inoltre sono stati apportati opportuni chiarimenti nelle sezioni “Descrizione”, “Massa”, “Volume”, “Temperatura”, “Pesata accurata”, “Solventi”, “Indicatori”, “Limiti di contenuto”, “Filtrazione”.
Il “Campionamento” dell'OFS comprende definizioni di termini, disposizioni generali ed è stata aggiunta la sezione “Regole di campionamento”. Sono state inoltre introdotte nuove sezioni: “Campionamento da medicinali e materiali sfusi
pesca”, “Campionamento dei medicinali nelle confezioni di consumo”, “Confezionamento, etichettatura, conservazione dei campioni selezionati”, “Requisiti per i locali, le attrezzature e il personale di campionamento”.
OFS “Sieve Analysis” è stato sviluppato per sostituire l'edizione OFS GF XI “Determinazione della macinazione di polveri e setacci” e indica lo scopo dell'analisi dei setacci, le condizioni e i metodi per la sua implementazione, la classificazione delle dimensioni tipiche dei setacci in conformità con i requisiti del mondo standard.
La nuova edizione della monografia della Farmacopea Generale “Sterilizzazione” contiene i moderni metodi e condizioni attuali per la sterilizzazione di sostanze farmaceutiche, farmaci, eccipienti, ecc., un criterio per il livello di sterilizzazione e una descrizione degli indicatori biologici di sterilizzazione.
In conformità con ulteriori dati sulla tossicità, sono stati apportati chiarimenti alla monografia della Farmacopea Generale “Solventi organici residui” e sono state aggiunte informazioni sui solventi con tossicità non sufficientemente comprovata.
Nella Monografia “Radiofarmaci” della Farmacopea Generale la sezione “Elenco degli indicatori di qualità che i radiofarmaci di produzione industriale e di produzione estemporanea devono soddisfare” è stata ampliata e la sezione “Emivita” è stata integrata con un’equazione per l’emivita curva.
La Monografia della Farmacopea Generale “Sostanze Farmaceutiche” ha apportato significative integrazioni alla sezione che caratterizza i requisiti di qualità delle sostanze farmaceutiche (ad esempio “Solventi organici residui”, “Endotossine batteriche o pirogenicità”, ecc.). Viene fornita una definizione modificata del termine “sostanza farmaceutica”. La Monografia della Farmacopea Generale è stata integrata con le sezioni relative ai metodi di analisi biologica: “Tossicità anomala” e “Sostanze istaminiche e/o depressive”. Comprende tabelle come “Limiti per il controllo, l’identificazione e la qualificazione delle impurezze correlate per le sostanze farmaceutiche”, “Limiti per il controllo, l’identificazione e la qualificazione delle impurezze correlate nei peptidi ottenuti sinteticamente” e “Criteri per la standardizzazione del contenuto ammissibile di metalli pesanti”.
La Monografia della Farmacopea Generale “Durata di validità dei medicinali” è stata integrata con la sezione “Prove di stabilità con il metodo dell’”invecchiamento accelerato”.
Nella Monografia della Farmacopea Generale “Reazioni generali all'autenticità” è stata inoltre introdotta la sezione “Alluminio” e nella Monografia della Farmacopea Generale “Metodo di combustione in un pallone con ossigeno” è stata aggiunta la sezione “Selenio”.
La descrizione dei test per la purezza e i limiti consentiti delle impurità nei medicinali continua. Pertanto, per la prima volta vengono presentati metodi per determinare le impurità di alluminio, fosfati, mercurio e selenio. I metodi per determinare le impurità di ammonio, calcio, arsenico, solfati, cloruri e zinco e i requisiti normativi per il loro contenuto sono armonizzati con i requisiti degli standard mondiali. La monografia della Farmacopea generale “Metalli pesanti” specifica inoltre i metodi per la determinazione quantitativa dei singoli ioni, mentre la monografia della Farmacopea generale “Ferro” contiene chiarimenti riguardanti la concentrazione dei reagenti.
Si consiglia di effettuare la determinazione del fluoro nei medicinali con tre metodi: titrimetrico, spettrofotometrico e ionometrico.
Oltre alla determinazione del numero di saponificazione, del numero di acido, di etere e di iodio, la XIII edizione della Farmacopea di Stato della Federazione Russa comprende monografie farmacologiche generali dedicate alla determinazione del numero di perossido, ossidrile e anisidina. A differenza dell'indice di perossido, l'indice di anisidina caratterizza il contenuto di prodotti di ossidazione secondaria (aldeidi, chetoni) nella sostanza farmaceutica e/o nel prodotto farmaceutico testato e fornisce quindi un quadro completo della qualità del farmaco analizzato.
La Monografia della Farmacopea Generale “Determinazione delle Proteine” è stata notevolmente rivista: è stata modificata la struttura dell'articolo, sono stati apportati chiarimenti sulla determinazione delle sostanze interferenti, è stata ampliata la descrizione dei metodi spettrofotometrici e colorimetrici per la determinazione delle proteine ed è stata ampliata la descrizione dei metodi spettrofotometrici e colorimetrici per la determinazione delle proteine. è stato introdotto il metodo fluorimetrico per la determinazione delle proteine utilizzando l'o-ftalaldeide. È escluso un metodo come la determinazione delle proteine con il reagente di Nessler: questo metodo è incluso in una monografia separata della Farmacopea Generale "Determinazione dell'azoto proteico con il reagente di Nessler con precipitazione preliminare del materiale proteico nei medicinali immunobiologici".
Per caratterizzare l'indicatore principale della qualità dei farmaci antiacidi, la 13a edizione della Farmacopea di Stato della Federazione Russa ha incluso per la prima volta la Monografia della Farmacopea Generale "Determinazione della capacità di neutralizzazione dell'acido".
I moderni metodi spettroscopici per lo studio della struttura e della qualità dei farmaci sono la spettrometria Raman, la spettrometria di fluorescenza a raggi X, la spettrometria del vicino infrarosso, la spettrometria infrarossa, la spettrofotometria ultravioletta e visibile, la spettrometria di emissione atomica, la fluorimetria, la risonanza della spettroscopia magnetica nucleare, la spettrometria di massa, ecc. Tenendo conto delle moderne capacità dei metodi spettroscopici, sono stati sviluppati per la prima volta OFS come “spettrometria Raman”, “spettrometria di fluorescenza a raggi X”, “spettrometria di massa” e “spettrometria del vicino infrarosso”.
La necessità di introdurre il "Polimorfismo" e la "Cristallinità" dell'OFS è dovuta all'importanza di valutare il polimorfismo e il grado di cristallinità o il contenuto della frazione amorfa nelle sostanze farmaceutiche, che successivamente determina l'effetto terapeutico dei farmaci e influenza significativamente i parametri della loro biodisponibilità.
La Monografia della Farmacopea Generale “Spettrometria di Emissione Atomica e Spettrometria di Assorbimento Atomico” della XII edizione della Farmacopea di Stato (Parte 1) è suddivisa in due Monografie di Farmacopea Generale: “Spettrometria di Emissione Atomica” e “Spettrometria di Assorbimento Atomico”. La prossima edizione del Fondo statale della Federazione Russa presenterà una versione rivista e ampliata della monografia della Farmacopea generale “Spettrometria delle emissioni atomiche”.
Nella nuova edizione della Monografia della Farmacopea Generale "Fluorimetria", la formulazione della definizione del metodo è stata modificata verso una maggiore brevità e versatilità, vengono fornite le sostanze farmaceutiche per le quali è disponibile questo metodo di determinazione, vengono descritte le sorgenti di radiazioni eccitanti, il concetto di spostamento di Stokes viene fornito con una breve giustificazione della causa di questo fenomeno, gruppi di composti con proprietà fluorescenti-
Abbiamo aggiunto un elenco di fattori che influenzano l'intensità della fluorescenza.
Per la prima volta la Farmacopea di Stato include articoli di farmacopea generale “Microscopia ottica” e “Determinazione della distribuzione granulometrica mediante diffrazione della luce laser”. A differenza del metodo microscopico, il metodo per lo studio dei sistemi dispersi basato sulla diffusione della luce laser consente la valutazione di tutte le particelle, non è distruttivo e consente di misurare dimensioni delle particelle nell'intervallo da 0,1 μm a 3 mm, a differenza della microscopia ottica , che viene utilizzato per caratterizzare particelle con dimensioni da 1 micron o più.
Due articoli separati sono dedicati alla perdita di peso durante l'essiccazione e alla determinazione dell'acqua. Oltre al semi-micrometodo di K. Fischer viene descritto un metodo coulometrico (micrometodo) che permette di quantificare microquantità di acqua nei medicinali.
Nella Monografia “Viscosità” della Farmacopea Generale è stata modificata la definizione di liquidi non newtoniani e sono state caratterizzate le condizioni per la determinazione della viscosità su un viscosimetro rotazionale. Sono state aggiunte come nuove le seguenti sottosezioni: “Viscosimetri a cilindro concentrico (viscosimetri assoluti)”, “Viscosimetri a sistema cono-piano (viscosimetri assoluti)” e “Viscosimetri a fuso (viscosimetri relativi)”.
Lo sviluppo dell'OFS "Conducibilità elettrica" è stato causato dalla necessità di includere questo indicatore di qualità e il metodo per la sua determinazione nell'"Acqua purificata" e "Acqua per preparazioni iniettabili" dell'OFS.
Un'alternativa o un'aggiunta ai metodi di analisi cromatografici è il metodo dell'elettroforesi. Durante la revisione della Monografia “Elettroforesi” della Farmacopea Generale, particolare attenzione è stata posta alla descrizione del metodo più utilizzato nell'analisi farmaceutica dell'elettroforesi proteica in gel di poliacrilammide con sodio dodecil solfato. Rispetto all’elettroforesi tradizionale, l’introduzione dell’elettroforesi capillare ha reso possibile la quantificazione automatizzata non solo di grandi molecole o microparticelle cariche, ma anche di cationi, anioni e composti neutri.
Il metodo dell'elettroforesi su gel di poliacrilammide è ampiamente utilizzato per separare varie proteine e stimare il loro peso molecolare. Variando la concentrazione di poliacrilammide nel gel, è possibile controllare l'intervallo dei pesi molecolari delle proteine separate, il che è molto conveniente per ottenere risultati accurati. Il frazionamento delle molecole proteiche mediante questo metodo è ampiamente utilizzato per controllare la qualità dei farmaci proteici.
Per la prima volta, nella pratica dell'analisi farmacopea domestica, viene introdotta l'analisi elementare automatica, che consente di semplificare notevolmente l'analisi dei composti organici contenenti azoto, zolfo, cloro, bromo, ossigeno e altri elementi. La determinazione si basa sulla decomposizione ossidativa ad alta temperatura delle sostanze in studio e successiva determinazione selettiva dei prodotti di decomposizione corrispondenti a questi elementi mediante gascromatografia. Uno dei vantaggi dell'analisi elementare automatica è la possibilità di utilizzare un campione standard con un contenuto noto dell'elemento da determinare per valutare la qualità di vari medicinali per questo elemento.
La determinazione dell'attività di adsorbimento degli enterosorbenti è un indicatore specifico della qualità di questa classe di farmaci. L'attività di adsorbimento viene utilizzata per caratterizzare la capacità di assorbimento degli enterosorbenti; i metodi per la sua determinazione si riflettono in questa monografia della Farmacopea Generale.
Gli articoli che descrivono i metodi biologici per il controllo di qualità dei medicinali inclusi nella XIII edizione del Fondo statale della Federazione Russa corrispondono all'approccio moderno ai test biologici. La Monografia della Farmacopea Generale “Endotossine Batteriche” introduce per la prima volta la descrizione dei metodi fotometrici per la determinazione delle endotossine batteriche: turbidimetrico e cromogenico.
Dalla monografia della Farmacopea Generale "Metodi biologici per valutare l'attività delle materie prime vegetali e dei preparati medicinali contenenti glicosidi cardiaci", durante la sua revisione è stato escluso il metodo di valutazione biologica del contenuto di glicosidi cardiaci effettuato sui gatti.
La Monografia della Farmacopea Generale “Purezza microbiologica” è stata notevolmente migliorata e integrata con nuove sezioni, tra cui quelle riguardanti i requisiti dei medicinali immunobiologici.
La revisione della Monografia della Farmacopea Generale “Determinazione dell'efficacia dei conservanti antimicrobici” ha permesso di introdurre in essa opportune integrazioni e chiarimenti riguardo alle categorie di medicinali che contengono conservanti e ai criteri per valutare l'efficacia dei conservanti antimicrobici nei medicinali.
Revisione della Monografia della Farmacopea Generale “Reagenti. Indicatori" ha portato ad un aumento significativo dell'elenco dei reagenti e degli indicatori utilizzati nelle analisi della farmacopea. I nomi chimici dei reagenti e degli indicatori sono forniti in conformità con i requisiti dell'Unione Internazionale di Chimica Pura e Applicata (IUPAC). Sono indicati i numeri di registrazione CAS (Chemical Abstracts Service) delle sostanze chimiche incluse nel registro del Chemical Abstracts Service. Sono stati apportati chiarimenti e integrazioni alle formule chimiche e ai parametri fisici dei reagenti e degli indicatori.
In occasione della revisione della Farmacopea Generale, l'“Elaborazione statistica dei risultati di esperimenti chimici e test biologici” è stata divisa in due Farmacopea Generale: “Elaborazione statistica dei risultati di un esperimento chimico” ed “Elaborazione statistica dei risultati della determinazione dell'attività farmacologica specifica”. dei farmaci con metodi biologici”.
Per la prima volta, la XIII edizione del Fondo statale della Federazione Russa ha sviluppato e incluso sostanze farmaceutiche generali come “Forme di dosaggio”, “Forme di dosaggio per inalazioni”, “Cerotti transdermici”, “Soluzioni” e “Granuli pressati ”.
La monografia della Farmacopea Generale “Forme di dosaggio” contiene termini e definizioni di base, classificazione delle forme di dosaggio, requisiti generali per la produzione/fabbricazione, valutazione della qualità, imballaggio, etichettatura e conservazione dei medicinali in forme di dosaggio appropriate. Questa monografia della Farmacopea generale contiene indicatori di qualità obbligatori per valutare la qualità di un medicinale in qualsiasi forma di dosaggio, nonché indicatori di qualità che caratterizzano le caratteristiche della produzione/fabbricazione del medicinale e dei suoi principi attivi e ausiliari.
17 Monografia della Farmacopea Generale per le forme farmaceutiche furono introdotte per sostituire i corrispondenti articoli del Fondo statale dell'URSS, edizione XI, con aggiunte e modifiche apportate ad essi.
La maggior parte delle monografie della Farmacopea generale sui metodi di valutazione degli indicatori farmaceutici e tecnologici della qualità delle forme di dosaggio sono incluse per la prima volta nella 13a edizione della Farmacopea statale della Federazione Russa. Sono stati sviluppati OFS separati per i metodi di analisi precedentemente descritti negli articoli della Farmacopea di Stato XI per le forme farmaceutiche (metodi per la determinazione del volume estraibile delle forme farmaceutiche per uso parenterale, abrasione delle compresse, tempo di completa deformazione delle supposte a base lipofila, disintegrazione delle compresse e capsule).
Per la prima volta sviluppati e inclusi nel Fondo statale della Federazione Russa nella XIII edizione della Monografia della Farmacopea Generale per tali metodi per determinare indicatori di qualità farmaceutica e tecnologica delle forme di dosaggio come “Inclusioni meccaniche visibili nelle forme di dosaggio per uso parenterale e oftalmico forme di dosaggio”, “Inclusioni meccaniche invisibili nelle forme di dosaggio per uso parenterale”, “Peso (volume) del contenuto della confezione”, “Uniformità di dosaggio”, “Uniformità della massa delle forme di dosaggio”, “Resistenza alla compressione compresse”, “Disintegrazione supposte e compresse vaginali”, “Dissoluzione per supposte a base lipofila”, “Grado di fluidità polveri”, “Dissoluzione per cerotti transdermici”.
La sottosezione “Materie prime vegetali medicinali e metodi della sua analisi” comprende 23 Farmacopea Generale e 55 FS. I requisiti per il campionamento, lo stoccaggio, l'imballaggio, l'etichettatura e il trasporto delle materie prime a base di piante medicinali e dei preparati a base di erbe medicinali sono presentati nella sottosezione "Articoli generali" della Monografia della Farmacopea Generale "Campionamento di materie prime a base di piante medicinali e preparati a base di erbe medicinali", Monografia della Farmacopea Generale “Conservazione delle materie prime vegetali officinali e dei preparati erboristici” e Monografia della Farmacopea Generale “Imballaggio, etichettatura e trasporto delle materie prime e dei preparati erboristici officinali”.
I requisiti generali per le materie prime vegetali medicinali sono stabiliti nella Monografia della Farmacopea Generale “Materie prime vegetali medicinali”. 12 OFS sono dedicati ai metodi di analisi dei materiali vegetali officinali e dei preparati erboristici officinali. 8 Le monografie della Farmacopea Generale descrivono i requisiti per i metodi di analisi dei materiali delle piante medicinali in base ai gruppi morfologici: fiori, frutti, semi, germogli, erbe, foglie, corteccia e organi sotterranei. In questa sezione sono inoltre presentate 2 Monografie di Farmacopea Generale per i medicinali di origine vegetale: Monografia di Farmacopea Generale “Oli grassi vegetali” e “Oli essenziali”.
La monografia della Farmacopea generale “Materie prime vegetali medicinali” è stata sviluppata e inclusa per la prima volta nel Fondo statale della Federazione Russa. Questo articolo fornisce una classificazione delle materie prime delle piante medicinali in base ai gruppi morfologici, alla macinazione, al contenuto dell'uno o dell'altro gruppo di sostanze biologicamente attive, fornisce i principali indicatori di qualità delle materie prime delle piante medicinali e i requisiti generali per lo stoccaggio e l'imballaggio.
Delle 12 monografie della Farmacopea generale sui metodi di analisi delle materie prime delle piante medicinali, 3 monografie della Farmacopea generale sono incluse nel Fondo statale della Federazione Russa nella XIII edizione per la prima volta, 9 monografie della Farmacopea generale sono state riviste e introdotte per sostituire gli articoli del Fondo statale dell'URSS nell'XI edizione. Per la prima volta inclusa nella pratica dell'analisi farmacopea nazionale: Monografia generale della farmacopea “Determinazione del contenuto di metalli pesanti e arsenico nelle materie prime delle piante medicinali e nelle piante medicinali”
medicinali", Monografia della Farmacopea Generale "Determinazione del contenuto di pesticidi residui nelle materie prime di piante medicinali e nei preparati a base di erbe medicinali", Monografia della Farmacopea Generale "Determinazione del coefficiente di assorbimento d'acqua e del coefficiente di consumo delle materie prime di piante medicinali".
La XIII edizione del Fondo statale della Federazione Russa comprende nuovi tipi di materie prime vegetali medicinali approvate per uso medico, come i frutti secchi di aronia, foglie di ginkgo biloba, erba di meliloto e germogli di pioppo. La struttura delle monografie della farmacopea sulle materie prime delle piante medicinali è in armonia con i requisiti degli standard farmacopeici mondiali per le materie prime delle piante medicinali.
La sottosezione “Gruppi di medicinali immunobiologici e metodi della loro analisi” comprende 43 Monografie di Farmacopea Generale e 48 FS per i farmaci immunobiologici.
Gli IMP includono vaccini, tossoidi, sieri e allergeni.
Per la prima volta, la pratica dell’analisi farmacopea nazionale ha introdotto l’OFS per singoli gruppi di ILP, come “Batteriofagi terapeutici e profilattici”, “Probiotici”, “Probiotici contenenti bifidi”, “Probiotici contenenti colax”, “Probiotici contenenti lattosio contenenti probiotici”, “Probiotici contenenti spore” e “Medicinali ottenuti con metodi di DNA ricombinante”.
Dei 48 FS per IMP inclusi nella XIII edizione del Fondo statale della Federazione Russa, 5 FS sono stati sviluppati per la prima volta nella pratica dell'analisi farmacopea nazionale: "Vaccino dissenteria contro il lipopolisaccaride di Shigella Sonne", "Vaccino contro la rosolia in coltura viva ”, “Vaccino inattivato contro il vaiolo”, “Immunoglobulina umana contro il vaiolo” " FS "Supposte pirogeniche, rettali" è stato sviluppato per la prima volta nella pratica dell'analisi farmaceutica nazionale e mondiale.
I medicinali provenienti dal sangue e dal plasma sanguigno dell'uomo e degli animali sono rappresentati da 13 OFS e 8 FS.
I medicinali ricavati dal sangue e dal plasma sanguigno umani comprendono preparati di albumina umana
ka, preparazioni di immunoglobuline umane e preparazioni di fattori della coagulazione del sangue contenenti uno dei fattori della coagulazione del sangue o una loro combinazione.
12 Farmacopea Generale Nella XIII edizione della Farmacopea di Stato della Federazione Russa vengono presentate per la prima volta monografie sui medicinali derivanti dal sangue umano e animale e dal plasma sanguigno.
Le monografie farmacopeiche per sostanze farmaceutiche di origine sintetica e minerale contengono i nomi chimici delle sostanze medicinali in conformità con i requisiti dell'Unione internazionale di chimica pura e applicata (IUP), indicatori di qualità, i loro valori standardizzati e metodi corrispondenti per l'analisi di questi indicatori .
Il metodo della spettrometria a infrarossi, che fornisce il risultato più affidabile, è considerato il principale metodo di identificazione. Per una serie di sostanze, la tredicesima edizione dell'Appendice al Fondo statale della Federazione Russa contiene disegni degli spettri IR di campioni standard di queste sostanze farmaceutiche.
Per la determinazione quantitativa, viene data preferenza ai classici metodi di analisi titrimetrici. Insieme a questo, sono ampiamente utilizzati metodi moderni di analisi fisica e chimica, come la spettroscopia nella regione dell'ultravioletto, la cromatografia a gas e liquida ad alte prestazioni, che comportano l'uso di campioni standard. Il contenuto della sostanza attiva è indicato in termini di sostanza secca (se viene determinata la perdita di peso all'essiccazione), anidra (se viene determinata l'acqua) o sostanza anidra che non contiene solventi organici residui.
Pertanto, l'entrata in vigore della Monografia della Farmacopea Generale e delle FS preparate per la prossima XIII edizione del Fondo Statale della Federazione Russa non solo annullerà o sostituirà gli articoli obsoleti del Fondo Statale della Federazione Russa delle edizioni precedenti, ma garantirà inoltre che il livello di analisi della farmacopea nazionale soddisfi i requisiti degli standard mondiali.
letteratura
1. Farmacopea statale dell'URSS. 10a ed. M.: Medicina; 1968.
2. Farmacopea statale dell'URSS. 11a ed. vol. 1. M.: Medicina; 1987.
3. Farmacopea statale dell'URSS. 11a ed. vol. 2. M.: Medicina; 1989.
4. Farmacopea statale della Federazione Russa. 12a ed. Parte 1. M.: Centro Scientifico per la Competenza dei Prodotti Medici; 2007.
Istituzione di bilancio dello Stato federale "Centro scientifico per la competenza dei prodotti medici" del Ministero della sanità della Federazione Russa. Federazione Russa, 127051, Mosca, Petrovsky Boulevard, 8.
Merkulov Vadim Anatolievich. Primo vicedirettore generale, Dr. med. scienze, professore.
Sakanyan Elena Ivanovna. Direttore del Centro per la Farmacopea e la Cooperazione Internazionale, Dr. Pharm. scienze, professore.
Shemeryankina Tatyana Borisovna. Capo del Dipartimento di Farmacopea di Stato e Analisi Farmacopea, Ph.D. farm. Sci. Mochikina Olga Alekseevna. Ricercatore presso il Dipartimento di Farmacopea di Stato e Analisi Farmacopea.
Bunyatyan Natalya Dmitrievna. Vicedirettore generale per la ricerca, Dr. Pharm. scienze, professore.
1. La Farmacopea di Stato dell'URSS. 10a ed. Mosca: Meditsina; 1968 (in russo).
2. La Farmacopea statale dell'URSS. 11a ed. V. 1. Mosca: Meditsina; 1987 (in russo).
3. La Farmacopea di Stato dell'URSS. 11a ed. V. 2. Mosca: Meditsina; 1989 (in russo).
4. La Farmacopea Statale della Federazione Russa. 12a ed. V. 1. Mosca: Istituzione di bilancio dello Stato federale “Centro scientifico per la valutazione esperta dei prodotti medicinali” del Ministero della sanità della Federazione Russa; 2007 (in russo).
Istituzione di bilancio dello Stato federale "Centro scientifico per la valutazione specialistica dei medicinali" del Ministero della sanità della Federazione Russa, 8 Petrovsky Boulevard, Mosca, 127051, Federazione Russa.
Merkulov V.A. Primo Vice Direttore Generale. Dottore in Scienze Mediche, professore. Sakanyan EI. Direttore del Centro per la farmacopea e la cooperazione internazionale. Dottore in Scienze Farmaceutiche, professore.
TBC Shemeryankina. Responsabile del Dipartimento di Farmacopea dello Stato e analisi della farmacopea. Candidato di Scienze Farmaceutiche.
Mochikina O.A. Ricercatore del Dipartimento di Farmacopea del Dipartimento di Stato e analisi della farmacopea.
Bunyatyan ND. Vicedirettore generale per il lavoro scientifico. Dottore in Scienze Farmaceutiche, professore.
MINISTERO DELLA SALUTE DELLA FEDERAZIONE RUSSA
ARTICOLO DI FARMACOPEA
GinsengpresenteradiciFS.2.5.0013.15
Panaci ginseng radici In cambio del Fondo GlobaleXI, vol. 2, art. 66
Raccolte a fine agosto - inizio settembre e radici essiccate della pianta erbacea perenne selvatica e coltivata vero ginseng - Panax ginseng C. UN. Ehi, sem. Araliaceae – Araliacee.
AUTENTICITÀ
Segni esterni. Materie prime intere. Radici lunghe fino a 25 cm, spesse 0,7–2,5 cm, con 2–5 rami grandi, meno spesso senza di essi. Le radici sono fittonanti, longitudinalmente, meno spesso rugose a spirale, fragili, con frattura uniforme. Il “corpo” della radice è ispessito, quasi cilindrico, con ispessimenti anulari ben definiti sulla sommità. Nella parte superiore della radice c'è un rizoma ristretto e rugoso trasversalmente - un "collo". Il rizoma è corto con numerose cicatrici dovute ai fusti caduti; in alto forma una “testa”, che è un resto espanso del fusto e una gemma apicale (a volte 2-3). Dal “collo” si estendono talvolta una o più radici avventizie. Potrebbero mancare il “collo” e la “testa”. Il colore delle radici sulla superficie e sul taglio è bianco-giallastro, su una frattura fresca è bianco. L'odore è specifico. Il sapore dell'estratto acquoso è dolce, pungente, poi piccante-amaro.
Materie prime frantumate. Esaminando le materie prime frantumate con una lente d'ingrandimento (10×) o con uno stereomicroscopio (16×), sono visibili pezzi di radici di varie forme che passano attraverso un setaccio con fori di 7 mm. Il colore in superficie e sulla frattura è bianco-giallastro. L'odore è specifico. Il sapore dell'estratto acquoso è dolce, pungente, poi piccante-amaro.
Polvere. Esaminando la polvere con una lente d'ingrandimento (10×) o con uno stereomicroscopio (16×), è visibile una miscela di particelle frantumate di radici di varie forme di colore bianco-giallastro, che passano attraverso un setaccio con fori di 2 mm. L'odore è specifico. Il sapore dell'estratto acquoso è dolce, pungente, poi piccante-amaro.
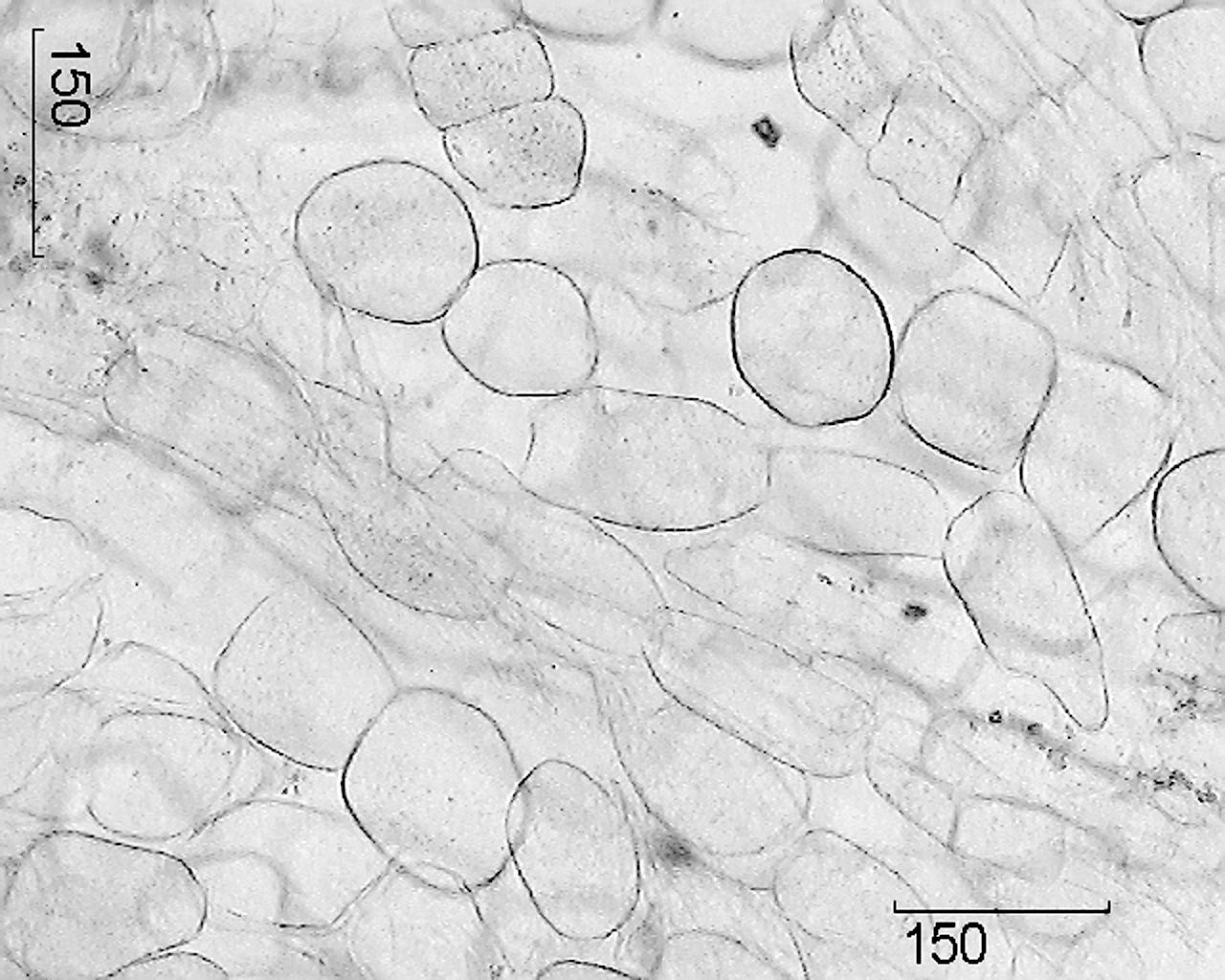
Segni microscopici. Materie prime intere. Una sezione trasversale della radice principale rivela uno stretto strato di tappo marrone chiaro, un'ampia corteccia, una linea di cambio chiara e legno.
La radice principale è ricoperta di periderma, le cui cellule sono a parete sottile e lignificate, non suberizzate. Floema e xilema sono separati dalla zona cambiale, che corre approssimativamente attraverso la metà del raggio della radice e
a volte non è visibile. Alla periferia, dallo xilema primario si estendono i raggi radiali primari a grandi cellule del tessuto parenchimale, tra i quali si trova lo xilema secondario, intersecato da numerosi raggi radiali secondari del parenchima principale. Lo xilema è costituito da cellule del parenchima a pareti sottili contenenti granuli di amido. I vasi dei raggi midollari hanno pareti ispessite e lignificate e si trovano isolati o raccolti in gruppi di 3-6. Occasionalmente si trovano cellule contenenti pigmenti gialli nel parenchima del legno. Al centro della radice sono presenti resti vagamente riconoscibili dello xilema primario sotto forma di 2 raggi. Il floema è costituito principalmente da elementi a piccole cellule; contiene contenitori schizogenici chiaramente visibili contenenti goccioline di secrezione dal giallo chiaro al rosso-marrone. I grani di amido sono piccoli, rotondi, semplici. Le singole cellule del parenchima contengono drusen di ossalato di calcio. La parte esterna della corteccia secondaria è delimitata da una zona di diverse (4-6) file di grandi cellule parenchimatiche allungate tangenzialmente del filloderma, rotonde o ovali, con un guscio leggermente ispessito.
|
|
||
|
|
|
|
|
|
|
|
Immagine – Vere radici di ginseng.
1 – frammento di sezione trasversale della radice principale (100×); 2 – frammento di sughero (400×); 3 – frammento di una sezione trasversale di una radice avventizia: a – vasi xilematici, b – grani di amido (400×); 4 – frammento di una sezione trasversale della radice principale con un canale secretorio: a – cellule di rivestimento del canale, b – cavità del canale (400×); 5 – frammento del parenchima dei raggi midollari: a – drusen di ossalato di calcio, b – granuli di amido (400×); 6 – cellule del parenchima del raggio midollare (100×).
Su una sezione trasversale di una radice avventizia, al centro, un raggio di vasi dello xilema primario è il residuo del fascio vascolare diarchico nella struttura primaria. Due settori dello xilema secondario sono separati dai raggi radiali del parenchima principale. Le cellule del parenchima sono rotonde o ovali, parzialmente o completamente piene di granuli di amido. Il sughero è costituito da 5-7 strati di cellule rettangolari, a parete sottile, debolmente lignificate.
Materie prime frantumate. Quando si esamina un campione pressato, dovrebbero essere visibili frammenti di sezioni trasversali e longitudinali delle radici principali e avventizie.
I frammenti della radice principale sono rappresentati da raggi e vasi xilematici, che riempiono le cellule del parenchima dei raggi midollari con granuli di amido, cavità del canale e cellule del rivestimento, cellule del parenchima con pigmenti e cellule del cambio.
I frammenti della radice avventizia sono rappresentati da cellule a tappo, parenchima con grani di amido, ricettacoli, corteccia primaria e secondaria, vasi, raggi midollari.
Polvere. Quando si esamina una microvetrina, sono visibili frammenti di epidermide, sughero, legno, parenchima e drusen di ossalato di calcio.
Determinazione dei principali gruppi di sostanze biologicamente attive
Cromatografia su strato sottile
Sulla linea di partenza di una piastra cromatografica analitica con uno strato di gel di silice con indicatore fluorescente di 10 × 15 cm su un substrato di alluminio, applicare 20 μl della soluzione in esame (vedere sezione “Determinazione quantitativa”, preparazione della soluzione A del soluzione test) e 50 μl di una soluzione campione standard (SS) di panaxoside Rg 1 (vedere la sezione “Determinazione quantitativa” preparazione della soluzione A CO panaxoside Rg 1). La piastra con i campioni applicati viene essiccata all'aria, posta in una camera, presaturata per almeno 2 ore con una miscela solvente di cloroformio - metanolo - acqua (26:14:3), e cromatografata utilizzando un metodo ascendente. Quando il fronte del solvente supera circa l'80–90% della lunghezza della lastra dalla linea di partenza, viene tolto dalla camera, essiccato fino a rimuovere tracce di solventi, trattato con acido fosfotungstico con una soluzione alcolica al 20% e riscaldato in Forno a 100–105 °C per 3 minuti, dopodiché visione alla luce del giorno.
Il cromatogramma della soluzione in esame deve mostrare almeno 6 zone di adsorbimento dal rosa chiaro al rosa scuro; la zona dominante è a livello zonale nel cromatogramma della soluzione CO di panaxoside Rg 1 ; è consentito il rilevamento di altre zone di assorbimento.
Quando si applica una goccia di acido solforico concentrato sulla polvere di radice di ginseng dopo 1-2 minuti, appare un colore rosso mattone, che vira al rosso-viola e poi al viola (panaxosidi).
Test
Umidità. Materie prime intere materie prime frantumate, polvere - non più del 13%.
Cenere comune. Materie prime intere materie prime frantumate, polvere - non più del 5%.
Cenere, insolubile in acido cloridrico. Materie prime intere materie prime frantumate, polvere - non più del 2%.
Macinazione delle materie prime.Materie prime intere: particelle che passano attraverso un setaccio con fori di 3 mm - non più del 5%. Materie prime frantumate: particelle che non passano attraverso un setaccio con fori di 7 mm - non più del 5%; particelle che passano attraverso un setaccio con fori di 0,5 mm - non più del 5%. Polvere: particelle che non passano attraverso un setaccio con fori di 2 mm - non più del 5%; particelle che passano attraverso un setaccio con fori di 0,18 mm - non più del 5%.
Affari esteri
Le radici si sono scurite dalla superficie . Materie prime intere materie prime frantumate – non più del 3%.
Impurità organica. Materie prime intere materie prime frantumate – non più dello 0,5%.
Impurità minerale . Materie prime intere, materie prime frantumate, polvere - non più dell'1%.
Metalli pesanti. In conformità con i requisiti della Monografia della Farmacopea Generale “Determinazione del contenuto di metalli pesanti e arsenico nei materiali vegetali e nei preparati erboristici medicinali”.
Radionuclidi. In conformità con i requisiti della Monografia della Farmacopea Generale “Determinazione del contenuto di radionuclidi nei materiali vegetali e nelle preparazioni erboristiche medicinali”.
Residui di pesticida. In conformità con i requisiti della Monografia della Farmacopea Generale “Determinazione del contenuto di pesticidi residui nei materiali vegetali e nei preparati erboristici medicinali”.
Purezza microbiologica. Conforme ai requisiti della Monografia della Farmacopea Generale “Purezza microbiologica”.
quantificazione. Materie prime intere materie prime frantumate, polvere: la quantità di panaxosidi in termini di panaxoside Rg 1 - non inferiore al 2%; sostanze estrattive estratte con il 70% di alcol - almeno il 20%.
("Farmacopea statale della Federazione Russa. XIII edizione. Volume I")
Questo articolo generale della farmacopea stabilisce i requisiti generali per lo stoccaggio delle sostanze farmaceutiche, degli eccipienti e dei medicinali e si applica a tutte le organizzazioni in cui avviene lo stoccaggio dei medicinali, tenendo conto del tipo di attività dell'organizzazione.
Lo stoccaggio delle materie prime vegetali e dei preparati erboristici viene effettuato in conformità alla Monografia della Farmacopea Generale “Conservazione delle materie prime vegetali e dei preparati erboristici”.
Magazzinaggio- il processo di conservazione dei medicinali fino al loro utilizzo entro la data di scadenza stabilita, che costituisce parte integrante della circolazione dei medicinali.
Requisiti generali per gli impianti di stoccaggio
medicinali e organizzazione della loro conservazione
La conservazione dei medicinali deve essere effettuata nei locali destinati a tali scopi. La progettazione, la composizione, le dimensioni delle aree di stoccaggio, il loro funzionamento e le attrezzature devono garantire condizioni di conservazione adeguate per i vari gruppi di medicinali.
Il complesso delle strutture di stoccaggio dovrebbe includere:
- una sala (area) di ricevimento destinata al disimballaggio e alla ricezione delle confezioni dei medicinali e alla loro ispezione preliminare;
- locale (zona) per il campionamento dei medicinali in conformità con i requisiti della Monografia della Farmacopea Generale “Campionamento”;
- stanza (zona) per la conservazione in quarantena dei medicinali;
- locali per medicinali che richiedono condizioni di conservazione speciali;
- stanza (area) per la conservazione dei farmaci rifiutati, restituiti, richiamati e/o scaduti. I farmaci specificati e i relativi luoghi di conservazione devono essere chiaramente contrassegnati.
L'area deposito è allocata in un locale deposito comune in assenza di un locale separato e isolato.
Le finiture dei locali destinati alla conservazione dei medicinali devono soddisfare i requisiti igienico-sanitari vigenti; le superfici interne delle pareti e dei soffitti devono essere lisce, consentendo la pulizia con acqua.
In ogni locale di conservazione è necessario mantenere le condizioni climatiche, rispettando la temperatura e l'umidità stabilite dalla monografia di farmacopea o dalla documentazione normativa dei medicinali.
Il ricambio d'aria necessario nei magazzini viene creato utilizzando condizionatori d'aria, ventilazione di mandata e di scarico o altre apparecchiature. L'illuminazione naturale e artificiale nei locali di stoccaggio deve garantire lo svolgimento accurato e sicuro di tutte le operazioni eseguite nel locale. Se necessario, dovrebbe essere garantita la protezione dei medicinali dalle radiazioni solari.
I locali destinati alla conservazione dei medicinali devono essere dotati del numero richiesto di strumenti di misurazione (termometri, igrometri, psicrometri, ecc.) debitamente verificati per il monitoraggio e la registrazione della temperatura e dell'umidità, effettuati almeno una volta al giorno.
Gli strumenti di misura sono posizionati ad una distanza di almeno 3 metri da porte, finestre e apparecchi di riscaldamento in un luogo accessibile per la lettura delle letture, ad un'altezza di 1,5-1,7 metri dal pavimento. Allo stesso tempo, si consiglia di posizionarli in luoghi in cui vi è la maggiore probabilità di fluttuazioni di temperatura e umidità o si osservano più spesso deviazioni dai parametri richiesti.
Le registrazioni di registrazione devono dimostrare le condizioni di temperatura e umidità stabilite per i locali e, se non conformi, le azioni correttive.
I locali di stoccaggio devono essere dotati di un numero sufficiente di armadi, casseforti, scaffalature, unità di stoccaggio e pallet. L'attrezzatura deve essere in buone condizioni e pulita.
Scaffalature, armadi e altre attrezzature devono essere installate in modo da garantire l'accesso ai medicinali, il libero passaggio del personale e, se necessario, l'accessibilità alle operazioni di carico e scarico, nonché l'accessibilità alle attrezzature, alle pareti e ai pavimenti del locale. per la pulizia.
Nei locali destinati alla conservazione dei medicinali devono essere mantenute adeguate condizioni igieniche. La frequenza e i metodi di pulizia dei locali devono essere conformi ai requisiti dei documenti normativi. I disinfettanti sanitari utilizzati devono essere sicuri; deve essere eliminato il rischio di contaminazione dei medicinali conservati con questi prodotti.
Dovrebbero essere sviluppate istruzioni specifiche per la pulizia dei medicinali versati o sparsi per garantire la completa eliminazione e prevenire la contaminazione di altri medicinali.
Quando svolgono lavori nei locali per la conservazione dei medicinali, i dipendenti devono indossare indumenti e scarpe speciali e osservare le norme di igiene personale.
Nei magazzini, i medicinali vengono collocati in conformità con le condizioni di conservazione specificate nella monografia della farmacopea o nella documentazione normativa dei medicinali, tenendo conto delle loro proprietà fisico-chimiche e pericolose, degli effetti farmacologici e tossicologici, del tipo di forma di dosaggio del medicinale e il metodo del suo utilizzo, lo stato aggregato del farmaco. Quando si utilizza la tecnologia informatica, è consentito posizionare i medicinali in ordine alfabetico, in base al codice.
Devono essere identificati scaffali, armadietti e scaffali destinati alla conservazione dei medicinali. È inoltre necessario identificare i medicinali conservati utilizzando una rack card o, quando si utilizza la tecnologia informatica, utilizzando codici e dispositivi elettronici.
Quando le operazioni di scarico e carico vengono effettuate manualmente, l'altezza di accatastamento dei medicinali non deve superare 1,5 metri. Quando si utilizzano dispositivi meccanizzati durante le operazioni di scarico e carico, i medicinali devono essere immagazzinati su più livelli. Allo stesso tempo, l'altezza totale di posizionamento dei medicinali sugli scaffali non deve superare le capacità dei meccanismi di carico e scarico.
I medicinali nei magazzini devono essere collocati in armadi, scaffali, scaffali, pallet, ecc. Non è consentito posizionare medicinali sul pavimento senza pallet.
I pallet possono essere posizionati sul pavimento in una fila o su scaffalature su più livelli, a seconda dell'altezza dello scaffale. Non è consentito posizionare i pallet con i medicinali su più file in altezza senza l'uso di scaffalature.
Quando si creano le condizioni di conservazione per un particolare medicinale, è necessario essere guidati dai requisiti specificati nella monografia della farmacopea o nella documentazione normativa per questo medicinale, stabiliti dal produttore (sviluppatore) del medicinale sulla base dei risultati di un test di stabilità studio in conformità con la monografia della Farmacopea Generale “Durata di conservazione dei medicinali”.
I medicinali sono conservati in confezioni (consumatore, gruppo) che soddisfano i requisiti della documentazione normativa per questo medicinale.
I medicinali vengono conservati ad un'umidità relativa non superiore al 60%+/-5% a seconda della zona climatica pertinente (I, II, III, IVA, IVB), a meno che nella documentazione normativa non siano specificate condizioni di conservazione speciali.
I medicinali devono essere conservati per prevenire la contaminazione, la miscelazione e la contaminazione incrociata. È necessario evitare odori estranei nelle aree di stoccaggio.
Nell'organizzazione deve essere implementato un sistema di registrazione dei medicinali con una data di scadenza limitata. Se in magazzino sono presenti più lotti con lo stesso nome di farmaco, è necessario prendere per primo per l'uso il farmaco la cui data di scadenza scade prima degli altri.
I medicinali scartati devono essere identificati e conservati in un locale (area) apposito in condizioni che non ne consentano l'uso non autorizzato.
Caratteristiche d'immagazzinamento di certi gruppi di medicinali
I medicinali con proprietà pericolose (gas infiammabili, esplosivi, radiofarmaceutici, caustici, corrosivi, compressi e liquefatti, ecc.) devono essere conservati in locali appositamente progettati dotati di ulteriori apparecchiature di sicurezza.
Durante lo stoccaggio, è necessario garantire la sicurezza e la qualità dichiarata dei medicinali, prevenire la possibilità che i medicinali manifestino le loro proprietà pericolose e creare condizioni di lavoro sicure per i dipendenti che lavorano con tali medicinali.
Quando si organizzano i locali e si organizza lo stoccaggio di medicinali pericolosi, è necessario essere guidati dai requisiti delle leggi federali e degli atti normativi della Federazione Russa.
La conservazione dei medicinali narcotici e psicotropi deve essere effettuata in conformità con le leggi e i regolamenti federali della Federazione Russa.
Quando si conservano medicinali che richiedono protezione dall'influenza di fattori ambientali (luce, temperatura, composizione atmosferica dell'aria, ecc.), è necessario garantire il regime di conservazione specificato nella monografia della farmacopea o nella documentazione normativa. Le deviazioni dalle condizioni regolamentate sono consentite una sola volta per un breve periodo (non più di 24 ore), a meno che non siano specificate separatamente condizioni speciali, ad esempio la conservazione permanente in un luogo freddo.
I medicinali che possono modificare le loro proprietà sotto l'influenza dell'energia luminosa (ossidarsi, ridursi, decomporsi, cambiare colore, ecc.) sono fotosensibili o fotosensibili; i farmaci resistenti alla luce sono fotostabili. L'influenza dell'energia luminosa può manifestarsi nell'esposizione alla luce solare diretta, nella luce diffusa nella regione visibile dello spettro luminoso e nella radiazione nella regione ultravioletta.
L'etichettatura dei farmaci fotosensibili di solito contiene l'istruzione: "Conservare in un luogo protetto dalla luce". I medicinali che necessitano di protezione dalla luce devono essere conservati in locali o aree appositamente attrezzate che garantiscano protezione dalla luce naturale e artificiale.
Le sostanze farmaceutiche che richiedono protezione dalla luce devono essere conservate in imballaggi realizzati con materiali che proteggono dalla luce o in una stanza o armadio buio. Se i contenitori in vetro per medicinali vengono utilizzati per il confezionamento di sostanze farmaceutiche particolarmente sensibili alla luce, il contenitore deve essere rivestito con carta nera resistente alla luce.
I medicinali fotosensibili devono essere confezionati in imballaggi secondari (di consumo) protetti dalla luce e/o devono essere conservati in un luogo protetto dalla luce.
I medicinali che, a contatto con acqua, umidità, possono rilasciare gas, ecc., sono sensibili all'umidità. L'etichettatura dei medicinali sensibili all'umidità di solito contiene l'istruzione: "Conservare in un luogo asciutto".
Quando si conservano tali medicinali, è necessario garantire che l'umidità relativa non superi il 50% a temperatura ambiente (in normali condizioni di conservazione) o la pressione di vapore equivalente ad un'altra temperatura. L'adempimento del requisito prevede anche la conservazione del medicinale sensibile all'umidità in imballaggi di consumo ermetici (a prova di umidità) che garantiscono la protezione specificata e il rispetto delle condizioni di conservazione durante la circolazione del medicinale.
Per mantenere un basso contenuto di umidità durante la conservazione dei medicinali, nei casi prescritti vengono utilizzati agenti essiccanti, a condizione che sia evitato il loro contatto diretto con il medicinale.
I medicinali con proprietà igroscopiche devono essere conservati ad un'umidità relativa non superiore al 50% nell'imballaggio, che è un contenitore di vetro per medicinali, chiuso ermeticamente, o in un imballaggio con protezione aggiuntiva, ad esempio in un sacchetto di pellicola di plastica, in conformità con i requisiti della monografia della farmacopea o della documentazione normativa.
Alcuni gruppi di farmaci cambiano le loro proprietà sotto l'influenza dei gas atmosferici, come l'ossigeno o l'anidride carbonica. Per garantire la protezione dei medicinali dagli effetti dei gas, si raccomanda di conservare i medicinali in imballaggi sigillati realizzati con materiali impermeabili ai gas. Se possibile, la confezione deve essere riempita fino all'orlo e sigillata ermeticamente.
Medicinali che sono in realtà medicinali volatili o medicinali contenenti un solvente volatile; soluzioni e miscele di sostanze volatili; I medicinali che si decompongono con formazione di prodotti volatili necessitano di condizioni di conservazione che li proteggano dalla volatilizzazione e dall'essiccamento. Si raccomanda di conservare i medicinali in un luogo fresco, in imballaggi ermeticamente chiusi realizzati con materiali impermeabili alle sostanze volatili, o in imballaggi primari e secondari (di consumo) secondo i requisiti specificati nella monografia della farmacopea o nella documentazione normativa.
I medicinali, che sono sostanze farmaceutiche contenenti acqua di cristallizzazione (cristalli idrati), presentano le proprietà delle sostanze igroscopiche. Si raccomanda di conservare gli idrati cristallini in imballaggi ermeticamente chiusi in conformità con i requisiti specificati nella monografia della farmacopea o nella documentazione normativa. Di norma, gli idrati cristallini vengono conservati a temperature comprese tra 8 e 15 ° C e un'umidità relativa dell'aria non superiore al 60%.
I medicinali che cambiano le loro proprietà sotto l'influenza della temperatura ambiente sono termosensibili. I medicinali possono modificare le loro proprietà se esposti a temperatura ambiente o superiore (medicinali termolabili) o se esposti a basse temperature, compreso il congelamento.
Quando si conservano farmaci termosensibili, è necessario garantire il regime di temperatura regolato dai requisiti della monografia farmacopea o dalla documentazione normativa indicata sulla confezione primaria e/o secondaria (di consumo) del farmaco.
I medicinali termolabili devono essere conservati in locali appositamente attrezzati (frigoriferi) o in locali di stoccaggio dotati di un numero sufficiente di armadi refrigerati e frigoriferi. Per conservare i farmaci termolabili devono essere utilizzati frigoriferi farmaceutici o frigoriferi per sangue ed emoderivati.
La corretta qualità dei farmaci immunobiologici, la sicurezza e l’efficacia del loro utilizzo sono garantite dal sistema della “catena del freddo”, che deve essere attuato a tutti e quattro i livelli.
Risoluzione del medico sanitario capo dello Stato della Federazione Russa n. 15 del 10 aprile 2002 “Sull'attuazione delle norme sanitarie ed epidemiologiche SP 3.3.2.1120-02″
I frigoriferi (camere, armadi) devono essere impostati ad una temperatura che corrisponda alle condizioni di temperatura per la conservazione dei medicinali in essi contenuti. I medicinali immunobiologici devono essere conservati a una temperatura non superiore a 8°C. Ciascuna confezione di medicinale immunobiologico conservata nel frigorifero deve essere dotata di accesso all'aria fresca. I medicinali immunobiologici non devono essere conservati in frigorifero insieme ad altri medicinali.
Per monitorare le condizioni di temperatura di conservazione dei medicinali termolabili, tutti i frigoriferi (camere, armadi) devono essere dotati di termometri. Il monitoraggio continuo del regime di temperatura viene effettuato utilizzando termografi e registratori di temperatura, le cui letture vengono registrate almeno due volte al giorno.
Il regime di temperatura sui ripiani del frigorifero è diverso: la temperatura è più bassa vicino al vano congelatore, più alta vicino al pannello della porta apribile.
Fornire un luogo fresco significa conservare i medicinali in frigorifero ad una temperatura compresa tra 2 e 8°C, evitando il congelamento. Per conservazione refrigerata si intende la conservazione dei farmaci a una temperatura compresa tra 8 e 15 °C. In questo caso è consentita la conservazione dei medicinali in frigorifero, ad eccezione dei medicinali che, se conservati a una temperatura del frigorifero inferiore a 8°C, possono modificare le loro caratteristiche fisico-chimiche, ad esempio tinture, estratti liquidi, ecc.
La conservazione a temperatura ambiente implica un intervallo di temperatura compreso tra 15 e 25 °C o, a seconda delle condizioni climatiche, fino a 30 °C. La conservazione nel congelatore garantisce la temperatura dei medicinali da -5 a -18 °C. La conservazione in surgelazione richiede temperature inferiori a -18 °C.
Si consiglia di posizionare i medicinali nelle aree e sui ripiani del frigorifero che corrispondono alle loro condizioni di temperatura di conservazione. Non è consentito conservare farmaci immunobiologici sul pannello della porta del frigorifero.
Nei locali di stoccaggio è necessario fornire condizioni di conservazione per i medicinali che richiedono protezione dall'esposizione a basse temperature, per i quali la monografia farmacopea o la documentazione normativa fissa un limite di temperatura inferiore per la conservazione.
Non è consentito congelare i medicinali che presentano gli opportuni requisiti nella monografia della farmacopea o nella documentazione normativa e sono indicati sulla confezione primaria o secondaria, compresi i preparati insulinici, i preparati immunobiologici adsorbiti, ecc.
Non è consentito congelare i medicinali inseriti in confezioni che possono essere distrutte dal congelamento, ad esempio medicinali in fiale, bottiglie di vetro, ecc.
Nella tabella sono riportate le definizioni utilizzate nella farmacopea che caratterizzano le condizioni di temperatura per la conservazione dei medicinali.
È necessario garantire il rispetto delle condizioni di conservazione dei medicinali e il mantenimento della loro integrità durante il trasporto.
Per i medicinali particolarmente sensibili alle variazioni di temperatura (vaccini, sieri e altri medicinali immunobiologici, medicinali insulinici, ecc.), durante il trasporto deve essere rispettato il regime di temperatura regolamentato dalla monografia della farmacopea o dalla documentazione normativa.
Definizioni che caratterizzano le modalità di conservazione dei farmaci