Која киселина е најопасна? Најсилната киселина во светот. Најсилната суперфлуидност. Најневеројатните супстанции Најсилната киселина без кислород
Човекот отсекогаш барал да најде материјали кои не оставаат никакви шанси за неговите конкуренти. Уште од античко време, научниците ги бараат најтешките материјали на светот, најлесните и најтешките. Жедта за откривање доведе до откритие идеален гаси совршено црно тело. Ви претставуваме најмногу неверојатни супстанцииво светот.
1. Најцрната материја
Најцрната супстанција во светот се нарекува Vantablack и се состои од збирка јаглеродни наноцевки (види јаглерод и неговите алотропи). Едноставно кажано, материјалот се состои од безброј „влакна“, откако ќе се зафатат во нив, светлината отскокнува од една цевка во друга. На овој начин, околу 99,965% од светлосниот флукс се апсорбира и само мал дел се рефлектира назад.
Откривањето на Vantablack отвора широки изгледи за употреба на овој материјал во астрономијата, електрониката и оптиката.
2. Најзапалива материја
Хлорот трифлуорид е најзапаливата супстанција досега познати на човештвото. Тој е силен оксидирачки агенс и реагира со речиси сите хемиски елементи. Хлорот трифлуорид може да изгори бетон и лесно да го запали стаклото! Употребата на хлор трифлуорид е практично невозможна поради неговата феноменална запаливост и неможноста да се обезбеди безбедна употреба.
3. Најотровната супстанција
Најмоќниот отров е ботулински токсин. Го знаеме под името ботокс, што го нарекуваат во козметологијата, каде што ја најде својата главна примена. Ботулински токсин е хемикалија произведена од бактеријата Clostridium botulinum. Покрај тоа што ботулинскиот токсин е најтоксичната супстанција, тој има и најголема молекуларна тежина меѓу протеините. За феноменалната токсичност на супстанцијата сведочи фактот дека само 0,00002 mg min/l ботулински токсин е доволно за да ја направи погодената област смртоносна за луѓето половина ден.
4. Најжешката супстанца
Ова е таканаречената кварк-глуонска плазма. Супстанцијата е создадена со судир на златни атоми со брзина речиси на светлината. Кварк-глуонската плазма има температура од 4 трилиони степени Целзиусови. За споредба, оваа бројка е 250.000 пати поголема од температурата на Сонцето! За жал, животниот век на материјата е ограничен на трилиони дел од еден трилионити дел од секундата.
5. Најкаустична киселина
Во оваа номинација, шампион е флуорид-антимон киселина H. Флуорид-антимон киселина е 2×10 16 (двесте квинтилиони) пати повеќе каустична од сулфурна киселина. Тоа е многу активна супстанција и може да експлодира ако се додаде мала количина на вода. Пареите на оваа киселина се смртоносни отровни.
6. Најексплозивна материја
Најексплозивна супстанција е хептанитрокубан. Тоа е многу скапо и се користи само за научно истражување. Но, малку помалку експлозивниот октоген успешно се користи во воените работи и во геологијата при дупчење бунари.
7. Најрадиоактивна супстанција
Полониум-210 е изотоп на полониум кој не постои во природата, туку е произведен од луѓе. Се користи за создавање минијатурни, но во исто време, многу моќни извори на енергија. Има многу краток полуживот и затоа е способен да предизвика тешки зрачења.
8. Најтешката материја
Ова е, се разбира, фулерит. Неговата цврстина е речиси 2 пати поголема од онаа на природните дијаманти. Можете да прочитате повеќе за фулеритот во нашата статија Најтврдите материјали во светот.
9. Најсилниот магнет
Најсилниот магнет на светот е направен од железо и азот. Во моментов, деталите за оваа супстанца не се достапни за пошироката јавност, но веќе е познато дека новиот супер-магнет е за 18% помоќен од најсилните магнети кои моментално се користат - неодимиумот. Неодимиумските магнети се направени од неодимиум, железо и бор.
10. Најтечна супстанција
Суперфлуидниот хелиум II речиси и да нема вискозитет на температури блиску до апсолутна нула. Овој имот се должи на неговата единствен имотистечете и истурете од контејнер направен од кој било цврст материјал. Хелиум II има изгледи за употреба како идеален топлински спроводник во кој топлината не се распаѓа.
Повеќе од една генерација хемичари се расправаа за тоа која киселина е најсилна. ВО различни времињаОваа титула ја добија азотна, сулфурна и хлороводородна киселина. Некои веруваа дека не може да има соединение посилно од флуороводородна киселина. Неодамна се добиени нови соединенија со силни киселински својства. Можеби токму меѓу нив е пронајдена и најсилната киселина на светот? Оваа статија ги испитува карактеристиките на најмоќните постојани киселини на нашето време и ги дава нивните кратки хемиски карактеристики.
Концепт на киселина
Хемијата е точна квантитативна наука. И насловот „Најсилната киселина“ треба разумно да се припише на одредена супстанција. Кој би можел да биде главниот индикатор што ја карактеризира силата на секоја врска?
Прво, да се потсетиме на класичната дефиниција за киселина. Овој збор главно се користи за сложени хемиски соединенија кои се состојат од водород и киселински остаток. Бројот на атоми на водород во соединението зависи од валентноста на киселинскиот остаток. На пример, во молекула на хлороводородна киселина има само еден водороден атом; а сулфурната киселина веќе има два H + атоми.

Својства на киселините
Сите киселини имаат некои хемиски својства, што може да се нарече заеднички за дадена класа на хемиски соединенија.

Во сите горенаведени својства, се манифестира друга „вештина“ на која било позната киселина - ова е способност да се откаже од атом на водород, заменувајќи го со атом на друга хемиска супстанција или молекула на кое било соединение. Токму оваа способност ја карактеризира „јачината“ на киселината и степенот на нејзината интеракција со другите хемиски елементи.
Вода и киселина
Присуството на вода значително ја намалува способноста на киселината да донира атоми на водород. Ова се објаснува со фактот дека водородот е способен да формира свој хемиски врскипомеѓу киселината и молекулите на водата, со што неговата способност да се одвои од базата е помала од онаа на неразредените киселини.
Супер киселина
Зборот „суперкиселина“ беше воведен во хемискиот речник во 1927 година, со помош на познатиот хемичар Џејмс Конант.
Стандардот за јачината на ова хемиско соединение е концентрирана сулфурна киселина. Хемикалијата или која било мешавина што е покисела од концентрирана сулфурна киселина се нарекува супер киселина. Вредноста на суперкиселината се определува со нејзината способност да пренесе позитивно електрично полнење на која било база. Како основен параметар за одредување на киселоста се зема соодветниот индикатор H 2 SO 4. Меѓу силните киселини, постојат супстанции со прилично необични имиња и својства.
Познати силни киселини
Најпознати киселини од текот на неорганската хемија се хидројодните (HI), хидробромните (HBr), хлороводородните (HCl), сулфурните (H 2 SO 4) и азотни (HNO 3) киселини. Сите тие имаат висок индекс на киселост и се способни да реагираат со повеќето метали и бази. Во оваа серија, најсилната киселина е мешавина од азотна и хлороводородна киселина, наречена „аква регија“. Формулата на најсилната киселина во оваа серија е HNO 3+3 HCl. Ова соединение е способно да раствори дури и благородни метали како злато и платина.

Доволно чудно, флуороводородната киселина, која е соединение на водород со најсилен халоген - флуор, не беше вклучена во претендентите за титулата „Најсилната киселина во хемијата“. Единствената карактеристика на оваа супстанца е нејзината способност да го раствори стаклото. Затоа, таквата киселина се чува во полиетиленски контејнери.
Силни органски киселини
Претенденти за титулата „Најсилната киселина во органска хемија» - мравја и оцетна киселина. Мравја киселина е најсилна во хомологната серија на заситени киселини. Името го добило поради фактот што дел од него е содржан во секретите на мравките.

Оцетната киселина е малку послаба од мравја киселина, но нејзиниот спектар на дистрибуција е многу поширок. Често се наоѓа во растителните сокови и се формира при оксидација на разни органски материи.
Неодамнешните случувања во областа на хемијата овозможија да се синтетизира нова супстанција која може да се натпреварува со традиционалните органски супстанции. Трифлуорометансулфонска киселина има индекс на киселост повисок од оној на сулфурната киселина. Покрај тоа, CF3SO3H е стабилна хигроскопна течност со утврдени физичко-хемиски својства во нормални услови. Денес на ова соединение може да му се додели титулата „Најсилна органска киселина“.
Многумина можеби мислат дека степенот на киселост не може да биде значително повисок од оној на сулфурната киселина. Но, неодамна, научниците синтетизираа голем број супстанции чии параметри на киселост се неколку илјади пати повисоки од оние на сулфурната киселина. Соединенијата добиени со реакција на протички киселини со Луис киселини имаат ненормално високи вредности на киселост. ВО научниот светтие се нарекуваат: сложени протински киселини.
Магична киселина
Да. Сè е точно. Магична киселина. Така се вика. Магичната киселина е мешавина од водород флуорид или флуоросулфоронска киселина со антимон пентафлуорид. Хемиска формулаОваа врска е прикажана на сликата:

Ова чудно имеМагичната киселина е добиена на божиќната забава на хемичарите што се одржала на почетокот на 1960-тите. Еден од членовите на истражувачката група на J. Olah покажа смешен трик со растворање на восочна свеќа во оваа неверојатна течност. Ова е една од најсилните киселини на новата генерација, но веќе е синтетизирана супстанца која ќе ја надмине по сила и киселост.
Најсилната киселина во светот
Карборанската киселина е карборанска киселина, која е убедливо најсилното соединение во светот. Формулата на најсилната киселина изгледа вака: H(CHB11Cl11).
Ова чудовиште е создадено во 2005 година на Универзитетот во Калифорнија во тесна соработка со Новосибирскиот институт за катализа SB RAS.
Самата идеја за синтеза се појавила во главите на научниците заедно со сонот за нови, досега невидени молекули и атоми. Новата киселина е милион пати посилна од сулфурната киселина, но сепак не е воопшто агресивна, а најсилната киселина лесно може да се чува во стаклено шише. Точно, со текот на времето стаклото се раствора, а со зголемување на температурата брзината на оваа реакција значително се зголемува.

Оваа неверојатна мекост се должи на високата стабилност на новото соединение. Како и сите кисели хемикалии, карборанската киселина реагира лесно, давајќи го својот единствен протон. Во овој случај, киселинската база е толку стабилна што хемиската реакција не продолжува понатаму.
Хемиски својства на карборанска киселина
Новата киселина е одличен донатор на протони H+. Тоа е она што ја одредува јачината на оваа супстанца. Растворот на карборанска киселина содржи повеќе водородни јони од која било друга киселина во светот. ВО хемиска реакција SbF 5 - антимон пентафлуорид, го врзува флуорниот илон. Во овој случај, се ослободуваат се повеќе атоми на водород. Затоа, карборанската киселина е најсилна во светот - суспензијата на протоните во нејзиниот раствор е 2 × 10 19 пати поголема од онаа на сулфурната киселина.
Сепак киселинска базаОваа врска е неверојатно стабилна. Молекулата на оваа супстанца се состои од единаесет атоми на бром и исто толку атоми на хлор. Во вселената, овие честички формираат сложена, геометриски правилна фигура, која се нарекува икозаедрон. Овој распоред на атоми е најстабилен и ова ја објаснува стабилноста на карборанската киселина.

Значење на карборанска киселина
Најсилната киселина на светот на своите творци им донесе заслужени награди и признанија во научниот свет. Иако сите својства на новата супстанца не се целосно разбрани, веќе станува јасно дека значењето на ова откритие оди подалеку од лабораториите и истражувачките институти. Карборанската киселина може да се користи како моќен катализатор во различни индустриски реакции. Покрај тоа, новата киселина може да комуницира со најтврдокорните хемикалии - инертни гасови. Во моментов, се работи за да се овозможи ксенон да реагира.
Несомнено, неверојатните својства на новите киселини ќе најдат примена во различни области на науката и технологијата.
Има многу киселини кои и во минимални количини претставуваат опасност за луѓето. Многу луѓе веруваат дека сулфурната киселина е најопасна, но тоа апсолутно не е точно. Карборанската киселина се смета за најсилна, која може да се чува само во специјални контејнери. Таа е многу пати посилна од сулфурна киселина и ви овозможува брзо растворање на метали, стакло и други супстанции кои се отпорни на други хемикалии. Но, ако карборанската киселина е многу ретка, и тоа само во лабораториски услови, тогаш може да се сретнете со друга моќна супстанција во Секојдневниот живот. Според многу експерти, најотровна киселина е цијановодородна киселина, а може да се најде не само во лабораторија, туку и во храната.
Како може да се отруете?
Цијановодородна киселина е многу токсична. Кога ќе влезе во човечкото тело, знаците на труење се појавуваат прилично брзо. Оваа супстанца може да влезе во телото со производи кои ја содржат, како и со оние производи кои биле третирани со цијанид.
Најголем дел од оваа токсична супстанца се наоѓа во бадемите. Вкупниот износ може да достигне и до 3%. Човек треба да изеде само мал грст бадеми за да се отруе.Покрај тоа, оваа опасна супстанца се наоѓа во семето на бобинки и некои плодови. Повеќето киселини содржат:
- праска – до 2,8%;
- кајсија - до 1,6%;
- слива – до 0,95%;
- цреша - околу 0,8%;
- јаболко - приближно 0,6%.
Во зрната бадеми и овошните јадра, цијановодородната киселина не е присутна во чиста форма, туку во форма на амигдалин гликозид. Токму оваа супстанца им дава специфичен вкус и арома на јаткастите плодови. Откако во човечкото тело, амигдалин се распаѓа на три компоненти, од кои едната е цијановодородна киселина. Со оваа супстанца особено се богати горчливите бадеми, па возрасните можат да го јадат овој производ во мали количини, но децата воопшто не треба да го јадат.
Вината направени од бобинки и овошје со семиња претставуваат голема опасност. Виното натопено со цреши со јами, сливи и кајсии може да доведе до труење.
Компотите и џемот направени од бобинки заедно со семиња не претставуваат опасност по здравјето. Кога се загрева до 80 степени, цијановодородната киселина се распаѓа на безбедни компоненти.
Колку киселина ќе предизвика труење
 Количината на храна што треба да ја јадете за да се отруете може значително да варира. Тоа зависи од возраста на лицето, телесната тежина, општа состојбаздравје и присуство на хронични патологии. Но, постојат просеци кои треба да се следат.
Количината на храна што треба да ја јадете за да се отруете може значително да варира. Тоа зависи од возраста на лицето, телесната тежина, општа состојбаздравје и присуство на хронични патологии. Но, постојат просеци кои треба да се следат.
Тешка интоксикација може да настане ако изедете 30 јаткасти плодови од бадеми, повеќе од 50 семки од кајсии, повеќе од 70 семки од сливи или цреши. Може да се отруете ако изедете повеќе од 100 семки од јаболка.
Под влијание на самата отровна киселина може да дојде до фатално труење. Критичната доза на амигдалин е 1 mg на килограм човечка телесна тежина. Доволно е да изедете 40 зрна горчливи бадеми или 100 семки од кајсии за да добиете фатално труење.
Гурманите кои навистина сакаат бадеми во нивната непроменета форма, треба да го купат деликатесот само во специјализирани продавници. Пакувањето мора да ги содржи сите информации за производителот и составот на производот. Дури и слатките бадеми можат да доведат до труење ако се консумираат прекумерно.
Сега горчливите бадеми се користат само во производството на одредени лекови и козметички производи. Таквите јаткасти плодови практично не се јадат.
Симптоми на труење
Цијановодородна киселина, откако ќе влезе во крвотокот, доаѓа во контакт со црвените крвни зрнца, притоа блокирајќи го одвојувањето на кислородот и неговото понатамошно пренесување во ткивата. Поради ова, количината на кислород во крвта многу се зголемува, но воопшто не стигнува до органите, што доведува до хипоксија. Мозокот е првенствено погоден. Сите функции на овој орган се сериозно инхибирани, а функционирањето на сите системи и други важни органи во телото е нарушено.
Кога се труе со оваа киселина, се појавуваат следниве карактеристични знаци:
- кожата и сите мукозни мембрани стануваат светло розеви;
- силна главоболка, како и вртоглавица, усните се вкочанети и зениците се шират;
- постои нерамнотежа, лицето не може нормално да застане на нозе, координацијата на движењата е нарушена;
- пулсот се забрзува, како и дишењето;
- жртвата чувствува болка во градите и останување без здив;
- се јавува гадење и повраќање;
- има метален вкус и горчина во устата;
- може да има неконтролирани движења на дебелото црево.
Жртвата испушта карактеристична арома на горчливи бадеми, со која може да се утврди дека лицето е отруено. Ако состојбата е многу тешка, тогаш брзото дишење брзо се заменува со бавен пулс. Настанува парализа на респираторниот центар и почнуваат конвулзии.
Доколку во случај на труење со цијановодородна киселина не и се пружи помош на жртвата во рок од 3 минути, тогаш ќе настапи смрт.
Итна грижа
Во случај на труење со силна киселина - цијановодородна киселина, мора веднаш да повикате брза помош. Пред да пристигнат лекарите, на жртвата и се дава прва помош, која се состои од следните мерки:

Противотров за цијановодородна киселина е слаб раствор на метиленско сино. Овој лек обично го даваат лекарите за итни случаи.
Откако ќе се пружи прва помош, жртвата треба да се отстрани од сета тесна облека и да се стави во кревет, со крената глава со перници. Ако некое лице има збунета свест, тогаш се препорачува да шмрка памук намачкан со амонијак. Амонијакот, еднаш во крвта, ја неутрализира киселината.
Ако некое лице нема дишење или пулс, неопходно е да се изврши компресија на градниот кош и да се изврши вештачко дишење што е можно поскоро. Таквите мерки мора да се спроведат во првите неколку минути по прекинот на виталните процеси.
Во болнички услови, на пациентот му се даваат антиконвулзиви, противотрови и лекови за да се врати нормалната циркулација на крвта. За време на процесот на опоравување, на пациентот му се препишува комплекс на витамини.
По труење со цијановодородна киселина, некое лице треба да избегнува физички и ментален стрес. Во тоа време, на пациентот му се препорачува да пие многу течности, вклучително и млеко. Исто така, треба да шетате многу на свеж воздух, да се придржувате до урамнотежена исхрана и да се откажете од сите лоши навики.
Брзиот развој на науката им овозможува на научниците да направат нови сензационални откритија во областа на физиката, хемијата и други области. Научниот свет е систематски шокиран од вестите за создавање на нови супстанции со уникатни, досега невидени својства. Се разбира, обичните луѓе не секогаш следат такви откритија. Не секој знае дека најсилната киселина во светот е создадена во Америка во 2005 година. За многумина, најмоќната од овие хемикалии останува сулфурната киселина, која била добро проучена на училиште.
Карборанската киселина е најсилната во светот
Во 2005 година, научниците кои работат на Универзитетот во Калифорнија во САД успеаја да создадат нова киселина со невидена сила. Измисленото соединение е милион пати посилно од концентрираната сулфурна киселина. Научниците во тој момент тргнале да пронајдат нова молекула која ќе стане вистинско откритие во научниот свет и успеале да постигнат позитивен резултат.
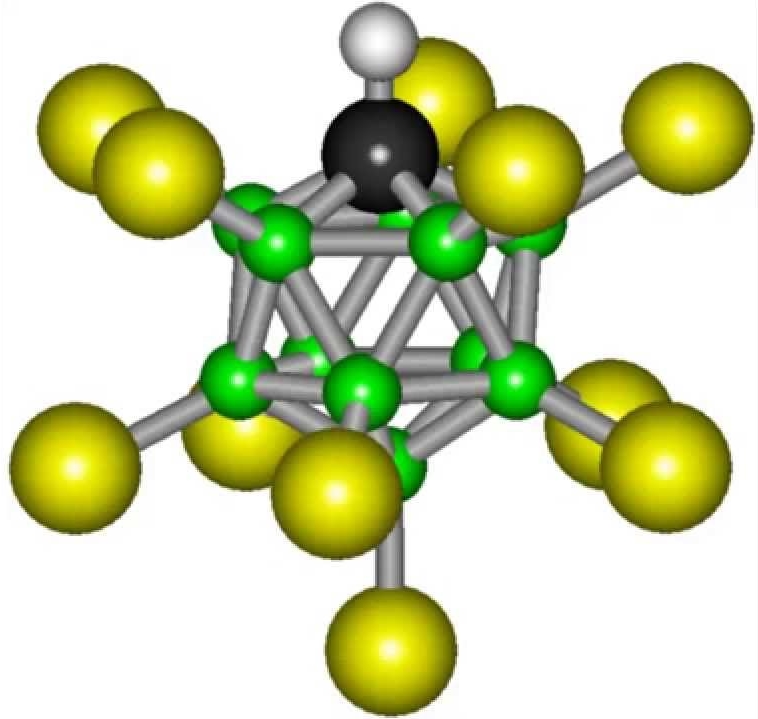
Формулата на карборанската киселина не е многу сложена: H(CHB11Cl11). Но, сè уште нема да биде можно да се синтетизира таква супстанција во обична лабораторија. Карборанската киселина е повеќе од трилион пати покисела од обичната вода.
Уникатно својство на најсилната киселина
Ако некаде се спомене најмоќната киселина на светот, човечката имагинација замислува супстанца која раствора се што ќе и се најде на патот. Всушност, деструктивните својства воопшто не се главниот знак за јачината на хемиската супстанција. На пример, многумина веруваа дека најмоќната киселина е флуороводородна киселина, бидејќи го раствора стаклото. Но, ова е далеку од вистината. Флуороводородната киселина ги кородира стаклените садови, но може да се чува во полиетиленски садови.

Признаена како најмоќната карборанска киселина во светот, може лесно да се чува во стаклени садови. Факт е дека оваа хемикалија се карактеризира со значителна хемиска стабилност. Како и другите слични соединенија, карборанската киселина, кога реагира со реагенси, ослободува наелектризирани атоми на водород. По таквата реакција, составот има мал негативен полнеж и нема деструктивен ефект врз околните материјали.
Понатамошна работа со карборанска киселина
Се разбира, креаторите на карборанската киселина станаа добро познати во светската научна заедница. Покрај тоа, на брилијантните научници им беа доделени многу заслужени награди за нивниот значаен придонес во развојот на науката. Употребата на новата супстанција повеќе не е ограничена само на научни лаборатории: карборанската киселина се користи во индустријата како моќен катализатор.

Единствена карактеристика на најмоќната киселина во светот е нејзината способност да комуницира со инертни гасови. Денес, се спроведуваат многу студии за да се утврди можноста за реакција помеѓу ксенон и карборанска киселина. Научниците исто така неуморно работат на проучување на другите својства на најмоќната киселина.
Најпознатата силна киселина
Научниците добро ја знаат карборанската киселина. Обичните луѓе најчесто веруваат дека сулфурната киселина е најсилна. Ова се должи на честата употреба на супстанцијата во индустријата. Често се користи од производителите на минерални ѓубрива за производство на суперфосфати и амониум сулфати.
Сулфурната киселина е широко користена во металуршката индустрија. Се користи и за чистење на метали од оксидација. Производството на течно гориво не може да се направи без употреба на сулфурна киселина. Може да се користи за чистење на следниве производи:
- масла за подмачкување;
- керозин;
- парафин;
- минерални масти.

Но, не е само индустриската употреба што ги тера многу луѓе да веруваат дека сулфурната киселина е најсилната во светот. Ова мислење е формирано поради фактот што супстанцијата, кога ќе се навлезе во месото, ја оцрнува. Ова својство на сулфурна киселина често се користи во снимањето на криминални филмови.
Најсилната органска киселина
Ако зборуваме за најсилната киселина во органската хемија, тогаш лидерството овде припаѓа на мравја киселина. Супстанцијата била наречена така бидејќи била пронајдена во секретите на мравките. Мравја киселина има широк спектар на намени. Често се користи во медицината бидејќи има аналгетски и иритирачки својства. Мравја киселина е присутна во многу масти кои се користат за лекување на модринки, проширени вени и отоци. Лековите кои ја содржат оваа супстанца можат да помогнат да се ослободите од акните.

Мравја киселина е исто така широко користена во хемиската индустрија. Се користи и во земјоделството и пчеларството. Супстанцијата се користи и во храната како додаток Е236.
И покрај нејзината распространетост, мравја киселина може да претставува сериозна закана. Контактот на концентрираната супстанција со кожата предизвикува изгореници или силна болка. Дури и вдишувањето на пареата на мравја киселина може да предизвика оштетување на респираторниот тракт. Но, позитивното својство на супстанцијата е тоа што брзо се елиминира од телото без да се акумулира во него.
Многу луѓе се обидуваат сами да го дознаат одговорот на прашањето која е најсилната киселина. Не е многу тешко да се разбере ова, но треба да прочитате посебна литература. За оние кои само сакаат да го знаат одговорот на ова прашање, оваа статија е напишана.
Многу луѓе веруваат дека најсилната киселина е флуороводородна киселина, бидејќи може да го раствори стаклото. Оваа пресуда е практично неоснована. Според разбирањето на другите, најсилната киселина е сулфурната киселина. Последната изјава има сосема логично објаснување. Факт е дека сулфурната киселина е многу силна меѓу оние што се користат во индустријата. При контакт со живо ткиво, може да го јагленоса месото и да остави тешки изгореници на кои им треба долго време да зараснат и се проблематични. Неговото производство не бара никакви посебни материјални трошоци. И слободно може да се каже дека не е најсилна. Науката ги знае таканаречените суперкиселини. За нив ќе зборуваме понатаму. Но, на ниво на домаќинство, најзастапена од силните киселини е сепак сулфурната киселина. Затоа е опасна.
Па, како може киселината да биде силна и нежна? Одговорот лежи во тоа како хемичарите ја одредуваат јачината на киселината. Јачината на киселината е способност на киселината да додаде водороден јон на основните молекули. Друг пример е изборот на киселина за чистење на наслаги од варовник во бакарен котел, истакна тој. Мудриот сопственик на куќа избира хлороводородна киселина наместо азотна киселина бидејќи хлорниот дел од хлороводородната киселина не го напаѓа бакарот, додека нитратниот дел од азотна киселина го раствора котелот во неред од отровни кафеави испарувања.
Многу современи хемичари веруваат дека најсилната киселина во светот е карборан. Ова го потврдуваат резултатите од темелното истражување. Оваа киселина е повеќе од милион пати помоќна од концентрираната сулфурна киселина. Неговото феноменално својство е способноста да се чува во епрувета, што многу други супстанции од споменатата серија не го поседуваат. Хемискиот состав, кој се сметаше за најкаустичен, не можеше да се зачува во стаклени садови. Факт е дека карборанската киселина има значителна хемиска стабилност. Како и другите супстанции слични на него, кога реагира со други реагенси, донира атоми на водород со полнења за нив. Сепак, составот што останува по реакцијата, иако има негативен полнеж, е многу стабилен и не може да дејствува понатаму. Карборанската киселина има едноставна формула: H(CHB 11 Cl 11). Но, добивањето на готовата супстанција во обична лабораторија не е лесно. Вреди да се напомене дека е повеќе од трилион пати покисела од обичната вода. Според пронаоѓачот, оваа супстанцасе појави како резултат на развојот на нови хемикалии.
Новите „јаки, но нежни“ киселини се нарекуваат карбонатни киселини. Тајната на нивната моќ е двојна. Што е најважно, карбонатниот дел од киселината е екстремно слаба база, послаба од флуоросулфатниот дел на флуорсулфурна киселина, која беше претходниот рекордер за најсилна киселина. Второ, карбораните имаат исклучителна хемиска стабилност.
Според Рид, тие имаат икозаедрален распоред од единаесет атоми на бор плус еден јаглероден атом, што е веројатно хемиски најстабилниот кластер на атоми во целата хемија. Ова значи дека карборанската половина на киселината не може да учествува во хемијата на корозија и распаѓање прикажана од флуоридот и нитратот во флуороводородна киселина и азотна киселина. Како резултат на тоа, карборанските киселини можат да додадат водородни јони на слабо базичните молекули без да ги уништат често деликатните, позитивно наелектризирани молекули кои се формираат.
Списокот на најкаустични супстанции содржи флуороводоводни, флуороводоводни и други силни киселини. Индустриските реагенси не се вклучени. Сепак, сепак треба да бидете претпазливи за такви вообичаени киселини како сулфурна, хлороводородна, азотна и други. Не би сакал никого да исплашам, но супстанците од оваа листа обично се користат за напади врз здравјето и намерно нарушување на изгледот.
Тоа е нивниот силен, но нежен квалитет, додаде Рид. Ниту една од овие позитивно наелектризирани молекули претходно не била „флаширана“ на собна температура бидејќи претходно користените киселини ги разградувале. Силните, но нежни карбононски киселини ја надминуваат оваа тешкотија, дозволувајќи им на хемичарите поблиску да ги разгледаат важните молекули чие постоење е типично минливо, рече Рид. Закиселените молекули се важни краткотрајни посредници во огромна разновидност на хемиски трансформации катализирани од киселина, вклучително и варење на храната, подобрување на бензинот, формирање полимери и фармацевтска синтеза.
 е дека меѓу масните киселини кои се наоѓаат во храната, мравја киселина е најсилна. Често се користи за зачувување на зеленчук и за медицински цели, но само во форма на раствор.
е дека меѓу масните киселини кои се наоѓаат во храната, мравја киселина е најсилна. Често се користи за зачувување на зеленчук и за медицински цели, но само во форма на раствор.
Мора повторно да се каже дека најсилната киселина е карборан. Но, денес треба да бидеме повнимателни со супстанциите што се користат во индустријата и секојдневниот живот. Хемијата е прилично корисна и сложена наука, но за широко распространето производство на едноставни соединенија не е потребно посебно знаење и затоа е лесно да се добие киселина во доволни количини. Ова создава зголемена опасност во случај на невнимателно ракување или спроведување на лоши намери.
Колку се силни карборанските киселини? Најсилниот од нив е најмалку милион пати посилен од концентрирана сулфурна киселина и стотици пати посилен од претходниот рекордер, флуоросулфурна киселина. Концентрираната сулфурна киселина веќе е повеќе од милијарда пати посилна од разредената киселина во базенот или желудочната киселина. Кисели средини еднакви или поголеми од киселоста на карбонатните киселини биле постигнати претходно со додавање на антимон пентафлуорид на флуоросулфурна киселина, но овие мешавини се многу корозивни и имаат други ограничувања.
Зборувајќи на јазикот на хемијата, киселините се оние супстанции кои покажуваат способност да ослободуваат водородни катјони или супстанции кои имаат способност да прифатат електронски пар како резултат на формирањето ковалентна врска. Меѓутоа, во обичниот разговор, киселина најчесто се подразбира само како оние соединенија кои, кога се формираат во водени раствори, произведуваат вишок на H30+. Присуството на овие катјони во растворот и дава на супстанцијата кисел вкус и способност да реагира на индикаторите. Во овој материјал ќе зборуваме за тоа која супстанца е најсилната киселина, а исто така ќе зборуваме и за други кисели материи.
Киселините кои се толку силни се нарекуваат суперкиселини и реагираат со јаглеводородите од нафтата во процес наречен пукање на јаглеводороди. Ова е важен процес за зголемување на октанските нивоа на бензинот. Новите киселини би можеле да бидат многу важни за разбирање и подобрување на овој процес, рече Рид. Карборанските киселини го носат ова поле уште подалеку.
Најпознатата силна киселина
Постојат многу други молекули кои реагираат неправилно со традиционалните киселини и затоа не се многу корисни. Карборанските киселини обезбедуваат многу чиста киселост без никаква жестокост. Така, треба да биде возможна почиста киселинска катализа на реакции важни за производство на фармацевтски производи и нафтени производи.
Флуороводородна киселина антимон пентафлуорид (HFSbF5)
За да се опише киселоста на супстанцијата, постои PH индикатор, што е негативен децимален логаритам на концентрацијата на водородни јони. За обичните супстанции, овој индикатор се движи од 0 до 14. Сепак, овој индикатор не е погоден за опишување на HFSbF5, кој исто така се нарекува „супер киселина“.
Рид вели: Нашето истражување вклучува правење молекули кои никогаш порано не биле направени. Карборанските киселини ни овозможуваат да го направиме тоа. Ова е вистинската вредност на оваа студија. Науката напредува и во исто време студентите ја доживуваат возбудата на откритието додека стануваат научници.
Универзитетот во Калифорнија, Риверсајд, е кандидат за докторат истражувачки универзитет, жива лабораторија за иновативно истражување за прашања од клучно значење за внатрешноста на Јужна Калифорнија, државата и заедниците ширум светот. Силната киселина се дефинира како pH вредност, што е јачината на водородот што ја прави киселината силна. Сепак, pH вредноста не работи во растечки редослед. Колку е помала pH вредноста, толку посилна ќе биде киселината. Скалата на pH се движи од 1 до растворите со pH вредност помала од 7 се сметаат за киселини, додека растворите со pH поголема од 7 се сметаат за бази.
Нема точни податоци за активноста на оваа супстанца, но познато е дека дури и 55% раствор на HFSbF5 е речиси 1.000.000 пати посилен од концентрираниот H2SO4, кој во обичните умови се смета за една од најсилните киселини. Сепак, антимон пентафлуорид е прилично редок реагенс, а самата супстанција е создадена само во лабораториски услови. Не се произведува на индустриско ниво.
Список на најсилните киселини и нивната употреба
Киселините со pH вредност помала од 1 се сметаат за најсилни, а растворите со pH вредност над 13 се сметаат за силна основа. рН вредноста е 2 и се смета за една од корисните киселини. Солта или кремот од забен камен што се наоѓа во него природно се развива за време на производството на вино. Се меша со натриум бикарбонат и се продава комерцијално како печива. Се користи во готвењето и има уникатен кисел вкус.
Факт е дека тоа е изворот на дијамантите кои се наоѓаат на капачето или на дното од шишето. Ова се користи како органско соединение, а се произведува со помош на сите живи организми. Овие слатки носат предупредувања за нив, информирајќи ги клиентите дека можат да предизвикаат иритација на устата. Лимонот обично се наоѓа во лимоните и има pH вредност. Најчесто се наоѓа во храната со агруми, а исто така делува како посредник во циклусот на лимонска киселина што се јавува во метаболизмот на аеробните организми.Тоа е силна и јадечка киселина која се користи во вкусовите на храна и пијалоци, како што се безалкохолните пијалоци и лимонади.
Карборонска киселина (H(CHB11Cl11))
Уште една супер киселина. H(CHB11Cl11)) е најсилната киселина во светот што може да се чува во специјални контејнери. Молекулата на супстанцијата има облик на икозаедрон. Карборанската киселина е многу посилна од сулфурната киселина. Може да раствори метали, па дури и стакло.
Оваа супстанца е создадена на Универзитетот во Калифорнија во Соединетите Американски Држави со учество на научници од Новосибирскиот институт за каталитички процеси. Како што рече еден од вработените на американскиот универзитет, идејата зад создавањето била желбата да се создадат молекули претходно непознати за никого.
Се додава во сладоледот, каде што делува како емулгатор кој го спречува ослободувањето на мастите. Исто така, делува како средство за чистење и може да се користи за отстранување на вар од испарувачите и котлите. Ја омекнува водата, што ја прави корисна за правење детергенти за перење и сапуни. Тој е без мирис и може да се користи во козметички и додатоци во исхраната.
Оттука, се користи во широк спектар на индустриски, како и домашни производи. Сулфурот е познат и како сулфурен; рН вредноста е 5 и ова хемиско соединение. Има малку докази дека постои во раствор, но постои во гасната фаза. Основите за ова се вообичаените анјони, бисулфат и сулфит. Делува како средство за намалување и дезинфекција. Тие, исто така, делуваат како благи избелувачи и можат да им помогнат на оние материјали кои се уништени од белилото со хлор.
Јачината на H(CHB11Cl11)) се должи на фактот дека тој совршено донира водороден јон. Во растворите на оваа супстанца, концентрацијата на овие јони е многу повисока отколку кај другите. Другиот дел од молекулата, по ослободувањето на водородот, вклучува единаесет јаглеродни атоми, кои формираат икозаедрон, што е прилично стабилна структура, зголемувајќи ја инертноста на корозија.
рН вредноста е 5 и е минерална киселина. Адитив за храна со инхибитор на 'рѓа што се користи во стоматолошки производи. Тоа е исто така кристално цврсто тело, делува како редукционо средство и има конјугирачка основа.
Друга најсилна киселина е попознатиот водород флуорид. Индустријата го произведува во форма на раствори, најчесто четириесет, педесет или седумдесет проценти. Супстанцијата своето име го должи на флуорспатот, кој служи како суровина за водород флуорид.
Оваа супстанца нема боја. Кога се раствора во H20, се јавува значително ослободување на топлина. При ниски температури, HF е способен да формира слаби соединенија со вода.
Ја апсорбира влагата од воздухот и е безбојна кристална цврстина. Формира сируп и е растворлив во вода кога се ослободува на висока температура. Оваа pH вредност е 0 и е безбојна течност. Се користи за. Производство на неоргански и органски нитрати Производство на нитро соединенија за вештачки ѓубрива Бои-интермедијатори Органски хемикалии Експлозиви. Ако некое лице е постојано изложено на испарувања, тоа може да предизвика хемиски пеномонитис и хроничен бронхитис.
Супстанцијата го кородира стаклото и многу други материјали. За негов транспорт се користи полиетилен. Многу добро реагира со повеќето метали. Не реагира со парафин.
Доста токсичен и има наркотични ефект. Ако се проголта, може да предизвика акутно труење, нарушена хематопоеза, откажување на органите и нарушување на респираторниот систем.
Тоа е безбојна течност која испушта бели испарувања кога се пушта во вода. Две други имиња за оваа киселина се сулфурен оксид и сулфурен анхидрид. Широко се користи во производството на хемикалии и експлозиви. На пример, се користи во производството на синтетички детергенти, лекови, индустриски бои и пигменти, ѓубрива итн. Долготрајната изложеност може да има негативни здравствени ефекти и може сериозно да го оштети човечкото тело.
Хлороводородна киселина има pH вредност. Ова е агресивна и најмоќна киселина, која главно се користи во лабораториски услови. Формирањето на оваа киселина се врши со растворање на водород хлорид во вода. Се користи за многу работи како што се производство на хлориди, ѓубрива и умирање. Други употреби на киселината вклучуваат текстил, галванизација и изработка на гума. Ако некое лице е изложено на оваа силна хлороводородна киселина, тогаш изложеноста ќе доведе до следните работи.


Супстанцијата е силна киселина со две бази. Сулфурот во соединението има највисока состојба на оксидација (плус шест). Тој е без мирис и боја. Најчесто се користи во раствор со вода или сулфурен анхидрид.
Постојат неколку начини да се добие H2S04:
- Индустриски метод (оксидација со диоксид).
- Метод на кула (производство со употреба на азотен оксид).
- Други (врз основа на добивање супстанција од интеракцијата на сулфур диоксид со разни материи, не многу вообичаено).
Концентрираниот H2SO4 е многу силен, но неговите раствори исто така претставуваат сериозна опасност. Кога се загрева, тој е прилично силен оксидирачки агенс. Кога се во интеракција со метали, тие оксидираат. Во овој случај, H2S04 се редуцира до сулфур диоксид.
H2SO4 е многу каустичен. Може да влијае на кожата, респираторниот тракт, мукозните мембрани и внатрешните органи на луѓето. Многу е опасно не само да се внесе во телото, туку и да се вдишуваат неговите пареи.
Мравја киселина (HCOOH)
Оваа супстанца е заситена киселина со една база. Интересно е што и покрај својата сила, се користи како додаток во исхраната. Во нормални услови е безбоен, растворлив во ацетон и лесно се меша со вода.
HCOOH е опасен при високи концентрации. Со концентрација помала од десет проценти, има само иритирачки ефект. На повисоки нивоа, може да кородира ткива и многу супстанции.
Концентрираниот HCOOH при контакт со кожата предизвикува многу тешко изгореници, што предизвикува силна болка. Пареата на супстанцијата може да ги оштетат очите, респираторните органи и мукозните мембрани. Внесувањето внатре предизвикува сериозно труење. Меѓутоа, киселината во многу слаби концентрации лесно се обработува во телото и се отстранува од него.

Во случај на труење со метанол, во телото се формира и мравја киселина. Тоа е нејзина работа во овој процесдоведува до оштетување на видот поради оштетување на оптичкиот нерв.
Оваа супстанца се наоѓа во мали количини во овошјето, копривата и секретите на некои инсекти.
Азотна киселина (HNO3)
Азотна киселина е силна киселина со една база. Добро се меша со H20 во различни пропорции.
Оваа супстанца е еден од најпопуларните производи на хемиската индустрија. Постојат неколку методи за негова подготовка, но најчесто се користи оксидација на амонијак во присуство на платина катализатор. HNO3 најчесто се користи во производството на вештачки ѓубрива за земјоделство. Покрај тоа, се користи во воена сфера, во создавањето на експлозиви, во индустријата за накит, да се утврди квалитетот на златото, а исто така и во создавањето на одредени лекови (на пример, нитроглицерин).

Супстанцијата е многу опасна за луѓето. Пареите на HNO3 го оштетуваат респираторниот тракт и мукозните мембрани. Киселината што се навлегува на кожата остава зад себе чирови на кои им треба многу долго време да зарасне. Кожата исто така добива жолта нијанса.
Кога е изложен на топлина или светлина, HNO3 се распаѓа до азот диоксид, кој е прилично токсичен гас.
HNO3 не реагира со стакло, поради што овој материјал се користи за складирање на супстанцијата. Киселината првпат ја добил алхемичарот Џабир.