Концепт на теорија на кристално поле. Модели на хемиско поврзување. Теорија на кристално поле. Комплекси со низок и висок спин
Слабо поле силно поле
Средно поле
Фрак34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
Лигандите со слабо поле со елементи од 3d серијата формираат комплекси со висок спин, а лигандите со силно поле формираат комплекси со ниско вртење. Разликата меѓу нив влијае на електронската структура на комплексите само за конфигурации d 4 – d 7:
3+ д 5 3– д 5
комплекс со високо вртење комплекс со низок спин
H 2 O – лиганд на слабо поле CN – – лиганд на силно поле
Комплексите со низок спин се секогаш постабилни од комплексите со високо вртење. Лигандите со средно поле, во зависност од условите (полнетост и природата на централниот атом), можат да формираат комплекси со висок и низок спин.
Пример.Врз основа на TCP, направете претпоставка за електронската структура на јоните на хексамин кобалт(II) (Δo = 21600 cm–1, P = 21000 cm–1) и хексамин кобалт (III) (Δo = 9500 cm–1, P = 22500). cm–1).
Амонијакот е лиганд со средно поле и, во зависност од степенот на оксидација на металот, може да формира комплекси со висок и низок спин. Дозволете ни да дознаеме кои комплекси ќе бидат енергетски постабилни за кобалт (II) и кобалт (III). За да го направите ова, споредете го ESC на секој јон во силно и слабо поле:
(а) 3+, г 6

силно поле слабо поле
ESKP (силно поле) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 cm –1
ESKP (слабо поле) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 cm – 1
Енергетската добивка е поголема во случај на комплекс со низок спин.
(б) 2+ , г 7

силно поле слабо поле
ESKP (силно поле) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 cm–1
ESKP (слабо поле) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 cm – 1
Енергетската добивка е поголема во случај на комплекс со високо вртење.
Така, јонот 3+ е со низок спин, а јонот 2+ е со висок спин.
ESC се зголемува со зголемување на Δo, меѓутоа, тоа е различно за состојби со високо вртење и ниско вртење (сл. 1.28. Зависноста на ESC за комплекси со високо вртење и низок спин со конфигурација d 6 од вредноста Δo = 10Dq Регионот во кој е можно постоењето на двете држави е засенчен). Регионот во близина на пресечната точка на овие две линии кореспондира со комплекси кои можат да постојат и во состојби со висок и низок спин.
Пример е железниот(II) тиоцијанат комплекс со 1,10-фенантролин, кој е високо-спин (парамагнетичен) на ниски температури и низок спин (дијамагнетски) на покачени температури (М. Марчиви, П. Гвионо, Ј. А. К. Хауард , G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, с. 124, стр. 194). Промената на мноштвото е придружена со промена на меѓуатомските растојанија и геометријата на координативната средина: комплексот со низок спин е правилен октаедар, а комплексот со високо вртење е искривен. Обратна транзиција во состојба на високо вртење е можна под влијание на високи притисоци или зрачење. Во моментов се познати неколку десетици такви системи.
Зборувајќи за својствата на σ-донатор и π-акцептор на лигандот, отидовме подалеку од TCP, користејќи ги пристапите на методот на молекуларната орбита како што се применува на сложените соединенија (том 1). Да потсетиме дека сликата на разделувањето на d-орбиталите е фрагмент од општата шема на молекуларни орбитали во октаедрален комплекс, каде t 2g орбиталите се сметаат за неврзувачки, а e g - како антиврзувачки (сл. Том 1) .
Формирањето врски во октаедрален комплекс без π-врзување ги вклучува s-, p- и d-орбиталите на металот и по една орбитала од секој лиганд. Од 15 атомски орбитали се формираат 15 молекуларни орбитали, од кои шест (а 1 g, t 1 u, e g (фуснота: буквата во ознаката на орбиталите го означува степенот на нивната дегенерација: t - трипати дегенерирано, е - двојно дегенерирано, а - недегенерирано и присуство на центар на симетрија: g - симетрично, u - асиметрично)) σ-врзување, три (t 2 g) - неврзувачки и шест (на пр. g *, t 1 u *, 1 g *) σ-олабавување. Сврзувачките орбитали се поблиску по енергија до орбиталите на лигандот, додека неврзаните орбитали се локализирани претежно на металниот атом. Енергијата d xy , d xz , d yz (t 2 g) на металните орбитали практично не се менува за време на формирањето на комплексот.
Присуството на празна орбитала со ниска енергија во лигандот, слична по симетрија на металните орбитали, доведува до намалување на енергијата на t 2g орбитали, практично без да влијае на пр., а со тоа да се зголеми Δо (сл. 1.29. Фрагменти од MO дијаграм за кобалт(III) комплекс со σ-донорски лиганд (а) и σ-донатор, π-акцептор лиганд (б)).
Ефектот на Јан-Телер.Во 1937 година, Јанг и Телер ја докажаа теоремата според која секоја нелинеарна молекула во дегенерирана електронска состојба е нестабилна и спонтано претрпува дисторзија што ја намалува нејзината симетрија и води до отстранување на дегенерацијата. Теоремата го предвидува само самиот факт за отстранување на дегенерацијата, но не укажува како таа ќе биде отстранета. Врз основа на оваа теорема, беше објаснето изобличувањето на октаедралната геометрија на голем број комплекси, а самиот факт за присуството на такво нарушување беше наречен Џан-Телров ефект. Ајде да погледнеме на пример. Бакарните(II) комплекси со конфигурација d9, по правило, не претставуваат правилен октаедар, туку се издолжени или компресирани по една од оските (сл. 1.30. Дисторзија на октаедралната геометрија кај бакарните(II) комплекси). Да го разгледаме случајот со пролатен октаедар. Отстранувањето на лигандите лоцирани по оската z предизвикува отстранување на дегенерацијата поради промена на енергиите на орбиталите. Орбиталите насочени по оската z (d xz, d yz, d z 2) комуницираат послабо со орбиталите на лигандите во споредба со орбиталите кои немаат z компонента (d xy, d x 2 -y 2), и затоа ја намалуваат нивната енергија. Пар орбитали со иста симетрија, кои имаат z-компонента (d xz, d yz), остануваат дегенерирани и добиваат зголемена енергија. (Сл. 1.31. Промена на енергиите на d-орбиталите кога октаедарот е искривен). Ефектот Jahn-Teller најсилно се манифестира во комплекси со нееднакво пополнети eg орбитали, односно со конфигурации t 2g 3 e g 1 (што одговара на d 4 јонот во слабо поле: CrCl 2, K 3 MnF 6) и t 2g 6 e g 3 ( одговара на d 9 јон: скоро сите бакар(II) комплекси) и t 2g 6 e g 1 (одговара на d 7 јонот во силно поле, ретко, K 3 NiF 6),. Незначителен Jahn-Teller ефект е типичен за комплекси со нееднакво пополнети t 2g орбитали, односно за електронски конфигурации t 2g 1 (d 1), t 2g 2 (d 2), t 2g 4 (d 4 во силно поле) , t 2g 5 (d 5 во силно поле), t 2g 5 e g 1 (d 6 во слабо поле), t 2g 5 e g 2 (d 7 во слабо поле). Јоните со конфигурации d 3 и d 5 на слабо поле, d 3 и d 6 во силно поле, d 8 и d 10 во никој случај не се Џан-Тлер.
Јан-Телровиот ефект се манифестира во нееднаквоста на должините на врските во многу комплекси на бакар (II) и манган (III) и во немонотоничната промена во чекорните константи на стабилноста на комплексите. На пример, во безводен бакар(II) хлорид, бакарниот атом е опкружен со шест атоми на хлор, од кои четири се наоѓаат на растојание од 0,230 nm, а другите два се наоѓаат на растојание од 0,295 nm од него.
Познати се бакарни(II) комплекси (Cl 2, (C 6 H 5 SO 3) 2, итн.), кои се состојат од неколку кристалографски нееквивалентни јони на Jahn-Teller, секој со свој тип на дисторзија, кои се трансформираат еден во друг, менувајќи се растојанието метал-лиганд толку брзо што севкупните растојанија метал-лиганд се чини дека се исти. Овој случај беше повикан динамичен или пулсирачки ефект на Џан Телер(P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214).
Меѓутоа, ефектот на Јан-Тлер не е универзален закон. Во моментов, познати се сложени јони со конфигурација на Џан-Телер, кои се неискривени октаедри: 4–, 3+.
Разделување во полиња со симетрија различна од октаедра.
Покрај октаедарските, постојат многу познати комплекси со различна геометрија - квадратна рамнина, тетраедарска, тригонално-пирамидална, квадратна пирамидална, линеарна итн. Расцепувањето во секое од овие полиња е различно отколку во октаедарот; определена со симетријата на координацискиот полиедар.
Квадратно-рамни комплекси може да се сметаат како екстремен случај на тетрагонално изобличување на октаедралната геометрија, кога лигандите лоцирани по една од координатните оски се отстранети до бесконечност (сл. 1.27б). Ознаките на орбиталите се прикажани на сликата. Квадратните комплекси се најтипични за јони со електронска конфигурација d 8 – Ni 2+, Pd 2+, Pt 2+, Au 3+. Нивната стабилност нагло се зголемува со зголемување на Δ, односно при движење од елементи од серијата 3d до тешки преодни елементи. Така, на пример, ако паладиумот, платината и златото ги имаат скоро сите комплекси со координативен број од четири квадрати, тогаш никелот формира рамни квадратни комплекси само со лиганди со високо поле: 2–, Ni(dmg) 2. Комплексите на никел (II) со лиганди со ниско поле, како што се халогените, имаат тетраедрална геометрија.
Некои квадратни рамни комплекси на преодни метали формираат синџири во цврста форма со премостувачки лиганди, на пример Pt-CN-Pt во K 2 Br 0,3, каде што атомите на платината се делумно во +4 оксидациона состојба. Високата продорна способност на 5d орбиталите обезбедува нивно преклопување со формирање на единствена енергетска лента и, следствено, метална спроводливост во насока на ланецот. Таквите молекуларни комплекси се способни да спроведат електрична струја и во моментов интензивно се проучуваат.
Во полето на тетраедрална симетрија, орбиталите d xy , d yz , d xz имаат максимална енергија, се нарекуваат t 2 -орбитали, а минималната енергија е орбиталите d x 2 –y 2 и d z 2, тие се означени e . Поради присуството на помал број лиганди и нивното различно распоредување, тетраедарското поле (сл. 1.32. Споредба на расцепите во тетраедарското и октаедрното поле) излегува дека е 2,25 пати послабо од октаедарното: .
Повеќето тетраедарски комплекси се со високо вртење (Фуснота - Познати се неколку примери на тетраедарски комплекси со низок спин, на пример, Cr(N(Si(CH 3) 3) 2 ) 3 NO (хром(II), d 4 ; D. C. Бредли, Хем. , 1491)). Максимална стабилизација на тетраедарската средина со кристалното поле се постигнува со конфигурации d 2 (FeO 4 2–, MnO 4 3–) и d 7 (2–). Поради релативно ниската енергија на стабилизација, тетраедарските комплекси почесто се формираат од јони со конфигурации d 0 (TiCl 4, MnO 4 –, CrO 4 2–), d 5 во слабо поле (FeCl 4 –) и d 10 (ZnCl 4 2–) со нула ESKP, како и јони на непреодни метали (AlCl 4 –). Формирањето на тетраедарски комплекси во споредба со октаедарските често е фаворизирано од стеричниот фактор, на пример, јонот е постабилен од 3-.
Користење на TCP за објаснување на стабилноста на комплексите. Серијата Ирвинг-Вилијамс.Теоријата на кристално поле овозможува да се објасни немонотоничната природа на промените во енергиите на кристалната решетка на оксиди и халиди, константи на стабилност на комплексите итн. Редоследот на промена на енергиите на хидратација на двојно наелектризираните катјони на 3d металите генерално се совпаѓа со природата на промените во ESC кај комплексите со високо вртење (сл. 1.33. Промена на енергијата на хидратација на двојно наелектризираните катјони метали од 3d серијата (а) и промената на ESC во комплексите со високо вртење (б) ), колку е посилна стабилизацијата со кристалното поле, толку е поголема хидратацијата. Познато е дека константите на замена на молекула на вода со лиганд со слабо поле L
2+ + L x– = (2-x)+ + H 2 O
почитувајте ја серијата Ирвинг-Вилијамс: Mn 2+< Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ < Zn 2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Нефелоаксетички ефект.Откриено е дека меѓусебното одбивање на d-електроните слабее кога атомот се става во полето на лиганди. Овој ефект на лигандот врз d-електроните на металниот атом се нарекува нефелоаксетички ефект од грчките зборови νεφελη - облак и αυξανω - зголемување. Серијата лиганди, распоредени по редослед на зголемување на нивното влијание врз металните орбитали, речиси целосно одговара на спектрохемиската серија. Причината за нефелоаксетичниот ефект е преклопувањето на d-орбиталите на металот со орбиталите на лигандите, поради што d-облакот се шири во просторот. Присуството на овој ефект јасно ги покажува ограничувањата на наједноставниот електростатички модел - теоријата на кристално поле, која претпоставува дека лигнадите се точкасти негативни полнежи.
Теорија на полиња на лиганди.Теоријата на кристално поле беше развиена од Бете во 1929 година. Во моментов, таа е широко користена во модифицирана форма со корекции за одредена ковалентност на врската метал-лиганд. Оваа теорија се нарекува теорија на полиња на лиганди. Присуството на ковалентен придонес ја менува енергијата на металните орбитали во споредба со онаа пресметана со TCP. Процентот на ковалентност се зема предвид со воведување фактори за корекција што овозможуваат изедначување на експерименталните вредности со пресметаните.
Боење на комплекси.
Бојата на комплексите на d-преодни елементи е поврзана со транзиции на електрони од една d-орбитала во друга. Ова е јасно илустрирано со примерот на јонот Ti 3+, дискутиран во првиот том од учебникот. Со апсорпција на енергија што одговара на сините и зелените делови од видливиот спектар, единствениот d-електрон во јонот Ti 3+ се движи кон орбиталата e g (сл. 1.35. Спектар на јонот 3+). Бојата на јонот се должи на дополнителни бои - црвена и виолетова. (Фуснота - Внимателниот читател ќе забележи одредена асиметрија на појасот на апсорпција. Тоа е последица на мало расцепување на нивото t 2g предизвикано од ефектот Jahn-Teller). На вториот лист од учебникот е претставен дијаграм кој прикажува комплементарни бои и кој е добро познат на секој уметник. Преодната енергија, изразена во реципрочни сантиметри (1000 cm –1 = 12 kJ), одговара на параметарот на разделување Δο - најчесто се одредува од електронски спектри. Брановата должина е обратно пропорционална со енергијата:
 .
.
Во случај на комплекси со голем број електрони, сликата на спектарот станува посложена и во неа се појавуваат дополнителни ленти. Ова се должи на фактот што возбудената состојба t 2g 1 e g 1 може да се реализира на неколку начини, во зависност од тоа во кои две d-орбитали се електроните. На пример, состојба во која електроните зафаќаат d xy и d x 2 –y 2 орбитали ќе биде повисока по енергија од состојбата d xy 1 d z 2 1 поради поголемата одбивност на електроните долж оската x. Енергијата што одговара на опсегот со најниска енергија е еднаква на параметарот на разделување Δo.
За подетално да се опишат електронските спектри, неопходно е да се воведат некои концепти. Да го наречеме секое распоредување на електрони на подниво микросостојба. Бројот на микросостојби N, во кои n електрони заземаат x орбитали, е еднаков на

Секоја микросостојба се карактеризира со свои вредности на спин и аголен моментум. Се нарекува збир на микросостојби со идентични енергии термин, на пример, 3 P, 5 D, 1 S. Дигиталниот индекс означува мноштво, што се пресметува како:
множина = број на неспарени електрони во основната состојба + 1.
Имињата на поимите се читаат со назнака за мноштво: „тројка P“, „квинтет D“, „единечна S“. Буквата го означува вкупниот аголен момент L на атом или јон, што е еднакво на максималната вредност на збирот на аголниот момент m l на поединечните орбитали окупирани од електрони. На пример, јонот Ti 3+ содржи еден d-електрон, бројот на микросостојби е N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (бидејќи за d-орбиталата m l = –2, –1, 0, 1, 2, бројот на електрони е 1, според тоа, максималната сума m l е еднаква на најголемата вредност на m l), множите 2'5 – 2)! = 45, L = 3(F) (бидејќи за d-орбиталата m l = –2, –1, 0, 1, 2, бројот на електрони е 2, според тоа, максималната сума на двете најголеми вредности е еднакво на m l), множина 2 + 1 = 3. Следствено, терминот на основната микросостојба е 3 F. Со различен распоред на два електрони на d-поднивото, се постигнуваат состојби опишани со други поими - 3 P, 1 G , 1 D, 1 S, итн. Врската помеѓу нумеричките вредности на L и азбучните симболи е дадена подолу:
L = 0 1 2 3 4 5 6 7
Слично на тоа, можеме да ги изведеме термините на основата и возбудените состојби за другите јони на d-елементите (Табела 1.5.). Ве молиме имајте предвид дека термините за јони со конфигурација d n и d 10-n се исти.
Табела. 1.5.
Услови на земјата и најблиските возбудени состојби за различни конфигурации на d-електрони.
Поимите се поделени во октаедрално поле како орбитали, означени со слични букви. Поимите D се поделени на T 2 g и Eg компоненти, како d-орбитали, F термини - на T 1 g, T 2 g и A 2 g, како f-орбитали. Условите S и P воопшто не се поделени. Можностите за електронски транзиции помеѓу различни состојби се ограничени со правилата за селекција. Така, во комплексите се дозволени само транзиции помеѓу состојби со иста мноштво. Секоја таква транзиција одговара на лента во спектарот на апсорпција. Како пример, земете го електронскиот спектар на комплексот 3+ (сл. 1.36. Електронски спектар на комплексот 3+). Трите ленти се должат на три електронски транзиции: 4 A 2 g ® 4 T 2 g, 4 A 2 g ® 4 T 1 g, 4 A 2 g ® 4 T 1 g (P). Преминот со најмала енергија одговара на вредноста на параметарот на разделување: Δo = 17400 cm–1. Комплексот ја апсорбира светлината во црвените (17400 cm–1) и сините (23000 cm–1) делови од видливиот спектар и во блискиот ултравиолетови (37800 cm–1), според тоа, има виолетова боја.
Според правилото на Лапорте, транзициите помеѓу состојбите со ист паритет, кои вклучуваат транзиции s-s, p-p, d-d, f-f, се малку веројатни или, на јазикот на спектроскопијата, тие се забранети во октаедарски комплекси. Можни се забранети транзиции, но се случуваат со слаб интензитет. Ова е причината зошто солите на преодните метали имаат забележлива боја само во концентрирани раствори. Многу пати е послаба од бојата на перманганат или дихромат, чии јони не содржат d-електрони.
Правилото на Лапорте е применливо само во случај на комплекси кои имаат центар на симетрија. Кога октаедарот е искривен, центарот на симетријата исчезнува, забраната Лапорте се укинува и се појавува боја. На пример, јонот 3+ е безбоен, но растворите на солите на железо (III) често се жолто-портокалови поради хидролизата што доведува до формирање на асиметрични честички со искривена октаедрална средина.
Бојата на комплексите, покрај d-d премините од една метална d-орбитала во друга (од t 2g до eg во октаедралните комплекси), се определува со уште два фактори: транзиции од орбитали на лиганд во метални орбитали (тие се нарекуваат пренос на полнеж ) и транзиции во орбиталите на лигандот. Овие транзиции не потпаѓаат под владеењето на Лапорте и затоа имаат висок интензитет.
Опсегот за пренос на полнеж е присутен во електронскиот спектар на кое било соединение, но во некои случаи е во ултравиолетовиот дел од спектарот и не се перцепира од нас како боја. Ако разликата помеѓу енергиите на орбиталите на лигандот и металните орбитали се намали, опсегот за пренос на полнеж паѓа во видливиот дел од спектарот. Преносот на полнеж е тој што ја објаснува интензивната боја на перманганат, дихромат, жива сулфид, титаниум(IV) пероксо комплекси и многу други соединенија со празни d-орбитали. Во некои случаи, под влијание на светлината, преносот на полнеж од орбиталите на лигандот до орбиталите на металот се случува неповратно, односно е придружен со хемиски процес. Пример е фотохемиското распаѓање на сребрените халиди, што е основа на црно-белата фотографија: Ag + Br – ¾® Ag 0 + Br 0 .
Во електронскиот спектар на калиум перманганат, забележани се четири појаси, што одговараат на транзиции на електрони од неврзувачки орбитали локализирани претежно на лигандот (a 1, t 2 σ орбитали и e, t 1, t 2 π орбитали) до e*, t2 '' антисврзувачки орбитали орбитали локализирани на металниот атом ((сл. 1.37. Енергетски дијаграм на тетраедралниот јон MnO 4 - со π-врзување. Транзициите на електроните се прикажани со стрелки):
ν 1 , Mn(e*) ¾ O(t 1) 17700 cm -1
ν 2 , Mn(t 2'') ¾ O(t 1) 29500 cm -1
ν 3, Mn(e*) ¾ O(t 2) 30300 cm -1
ν 4 , Mn(t 2 '') ¾ O (t 2) 44400 cm -1
Појасот со најмала енергија паѓа во видливиот дел од спектарот (λ = 107/17700 = 565 nm), што одговара на апсорпцијата на зелената светлина и на преносот на темноцрвена светлина.
3. Механизми на реакции кои вклучуваат сложени соединенија.
Огромното мнозинство на хемиски процеси се случуваат како секвенцијален синџир на некои елементарни фази, а равенката на реакцијата носи само информации за главните крајни производи на реакцијата. Оваа низа на елементарни трансформации на патот од почетни супстанции до производи се нарекува механизам. Средните, обично нестабилни соединенија низ кои минува патот од реактантите до производите се нарекуваат посредници. Секој посредник има одреден животен век, обично екстремно краток, до 10 -14 секунди. На енергетскиот профил на реакцијата одговара на минимум (сл. а) (сл. 1.38. Енергетски профили на реакција што се одвива низ: (а) средна, (б) преодна состојба.). Како по правило, меѓупроизводите може да се детектираат во реакциона смеса со спектрални методи, а само во ретки случаи може да се изолираат во индивидуална форма. Затоа, главните информации за механизмот на реакција обично се добиваат преку проучување на неговата кинетика - одредување на константи на брзина и пресметување на параметрите за активирање (енталпија, ентропија, волумен). Во овој случај, механизмот е модел кој е во согласност со кинетичките податоци, модел кој може да се подобрува, модифицира, ревидира.
Во некои реакции, посредниците не се формираат, а преминот од реактантите кон производите се случува последователно - еден од атомите постепено се отстранува, а другиот се приближува. Во овој случај, се вели дека реакцијата ќе продолжи транзициска состојбаили активиран комплекс. Тоа одговара на максимум во енергетскиот профил на реакцијата (сл. Б).
Додаток: Лабилни и инертни комплекси
Термодинамичката стабилност на честичката се определува со промената на Гибсовата енергија за реакцијата на нејзината дисоцијација или со вредноста на константата на стабилност на овој процес. Кинетичката стабилност покажува колку брзо одредена честичка комуницира со други честички или се подложува на распаѓање. Се смета за хемиска честичка инертен, доколку реагира со полуживот поголем од 1 минута. Честичките кои реагираат со поголема брзина се нарекуваат лабилен. Мора да се запомни дека кинетичката и термодинамичката стабилност не зависат една од друга, односно истата супстанција може да има висока константа на стабилност и во исто време да биде инертна или, обратно, лабилна. Некои такви примери се дадени во Табела 1.6.
Табела 1.6. Константи на стабилност и стапки на супституција на лиганд во цијано-комплексите на некои метали.
Хенри Таубе ја покажа врската помеѓу кинетичката стабилност на октаедарските комплекси и електронската конфигурација на централниот јон во октаедарското поле. Според Таубе, следните комплекси се лабилни:
· поседуваат најмалку една празна t 2g орбитала - можат да ја користат во реакции според асоцијативниот (A, I a) механизам, или
· Имајќи барем еден електрон во орбиталата на пр. - ова ја промовира реакцијата со механизмот за дисоцијација (D, I d), бидејќи Отстранувањето на електрон од орбиталата e g ја намалува енергијата на преодната состојба.
Така, октаедрални комплекси на хром (III) (t 2g 3), комплекси со низок спин на железо (II) (t 2g 6) и железо (III) (t 2g 5), како и комплекси од 4d-, 5d- преодните елементи се класифицирани како инертни со број на d-електрони повеќе од два.
КРАЈ НА ДОДАТОК
Унифицирана класификација на неоргански реакции сè уште не е развиена. Конвенционално, можеме да ја предложиме следната шема (сл. 1.39. Шема што ја илустрира класификацијата на неорганските реакции):
1) Реакциите на замена, додавање или елиминација на лиганди влијаат на промената во координативната сфера на металот,
2) Редокс реакциите се поврзани со промена на електронската конфигурација на металот, но не влијаат на неговата координативна средина,
3) Реакциите на координирани лиганди вклучуваат промена на лигандот без промена на координативната сфера на комплексот.
Реакции на замена.Во широка смисла, реакциите на супституција значат процеси на замена на некои лиганди во координативната сфера на метал со други. Ваквите реакции може да се појават или со или без промена на состојбата на оксидација. Следејќи ја горенаведената класификација, овој термин ќе го користиме само во однос на реакциите што се случуваат без промена на состојбите на оксидација.
Класификацијата на реакциите на супституција во неорганската хемија беше развиена од Лангфорд и Греј. Се заснова на дефиницијата на таканаречениот ограничувачки механизам, а не на описот на одреден механизам. Прво се одредува стехиометрискиот механизам, а потоа внатрешниот. Стоихиометриски механизаме низа од елементарни фази во преминот од почетни материи кон производи. Може да биде дисоцијативна (Д), асоцијативна (А) и размена (реципрочна размена, I). Дисоцијативните и асоцијативните процеси претставуваат, како да се, два ограничувачки случаи, директно спротивни еден на друг. И двата процеса се случуваат во две фази преку формирање на посредник.
Дисоцијативна (Д)
Процесот е двостепен, во ограничувачкиот случај се одвива преку посредник со намалена концентрација:
ML 6 + L, + Y ¾® ML 5 Y
Асоцијативна (А)
Процесот е двостепен, се карактеризира со формирање на посредник со зголемена концентрација:
ML 6 + Y, ¾® ML 5 Y + L
Заемна размена (I)
Повеќето реакции на размена се одвиваат преку овој механизам. Процесот е едностепен и не е придружен со формирање на посредник. Во преодната состојба, реагенсот и групата што заминува се поврзани со реакциониот центар, влегуваат во неговата најблиска координативна сфера и за време на реакцијата една група се поместува со друга, се случува размена на два лиганди:
ML 6 + Y ML 5 Y + L.
Состојбата на транзиција е или комплекс на надворешната сфера или, во случај на наелектризирани лиганди, јонски пар MX 5 L + Y - .
Внатрешен механизам (аили г) го карактеризира процесот на супституција на лиганди на молекуларно ниво. Тоа покажува кој од двата процеса - формирање или прекин на врска во преодната состојба - е ограничувачки. Ако брзината на реакцијата е одредена со формирање на врска помеѓу реакциониот центар и реагенсот, зборуваме за асоцијативно активирање. Во спротивно, кога ограничувачкиот фактор е прекин на врската помеѓу реакциониот центар и групата што заминува, процесот продолжува со дисоцијативно активирање. Осврнувајќи се на стехиометрискиот механизам, лесно е да се забележи дека дисоцијативниот процес секогаш одговара на дисоцијативното активирање, а асоцијативниот процес секогаш одговара на асоцијативното активирање, односно концептот на внатрешен механизам се покажува како информативен само во случај на механизам за взаемна размена - може да се појави и со разединувачко (I d) и со асоцијативно (I a) активирање. Во случајот на механизмот за реципрочна размена со асоцијативна активација (Ia), брзината на реакција зависи од природата на Y. Во преодната состојба, металниот атом е цврсто врзан и за групата што заминува и за нуклеофилот кој напаѓа. Пример е процесот на замена на атом на хлор со бром и јод во комплекс од платина со диетилентриамин (диен):
Y - ¾¾® + + Cl -
Y = Br, I брзините се разликуваат многу.
Во случај на механизам за реципрочна размена со дисоцијативно активирање (I d), брзината на реакција не зависи од природата на реагенсот Y. Напаѓачките и напуштачките групи во преодната состојба се слабо врзани за централниот јон. Овој механизам се користи за замена на водата со амин во аква комплекси на многу преодни метали, на пример, никел:
2+ + Y ¾¾® 2+ + H 2 O
Y = NH 3, py брзините се блиски.
Проучувањето на механизмите на реакции на супституција во комплекси на многу метали е само во почетната фаза. Сеопфатни информации се добиени само за квадратно-рамни комплекси на платина и октаедрални комплекси на хром(III) и кобалт(III). Може да се смета дека е цврсто утврдено дека во комплексите на платина (II), супституцијата се јавува според асоцијативниот механизам (A, Ia) преку средна или преодна состојба во форма на тригонална бипирамида. Октаедралните комплекси на кобалт (III) реагираат дисоцијативно (механизми D, I d). Специфични примери на такви реакции ќе бидат земени во предвид при опишување на хемијата на овие елементи.
Редокс реакции.Повеќето редокс процеси се сложена комбинација на поединечни елементарни фази, од кои секоја вклучува пренос на еден или, многу поретко, два електрони. Невозможен е истовремен пренос на поголем број електрони во растворите.
Трансферот на единечни електрони може да се случи преку еден од двата механизми: надворешна сфера, односно со тунелирање или внатрешна сфера, преку премостувачки лиганд. Интрасферниот механизам се реализира во комплекси кои содржат халиди, хидроксидни јони и карбоксилни групи кои можат да дејствуваат како мостови помеѓу металите. Пример е реакцијата помеѓу јоните на пентамин хлорокобалт(III) и хексааквахром(II). Процесот може грубо да се подели во три фази: формирање на хетерометален комплекс со премостувачки хлориден јон, пренос на електрони и распаѓање на премостувачкиот комплекс. Добиениот 2+ јон, бидејќи е лабилен, веднаш се претвора во аква комплекс, а инертниот [(H 2 O) 5 CrCl] 2+ не комуницира со вода:

Ако во системот нема честички кои би можеле да дејствуваат како мостови, процесот продолжува во надворешната сфера:
2+ + 3+ = 3+ + 2+ .
Особено е неопходно да се истакнат реакциите на оксидативно додавање и редуктивна елиминација, дискутирани во Поглавје 6.
Реакции на координирани лиганди.Оваа група на реакции вклучува процеси на модификација на лиганди координирани од метален јон. На пример, дикетонатните комплекси, како слободните дикетони, може да се нитрираат, ацилираат или халогенираат. Најинтересен и невообичаен пример за реакции на координирани лиганди е синтеза на шаблон– уникатен метод за „склопување“ на лиганд на метален јон. Пример е синтезата на фталоцијанини од нитрил на фтална киселина, која се јавува во присуство на бакар (II) јони, и синтеза на макроциклична Шифова база од 2-аминобензалдехид, која се јавува во присуство на јони на никел (II):

Во отсуство на метал, процесот се одвива по друга патека, а саканиот производ е присутен само во мала количина во реакционата смеса. Металниот јон делува во синтезата на шаблоните како матрица („шаблон“), стабилизирајќи еден од производите кои се во рамнотежа едни со други и ја поместуваат рамнотежата кон нејзиното формирање. На пример, во реакцијата X + Y ¾® се формира мешавина од производи А и Б, во која доминира Б, кој има помала енергија. Во присуство на метален јон, супстанцијата А преовладува во производите на реакцијата во форма на комплекс со М (сл. 1.40. Енергетски дијаграм на интеракцијата на X и Y во отсуство на метален јон (лево) и во неговата присуство (б)).
Прашања и задачи
1. Кое од наведените соединенија има перовскитна структура? BaTiO 3, LiNbO 3, LaCrO 3, FeTiO 3, Na 2 WO 4, CuLa 2 O 4, La 2 MgRuO 6. Табелата со јонски радиуси е дадена во Додаток. Имајте на ум дека во сложените оксидни фази, позициите Б може да содржат катјони од два различни метали.
2. Користејќи го TCP, одреди дали следните спинели ќе бидат прави или превртени: ZnFe 2 O 4, CoFe 2 O 4, Co 3 O 4, Mn 3 O 4, CuRh 2 O 4.
3. Тиоцијанат јон SCN - има два донорски центри - тврд и мек. Предвиди каква структура ќе имаат тиоцијанатните комплекси на калциум и бакар(I). Зошто не е можно да се добие бакар(II) тиоцијанат?
4. Спектарот на аква јонот Cr 2+ (термин на основна состојба 5 D) има две појаси (сл. 1.41. Спектар на аква јонот Cr 2+), иако меѓу поимите на најблиските возбудени состојби нема ниту еден со истата мноштво. Што го објаснува ова? Каква боја има овој јон?
5. Користејќи ги вредностите Δο подолу, пресметајте го ESC за следните комплекси во kJ/mol:
(а) 2–, Δο = 15000 cm–1,
(б) 2+, Δο = 13000 cm–1,
(в) 2–, Δο (за 4–)= 21000 cm–1,
Земете ја енергијата на спарување еднаква на 19000 cm –1, 1 kJ/mol = 83 cm –1. Пресметајте ги нивните магнетни моменти (спин компонента).
6. Користејќи TCP, објаснете зошто CN – јонот реагира со хексакваникел (III) јон за да формира хексацијаноферат (II), а со хексакваникел (II) јон за да формира тетрацијаноникелат (II).
7. Подолу се дадени реакционите константи за секвенцијална замена на водата во бакар(II) аква комплексот со амонијак: K 1 = 2´10 4 , K 2 = 4´10 3 , K 3 = 1´10 3 , K 4 = 2´10 2, K5 = 3´10 –1, K6<< 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. Како се менува ригидноста на катјоните при движење по 3d ред? Дали ова е во согласност со редоследот на промена на константите на стабилност на комплексите (серија Ирвинг-Вилијамс, Сл. 1.34).
9. Објаснете зошто хексакватичниот јон на железо (III) е безбоен, а растворите на солите на железото (III) се обоени.
10. Предложете механизам за реакцијата 3– + 3– = 4– + 2–, ако се знае дека внесувањето на тиоцијанат јон во растворот доведува до промена на брзината на реакцијата, а брзината е практично независна од присуство на амонијак. Понудете објаснување за овие факти.
Концептот на промени во електронската структура на јоните на преодниот метал под дејство на електричното поле на наелектризираните честички што ги опкружува беше предложен од Бекерел и понатаму развиен од H.A. Бете и Ј. Ван Влек на почетокот XX В. Овие концепти беа применети за описот на електронската структура и својствата на сложените соединенија само во средината XX век од Х. Хартман и моделот беше наречен „теорија на кристално поле“ (CFT).
Основни одредби на TCH за преодни комплексиг метали Сл. 24):
1. - Комплексот постои и е стабилен поради електростатската интеракција на комплексниот агенс со лигандите.
2. - Лигандите се сметаат без да се земе предвид нивната електронска структура како точки наплаќања или диполи.
3. - Под влијание на електричното поле на лигандите, валентна петкратна дегенерација ( n -1) г орбиталите се поделени во зависност од симетријата на околината на лигандот.
4. - Дистрибуција на метални валентни електрони меѓу разделувањето ( n -1) г орбиталите зависи од односот на енергијата на спин-спарување и енергијата на разделување.
Размислете, на пример, промената на енергијата на петкратно дегенерирано ( n -1) г орбитали на централниот метален јон М n+ , лоциран во центарот на координатите, под влијание на октаедралното поле на негативно наелектризираните лиганди [ ML 6] z , кој се наоѓа на координатните оски (сл. 25). Како резултат на одбивањето на валентните електрони на металот од негативно наелектризираните лиганди со рамномерна распределба на негативното полнење околу металот (сферично симетрично електрично поле), енергијата на сите петг орбиталите ќе се зголемат за износот E 0 во споредба со слободниот M n+ јон. Затоа штог орбиталите имаат различни просторни ориентации, тогаш со концентрацијата на негативни полнежи на лигандите лоцирани на координатните оски, зголемувањето на нивната енергија се разликува. Засилување на енергијата d z 2 и d x 2- y 2 орбиталите насочени кон лигандите на координатните оски имаат поголем енергетски пораст dxy, dxz и dyz орбитали насочени помеѓу координатните оски.
Енергија на фисијапеткратно дегенерирано ( n -1) орбитали во двојно дегенерирани d x 2- y 2, z 2 орбитали и тројно дегенерира d xy, xz, yz орбиталите се нарекуваат (сл. 26) параметар за разделување на кристално поле.Од енергијата на расцепг орбиталите во октаедралното поле на лигандите не се менуваат во споредба со сферично симетричното електрично поле, потоа зголемувањето на енергијата на двете d x 2- y 2, z 2 орбиталите се јавуваат на 0,6Д 0 и намалување на енергијата за три d xy , xz , yz орбитали за 0,4 Д 0 .
За да се покаже степенот на дегенерација и симетрија на металните орбитали поделени под влијание на електричното поле на лигандите, се користат специјални симболи. Тројно дегенерирано и симетрично во однос на центарот на симетрија и ротација околу координатните оски d xy , xz , yz t 2 g “, додека двојно дегенериран и исто така симетричен во однос на центарот на симетрија d x 2- y 2, z 2 орбиталите се означени со симболот "на пр " Така, под влијание на октаедралното електрично поле на лигандите, петкратно дегенерира ( n -1) г орбиталите на агентот за сложеност се поделени на тројно и двојно дегенерирани со различни енергии t 2 g и e g орбитали.
Слично разгледување на промената на енергијата на петкратно дегенерирано ( n -1) г орбитали на слободен метален јон во тетраедрална средина на лиганди во [ ML 4 ] z комплекси покажува (сл. 27) нивното делење, исто така, на два пати (д) и трикратно (т ) сепак, дегенерирани орбитали со спротивна енергетска положба. Претплата "е " кога е означено "д" и "т » орбиталите не се индицирани бидејќи тетраедарскиот комплекс нема центар на симетрија. Намалувањето на бројот на лиганди на тетраедарскиот комплекс во споредба со октаедралниот комплекс доведува до природно намалување на параметарот на разделување на кристалното поле:ДТ = 4/9 ДЗА .
Намалување на симетријата на лигандската средина на металот, на пример, тетрагонално искривување на октаедарски [ ML 6] z комплекси поврзани со продолжување на врските на метал-лиганд со аксијални лиганди [ ML 4 X 2 ] z и формирање во ограничувачки случај на рамнина-квадрат [ ML 4 ] z комплекси, води (сл. 28) до дополнително разделување на валентноста ( n -1) г метални орбитали.
Полнење на сплит ( n -1) г металните орбитали се јавуваат во согласност со принципите на Паули и минималната енергија. За октаедрални комплекси со d 1 , d 2 и d 3 електронската конфигурација на металот, валентни електрони, во согласност со правилото на Хун, се населуваатт 2 гр орбитали со паралелни вртења, што доведува до t 2 g 1 , t 2 g 2 и t 2 g 3 електронска структура на комплекси.
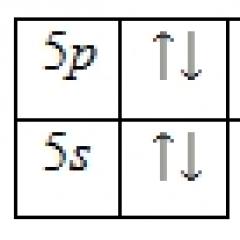
За метали со d 4 електронска конфигурација, се населуваат и три електронит 2 гр орбитали со паралелни вртења. Популацијата на четвртиот електрон зависи од енергетските трошоци за вредноста на енергијата на спин спарувањето (E sp.-sp.) за време на популацијатат 2 гр орбитали со антипаралелен спин и прекршување на правилото на Хунд, или надминување на енергијата на разделување со кристалното полеД o при пријавување на пр орбитали со паралелен спин во согласност со Хундовото правило. Во првиот случај се формира комплекс со t 2 g 4 електронска структура и намалена повеќекратност на центрифугирање во споредба со слободниот метал 2 S +1 = 3 (S - вкупен спин), наречен низок спин. Кога ќе се исполни правилото на Хунд и ќе се насели четвртиот електронна пр орбитали, се формира комплекс со t 2 g 3 e g 1 електронска структура и слободен спин мултиплет налик на метал 2С +1 = 5. Ваквите комплекси се нарекуваат високо-вртење.
Слично на тоа, кога се дистрибуира валентност d5, d6 и d7 метални електрони t 2 g и eg орбитали на октадрични комплекси во зависност од односот E sp.-sp. ИДО Можно е формирање на два вида комплекси:
На E sp.-sp. > ДО Се формираат високо-спин комплекси со електронската структура на металот t 2 g 3 e g 2 , t 2 g 4 e g 2 , t 2 g 5 e g 2 според правилото на Хунд и слободната мултипликација на спин слична на метал - 2 S +1 = 6, 5, 4;
E sp.-sp.< ДО Се формираат комплекси со низок спин со електронската структура на металот t 2 g 5 e g 0 , t 2 g 6 e g 0 , t 2 g 6 e g 1 и помала множина на центрифугирање во споредба со слободниот метал 2 S +1 = 2, 1, 2.
Метални комплекси со d 8, d 9 и d 10 електронската конфигурација се карактеризира со еден вид дистрибуција на електрони - t 2 g 6 e g 2, t 2 g 6 e g 3, t 2 g 6 e g 4 со мноштво на вртење слично на слободниот метал: 2 S +1 = 3, 2 и 0.
Значи параметаротД, карактеризирајќи го разделувањето ( n -1) г метални орбитали под влијание на електричното поле на лигандите е една од главните карактеристики на промените во својствата на комплексите во споредба со слободниот метален јон. Тоа е вредноста на параметаротДопределува за голем број електронски конфигурации на металот ја одредува можноста за формирање на високо или низок спин комплекси со различна дистрибуција на електрони над поделени орбитали и различни својства.
Вредноста на параметарот за разделување на кристално полеДзависи од природата на металот на средството за комплексирање, лигандите што го опкружуваат и нивната просторна положба околу средството за комплексирање:
1. Лиганди по редослед на зголемување на параметаротДза комплекси од ист метал и слична геометриска структура се наоѓаат во таканаречената спектрохемиска серија:јас -< Br - < Cl - < F - < OH - < C 2 O 4 2- ~ H 2 O < NCS - < NH 3 ~ En < NO 2 - < CN - < CO . На почетокот на редот има лиганди на „слабо поле“ - халидни јони, јони на хидроксид и оксалат, вода, кои формираат претежно комплекси со висок спин. Лигандите од десната страна на серијата: јаглерод моноксид, цијанид и нитритни јони се нарекуваат лиганди на „високо поле“ и обично се карактеризираат со формирање на комплекси со низок спин. За лиганди во средината на серијата - тиоцијанат јон, амонијак, етилендиамин, во зависност од природата на металот, се формираат комплекси со висок или низок спин.
2. Зголемување на ефикасноста на електричното поле на лиганди наг метални орбитали со зголемување на нивната големина во редот 3г<< 4 d < 5 d , како и зголемувањето на степенот на оксидација на металот доведува до зголемување на параметаротДво серијата: Mn(II)< Ni (II ) < Co (II ) < Fe (II ) < V (II ) < Fe (III ) < Co (III ) < Mn (IV ) < Mo (III ) < Rh (III ) < Ru (III ) < Pd (IV ) < Ir (III ) < Pt (IV ).
3. Параметар Дза тетраедарски комплекси е само 4/9 од параметаротДоктаедрални комплекси.
„Тешки“ комплекси 4г и 5 г металите, речиси без оглед на природата на лигандите, формираат претежно комплекси со низок спин, додека формирањето на комплекси со низок или висок спин е „лесно“ 3г метали главно се определува со јачината на полето на лигандот.
За разлика од MMS, теоријата на кристално поле за оправдување на разликата во магнетните својства на комплексите на ист метален јон со различни средини на лиганди, на пример, дијамагнетна [ Fe (CN ) 6 ] 4- и парамагнетна [ Fe (H2O ) 6 ] 2+ не ја користи хипотезата за нивната интраорбитална ( d 2 sp 3 хибридизација) и надворешно-орбитална ( sp 3 d 2 хибридизација) структура. Разликата во магнетните својства е одредена од природата на ниско и високо-спинирање на распределбата на 6-валентните електрони Fe (II ) со разделување t 2 g и eg орбитали (сл. 29). Бидејќи се силни и слаби теренски лиганди, се формираат јони на цијанид и молекули на вода Fe (II ) комплекси со низок и висок спин со t 2 g 6 e g 0 и t 2 g 4 e g 2 дистрибуција на електрони, што го одредува дијамагнетизмот [ Fe (CN ) 6 ] 4- и парамагнетизам [ Fe (H2O ) 6 ] 2+ комплекси.
Разделување на петкратно дегенерирано ( n -1) г метални орбитали во комплекси и промени на параметритеДво зависност од природата на лигандите, ја одредува карактеристичната боја на комплексите и во цврста состојба и во раствори. Кога комплексот апсорбира електромагнетно зрачење во видливиот регион на спектарот (400-750) nm, енергијата на квантите од која е Ееднаква на вредноста Д, пренос на електрони се случува од t 2 g на пр орбитали. Неапсорбираното електромагнетно зрачење на видливиот регион на спектарот е тоа што ја одредува бојата на комплексот во согласност со „Њутновиот круг на боја“ (сл. 30), покажувајќи ги примарните и секундарните бои на видливото зрачење.
Аквакомплекс титаниум ( III) [Ti (H 2 O) 6] 3+ c t 2 g 1 e g 0 електронска дистрибуција како резултат на фотоексцитација, што одговара на преминот на електронот кон повисока енергија e g орбитали:
3+ (t 2g 1 e g 0) + чn= * 3+ (t 2g 0 e g 1)
апсорбира светлосни кванти во жолтиот регион на спектарот, што доведува до неговата виолетова боја. Промената на лигандската средина на металниот јон во согласност со положбата на лигандот во спектрохемиската серија доведува до промена на параметаротДи, како последица на ова, на промена на енергијата и брановата должина на квантите апсорбирани од комплексот и на карактеристичната боја на комплексот - на пример, во серијата [ CuCl 4 ] 2- , [ Cu (H 2 O ) 4 ] 2+ , [ Cu (NH 3 ) 4 ] 2+ бојата на комплексите се менува од зелена во сина и виолетова.
Заедно со енергијата на разделување на кристалното полеД, исто така игра важна улога во TCH енергија за стабилизација на кристално поле(ESKP) - добивка во енергија при дистрибуција на електрони меѓу оние поделени во комплексот ( n -1) г метални орбитали во споредба со енергијата на петкратно дегенерирани ( n -1) г метални орбитали во еквивалентно сферично електрично поле (сл. 31, 32).
ESCP на октадрални и тетраедрални комплекси.|
Mn+ |
Октаедрални комплекси |
Тетраедарски комплекси |
|
|
Ниско вртење |
Високо вртење |
Високо вртење |
|
|
0.4 До |
0.6 ДТ |
||
|
0.8 До |
1.2 ДТ |
||
|
1.2 До |
0.8 ДТ |
||
|
г 4 |
1.6 До |
0.6 До |
0.4 ДТ |
|
г 5 |
2.0 До |
0 До |
0 ДТ |
|
г 6 |
2.4 До |
0.4 До |
0.6 ДТ |
|
г 7 |
1.8 До |
0.8 До |
1.2 ДТ |
|
г 8 |
1.2 До |
0.8 ДТ |
|
|
г 9 |
0.6 До |
0.4 ДТ |
|
|
г 10 |
0 До |
||
Проценка на вредноста EXP на комплексот се добива врз основа на дијаграми за разделување ( n -1) г метални орбитали во електричното поле на лиганди, кои покажуваат намалување или зголемување на енергијата на системот во споредба со сферичното електрично поле кога електроните се населуваат се делат ( n -1) г орбитали. За октаедарски [ ML 6] z комплекси (сл. 32) популација на секој електронт 2 гр орбиталите доведува до зголемување на енергијата на системот за 0,4До, пријавување на пр бара трошење на енергија 0.6ДО . За тетраедарски [ ML 4 ] z комплекси со спротивни енергетски позициие и т метални орбитали - окупација на секој електрон со поделбае и т орбиталите е придружена со намалување и зголемување на енергијата на системот за 0,6Дт и 0,4 ДТ.
Како одраз на термодинамичката стабилност на комплексите, проценките на нивните ESCR вредности се конзистентни со експерименталните податоци за промените во енергијата на кристалната решетка за комплекси хексафлуорид со висок спин 3г метали (сл. 33).
Вредностите на ESC ни овозможуваат да го одредиме најпреферираниот координациски изомер (сл. 34), на пример [ Cu (NH 3 ) 6 ][ NiCl 4 ] или [ Ni (NH 3 ) 6 ][ CuCl 4 ]. За да го направите ова, пресметајте ја разликата во ESC за комплексниот катјон и анјонот на изомерите. ESCR вредност [ Cu (NH 3 ) 6 ] 2+ и [NiCl 4 ] 2- е 0,6 Д o и 0,8 ДТ соодветно. Со оглед на тоаД t = 4/9 До , разликата помеѓу вредностите на ESCP [ Cu (NH 3 ) 6 ] 2+ и [NiCl 4 ] 2- ќе биде 19/45До . Слично на тоа, вредностите на ESKP [ Ni (NH 3 ) 6 ] 2+ и [CuCl 4 ] 2- е 1,2 Д o и 0.4 ДТ , а разликата меѓу нив е 28/45До . Голема разлика ESCP комплексен катјон [ Ni (NH 3 ) 6 ] 2+ и анјонот [CuCl 4 ] 2- во споредба со [ Cu (NH 3 ) 6 ] 2+ и [NiCl 4 ] 2- покажува попожелно формирање на изомерот на составот [ Ni (NH 3 ) 6 ][ CuCl 4 ].
Заедно со магнетните и оптичките својства на влијанието на електронската структура на металот врз термодинамичката стабилност на комплексите, ТКП предвидува изобличување на геометриската структура на комплексите со нерамномерна распределба на електроните над поделбата ( n -1) г метални орбитали (сл. 35). За разлика од редовната октаедрална структура [ Co (CN) 6 ] 3- s t 2 g 6 e g 0 електронска дистрибуција, тетрагонална дисторзија на сличен комплекс [ Cu (CN) 6 ] 4- s t 2 g 6 e g 3 електронска дистрибуција која содржи 3 електрони на 2-кратно дегенериранона пр орбитали, доведува до ефективна трансформација на октаедарот во квадратно-рамнински комплекс:
4- = 2- + 2CN - .
Сето горенаведено покажува дека релативната едноставност и широките способности на TCT за објаснување и предвидување на физичко-хемиските својства на комплексите ја одредуваат големата популарност на овој модел за опишување хемиски врски во сложени соединенија. Во исто време, фокусирајќи се на промените во електронската структура на металот за време на формирањето на комплексот, TCP не ја зема предвид електронската структура на лигандите, сметајќи ги како точки негативни полнежи или диполи. Ова води до голем број ограничувања на TCP кога се опишува електронската структура на комплексите. На пример, во рамките на TCP, тешко е да се објасни позицијата на одреден број лиганди и метали во спектрохемиските серии, што е поврзано со одреден степен на коваленција и можност за формирање на повеќе врски метал-лиганд. Овие ограничувања се елиминираат кога се разгледува електронската структура на сложените соединенија користејќи покомплексен и помалку визуелен метод на молекуларни орбитали.
Теорија на валентната врска беше првата од квантните механички теории што се користат за приближно објаснување на природата на хемиските врски во сложените соединенија. Неговата примена беше заснована на идејата за механизам донатор-акцепторформирање на ковалентни врски помеѓу лигандот и комплексниот агенс. Лигандброи донаторска честичка, способен за пренос на пар електрони акцептор – средство за комплексирање, кој обезбедува бесплатни квантни клетки (атомски орбитали) од своите енергетски нивоа за формирање на врски.
За формирање на ковалентни врски помеѓу комплексниот агенс и лигандите, потребно е празното с-, стр- или г- атомските орбитали на комплексниот агенс се подложени хибридизацијаодреден тип. Хибридните орбитали заземаат одредена позиција во вселената, а нивниот број одговара на координативен бројсредство за комплексирање.
Ова често се случува комбинирање на неспарени електронисредство за комплексирање во парови, што овозможува ослободување на одреден број квантни клетки - атомски орбитали, кои потоа учествуваат во хибридизација и формирање на хемиски врски.
Осамените парови на електрони на лигандите комуницираат со хибридните орбитали на агентот за комплексирање, и се преклопуваатсоодветните орбитали на комплексниот агенс и лигандот со појава на зголемена густина на електрони во меѓунуклеарниот простор. Електронските парови на комплексниот агенс, пак, комуницираат со празните атомски орбитали на лигандот, зајакнување на врската преку дативниот механизам. Така, хемиското поврзување во сложените соединенија е вообичаено ковалентендоволна врска издржливиИ енергетски поволни.
Електронските парови лоцирани во хибридните орбитали на агентот за комплексирање имаат тенденција да заземаат позиција во просторот во која нивната меѓусебна одбивност е минимална. Ова води кон структуракомплексните јони и молекули се чини дека се во одредена зависност од тип на хибридизација.
Да го разгледаме формирањето на некои комплекси од гледна точка на теоријата на валентни врски. Како прво, забележуваме дека валентните орбитали на атомите на комплексните агенси се блиски по енергија:
Е (n- 1)г » Е ns » Е н.п. » Е nd
|
Тип на хибридизација |
Геометрија на комплексот |
||
|
линеарна |
-
|
||
|
триаголен |
- |
||
|
тетраедар |
2-
|
||
|
2-
|
|||
|
сп 3 г(z 2) |
тригонална бипирамида |
||
|
сп 3 г(x 2 - y 2) |
квадратна пирамида |
3-
|
|
|
сп 3 г 2 , |
3+ |
||
|
сп 3 г 3 |
пентагонална бипирамида |
4-
|
На пример, катјонот 2+ го вклучува комплексниот агенс цинк (II). Електронската обвивка на овој конвенционален јон ја има формулата 3 г 10 4с 0 4стр 0 и може конвенционално да се прикаже на следниов начин:
Слободно 4 с- и 4 стр-орбиталите на атомот на цинк(II) формираат четири сп 3-хибридни орбитали ориентирани кон темињата на тетраедарот.
Секоја молекула на амонијак има осамен пар електрони на атомот на азот. Орбиталите на азотни атоми кои содржат поединечни парови електрони се преклопуваат со сп 3-хибридни орбитали на цинк(II), кои формираат тетраедрален комплекс катјон на тетраамин цинк(II) 2+:
Бидејќи јонот 2+ нема неспарени електрони, тој покажува дијамагнетнисвојства.
Тетрахлороманганат (II) јон 2- содржи пет неспарени електрони на 3 г-орбитали и празни 4 с- и 4 стр-орбитали. Се формираат празни орбитали сп 3-хибридни орбитали кои се преклопуваат со стр-атомски орбитали на хлоридни јони: 
Така добиениот тетраедарски јон 2- е парамагнетни, бидејќи содржи пет неспарени електрони.
Користење на конвенционален алгоритам за предвидување тип на хибридизација на атомски орбиталиво рамките на методот на валентна врска може да се определи геометрија на комплексисо различен состав. За да го направите ова, пред сè, неопходно е да се напише електронската формула за нивото на валентност и да се изгради дијаграм на дистрибуција на електрони над квантните ќелии. На пример, за неутрален атом на никел:

Транзиција 4 с-електрони за 3 г-преобразува подниво парамагнетниНи атом 0 инчи дијамагнетничестички Ni*: 
Добиените празни орбитали се подложени на хибридизација, формирајќи тетраедрална конфигурација. Така изграден тетраедарски дијамагнетникомплекс на тетракарбонилникел (CN = 4), кој се карактеризира со значителна стабилност.
Ако комплексниот агенс е никел(II) со електронска конфигурација 3 г 8 4с 0 4стр 0, потоа потребата да се преместат електроните од 4 с-поднивото пред да исчезне хибридизацијата, бидејќи има доволен број празни орбитали за да се реализира координацискиот број 4: 
Оваа структура има нестабилна парамагнетнитетрабромониколат(II)-јон 2- комплекс. Меѓутоа, кога се комбинираат два електрони 3 г-поднивото во пар и трансформацијата на една од квантните ќелии од ова подниво во празно ги менува и видот на хибридизација и карактеристиките на добиениот комплекс: 
Тип на хибридизација dsp 2 и рамнината квадратна форма на комплексот се реализираат при формирање на штала дијамагнетникомплекс тетрацијаноколат (II)-јон 2- (CN = 4): 
Ако синтезата на комплексот цијанид се изведува во услови на вишок лиганд, може да се реализира координативен број од 5: 
Стабилно дијамагнетникомплексот пентацијаноколат(II)-јон 3- има форма на квадратна пирамида: 
Октаедрален никел(II) 2+ комплекс, иако парамагнетни, но доста стабилна. Неговото образование се должи сп 3 г 2 -хибридизација на атомските орбитали на никел: 
Ако атомските орбитали на надворешниот г-подниво, сложено, по правило, во голема мера парамагнетнии се нарекува надворешно-орбиталнаили високо-вртење. Структурата на таквите комплекси може да одговара на типот на хибридизација, на пример, сп 3 г 2 .
Такви комплекси, при чие формирање се одвива хибридизација со учество на атомски орбитали на надворешниот г-поднивоа се нарекуваат интра-орбиталенили низок спини, по правило, дијамагнетниили слабо парамагнетна(сите или скоро сите електрони на средството за комплексирање се спарени, а типот на хибридизација, на пр. г 2 сп 3 или dsp 2).
При испитување на железни (II) комплекси, се наоѓаат и надворешни орбитални и интраорбитални комплекси.


Дијаграмот подолу покажува како тие се формираат парамагнетно високо-вртењехексафлуороферат (II)-јон 4- и дијамагнетно ниско-вртењехексацијаноферат (II) јон 4-.
Самата теорија на валентни врски не одговара на прашањето каков тип на комплекс се формира во секој конкретен случај, бидејќи овој метод не го зема предвид влијанието на природата на лигандот. Затоа, методот на валентна врска мора нужно да биде дополнет со податоци за магнетните својства на комплексот или информации за влијанието на лигандот врз природата на формираниот комплекс.
.Теорија на кристално поле ја замени теоријата на валентни врски во 40-тите години на XX век. Во својата чиста форма, моментално не се користи, бидејќи не може да го објасни формирањето на ковалентни врски во сложените соединенија и не ја зема предвид вистинската состојба на лигандите (на пример, нивните вистински големини) дури и во случај на блиски интеракции до чисто електростатско.
Веќе во средината на 50-тите години, поедноставената теорија на кристално поле беше заменета со подобрена теорија на поле на лиганд, земајќи ја предвид ковалентната природа на хемиските врски помеѓу комплексниот агенс и лигандот.
Сепак, најопштиот пристап за објаснување на формирањето на сложени соединенија е даден со молекуларна орбитална теорија(МО), кој моментално преовладува над сите други. Молекуларната орбитална метода обезбедува и чисто електростатско заемодејство во отсуство на преклопувачки атомски орбитали, и целиот сет на средни степени на преклопување.
Ајде да ги погледнеме основните концепти теорија на кристално поле, која, како и теоријата за валентни врски, сè уште ја задржува својата важност за квалитативниот опис на хемиските врски во сложените соединенија поради големата едноставност и јасност.
Во теоријата на кристално поле, се разгледува хемиската врска помеѓу комплексниот агенс и лигандот електростатско. Според оваа теорија, лигандите се наоѓаат околу комплексниот агенс на темињата на правилните полиедри ( полиедра) како точка трошоци. Теоријата не го зема предвид вистинскиот волумен на лигандот.
Лигандите, како точките полнежи, создаваат околу комплексниот агенс електростатско поле(„кристално поле“, ако земеме во предвид кристал од сложено соединение, или лигандско поле), во која енергетските нивоа на средството за комплексирање и, пред сè, г-поднивоа се разделуваат, и нивната енергија се менува. Природата на разделувањето, енергијата на новите нивоа на енергија зависи од симетријараспоред на лиганди (октаедарско, тетраедрално или друго кристално поле). Кога молекулите H 2 O, NH 3 , CO и други се координирани како лиганди, тие се сметаат како диполи, ориентирана со негативен полнеж кон комплексниот агенс.
Да го разгледаме случајот со октаедрално распоредување на лиганди (на пример, 3- или 3+). Во центарот на октаедарот има комплексен атом M(+n) со вклучени електрони г-атомски орбитали, а на нејзините темиња има лиганди во форма на точкести негативни полнежи (на пример, F - јони или поларни молекули како NH 3). Во конвенционален јон M(+n) кој не е поврзан со лиганди, енергиите на сите пет г-АО се исти (т.е. атомски орбитали дегенерира).
Меѓутоа, во октаедралното поле на лиганди г-АО на комплексниот агенс паѓаат во нееднаковпозиција. Атомски орбитали г(z 2) и г(x 2 -
y 2), издолжени по координатните оски, се најблиску до лигандите. Помеѓу овие орбитали и лигандите лоцирани на темињата на октаедарот, се јавуваат значителни разлики одбивни сили, што доведува до зголемување на орбиталната енергија. Со други зборови, овие атомски орбитали се предмет на максимална изложеност на полето на лигандот. Силно компресирана пружина може да послужи како физички модел на таквата интеракција. 

Други три г-АО - г(xy), г(xz) И г(yz), лоцирани помеѓу координатните оски и меѓу лигандите, се на поголемо растојание од нив. Интеракцијата на таквите г-АО со лиганди е минимална, а со тоа и енергија г(xy), г(xz) И г(yz)-АО се намалува во однос на оригиналниот. 

Така, петкратно дегенерира г-АО комплексирачки агенс, влегување во октаедрално лигандско поле, изложени разделувањево две групи на нови орбитали - тројно дегенерирани орбиталисо помала енергија, г(xy), г(xz) И г(yz), И двојно дегенерирани орбиталисо поголема енергија г(z 2) и г(x 2 -
y 2). Овие нови групи г-орбитали со понискоИ повисока енергијаозначуваат ге и г g: 
Разлика во енергијатадве нови поднивоа ге и г g го доби името параметар за разделување D0:
Е 2 – Е 1 = D0
Локација на две нови енергетски поднивоа ге и г g во однос на оригиналот ( г-АО) на енергетскиот дијаграм асиметрични:
(Е 2 – Е 0) > (Е 0 – Е 1).
Квантна механичка теоријатоа го бара кога новите нивоа на енергија се целосно населени со електрони, вкупната енергија останува непроменета, т.е. таа треба да остане еднаква на Е 0 .
Со други зборови, еднаквоста мора да биде исполнета
4(Е 2 – Е 0) = 6(Е 0 – Е 1),
каде 4 и 6 - максимумброј на електрони по г g - и ге -АО. Од оваа еднаквост произлегува дека
(Е 2 – Е 0) / (Е 0 – Е 1) = 3/2 и
(Е 2 – Е 1) / (Е 0 – Е 1 >) = 5/2, или
D0/( Е 0 – Е 1) = 5/2, од каде ( Е 0 – Е 1) = 2/5 ´ D 0 >. Поставување на секој електрон од максималните шест можни на ге-орбитали предизвикува намалување (добивки) енергијаза 2/5 D 0 . Напротив, поставувањето на секој електрон од четири можни на г g орбитали предизвикуваат зголемување (трошок) енергијаза 3/5 D 0 . Ако е населено со електрони ге - и г g -орбитали целосно, тогаш не победувајќиенергија нема(исто како што нема дополнителна потрошувачка на енергија): 4 ´ 3/5 ´ D 0 - 6 ´ 2/5 ´ D 0 = 0. Но, ако оригиналот г-АО е само населено делумнои содржи од 1 до 6 електрони, а овие електрони се поставени само на г e -AO, тогаш добиваме значителна енергетска добивка. Специфичноста на секој лиганд влијае на полето што го создава овој лиганд - силнаили слаб. Како посилно полелиганди отколку повеќезначење параметар за разделување D0. Проучувањето на параметарот на разделување обично се заснова на спектроскопскиистражување. Бранови должини ленти за апсорпцијакомплекси l во кристална состојба или во раствор, поради преминот на електроните од ге - вклучено г g-AO, поврзан со параметар за разделување D 0 како што следува: n = 1/l; Д каде е Планковата константа чеднакво на 6.626 ´ 10 - 34 J. s; Параметар за разделување, покрај типот на лигандот зависи на степенот на оксидацијаИ природатасредство за комплексирање. На зголемување на нуклеарното полнењена атомот што формира комплекс D 0 исто така се зголемува. Хексаминиридиум (III) 3+, хексаамминиридиум (III) 3+ и хексаамминиридиум (III) 3+ катјони ( З= 27, 45 и 77) се карактеризираат со параметри на разделување еднакви на 22900, 34100 и 41000 cm -1. Зависноста на D0 од природата на лигандите е поразновидна. Како резултат на проучувањето на бројни сложени соединенија, беше откриено дека во однос на нивната способност да го зголемат параметарот на расцепување на комплексните метали лоцирани во нивните вообичаени состојби на оксидација, најчестите лиганди може да се подредат на следново спектрохемиски серии, по кој вредноста на D 0 монотоно се зголемува: Така, најсилното електростатско поле околу комплексниот агенс и најсилното расцепување г-АО е предизвикана од NO 2 - лиганди, CN -
и CO. Да ја разгледаме распределбата на електроните над ге - и г g-орбитали во октаедралното поле на лигандите. Пријавување ге - и г g-орбиталите се јавува во целосна согласност со Хундовото правилоИ Паули принцип. Во овој случај, без оглед на вредноста на параметарот за разделување, првите три електрони се окупирани од квантни ќелии ге-подниво: Ако бројот на електрони по г- има повеќе од три поднивоа на комплексниот агенс, постојат две можности за нивно поставување на поделени поднивоа. При ниска вредност на параметарот на разделување (слабо поле на лигандите), електроните ја надминуваат енергетската бариера што ја одвојува ге - и г g-орбитали; четвртиот, а потоа и петтиот електрони ги населуваат квантните ќелии г g-подниво. Со силно лигандско поле и висока вредност D0, населението е населено со четвртиот и петтиот електрон г g-подниво исклучено; пополнување во тек ге-орбитали. На слаби полиња лигандинаселувајќи ги квантните ќелии со 4 или 5 електрони паралелни вртења, така што добиениот комплекс се покажува силно парамагнетни. Во силно лигандско полееден, а потоа се формираат два електронски парови на ге -подниво, така парамагнетизамкомплексот се покажува многу послаб. Шестиот, седмиот и осмиот електрони во случај на слабо поле завршуваат назад ге-подниво, надополнувајќи ги конфигурациите на електронски парови (еден во случајот г 6, два - г 7 и три - г 8): Во случај на силно лигандско поле, шестиот електрон се населува г e -AO, што доведува до дијамагнетизамкомплекс, по што одат седмиот и осмиот електрон г g-подниво: Очигледно, со конфигурација од осум електрони разлики во структуратапомеѓу комплекси со лиганди слабИ силните полиња исчезнуваат. Окупацијата на орбиталите од деветтиот и десеттиот електрон, исто така, не се разликува за комплексите од двата типа: Да се вратиме на разгледувањето на електронската структура на октаедралните комплексни јони 3+ и 3-. Според локацијата во спектрохемиски серии, амонијак NH 3 е еден од лигандите силно поле
и флуорид јон F - - слабо поле
. Следствено, окупацијата на атомските орбитали од електрони во овие комплекси ќе се случи според следнава шема: Во 3- анјон, F- лигандите создаваат слабо кристално поле (D 0 = 13000 cm - 1), а сите електрони од оригиналот 3 г 6 -АД се наоѓаат на ге - и г g орбитали без никакво спарување. Комплексен јон е високо-вртењеи содржи четири неспарени електрони, па затоа парамагнетни. Во јонот 3+, лигандите NH 3 создаваат силно кристално поле (D 0 = 22900 cm - 1), сите 3 г 6 -електрони се ставаат на енергетски поповолна ге-орбитали. Пренос на електрони од ге - вклучено г g-орбитали невозможнозатоа што исто така висока енергетска бариера. Затоа, овој комплексен катјон е низок спин, не содржи неспарени електрони и дијамагнетни. На сличен начин, може да се претстават шеми за дистрибуција на електрони преку орбитали во октаедрално поле за 2+ и 4- јони: Лигандите H 2 O создаваат слабо поле; размена на електрони помеѓу ге - и г g-орбиталите не предизвикува никакви тешкотии и затоа бројот на неспарени електрони во сложениот јон е ист како кај конвенционалниот јон Fe + II. Добиениот аква комплекс е високо-спин, парамагнетни. Многу сложени соединенија во кристална состојба и воден раствор се светло обоени. Така, воден раствор кој содржи 2+ катјони е обоен интензивно сино, 3+ катјони му даваат на растворот виолетова боја, а 2+ катјони му даваат црвена боја. Теоријата на кристално поле овозможува да се објасни појавата на една или друга боја во сложените соединенија. Ако светлината помине низ раствор или кристален примерок од супстанција видлив дел од спектарот, тогаш, во принцип, можни се три опции за физичкото однесување на примерокот: нема апсорпција на светлинакоја било бранова должина (примерок од супстанција безбоен, иако може да има апсорпциони ленти во ултравиолетовиот регион на спектарот); целосна апсорпција на светлинаниз целиот опсег на бранова должина (примерокот ќе се појави црна); конечно, апсорпција на светлинасамо одредена бранова должина(тогаш примерокот ќе има боја комплементарна на апсорбиранатесен дел од спектарот). Така, се одредува бојата на растворот или кристалите фреквенција на апсорпциони лентивидлива светлина: Апсорпцијата на светлосни кванти од комплекси (на пример, оние со октаедрална структура) се објаснува со интеракцијата на светлината со електроните лоцирани на ге-подниво, придружено со нивна транзиција кон празни орбитали г g-подниво. На пример, при поминување на светлината низ воден раствор кој содржи хексакватитаниум(III) 3+ катјони, се открива лента за апсорпција на светлина во жолто-зелената област на спектарот (20300 cm - 1, l »500 nm). Ова се должи на транзицијата на единствениот електрон на комплексниот агенс од ге-АО вклучен г g-подниво: Затоа, растворот што содржи 3+ добива виолетова боја (покрај апсорбираната жолто-зелена). Растворот на ванадиумова сол Cl 3 е зелен. Ова се должи и на соодветните транзиции на електроните кога тие апсорбираат дел од енергијата на светлосниот зрак. Во основната состојба, со електронска конфигурација на ванадиум(III) 3 г 2, два неспарени електрони се зафатени ге-подниво: Има само две опции за премин на два електронина г g -подниво: или и дветеелектроните се зафатени г g -AO, или само еденод нив. Сите други транзиции на електрони поврзани со намалување на вкупниот спин се забранети. Ако средството за комплексирање има електронска конфигурација г 0 или г 10 тогаш електронски транзицииСо ге - вклучено г g -подниво или обратно невозможнобило затоа што отсуство на електрони, било затоа што отсуство на празни орбитали. Затоа, растворите на комплекси со такви комплексни агенси како Sc(III), Cu(I), Zn(II), Cd(II) итн., не апсорбираат енергија во видливиот дел од спектарот и се појавуваат безбоен: Селективноста на апсорпцијата на светлина не зависи само од средство за комплексирањеИ неговата оксидациона состојба, но и од тип на лиганди. При замена на лиганди од левата страна на спектрохемиската серија во сложено соединение со лиганди кои создаваат силназабележано електростатско поле зголемувањеделот од енергијата што ја апсорбираат електроните од пренесената светлина и, како последица на тоа, намалувањебранова должина на соодветната апсорпциона лента. Така, воден раствор кој содржи тетрааквабакар(II) 2+ катјони е сино, а растворот од тетраамин бакар (II) 2+ сулфат е интензивно сино. ________________________ Повторете: >>> Апликации
Енергетска добивка поради приоритетно порамнувањеелектрони гсе нарекуваат е-атомски орбитали енергија на стабилизација на комплексот со лигандното поле.
брзина на светлината Со
= 3 ´ 10 10 cm/s.
Единица D 0 е иста како онаа на бранот број n: cm - 1, што приближно одговара на 12 J/mol.
Кај сложените соединенија кои вклучуваат комплексни агенси од истиот период и во иста оксидациска состојба, со исти лиганди, параметарот на расцепување е приближно ист. Со зголемување на степенот на оксидација на средството за комплексирање, вредноста на D 0 се зголемува. Така, за аква комплекси 2+ и 2+, вредноста на параметарот на разделување е 7800 и 10400 cm - 1, а за 3+ и 3+ - 13700 и 21000 cm - 1, соодветно.
I-Br -Кл - » NCS - БР 3 -Ф -Ох - H2O » H - NH 3 НЕ 2 -CN - "НЕ" CO. 









Спротивно на тоа, CN - лигандите предизвикуваат значително расцепување г-АО, во износ од 33000 cm - 1. Ова значи дека постои силна тенденција за алоцирање на сите електронина ге-орбитали. Добивка на енергија, добиена со таква популација на орбитали, е многу поголема од трошоците за енергија поради спарувањето на електроните.


Наведените транзиции на електрони кои примиле вишок енергија одговараат на лента за апсорпцијаоколу 400 nm во апсорпциониот спектар на раствор од хексакваванадиум (III) хлорид. Апсорпцијата на виолетово-виолетовиот регион на спектарот му дава дополнителна боја на растворот - светло зелена.

И Џон Ван Влек да ги опише пониските состојби на катјоните на преодните метали опкружени со лиганди - и анјони и неутрални молекули. Теоријата на кристално поле беше дополнително комбинирана [и рафинирана] со (делокализирана) молекуларна орбитална теорија во поопшта теорија која ја зема предвид делумната ковалентност на врската метал-лиганд во координативните соединенија.
Теоријата на кристално поле овозможува да се предвидат или интерпретираат спектрите на оптичка апсорпција и спектрите на електронска парамагнетна резонанца на кристалите и сложените соединенија, како и енталпиите на хидратација и стабилност во растворите на комплекси на преодни метали.
Преглед на теоријата на кристално поле[ | ]
Според TCP, интеракцијата помеѓу преодниот метал и лигандите произлегува од привлечноста помеѓу позитивно наелектризираниот метален катјон и негативниот полнеж на електроните во неврзувачките орбитали на лигандот. Теоријата смета дека промената на енергијата на пет е дегенерирана г-орбитали опкружени со точки полнежи на лиганди. Како што лигандот се приближува до металниот јон, електроните на лигандот стануваат поблиски до некои г-орбитали од другите, предизвикувајќи губење на дегенерација. Електрони г-орбиталите и лигандите се одбиваат меѓу себе како полнежи со ист знак. Така, енергијата на оние г-Електроните кои се поблиску до лигандите стануваат повисоки од оние што се подалеку, што доведува до поделба на нивоата на енергија г-орбитали.
Следниве фактори влијаат на разделувањето:
- Природата на металниот јон.
- Степенот на оксидација на металот. Колку е поголема состојбата на оксидација, толку е поголема енергијата на расцепување.
- Распоред на лиганди околу метален јон.
- Природата на лигандите кои го опкружуваат металниот јон. Колку е посилен ефектот на лигандите, толку е поголема разликата помеѓу високото и ниското ниво на енергија.
Најчестиот тип на координација на лиганди е октаедрала, во кој шест лиганди создаваат кристално поле со октаедрална симетрија околу металниот јон. Во октаедралната средина на метален јон со еден електрон во надворешната обвивка, d-орбиталите се поделени во две групи со разлика во енергетските нивоа Δ окт ( енергија на фисија), додека енергијата на орбиталите dxy, dxzИ d yzќе биде помал од г z 2 и г x 2 -y 2, бидејќи орбиталите од првата група се наоѓаат подалеку од лигандите и доживуваат помала одбивност. Трите орбитали со ниска енергија се означени како t 2 g, и две со високо - како на пр.
Следни најчести се тетраедарскикомплекси во кои четири лиганди формираат тетраедар околу метален јон. Во овој случај г-орбиталите исто така се поделени во две групи со разлика во енергетските нивоа Δ tetr. За разлика од октаедралната координација, орбиталите ќе имаат мала енергија г z 2 и г x 2 -y 2, и високо - г xy , г xzИ г yz. Покрај тоа, бидејќи електроните на лигандите не се директно во насока г-орбитали, енергијата на разделување ќе биде помала отколку со октаедрална координација. Користејќи TCP, можете исто така да опишете плано-квадрати други геометрии на комплекси.
Разликата во енергетските нивоа Δ помеѓу две или повеќе групи орбитали зависи и од природата на лигандите. Некои лиганди предизвикуваат помалку расцепување од другите, чии причини се објаснети. Спектрохемиски серии- експериментално добиена листа на лиганди, подредена во растечки редослед Δ:
Состојбата на оксидација на металот исто така влијае на Δ. Метал со повисока состојба на оксидација ги привлекува лигандите поблиску поради поголемата разлика во полнежот. Лигандите поблиску до металниот јон предизвикуваат поголемо расцепување.
Комплекси со низок и висок спин[ | ]
Лиганди кои предизвикуваат големо расцепување г-нивоата, како што се CN- и CO, се нарекуваат лиганди силно поле. Во комплексите со такви лиганди, неповолно е електроните да заземаат високоенергетски орбитали. Следствено, орбиталите со ниска енергија се целосно пополнети пред орбиталите со висока енергија да почнат да се полнат. Таквите комплекси се нарекуваат низок спин. На пример, NO 2 - е лиганд со високо поле кој предизвикува големо разделување. Сите 5 г-електроните на октаедралниот јон 3− ќе се наоѓаат на пониско ниво т 2е .
Спротивно на тоа, лигандите кои предизвикуваат мало расцепување, како што се I- и Br-, се нарекуваат лиганди слабо поле. Во овој случај, полесно е да се постават електрони во високоенергетски орбитали отколку да се постават два електрони во иста орбитала со ниска енергија, бидејќи два електрони во иста орбитала се одбиваат еден со друг, а енергетската цена за поставување на втор електрон во орбиталата е повисоко од Δ. Така, пред да се појават спарените електрони, во секоја од петте г-орбиталите мора да бидат поставени еден по еден електрон во согласност со правилото на Хунд. Таквите комплекси се нарекуваат високо-вртење. На пример, Br− е лиганд со слабо поле што предизвикува мало расцепување. Сите 5 г-орбитали на 3- јонот, кој исто така има 5 г-електроните ќе бидат окупирани од еден електрон.
Енергијата на разделување за тетраедарските комплекси Δ tetr е приближно еднаква на 4/9Δ окт (за истиот метал и лиганди). Како резултат на тоа, разликата во нивото на енергија г-орбиталите обично се под енергијата на спарувањето на електроните, а тетраедарските комплекси обично се со висок спин.
Дијаграми за дистрибуција г-електроните овозможуваат предвидување на магнетните својства на координационите соединенија. Комплексите со неспарени електрони се парамагнетни и се привлечени од магнетно поле, додека комплексите без се дијамагнетни и слабо се одбиваат.
Енергија на стабилизација на кристално поле[ | ]
Енергијата за стабилизација на кристално поле (CFE) е енергијата на електронската конфигурација на јон на преодниот метал во однос на просечната енергија на орбиталите. Стабилизацијата се јавува поради фактот што во полето на лигандот нивото на енергија на некои орбитали е пониско отколку во хипотетичко сферично поле, во кое сите пет г-орбиталите имаат иста одбивна сила, и сите г-орбиталите се дегенерирани. На пример, во октаедралниот случај нивото t 2 gпониско од просечното ниво во сферично поле. Следствено, ако овие орбитали содржат електрони, тогаш металниот јон е постабилен во полето на лигандот во однос на сферичното поле. Напротив, нивото на енергија на орбиталите на прнад просекот, а електроните содржани во нив ја намалуваат стабилизацијата.
Енергија на стабилизација со октаедрално поле
Постојат три орбитали во октаедрално поле t 2 gстабилизиран во однос на просечното енергетско ниво за 2/5 Δ октава, а двете орбитали на прдестабилизиран за 3/5 Δ окт. Погоре беа примери на две електронски конфигурации г 5 . Во првиот пример, постои комплекс со низок спин 3- со пет електрони внатре t 2 g. Неговиот ESP е 5 × 2 / 5 Δ окт = 2Δ окт. Во вториот пример, комплекс со висок спин 3− со ESKP (3 × 2 / 5 Δ окт) − (2 × 3 / 5 Δ окт) = 0. Во овој случај, стабилизирачкиот ефект на електроните во орбиталите на ниско ниво се неутрализира со дестабилизирачкиот ефект на електроните во орбиталите на високо ниво.
Дијаграми на разделување на d-ниво со кристално поле[ | ]
| октаедрала | пентагонално-бипирамидални | квадратно-антипризматичен |
|---|---|---|
Теорија на кристално полеја замени теоријата на валентни врски во 40-тите години на XX век. Во својата чиста форма, моментално не се користи, бидејќи не може да го објасни формирањето на ковалентни врски во сложените соединенија и не ја зема предвид вистинската состојба на лигандите (на пример, нивните вистински големини) дури и во случај на блиски интеракции до чисто електростатско.
Веќе во средината на 50-тите години, поедноставената теорија на кристално поле беше заменета со подобрена теорија на поле на лиганд, земајќи ја предвид ковалентната природа на хемиските врски помеѓу комплексниот агенс и лигандот.
Сепак, најопштиот пристап за објаснување на формирањето на сложени соединенија е даден со молекуларна орбитална теорија(МО), кој моментално преовладува над сите други. Молекуларната орбитална метода обезбедува и чисто електростатско заемодејство во отсуство на преклопувачки атомски орбитали, и целиот сет на средни степени на преклопување.
Ајде да ги погледнеме основните концепти теорија на кристално поле, која, како и теоријата за валентни врски, сè уште ја задржува својата важност за квалитативниот опис на хемиските врски во сложените соединенија поради големата едноставност и јасност.
Во теоријата на кристално поле, се разгледува хемиската врска помеѓу комплексниот агенс и лигандот електростатско. Според оваа теорија, лигандите се наоѓаат околу комплексниот агенс на темињата на правилните полиедри ( полиедра) како точка трошоци. Теоријата не го зема предвид вистинскиот волумен на лигандот.
Лигандите, како точките полнежи, создаваат околу комплексниот агенс електростатско поле(„кристално поле“, ако земеме во предвид кристал од сложено соединение, или лигандско поле), во која енергетските нивоа на средството за комплексирање и, пред сè, г-поднивоа се разделуваат, и нивната енергија се менува. Природата на разделувањето, енергијата на новите нивоа на енергија зависи од симетријараспоред на лиганди (октаедарско, тетраедрално или друго кристално поле). Кога молекулите H 2 O, NH 3 , CO и други се координирани како лиганди, тие се сметаат како диполи, ориентирана со негативен полнеж кон комплексниот агенс.
Размислете за случајот на октаедрален распоред на лиганди (на пример, -3 или 3+). Во центарот на октаедарот има комплексен јон M(+ n) со електрони на г-атомски орбитали, а на нејзините темиња има лиганди во форма на точкести негативни полнежи (на пример, F - јони или поларни молекули како NH 3). Во конвенционален јон M(+ n), кој не е поврзан со лиганди, енергиите на сите пет г-АО се исти (т.е. атомски орбитали дегенерира).
Меѓутоа, во октаедралното поле на лиганди г-АО на комплексниот агенс паѓаат во нееднаковпозиција. Атомски орбитали г(z 2) и d(x 2 -y 2), издолжени по координатните оски, се најблиску до лигандите. Помеѓу овие орбитали и лигандите лоцирани на темињата на октаедарот, се јавуваат значителни разлики одбивни сили, што доведува до зголемување на орбиталната енергија. Со други зборови, овие атомски орбитали се предмет на максимална изложеност на полето на лигандот. Силно компресирана пружина може да послужи како физички модел на таквата интеракција.
Други три г-АО - г(xy), г(xz) И г(yz), лоцирани помеѓу координатните оски и меѓу лигандите, се на поголемо растојание од нив. Интеракцијата на таквите г-АО со лиганди е минимална, а со тоа и енергија г(xy), г(xz) И г(yz)-АО се намалува во однос на оригиналниот.
Така, петкратно дегенерира г-АО комплексирачки агенс, влегување во октаедрално лигандско поле, изложени разделувањево две групи на нови орбитали - тројно дегенерирани орбиталисо помала енергија, г(xy), г(xz) И г(yz), И двојно дегенерирани орбиталисо поголема енергија г(z 2) и d(x 2 -y 2). Овие нови групи г-орбитали со понискоИ повисока енергијаозначуваат гε и гγ:
г(z 2) и d(x 2 -y 2)
г(xy), г(xz),г(yz)
Разлика во енергијатадве нови поднивоа гε и гγ беше именуван параметар за разделување Δ 0:
Е 2 – Е 1 = Δ 0 ≈ 0
Локација на две нови енергетски поднивоа гε и гγ во однос на оригиналот ( г-АО) на енергетскиот дијаграм асиметрични:
(Е 2 – Е 0) > (Е 0 – Е 1).
Квантна механичка теоријатоа го бара кога новите нивоа на енергија се целосно населени со електрони, вкупната енергија останува непроменета, т.е. таа треба да остане еднаква на Е 0 .
Со други зборови, еднаквоста мора да биде исполнета
4(Е 2 – Е 0) = 6(Е 0 – Е 1),
каде 4 и 6 - максимумброј на електрони по гγ- и гε-AO. Од оваа еднаквост произлегува дека
(Е 2 – Е 0) / (Е 0 – Е 1) = 3/2 и
(Е 2 – Е 1) / (Е 0 – Е 1) = 5/2, или
Δ 0 / ( Е 0 – Е 1) = 5/2, од каде ( Е 0 – Е 1) = 2/5Δ 0 .
Поставување на секој електрон од максималните шест можни на гε орбитали предизвикуваат намалување (добивки) енергијаза 2/5 Δ 0 .
Напротив, поставувањето на секој електрон од четири можни на гγ орбитали предизвикуваат зголемување (трошок) енергијаза 3/5 Δ 0 .
Ако е населено со електрони гε- и гγ-орбитали целосно, тогаш не победувајќиенергија нема(исто како што нема дополнителна потрошувачка на енергија).
Но, ако оригиналот г-АО е само населено делумнои содржи од 1 до 6 електрони, а овие електрони се поставени само на гε-AO, тогаш добиваме значителна енергетска добивка.
Енергетска добивка поради приоритетно порамнувањеелектрони гε-атомски орбитали се нарекуваат енергија на стабилизација на комплексот со лигандното поле.
Специфичноста на секој лиганд влијае на полето што го создава овој лиганд - силнаили слаб. Како посилно полелиганди отколку повеќезначење параметар за разделување Δ 0 .
Проучувањето на параметарот на разделување обично се заснова на спектроскопскиистражување. Бранови должини ленти за апсорпцијакомплекси во кристална состојба или во раствор, поради пренос на електрони од гε- на гγ-AO, поврзан со параметар за разделувањеΔ 0 како што следува:
λ = в / ν; Δ 0 = Е 2 – Е 1 = ч ν = ч · ( в / λ),
каде е Планковата константа чеднакво на 6,6260693 ∙ 10 -34 J s;
брзина на светлината Со
= 3 · 10 10 cm/s.
ЕдиницаΔ 0 е ист со бројот на бранот: cm -1, што приближно одговара на 12 J/mol. Параметар за разделување, покрај типот на лигандот зависи на степенот на оксидацијаИ природатасредство за комплексирање.
Кај сложените соединенија кои вклучуваат комплексни агенси од истиот период и во иста оксидациска состојба, со исти лиганди, параметарот на расцепување е приближно ист. Со зголемување на степенот на оксидација на средството за комплексирање, вредноста Δ 0 се зголемува. Така, за аква комплекси 2+ и 2+ вредноста на параметарот на разделување е 7800 и 10400 cm -1, а за 3+ и +3 13700 и 21000 cm -1, соодветно. На зголемување на нуклеарното полнењена атомот што формира комплекс Δ 0 исто така се зголемува. Хексаминиридиум (III) 3+, хексаамминиридиум (III) 3+ и хексаамминиридиум (III) 3+ катјони ( З= 27, 45 и 77) се карактеризираат со параметри на разделување еднакви на 22900, 34100 и 41000 cm -1.
Зависноста на Δ 0 од природата на лигандите е поразновидна. Како резултат на проучувањето на бројни сложени соединенија, беше откриено дека во однос на нивната способност да го зголемат параметарот на расцепување на комплексните метали лоцирани во нивните вообичаени состојби на оксидација, најчестите лиганди може да се подредат на следново спектрохемиски серии, по која вредноста Δ 0 монотоно се зголемува:
I > Br > Cl > NCS - ≈ NO 3 - > F - > OH - > H 2 O > H - > NH 3 > NO 2 - > CN - > NO > CO.
Така, најсилното електростатско поле околу комплексниот агенс и најсилното расцепување г-АО е предизвикан од лигандите CN-, NO и CO. Да ја разгледаме распределбата на електроните над гε- и гγ-орбитали во октаедралното поле на лигандите. Пријавување гε- и гγ-орбитали се јавува во целосна согласност со Хундовото правилоИ Паули принцип. Во овој случај, без оглед на вредноста на параметарот за разделување, првите три електрони се окупирани од квантни ќелии гε-подниво:
![]() dε
dε
Ако бројот на електрони по г- има повеќе од три поднивоа на комплексниот агенс, постојат две можности за нивно поставување на поделени поднивоа. При ниска вредност на параметарот на разделување (слабо поле на лигандите), електроните ја надминуваат енергетската бариера што ја одвојува гε- и гγ-орбитали; четвртиот, а потоа и петтиот електрони ги населуваат квантните ќелии гγ-подниво.
![]() dε
dε
Со силно лигандско поле и висока вредност Δ 0, популацијата на четвртиот и петтиот електрон гγ-поднивото е исклучено; пополнување во тек гε-орбитали.
![]() dε
dε
На слаби полиња лигандинаселувајќи ги квантните ќелии со 4 или 5 електрони паралелни вртења, така што добиениот комплекс се покажува силно парамагнетни. Во силно лигандско полееден, а потоа се формираат два електронски парови на гε-подниво, така парамагнетизамкомплексот се покажува многу послаб. Шестиот, седмиот и осмиот електрони во случај на слабо поле завршуваат назад гγ-подниво, надополнувајќи ги конфигурациите на електронски парови (еден во случајот г 6, два - г 7 и три - г 8):
![]() dε
dε
Во случај на силно лигандско поле, шестиот електрон се населува dε-АО, што води кон дијамагнетизамкомплекс, по што одат седмиот и осмиот електрон гγ-подниво:
![]() dε
dε
Очигледно, со конфигурација од осум електрони разлики во структуратапомеѓу комплекси со лиганди слабИ силните полиња исчезнуваат. Окупацијата на орбиталите од деветтиот и десеттиот електрон, исто така, не се разликува за комплексите од двата типа:
![]() dε
dε
Да се вратиме на разгледувањето на електронската структура на октаедралните комплексни јони 3+ и -3. Според локацијата во спектрохемиски серии, амонијак NH 3 е еден од лигандите силно полеи флуорид јон F - - слабо поле. Во анјонот -3, лигандовите F- создаваат слабо кристално поле (Δ 0 = 13000 cm -1), а сите електрони од оригиналната 3 г 6 -АД се наоѓаат на гε- и гγ орбитали без никакво спарување. Комплексен јон е високо-вртењеи содржи четири неспарени електрони, па затоа парамагнетни:

Во јонот 3+, лигандите NH 3 создаваат силно кристално поле (Δ 0 = 22900 cm -1), сите 3 г 6 -електрони се ставаат на енергетски поповолна гε-орбитали. Пренос на електрони од гε- на гγ орбитали невозможнозатоа што исто така висока енергетска бариера. Затоа, овој комплексен катјон е низок спин, не содржи неспарени електрони и дијамагнетни:

На сличен начин, може да се претстават шеми за дистрибуција на електрони преку орбитали во октаедрално поле за 2+ и -4 јони:


Лигандите H 2 O создаваат слабо поле; размена на електрони помеѓу гε- и гγ-орбиталите не предизвикуваат никакви тешкотии и затоа бројот на неспарени електрони во сложениот јон е ист како кај конвенционалниот јон Fe + II. Добиениот аква комплекс е високо-спин, парамагнетни.
Спротивно на тоа, CN - лигандите предизвикуваат значително расцепување г-АО, во износ од 33000 cm -1. Ова значи дека постои силна тенденција за алоцирање на сите електронина гε-орбитали. Добивка на енергија, добиена со таква популација на орбитали, е многу поголема од трошоците за енергија поради спарувањето на електроните.
Од перспектива на методот на валентна врска, хибридизацијата на валентни орбитали кои формираат врска во аква комплексот вклучува г- Надворешно подниво на AO (4 сп 3 г 2), и во низок спин - г- Внатрешно подниво на АД (3 г 2 4сп 3).
Така, во комплексите со високо вртење со лиганди со слабо поле, се јавува хибридизација со учество г-АО на надворешното подниво и низок спин со лиганди на високо поле - г- АД на внатрешно подниво. Бројот на неспарени електрони во комплексот може да се определи со електронска парамагнетна резонанца (EPR). Со помош на инструменти од овој метод, наречени EPR спектрометри, се проучуваат парамагнетни супстанции.
Теоријата на кристално поле овозможува да се објасни појавата на една или друга боја во сложените соединенија. Меѓу сложените соединенија, значителен број во кристална состојба и воден раствор се одликува со нивната светла боја. Така, воден раствор кој содржи 2+ катјони е обоен интензивно сино, 3+ катјони му даваат на растворот виолетова боја, а 2+ катјони му даваат црвена боја. Ако светлината помине низ раствор или кристален примерок од супстанција видлив дел од спектарот, тогаш, во принцип, можни се три опции за физичкото однесување на примерокот: нема апсорпција на светлинакоја било бранова должина (примерок од супстанција безбоен, иако може да има апсорпциони ленти во ултравиолетовиот регион на спектарот); целосна апсорпција на светлинаниз целиот опсег на бранова должина (примерокот ќе се појави црна); конечно, апсорпција на светлинасамо одредена бранова должина(тогаш примерокот ќе има боја комплементарна на апсорбиранатесен дел од спектарот).

Така, се одредува бојата на растворот или кристалите фреквенција на апсорпциони лентивидлива светлина. Апсорпцијата на светлосни кванти од комплекси (на пример, оние со октаедрална структура) се објаснува со интеракцијата на светлината со електроните лоцирани на гε-подниво, придружено со нивна транзиција кон празни орбитали гγ-подниво. На пример, при поминување на светлината низ воден раствор кој содржи хексакватитаниум(III) 3+ катјони, се открива лента за апсорпција на светлина во жолто-зелената област на спектарот (20300 cm -1, λ=500 nm). Ова се должи на транзицијата на единствениот електрон на комплексниот агенс од гε-AO на гγ-подниво:

Затоа, растворот што содржи 3+ добива виолетова боја (покрај апсорбираната жолто-зелена). Растворот на ванадиумова сол Cl 3 е зелен. Ова се должи и на соодветните транзиции на електроните кога тие апсорбираат дел од енергијата на светлосниот зрак. Во основната состојба, со електронска конфигурација на ванадиум(III) 3 г 2, два неспарени електрони се зафатени гε-подниво:

Има само две опции за премин на два електронина гγ-подниво: или и дветеелектроните се зафатени гγ-AO, или само еденод нив. Сите други транзиции на електрони поврзани со намалување на вкупниот спин се забранети.
Наведените транзиции на електрони кои примиле вишок енергија одговараат на лента за апсорпцијаоколу 400 nm во апсорпциониот спектар на раствор од хексакваванадиум (III) хлорид. Апсорпцијата на виолетово-виолетовиот регион на спектарот му дава дополнителна боја на растворот - светло зелена. Ако средството за комплексирање има електронска конфигурација г 0 или г 10 тогаш електронски транзицииСо гε- на гγ-подниво или обратно невозможнобило затоа што отсуство на електрони, било затоа што отсуство на празни орбитали. Според тоа, раствори на комплекси со комплексни агенси како што е Sc(III) (3 г 0), Cu (I) (3 г 10), Zn(II) (3 г 10), Cd(II) (4 г 10) итн., не апсорбираат енергија во видливиот дел од спектарот и се појавуваат безбоен. Селективноста на апсорпцијата на светлина не зависи само од средство за комплексирањеИ неговата оксидациона состојба, но и од тип на лиганди. При замена на лиганди од левата страна на спектрохемиската серија во сложено соединение со лиганди кои создаваат силназабележано електростатско поле зголемувањеделот од енергијата што ја апсорбираат електроните од пренесената светлина и, како последица на тоа, намалувањебранова должина на соодветната апсорпциона лента. Така, воден раствор кој содржи тетрааквабакар(II) 2+ катјони е сино, а растворот од тетраамин бакар (II) 2+ сулфат е интензивно сино.
Поврзани информации.