Hvilken syre er den farligste? Den sterkeste syren i verden. Den sterkeste superfluiditeten. De mest fantastiske stoffene Den sterkeste oksygenfrie syren
Mennesket har alltid søkt å finne materialer som ikke gir noen sjanser for sine konkurrenter. Siden antikken har forskere lett etter de hardeste materialene i verden, de letteste og de tyngste. Tørsten etter oppdagelse førte til oppdagelsen ideell gass og en helt svart kropp. Vi presenterer mest for deg fantastiske stoffer i verden.
1. Det svarteste stoffet
Det svarteste stoffet i verden heter Vantablack og består av en samling karbon-nanorør (se karbon og dets allotroper). Enkelt sagt består materialet av utallige "hår", når lyset er fanget i dem, spretter det fra ett rør til et annet. På denne måten absorberes omtrent 99,965 % av lysstrømmen og bare en liten brøkdel reflekteres ut igjen.
Oppdagelsen av Vantablack åpner for brede muligheter for bruk av dette materialet innen astronomi, elektronikk og optikk.
2. Det mest brannfarlige stoffet
Klortrifluorid er det mest brannfarlige stoffet noensinne kjent for menneskeheten. Det er et sterkt oksidasjonsmiddel og reagerer med nesten alle kjemiske elementer. Klortrifluorid kan brenne betong og lett antenne glass! Bruken av klortrifluorid er praktisk talt umulig på grunn av dens fenomenale brennbarhet og umuligheten av å sikre sikker bruk.
3. Det giftigste stoffet
Den kraftigste giften er botulinumtoksin. Vi kjenner den under navnet Botox, som er hva den kalles i kosmetologien, hvor den har funnet sin hovedapplikasjon. Botulinumtoksin er et kjemikalie som produseres av bakterien Clostridium botulinum. I tillegg til at botulinumtoksin er det giftigste stoffet, har det også den største molekylvekten blant proteiner. Den fenomenale toksisiteten til stoffet er bevist av det faktum at bare 0,00002 mg min/l botulinumtoksin er nok til å gjøre det berørte området dødelig for mennesker i en halv dag.
4. Det heteste stoffet
Dette er det såkalte kvark-gluonplasmaet. Stoffet ble skapt ved å kollidere gullatomer med nær lyshastighet. Quark-gluon plasma har en temperatur på 4 billioner grader Celsius. Til sammenligning er dette tallet 250 000 ganger høyere enn solens temperatur! Dessverre er materiens levetid begrenset til en trilliondel av en trilliondel av et sekund.
5. Den mest kaustiske syre
I denne nominasjonen er mesteren fluor-antimonsyre H. Fluor-antimonsyre er 2×10 16 (to hundre kvintillioner) ganger mer kaustisk enn svovelsyre. Det er et veldig aktivt stoff og kan eksplodere hvis en liten mengde vann tilsettes. Dampene fra denne syren er dødelig giftig.
6. Det mest eksplosive stoffet
Det mest eksplosive stoffet er heptanitrokubane. Det er veldig dyrt og brukes kun til Vitenskapelig forskning. Men det litt mindre eksplosive oktogenet brukes med hell i militære anliggender og i geologi ved boring av brønner.
7. Det mest radioaktive stoffet
Polonium-210 er en isotop av polonium som ikke finnes i naturen, men er produsert av mennesker. Brukes til å lage miniatyr, men samtidig veldig kraftige energikilder. Den har en svært kort halveringstid og er derfor i stand til å forårsake alvorlig strålesyke.
8. Det tyngste stoffet
Dette er selvfølgelig fulleritt. Hardheten er nesten 2 ganger høyere enn for naturlige diamanter. Du kan lese mer om fulleritt i vår artikkel The Hardest Materials in the World.
9. Den sterkeste magneten
Den sterkeste magneten i verden er laget av jern og nitrogen. For øyeblikket er detaljer om dette stoffet ikke tilgjengelige for allmennheten, men det er allerede kjent at den nye supermagneten er 18% kraftigere enn de sterkeste magnetene som for tiden er i bruk - neodym. Neodymmagneter er laget av neodym, jern og bor.
10. Det mest flytende stoffet
Superfluid Helium II har nesten ingen viskositet ved temperaturer nær absolutt null. Denne eiendommen er på grunn av sin unik eiendom lekkasje og hell ut av en beholder laget av fast materiale. Helium II har utsikter for bruk som en ideell termisk leder der varmen ikke forsvinner.
Mer enn én generasjon kjemikere kranglet om hvilken syre som er sterkest. I forskjellige tider Denne tittelen ble gitt til salpetersyre, svovelsyre og saltsyre. Noen mente at det ikke kunne være noen forbindelse sterkere enn flussyre. Nylig er det oppnådd nye forbindelser med sterke sure egenskaper. Kanskje det er blant dem den sterkeste syren i verden finnes? Denne artikkelen undersøker egenskapene til de kraftigste vedvarende syrene i vår tid og gir deres korte kjemiske egenskaper.
Syrekonsept
Kjemi er en eksakt kvantitativ vitenskap. Og tittelen "The Strongest Acid" bør med rimelighet tilskrives et bestemt stoff. Hva kan være hovedindikatoren som karakteriserer styrken til enhver forbindelse?
Først, la oss huske den klassiske definisjonen av syre. Dette ordet brukes hovedsakelig om komplekse kjemiske forbindelser som består av hydrogen og en syrerest. Antall hydrogenatomer i en forbindelse avhenger av valensen til syreresten. For eksempel, i et molekyl av saltsyre er det bare ett hydrogenatom; og svovelsyre har allerede to H+-atomer.

Egenskaper til syrer
Alle syrer har noen kjemiske egenskaper, som kan kalles felles for en gitt klasse kjemiske forbindelser.

I alle de ovennevnte egenskapene manifesteres en annen "ferdighet" av enhver kjent syre - dette er evnen til å gi fra seg et hydrogenatom, erstatte det med et atom av et annet kjemisk stoff eller et molekyl av en hvilken som helst forbindelse. Det er denne evnen som karakteriserer "styrken" til syren og graden av dens interaksjon med andre kjemiske elementer.
Vann og syre
Tilstedeværelsen av vann reduserer syrens evne til å donere hydrogenatomer betydelig. Dette forklares med at hydrogen er i stand til å danne sitt eget kjemiske bindinger mellom syre- og vannmolekyler, og dermed er evnen til å skille seg fra basen mindre enn for ufortynnede syrer.
Super syre
Ordet "superasyre" ble introdusert i den kjemiske ordboken i 1927, med hjelp av den berømte kjemikeren James Conant.
Standarden for styrken til denne kjemiske forbindelsen er konsentrert svovelsyre. Et kjemikalie eller en blanding som er surere enn konsentrert svovelsyre kalles en supersyre. Verdien av en supersyre bestemmes av dens evne til å gi en positiv elektrisk ladning til enhver base. Den tilsvarende H 2 SO 4-indikatoren er tatt som den grunnleggende parameteren for å bestemme surhetsgraden. Blant sterke syrer er det stoffer med ganske uvanlige navn og egenskaper.
Kjente sterke syrer
De mest kjente syrene fra uorganisk kjemi er hydrojod (HI), hydrobromsyre (HBr), saltsyre (HCl), svovelsyre (H 2 SO 4) og salpetersyre (HNO 3). Alle har en høy surhetsindeks og er i stand til å reagere med de fleste metaller og baser. I denne serien er den sterkeste syren en blanding av salpetersyre og saltsyre, kalt "aqua regia". Formelen til den sterkeste syren i denne serien er HNO 3+3 HCl. Denne forbindelsen er i stand til å løse opp selv edle metaller som gull og platina.

Merkelig nok ble flussyre, som er en forbindelse av hydrogen med det sterkeste halogenet - fluor, ikke inkludert i utfordrerne til tittelen "Den sterkeste syren i kjemi". Den eneste egenskapen til dette stoffet er dens evne til å oppløse glass. Derfor lagres slik syre i polyetylenbeholdere.
Sterke organiske syrer
Konkurrenter til tittelen «The Strongest Acid in organisk kjemi» - maursyre og eddiksyre. Maursyre er den sterkeste i den homologe serien av mettede syrer. Den har fått navnet sitt på grunn av at noe av det er inneholdt i maurs sekret.

Eddiksyre er litt svakere enn maursyre, men distribusjonsspekteret er mye bredere. Det finnes ofte i plantejuice og dannes under oksidasjon av ulike organiske stoffer.
Nylig utvikling innen kjemi har gjort det mulig å syntetisere et nytt stoff som kan konkurrere med tradisjonelle organiske stoffer. Trifluormetansulfonsyre har en surhetsindeks som er høyere enn for svovelsyre. Dessuten er CF3SO3H en stabil hygroskopisk væske med etablerte fysisk-kjemiske egenskaper under normale forhold. I dag kan tittelen "Strongest Organic Acid" tildeles denne forbindelsen.
Mange tror kanskje at surhetsgraden ikke kan være vesentlig høyere enn for svovelsyre. Men nylig har forskere syntetisert en rekke stoffer hvis surhetsparametere er flere tusen ganger høyere enn for svovelsyre. Forbindelser oppnådd ved å reagere protiske syrer med Lewis-syrer har unormalt høye surhetsverdier. I vitenskapelige verden de kalles: komplekse protiske syrer.
Magisk syre
Ja. Alt er riktig. Magisk syre. Det er det den heter. Magisk syre er en blanding av hydrogenfluorid eller fluorsulfonsyre med antimonpentafluorid. Kjemisk formel Denne forbindelsen er vist i figuren:

Dette merkelig navn Den magiske syren ble hentet på en kjemikers julefest som fant sted på begynnelsen av 1960-tallet. Et av medlemmene i J. Olahs forskningsgruppe viste et morsomt triks ved å løse opp et vokslys i denne fantastiske væsken. Dette er en av de sterkeste syrene i den nye generasjonen, men et stoff som vil overgå den i styrke og surhet er allerede syntetisert.
Den sterkeste syren i verden
Karboransyre er karbonsyre, som er den desidert sterkeste forbindelsen i verden. Formelen til den sterkeste syren ser slik ut: H(CHB11Cl11).
Dette monsteret ble opprettet i 2005 ved University of California i nært samarbeid med Novosibirsk Institute of Catalysis SB RAS.
Selve ideen om syntese oppsto i hodet til forskere sammen med drømmen om nye, hittil usynlige molekyler og atomer. Den nye syren er en million ganger sterkere enn svovelsyre, men den er ikke i det hele tatt aggressiv, og den sterkeste syren kan enkelt lagres i en glassflaske. Riktignok oppløses glasset over tid, og med økende temperatur øker hastigheten på denne reaksjonen betydelig.

Denne fantastiske mykheten skyldes den høye stabiliteten til den nye blandingen. Som alle sure kjemikalier, reagerer karbonsyre lett og donerer sitt eneste proton. I dette tilfellet er syrebasen så stabil at den kjemiske reaksjonen ikke går videre.
Kjemiske egenskaper til karboransyre
Den nye syren er en utmerket H+ protondonor. Dette er det som bestemmer styrken til dette stoffet. En løsning av karboansyre inneholder flere hydrogenioner enn noen annen syre i verden. I kjemisk reaksjon SbF 5 - antimonpentafluorid, binder fluor ylon. I dette tilfellet frigjøres flere og flere hydrogenatomer. Derfor er karbonsyre den sterkeste i verden - suspensjonen av protoner i løsningen er 2 × 10 19 ganger større enn for svovelsyre.
derimot syrebase Denne forbindelsen er utrolig stabil. Molekylet til dette stoffet består av elleve bromatomer og samme antall kloratomer. I verdensrommet danner disse partiklene en kompleks, geometrisk regelmessig figur, som kalles et ikosaeder. Dette arrangementet av atomer er det mest stabile, og dette forklarer stabiliteten til karboransyre.

Betydningen av karboransyre
Den sterkeste syren i verden ga sine skapere velfortjente priser og anerkjennelse i den vitenskapelige verden. Selv om alle egenskapene til det nye stoffet ikke er fullt ut forstått, er det allerede blitt klart at betydningen av denne oppdagelsen går utover laboratorier og forskningsinstitutter. Karboransyre kan brukes som en kraftig katalysator i ulike industrielle reaksjoner. I tillegg kan den nye syren samhandle med de mest gjenstridige kjemikaliene - inerte gasser. For tiden pågår det et arbeid for å la xenon reagere.
Utvilsomt vil de fantastiske egenskapene til nye syrer finne sin anvendelse i ulike felt av vitenskap og teknologi.
Det er mange syrer som, selv i minimale mengder, utgjør en fare for mennesker. Mange tror at svovelsyre er den farligste, men dette er absolutt ikke sant. Karboransyre regnes som den sterkeste, som kun kan lagres i spesielle beholdere. Det er mange ganger sterkere enn svovelsyre og lar deg raskt løse opp metaller, glass og andre stoffer som er motstandsdyktige mot andre kjemikalier. Men hvis karbonsyre er svært sjelden, og bare under laboratorieforhold, kan du møte et annet potent stoff i Hverdagen. Ifølge mange eksperter er den giftigste syren blåsyre, og den finnes ikke bare i laboratoriet, men også i mat.
Hvordan kan du bli forgiftet?
Blåsyre er veldig giftig. Når det kommer inn i menneskekroppen, vises tegn på forgiftning ganske raskt. Dette stoffet kan komme inn i kroppen med produkter som inneholder det, så vel som med de produktene som er behandlet med cyanid.
Det meste av dette giftige stoffet finnes i mandler. Det totale beløpet kan nå opptil 3 %. En person trenger bare å spise en liten håndfull mandler for å bli forgiftet. I tillegg finnes dette farlige stoffet i frøene til bær og noen frukter. De fleste syrer inneholder:
- fersken - opptil 2,8%;
- aprikos - opptil 1,6%;
- plomme - opptil 0,95%;
- kirsebær - omtrent 0,8%;
- eple – omtrent 0,6%.
I mandelkorn og fruktkjerner finnes ikke blåsyre i ren form, men i form av amygdalinglykosid. Det er dette stoffet som gir den spesifikke smaken og aromaen til nøtter. En gang i menneskekroppen brytes amygdalin ned i tre komponenter, hvorav den ene er blåsyre. Bitre mandler er spesielt rike på dette stoffet, så voksne kan spise dette produktet i små mengder, men barn bør ikke spise det i det hele tatt.
Viner laget av bær og frukt med frø utgjør en stor fare. Vin tilsatt kirsebær med groper, plommer og aprikoser kan føre til forgiftning.
Kompotter og syltetøy laget av bær sammen med frø utgjør ingen helsefare. Ved oppvarming til 80 grader brytes blåsyre ned til sikre komponenter.
Hvor mye syre vil forårsake forgiftning
 Mengden mat du må spise for å bli forgiftet kan variere betydelig. Det avhenger av personens alder, kroppsvekt, generell tilstand helse og tilstedeværelsen av kroniske patologier. Men det er gjennomsnitt som bør følges.
Mengden mat du må spise for å bli forgiftet kan variere betydelig. Det avhenger av personens alder, kroppsvekt, generell tilstand helse og tilstedeværelsen av kroniske patologier. Men det er gjennomsnitt som bør følges.
Alvorlig rus kan oppstå hvis du spiser 30 mandelnøtter, mer enn 50 aprikoskjerner, mer enn 70 plomme- eller kirsebærkjerner. Du kan bli forgiftet hvis du spiser mer enn 100 eplefrø.
Under påvirkning av selve den giftige syren kan det oppstå dødelig forgiftning. Den kritiske dosen av amygdalin er 1 mg per kilo menneskelig kroppsvekt. Det er nok å spise 40 korn bitre mandler eller 100 aprikoskjerner for å få dødelig forgiftning.
Gourmeter som virkelig elsker mandelnøtter i uendret form bør kun kjøpe delikatessen i spesialforretninger. Emballasjen skal inneholde all informasjon om produsent og sammensetning av produktet. Selv søte mandler kan føre til forgiftning hvis de spises i overkant.
Bitre mandler brukes nå bare i produksjonen av visse medisiner og kosmetiske produkter. Slike nøtter spises praktisk talt ikke.
Symptomer på forgiftning
Blåsyre, når den først er i blodet, kommer i kontakt med røde blodlegemer, mens den blokkerer løsrivelsen av oksygen og dens videre overføring til vev. På grunn av dette øker mengden oksygen i blodet kraftig, men det når ikke organene i det hele tatt, noe som fører til hypoksi. Hjernen er først og fremst påvirket. Alle funksjoner til dette organet er alvorlig hemmet, og funksjonen til alle systemer og andre viktige organer i kroppen blir forstyrret.
Når forgiftet av denne syren, vises følgende karakteristiske tegn:
- huden og alle slimhinner blir knallrosa;
- alvorlig hodepine, så vel som svimmelhet, leppene blir nummen og pupillene utvider seg;
- det er ubalanse, personen kan ikke stå på føttene normalt, koordinering av bevegelser er svekket;
- pulsen øker, det samme gjør pusten;
- offeret føler brystsmerter og kortpustethet;
- kvalme og oppkast oppstår;
- det er en metallisk smak og bitterhet i munnen;
- det kan være ukontrollerte avføringer.
Offeret avgir en karakteristisk aroma av bitre mandler, hvorved det kan fastslås at personen er forgiftet. Hvis tilstanden er svært alvorlig, blir rask pust raskt erstattet av en langsom puls. Lammelse av respirasjonssenteret oppstår, og kramper begynner.
Hvis det i tilfelle blåsyreforgiftning ikke gis bistand til offeret innen 3 minutter, vil døden inntreffe.
Øyeblikkelig hjelp
Ved forgiftning med en sterk syre - blåsyre, må du umiddelbart ringe en ambulanse. Før legene kommer, gis offeret førstehjelp, som består av følgende tiltak:

Motgiften for blåsyre er en svak løsning av metylenblått. Dette middelet gis vanligvis av legevakt.
Etter at førstehjelp er gitt, bør offeret fjernes fra alle stramme klær og legges i sengen med hodet hevet med puter. Hvis en person har en forvirret bevissthet, anbefales det at han snuser en bomullspinne fuktet med ammoniakk. Ammoniakk, en gang i blodet, nøytraliserer syren.
Hvis en person ikke har pust eller puls, er det nødvendig å utføre brystkompresjoner og utføre kunstig åndedrett så snart som mulig. Slike tiltak må gjennomføres i løpet av de første minuttene etter at vitale prosesser er avsluttet.
På sykehus får pasienten krampestillende midler, motgift og legemidler for å gjenopprette normal blodsirkulasjon. Under gjenopprettingsprosessen blir pasienten foreskrevet et kompleks av vitaminer.
Etter forgiftning med blåsyre, bør en person unngå fysisk og psykisk stress i noen tid. På dette tidspunktet anbefales pasienten å drikke rikelig med væske, inkludert melk. Du bør også gå mye i frisk luft, holde deg til et balansert kosthold og gi opp alle dårlige vaner.
Den raske utviklingen av vitenskap gjør det mulig for forskere å gjøre nye oppsiktsvekkende oppdagelser innen fysikk, kjemi og andre områder. Den vitenskapelige verden er systematisk sjokkert over nyheter om opprettelsen av nye stoffer med unike, tidligere usynlige egenskaper. Vanlige mennesker følger selvfølgelig ikke alltid med på slike oppdagelser. Ikke alle vet at den sterkeste syren i verden ble skapt i Amerika i 2005. For mange er den kraftigste av disse kjemikaliene svovelsyre, som ble godt studert på skolen.
Karboransyre er den sterkeste i verden
I 2005 klarte forskere som jobbet ved University of California i USA å lage en ny syre med enestående styrke. Den oppfunne forbindelsen er en million ganger sterkere enn konsentrert svovelsyre. Forskere i det øyeblikket satte ut for å finne et nytt molekyl som ville bli en virkelig oppdagelse i den vitenskapelige verden, og de klarte å oppnå et positivt resultat.
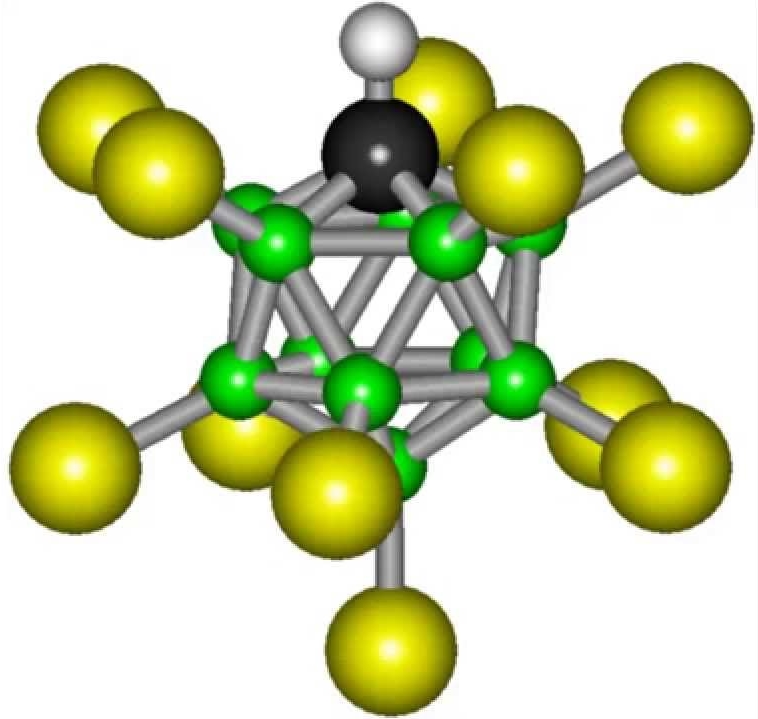
Formelen til karboransyre er ikke veldig kompleks: H(CHB11Cl11). Men det vil fortsatt ikke være mulig å syntetisere et slikt stoff i et vanlig laboratorium. Karboransyre er mer enn en billion ganger surere enn vanlig vann.
En unik egenskap til den sterkeste syren
Hvis den kraftigste syren i verden er nevnt et sted, forestiller menneskelig fantasi et stoff som løser opp alt i sin vei. Faktisk er destruktive egenskaper slett ikke hovedtegnet på styrken til et kjemisk stoff. For eksempel trodde mange at den kraftigste syren var flussyre, siden den løser opp glass. Men dette er langt fra sannheten. Flussyre korroderer glassbeholdere, men kan oppbevares i polyetylenbeholdere.

Anerkjent som den kraftigste karbonsyren i verden, kan den enkelt lagres i glassbeholdere. Faktum er at dette kjemikaliet er preget av betydelig kjemisk stabilitet. Som andre lignende forbindelser frigjør karboransyre ladede hydrogenatomer når den reagerer med reagenser. Etter en slik reaksjon har sammensetningen en liten negativ ladning og har ikke en ødeleggende effekt på omkringliggende materialer.
Videre arbeid med karboransyre
Selvfølgelig har skaperne av karboransyre blitt godt kjent i verdens vitenskapelige miljø. Dessuten ble strålende forskere tildelt mange velfortjente priser for deres betydelige bidrag til utviklingen av vitenskapen. Bruken av det nye stoffet er ikke lenger begrenset til vitenskapelige laboratorier: Karboransyre brukes i industrien som en kraftig katalysator.

En unik egenskap ved verdens kraftigste syre er dens evne til å samhandle med inerte gasser. I dag utføres det mange studier for å fastslå muligheten for en reaksjon mellom xenon og karbonsyre. Forskere jobber også utrettelig for å studere andre egenskaper til den kraftigste syren.
Den mest kjente sterke syren
Forskere er godt klar over karboansyre. Vanlige mennesker tror oftest at svovelsyre er sterkest. Dette skyldes hyppig bruk av stoffet i industrien. Det brukes ofte av produsenter av mineralgjødsel for å produsere superfosfater og ammoniumsulfater.
Svovelsyre er mye brukt i metallurgisk industri. Det brukes også til å rense metaller fra oksidasjon. Produksjon av flytende drivstoff kan ikke gjøres uten bruk av svovelsyre. Den kan brukes til å rengjøre følgende produkter:
- smøreoljer;
- parafin;
- parafin;
- mineralsk fett.

Men det er ikke bare industriell bruk som gjør at mange tror at svovelsyre er den sterkeste i verden. Denne oppfatningen ble dannet på grunn av det faktum at stoffet, når det kommer på kjøttet, forkuller det. Denne egenskapen til svovelsyre brukes ofte i filming av krimfilmer.
Den sterkeste organiske syren
Hvis vi snakker om den sterkeste syren i organisk kjemi, så tilhører ledelsen her maursyre. Stoffet ble kalt slik fordi det ble funnet i sekret fra maur. Maursyre har et bredt spekter av bruksområder. Det brukes ofte i medisin fordi det har smertestillende og irriterende egenskaper. Maursyre er tilstede i mange salver som brukes til å behandle blåmerker, åreknuter og hevelse. Medisiner som inneholder dette stoffet kan bidra til å bli kvitt akne.

Maursyre er også mye brukt i kjemisk industri. Det brukes også i landbruk og birøkt. Stoffet brukes også i mat som tilsetning E236.
Til tross for utbredelsen, kan maursyre utgjøre en alvorlig trussel. Kontakt av det konsentrerte stoffet med huden forårsaker brannskader eller sterke smerter. Selv innånding av maursyredamp kan forårsake skade på luftveiene. Men den positive egenskapen til stoffet er at det raskt elimineres fra kroppen uten å samle seg i det.
Mange prøver selv å finne ut svaret på spørsmålet om hvilken som er den sterkeste syren. Det er ikke veldig vanskelig å forstå dette, men du må lese spesiell litteratur. For de som bare vil vite svaret på dette spørsmålet, denne artikkelen ble skrevet.
Mange tror at den sterkeste syren er flussyre, fordi den kan løse opp glass. Denne dommen er praktisk talt grunnløs. I andres forståelse er den sterkeste syren svovelsyre. Det siste utsagnet har en helt logisk forklaring. Faktum er at svovelsyre er veldig sterk blant de som brukes i industrien. Ved kontakt med levende vev kan det forkulle kjøttet og etterlate alvorlige brannskader som tar lang tid å gro og er problematiske. Produksjonen krever ingen spesielle materialkostnader. Og det er trygt å si at hun ikke er den sterkeste. Vitenskapen kjenner de såkalte supersyrene. Vi vil snakke om dem videre. Men på husholdningsnivå er den vanligste av de sterke syrene fortsatt svovelsyre. Derfor er hun farlig.
Så hvordan kan en syre være sterk og skånsom? Svaret ligger i hvordan kjemikere bestemmer styrken til en syre. Syrestyrke er evnen til en syre til å tilføre et hydrogenion til basiske molekyler. Et annet eksempel er valget av syre for å rense kalkavleiringer inne i en kobberkjele, bemerket han. En klok huseier velger saltsyre fremfor salpetersyre fordi klordelen av saltsyre ikke angriper kobberet, mens nitratdelen av salpetersyre løser opp kjelen i et rot av giftige brune røyk.
Mange moderne kjemikere tror at den sterkeste syren i verden er karboran. Dette bekreftes av resultatene av grundig forskning. Denne syren er mer enn en million ganger kraftigere enn konsentrert svovelsyre. Dens fenomenale egenskap er evnen til å lagres i et reagensrør, som mange andre stoffer fra den nevnte serien ikke besitter. Den kjemiske sammensetningen, som ble ansett som den mest etsende, kunne ikke oppbevares i glassbeholdere. Faktum er at karbonsyre har betydelig kjemisk stabilitet. Som andre stoffer som ligner på den, donerer den hydrogenatomer med ladninger når den reagerer med andre reagenser. Imidlertid er sammensetningen som er igjen etter reaksjonen, selv om den har en negativ ladning, meget stabil og kan ikke virke videre. Karboransyre har en enkel formel: H(CHB 11 Cl 11). Men å få tak i det ferdige stoffet i et vanlig laboratorium er ikke lett. Det er verdt å merke seg at det er mer enn en billion ganger surere enn vanlig vann. I følge oppfinneren, dette stoffet dukket opp som et resultat av utviklingen av nye kjemikalier.
De nye «sterke, men milde» syrene kalles karbonatsyrer. Hemmeligheten bak deres makt er todelt. Det viktigste er at karbonatdelen av syren er en ekstremt svak base, svakere enn fluorsulfatdelen av fluorsvovelsyre, som var den tidligere rekordholderen for den sterkeste syren. For det andre har karboraner eksepsjonell kjemisk stabilitet.
I følge Reed har de et ikosaedrisk arrangement av elleve boratomer pluss ett karbonatom, som sannsynligvis er den mest kjemisk stabile klyngen av atomer i hele kjemien. Dette betyr at karborandelen av syren ikke kan delta i korrosjons- og nedbrytningskjemien som utvises av fluor og nitrat i flussyre og salpetersyre. Som et resultat kan karbonsyrer tilføre hydrogenioner til svakt basiske molekyler uten å ødelegge de ofte delikate, positivt ladede molekylene som dannes.
Listen over de mest kaustiske stoffene inneholder flussyre, flussyre og andre sterke syrer. Industrielle reagenser er ikke inkludert. Imidlertid må du fortsatt være forsiktig med slike vanlige syrer som svovelsyre, saltsyre, salpetersyre og andre. Jeg vil ikke skremme noen, men stoffer fra denne listen brukes vanligvis til å begå angrep på helsen og bevisst vansiring av utseende.
Det er deres sterke, men milde kvalitet, la Reed til. Ingen av disse positivt ladede molekylene ble "flasket" ved romtemperatur før fordi de tidligere brukte syrene spaltet dem. Sterke, men milde karbonsyrer overvinner denne vanskeligheten, slik at kjemikere kan se nærmere på viktige molekyler hvis eksistens vanligvis er flyktig, sa Reed. Forsurede molekyler er viktige kortlivede mellomprodukter i et stort utvalg av syrekatalyserte kjemiske transformasjoner, inkludert matfordøyelse, bensinforbedring, polymerdannelse og farmasøytisk syntese.
 er at blant fettsyrene som finnes i matvarer, er maursyre den sterkeste. Det brukes ofte til konservering av grønnsaker og til medisinske formål, men bare i form av en løsning.
er at blant fettsyrene som finnes i matvarer, er maursyre den sterkeste. Det brukes ofte til konservering av grønnsaker og til medisinske formål, men bare i form av en løsning.
Det må igjen sies at den sterkeste syren er karboran. Men i dag må vi være mer på vakt mot stoffer som brukes i industrien og hverdagen. Kjemi er en ganske nyttig og kompleks vitenskap, men den utbredte produksjonen av enkle forbindelser krever ikke spesiell kunnskap, og derfor er det lett å få tak i syre i tilstrekkelige mengder. Dette skaper økt fare ved uforsiktig håndtering eller gjennomføring av dårlige intensjoner.
Hvor sterke er karboransyrer? Den sterkeste av disse er minst en million ganger sterkere enn konsentrert svovelsyre, og hundrevis av ganger sterkere enn den forrige rekordholderen, fluorsvovelsyre. Konsentrert svovelsyre er allerede mer enn en milliard ganger sterkere enn fortynnet svømmebassengsyre eller magesyre. Sure miljøer lik eller større enn surheten til karbonatsyrer har blitt oppnådd tidligere ved å tilsette antimonpentafluorid til fluorsvovelsyre, men disse blandingene er svært etsende og har andre begrensninger.
Når vi snakker på kjemispråket, er syrer de stoffene som viser evnen til å frigjøre hydrogenkationer, eller stoffer som har evnen til å akseptere et elektronpar som et resultat av dannelsen kovalent binding. Men i vanlig samtale blir en syre oftest bare forstått som de forbindelsene som, når de dannes i vandige løsninger, produserer et overskudd av H30+. Tilstedeværelsen av disse kationene i løsning gir stoffet en sur smak og evnen til å reagere på indikatorer. I dette materialet vil vi snakke om hvilket stoff som er den sterkeste syren, og også snakke om andre sure stoffer.
Syrer som er så sterke kalles supersyrer, og de reagerer med hydrokarboner fra petroleum i en prosess som kalles hydrokarboncracking. Dette er en viktig prosess for å øke oktannivået i bensin. Nye syrer kan være svært viktige for å forstå og forbedre denne prosessen, sa Reed. Karboransyrer tar dette feltet enda lenger.
Den mest kjente sterke syren
Det er mange andre molekyler som reagerer uberegnelig med tradisjonelle syrer og er derfor lite nyttige. Karboransyrer gir svært ren surhet uten noen voldsomhet. Renere syrekatalyse av reaksjoner som er viktige for produksjon av legemidler og petroleumsprodukter bør derfor være mulig.
Flussyreantimonpentafluorid (HFSbF5)
For å beskrive surheten til et stoff er det en PH-indikator, som er den negative desimallogaritmen for konsentrasjonen av hydrogenioner. For vanlige stoffer varierer denne indikatoren fra 0 til 14. Denne indikatoren er imidlertid ikke egnet for å beskrive HFSbF5, som også kalles en "supersyre".
Reed sier: Vår forskning går ut på å lage molekyler som aldri har blitt laget før. Karboransyrer lar oss gjøre dette. Dette er den sanne verdien av denne studien. Vitenskapen går videre og samtidig opplever studentene spenningen ved oppdagelse når de blir forskere.
University of California, Riverside, er en doktorgradskandidat forskningsuniversitet, et levende laboratorium for nyskapende forskning på spørsmål som er kritiske for innlandet i Sør-California, staten og samfunn rundt om i verden. En sterk syre er definert som pH-verdien, som er styrken til hydrogen som gjør syren sterk. Imidlertid fungerer ikke pH-verdien i stigende rekkefølge. Jo lavere pH-verdi, jo sterkere vil syren være. pH-skalaen går fra 1 til løsninger med pH-verdi mindre enn 7 regnes som syrer, mens løsninger med pH større enn 7 regnes som baser.
Det er ingen eksakte data om aktiviteten til dette stoffet, men det er kjent at selv en 55% løsning av HFSbF5 er nesten 1 000 000 ganger sterkere enn konsentrert H2SO4, som i vanlige sinn regnes som en av de sterkeste syrene. Imidlertid er antimonpentafluorid et ganske sjeldent reagens, og selve stoffet ble laget bare under laboratorieforhold. Den produseres ikke i industriell skala.
Liste over de sterkeste syrene og deres bruk
Syrer med en pH-verdi mindre enn 1 regnes som de sterkeste, og løsninger med en pH-verdi over 13 regnes som en sterk base. pH-verdien er 2 og regnes som en av de gunstige syrene. Saltet eller fløten av tartar som finnes i den utvikler seg naturlig under vinproduksjon. Den blandes med natriumbikarbonat og selges kommersielt som bakevarer. Den brukes i matlaging og har en unik syrlig smak.
Det er et faktum at det er kilden til diamantene som finnes på flaskekorken eller bunnen. Denne brukes som organisk forbindelse, og det produseres ved hjelp av alle levende organismer. Disse søtsakene har advarsler om dem, og informerer kundene om at de kan forårsake munnirritasjon. Sitron finnes vanligvis i sitroner og har en pH-verdi. Det er ofte funnet i sitrusfruktmat, og det fungerer også som et mellomprodukt i sitronsyresyklusen som skjer i metabolismen til aerobe organismer. Det er en sterk og spiselig syre som brukes i mat- og drikkesmaker, som brus og limonader.
Karboransyre (H(CHB11Cl11))
Nok en supersyre. H(CHB11Cl11)) er den sterkeste syren i verden som kan lagres i spesielle beholdere. Stoffets molekyl har form av et ikosaeder. Karboransyre er mye sterkere enn svovelsyre. Det kan løse opp metaller og til og med glass.
Dette stoffet ble opprettet ved University of California i USA med deltagelse av forskere fra Novosibirsk Institute of Catalytic Processes. Som en av de ansatte ved det amerikanske universitetet sa, var ideen bak etableringen ønsket om å lage molekyler som tidligere var ukjent for noen.
Den tilsettes iskrem, hvor den fungerer som en emulgator som hindrer frigjøring av fett. Det fungerer også som et rengjøringsmiddel og kan brukes til å fjerne kalk fra fordampere og kjeler. Den myker opp vann, noe som gjør den nyttig til å lage vaskemidler og såper. Den er luktfri og kan brukes i kosmetikk og kosttilskudd.
Derfor brukes den i et bredt spekter av industrielle så vel som innenlandske produkter. Svovel er også kjent som svovelholdig; pH-verdien er 5 og dette kjemisk forbindelse. Det er lite som tyder på at det eksisterer i løsning, men det eksisterer i gassfasen. Basene for dette er de vanlige anionene, bisulfat og sulfitt. Det fungerer som et reduksjonsmiddel og desinfeksjonsmiddel. De fungerer også som milde blekemidler og kan hjelpe de materialene som blir ødelagt av klorblekemidler.
Styrken til H(CHB11Cl11)) skyldes det faktum at den perfekt donerer et hydrogenion. I løsninger av dette stoffet er konsentrasjonen av disse ionene mye høyere enn i andre. Den andre delen av molekylet, etter frigjøring av hydrogen, inkluderer elleve karbonatomer, som danner et ikosaeder, som er en ganske stabil struktur, noe som øker korrosjonsinertheten.
pH-verdien er 5 og det er en mineralsyre. Rusthemmende mattilsetning brukt i tannprodukter ElekIndustrial Etch Brukt i hjemmerengjøringsprodukter. Det er også et krystallinsk fast stoff, fungerer som et reduksjonsmiddel og har en konjugerende base.
En annen sterkest syre er det mer kjente hydrogenfluorid. Industrien produserer det i form av løsninger, oftest førti, femti eller sytti prosent. Stoffet skylder navnet sitt til flusspat, som fungerer som råstoff for hydrogenfluorid.
Dette stoffet har ingen farge. Ved oppløsning i H20 oppstår det en betydelig varmeavgivelse. Ved lave temperaturer er HF i stand til å danne svake forbindelser med vann.
Det absorberer fuktighet fra luften og er et fargeløst krystallinsk fast stoff. Den danner en sirup og er løselig i vann når den frigjøres med høy temperatur. Denne pH-verdien er 0 og det er en fargeløs væske. Den brukes til. Produksjon av uorganiske og organiske nitrater Produksjon av nitroforbindelser til gjødsel Fargestoffer-mellomprodukter Organiske kjemikalier Eksplosiver. Hvis en person konstant blir utsatt for damper, kan det forårsake kjemisk penomonitt og kronisk bronkitt.
Stoffet korroderer glass og mange andre materialer. Polyetylen brukes til transport. Reagerer veldig godt med de fleste metaller. Reagerer ikke med parafin.
Ganske giftig og har en narkotisk effekt. Ved inntak kan det forårsake akutt forgiftning, nedsatt hematopoiesis, organsvikt og forstyrrelse av luftveiene.
Det er en fargeløs væske som avgir hvite røyk når den slippes ut i vann. To andre navn for denne syren er svovelsyre og svovelsyreanhydrid. Det er mye brukt i produksjon av kjemikalier og eksplosiver. For eksempel brukes det til fremstilling av syntetiske vaskemidler, medisiner, industrielle fargestoffer og pigmenter, gjødsel, etc. Langvarig eksponering kan ha negative helseeffekter og kan skade menneskekroppen alvorlig.
Saltsyre har en pH-verdi. Dette er en aggressiv og kraftigste syre, som hovedsakelig brukes i laboratorieforhold. Dannelsen av denne syren utføres ved å løse opp hydrogenklorid i vann. Det brukes til mange ting som produksjon av klorider, gjødsel og å dø. Andre bruksområder for syren inkluderer tekstiler, galvanisering og gummifremstilling. Hvis en person blir utsatt for denne sterke saltsyren, vil eksponeringen føre til følgende ting.


Stoffet er en sterk syre med to baser. Svovelet i forbindelsen har den høyeste oksidasjonstilstanden (pluss seks). Den er luktfri og fargeløs. Oftest brukt i løsning med vann eller svovelsyreanhydrid.
Det er flere måter å skaffe H2S04 på:
- Industriell metode (dioksidoksidasjon).
- Tårnmetode (produksjon ved bruk av nitrogenoksid).
- Andre (basert på å oppnå et stoff fra samspillet av svoveldioksid med ulike stoffer, ikke veldig vanlig).
Konsentrert H2SO4 er veldig sterkt, men løsningene utgjør også en alvorlig fare. Ved oppvarming er det et ganske sterkt oksidasjonsmiddel. Når de samhandler med metaller, oksiderer de. I dette tilfellet reduseres H2S04 til svoveldioksid.
H2SO4 er svært etsende. Det kan påvirke hud, luftveier, slimhinner og indre organer hos mennesker. Det er veldig farlig ikke bare å få det inn i kroppen, men også å puste inn dampene.
maursyre (HCOOH)
Dette stoffet er en mettet syre med én base. Interessant nok, til tross for sin styrke, brukes den som et kosttilskudd. Under normale forhold er det fargeløst, løselig i aceton og lett blandet med vann.
HCOOH er farlig ved høye konsentrasjoner. Med en konsentrasjon på under ti prosent virker det bare irriterende. På høyere nivåer kan det korrodere vev og mange stoffer.
Konsentrert HCOOH ved kontakt med huden forårsaker en svært alvorlig forbrenning, som gir sterke smerter. Damper av stoffet kan skade øyne, luftveier og slimhinner. Å få den inne forårsaker alvorlig forgiftning. Imidlertid behandles syre i svært svake konsentrasjoner lett i kroppen og fjernes fra den.

Ved metanolforgiftning dannes det også maursyre i kroppen. Det er hennes arbeid i denne prosessen fører til synshemming på grunn av skade på synsnerven.
Dette stoffet finnes i små mengder i frukt, brennesle og sekresjoner fra enkelte insekter.
Salpetersyre (HNO3)
Salpetersyre er en sterk syre med én base. Blander godt med H20 i ulike proporsjoner.
Dette stoffet er et av de mest populære produktene i den kjemiske industrien. Det er flere metoder for fremstilling av det, men den mest brukte er oksidasjon av ammoniakk i nærvær av en platinakatalysator. HNO3 brukes oftest i produksjon av gjødsel til landbruket. I tillegg brukes den i militær sfære, i etableringen av eksplosiver, i smykkeindustrien, for å bestemme kvaliteten på gull, og også i etableringen av visse medisiner (for eksempel nitroglyserin).

Stoffet er svært farlig for mennesker. HNO3-damper skader luftveiene og slimhinnene. Syre som kommer på huden etterlater sår som tar svært lang tid å gro. Huden får også en gul fargetone.
Ved eksponering for varme eller lys brytes HNO3 ned til nitrogendioksid, som er en ganske giftig gass.
HNO3 reagerer ikke med glass, og det er derfor dette materialet brukes til å lagre stoffet. Syren ble først skaffet av alkymisten Jabir.