Protolytisk teori om syrer og baser. Syrer og baser i organisasjonskjemi. Konjugert syre og konjugert base. Syre-base likevekter, eksempler. Påvirkningen av substituenter i et molekyl på surhet og basicitet Moderne ideer om syre
Syrer og baser viser sine egenskaper kun i nærvær av hverandre. Ikke et eneste stoff vil gi fra seg et proton hvis det ikke er noen protonakseptor i systemet - en base, og omvendt, dvs. de dannes konjugert syre-base-par der jo sterkere syren er, desto svakere er dens konjugerte base, og jo sterkere basen er, desto svakere er dens konjugerte syre.
En syre som donerer et proton blir en konjugert base, og en base som aksepterer et proton blir en konjugert syre. En syre er vanligvis betegnet AN og en base er B
For eksempel: HCl-H+ + Cl-, HCl - sterk syre; C1 - ion - konjugert svak base;
CH 3 COOH - CH 3 COO - + H +, CH 3 COOH er en svak syre, og CH 3 COO - er det konjugerte sterke baseionet.
Det generelle synet kan representeres som følger:
Н+¦ : A + B Н:В+ + А:-
sett med grunnleggende elementer for motstand motstand
noe grunnleggende
Vi har allerede sagt at de sure egenskapene til forbindelser bare avsløres i nærvær av en base, og de grunnleggende egenskapene - i nærvær av en syre, dvs. i forbindelser er det en viss syre-base likevekt, for studien av hvilken H 2 O brukes som løsningsmiddel. I forhold til H 2 O som syre eller som base bestemmes syre-base-egenskapene til forbindelser.
For svake elektrolytter kvantifiseres surheten TIL Rav en reaksjon som involverer overføring av H + fra en syre til H 2 O som en base.
CH 3 COOH + H 2 O - CH 3 COO - + H 3 O +
som er basissyren
CH3COO - - acetation, konjugatbase;
H 3 O + - hydroniumion, konjugert syre.
Ved å bruke verdien av likevektskonstanten til denne reaksjonen og ta i betraktning at konsentrasjonen av H 2 O er nesten konstant, kan vi bestemme produktet K? kalt surhetskonstant TIL surhet (K EN).

Jo høyere K a, jo sterkere er syren. For CH3COOH Ka = 1,75 10-5. Slike små verdier er upraktiske i praktisk arbeid, derfor uttrykkes K a gjennom rK EN (pK = -?g K EN). For CH3COOH pKa = 4,75. Jo lavere pKa-verdien er, desto sterkere er syren.
Styrken til basene bestemmes av pK-verdien til BH +.
Sure egenskaper til organiske forbindelser med hydrogenholdige funksjonelle grupper (alkoholer, fenoler, tioler, karboksylsyrer, aminer).
Organiske syrer
I organiske forbindelser, avhengig av arten av elementet som H + er assosiert med, skilles følgende syrer ut:
HAN- syrer (karboksylsyrer, fenoler, alkoholer)
CH - syrer (hydrokarboner og deres derivater)
NH- syrer (aminer, amider, imider)
SH- syrer (tioler).
Et syresenter er et grunnstoff og dets tilhørende hydrogenatom.
Styrken på syren vil avhenge av anion stabilitet, de. fra konjugatbasen, som dannes når H+ skilles fra molekylet. Jo mer stabilt anion, desto høyere surhet av forbindelsen.
Anionstabilitet avhenger av en rekke faktorer som bidrar til ladningsdelokalisering. Jo høyere ladningsdelokalisering, jo mer stabilt anion, jo sterkere er de sure egenskapene.
Faktorer som påvirker graden av delokalisering:
- 1. Naturen til heteroatomet i det sure stedet
- 2. Elektroniske effekter av atomer av hydrokarbonradikaler og deres substituenter
- 3. Anionens evne til solvasjon.
- 1. Avhengighet av surhet på heteroatomet.
Naturen til et heteroatom forstås som dets elektronegativitet (E.O.) og polariserbarhet. Jo større (E.O.), jo lettere skjer den heterolytiske spaltningen i molekylet. I perioder fra venstre til høyre, når ladningen til kjernen øker, øker (E.O), dvs. elementers evne til å holde en negativ ladning. Som et resultat av skiftet i elektrontetthet blir bindingen mellom atomer polarisert. Jo flere elektroner og jo større radius atomet har, jo lenger er elektronene til det ytre energinivået plassert fra kjernen, jo høyere polariserbarhet og høyere surhet.
Eksempel: CH- NH- OH- SH-
økning i E.O. og surhet
C, N, O - elementer fra samme periode. E.O. vokser over perioden, surheten øker. I dette tilfellet vil polariserbarheten ikke påvirke surheten.
Polariserbarheten til atomer i en periode endres litt, så hovedfaktoren som bestemmer surhetsgraden er E.O.
Tenk nå på OH-SH-
økt surhet
O, S - er i samme gruppe, radiusen i gruppen øker fra topp til bunn, derfor øker polariserbarheten til atomet også, noe som fører til en økning i surhet. S har en større atomradius enn O, så tioler viser sterkere sure egenskaper sammenlignet med alkoholer.
Sammenlign tre forbindelser: etanol, etantiol og aminoetanol:
H 3 C - CH 2 - HAN, H 3 C - CH 2 - SH og H 3 C - CH 2 - N.H. 2
- 1. La oss sammenligne med radikale - de er like;
- 2. Av natur heteroatomet i den funksjonelle gruppen: S og O er i samme gruppe, men S har en større atomradius og høyere polariserbarhet, derfor har etantiol sterkere sure egenskaper
- 3. La oss nå sammenligne O og N. O har en høyere EO, derfor vil surheten til alkoholer være høyere.
- 2. Påvirkningen av hydrokarbonradikalet og substituentene som er tilstede i det
Det er nødvendig å gjøre elevene oppmerksom på at forbindelsene som sammenlignes må ha samme syresenter og samme løsemiddel.
Elektrontiltrekkende (E.A.) substituenter bidra til delokalisering av elektrontetthet, noe som fører til stabiliteten til anionet og følgelig en økning i surhet.
Elektrondonerende (E.D.) substituenter tvert imot bidrar de til konsentrasjonen av elektrontetthet i syresenteret, noe som fører til en reduksjon i surhet og en økning i basicitet.
For eksempel: monohydriske alkoholer viser svakere sure egenskaper sammenlignet med fenoler.
Eksempel: H 3 C > CH 2 > OH
- 1. Syresenteret er det samme
- 2. Løsemidlet er det samme
I monohydriske alkoholer skifter elektrontettheten fra hydrokarbonradikalet til OH-gruppen, dvs. radikalet viser en +I-effekt, da konsentreres en stor mengde elektrontetthet på OH-gruppen, som et resultat av at H + er tettere bundet til O og det er vanskelig å bryte O-H-bindingen, derfor viser enverdige alkoholer svake sure egenskaper .
I fenol, tvert imot, er benzenringen E.A., og OH-gruppen er E.D.
På grunn av det faktum at hydroksylgruppen går inn i felles konjugasjon med benzenringen, skjer delokalisering av elektrontettheten i fenolmolekylet og surheten øker, fordi konjugering er alltid ledsaget av en økning i sure egenskaper.
En økning i hydrokarbonradikalet i monokarboksylsyrer påvirker også endringen i sure egenskaper, og når substituenter introduseres i hydrokarbonet, oppstår en endring i sure egenskaper.
Eksempel: I karboksylsyrer, ved dissosiasjon, dannes karboksylationer - de mest stabile organiske anionene.

I karboksylationet er den negative ladningen på grunn av p, p-konjugering fordelt likt mellom de to oksygenatomene, dvs. det er delokalisert og følgelig mindre konsentrert, derfor er syresenteret i karboksylsyrer sterkere enn i alkoholer og fenoler.



Med en økning i hydrokarbonradikalet, som spiller rollen som E.D. surheten til monokarboksylsyrer avtar på grunn av reduksjonen i d + på karbonatomet til karboksylgruppen. Derfor, i den homologe serien av syrer, er maursyre den sterkeste.



Ved introduksjonen av E.A. substituent i et hydrokarbonradikal, for eksempel klor - surheten til forbindelsen øker, fordi på grunn av -I-effekten delokaliseres elektrontettheten og d + på C-atomet til karboksylgruppen øker, derfor vil trikloreddiksyre i dette eksemplet være den sterkeste.
3. Effekt av løsemiddel.
Samspillet mellom molekyler eller ioner av et oppløst stoff med et løsemiddel kalles en prosess løsning. Stabiliteten til et anion avhenger betydelig av dets solvatisering i løsning: jo mer ionet er solvatert, jo mer stabilt er det, og jo større solvatisering, jo mindre er størrelsen på ionet og jo mindre delokalisering av den negative ladningen i det.
Begrepene "syre" og "base" brukes for å referere til to grupper av forbindelser som har et sett med diametralt motsatte egenskaper. I 1923 foreslo I. Brønsted og T. Lowry en generell protolytisk teori om syrer og baser. I følge denne teorien tilsvarer følgende definisjoner begrepene syre og base.
En syre er et molekyl eller ion som er i stand til å donere et hydrogenkation (proton). Syre er en protondonor.
En base er et molekyl eller ion som er i stand til å feste et hydrogenkation (proton). Basen er en protonakseptor.
En syre, som gir fra seg et proton, blir til en partikkel som har en tendens til å akseptere det, som kalles konjugert base:

Basen, legger til et proton, blir til en partikkel som har en tendens til å gi den bort, som kalles konjugert syre:

Kombinasjonen av en syre og dens konjugerte base eller en base og dens konjugerte syre kalles konjugerte syre-base-par.
Styrken til en syre bestemmes av dens evne til å donere et proton, dvs. en sterk syre er en aktiv protondonor. Styrken til syrer i vandige løsninger avtar i følgende rekkefølge:

Styrken til en base bestemmes av dens evne til å akseptere et proton, dvs. en sterk base er en aktiv protonakseptor. Styrken til baser i vandige løsninger, det vil si deres affinitet for protoner, avtar i serien:
Sterke syrer, som lett donerer et proton, omdannes til konjugerte baser, som ikke lett godtar et proton. Derfor er dissosiasjonen av disse syrene nesten irreversibel:
Svake syrer, som har problemer med å gi fra seg et proton, omdannes til konjugerte baser som aktivt aksepterer et proton, noe som gjør dissosiasjonen av svake syrer til en reversibel prosess, og likevekten forskyves mot den udissosierte formen:

Sterke og svake baser oppfører seg på lignende måte, og forvandles som et resultat av reaksjonen til de tilsvarende konjugatsyrene, dvs. i disse tilfellene er det også konjugerte syre-base-par:
Noen stoffer er i stand til å virke i noen reaksjoner som en protondonor, donere det til forbindelser som har høyere affinitet for protonet, og i andre - som en protonakseptor, og ta det bort fra forbindelser med lavere affinitet for protonet. Slike stoffer kalles amfolytter.
Amfolytter er molekyler eller ioner som både kan donere og akseptere et proton, og derfor inngår reaksjoner som er karakteristiske for både syrer og baser. Amfolytt viser egenskapene til en syre eller en base avhengig av hvilke stoffer den interagerer med. En typisk amfolytt er vann, siden det dannes både en sterk syre og en sterk base som et resultat av dens elektrolytiske dissosiasjon:
![]()
I tillegg interagerer vann med syrer, fungerer som en base, og med baser, og viser egenskapene til en syre:
Amfolytter er hydroksyder av noen metaller (Zn, Al, Pb, Sn, Cr):
Amfolytter er hydroanioner av flerbasiske syrer, for eksempel HCO 3-, HP0 4 2- og H2PO4-.
Amfolytter er også forbindelser hvis molekyler inneholder to forskjellige syre-base-grupper, for eksempel biologisk viktige a-aminosyrer. Som et resultat av overføringen av et proton fra karboksylgruppen til aminogruppen, transformeres α-aminosyremolekylet fra en tautomer* som ikke inneholder ladede grupper til en tautomer med en bipolar-ionisk (zwitterionisk) struktur. Dermed er a-aminosyrer preget av prototropisk tautomerisme(Pkt. 21.2.1).

I krystallinsk tilstand og i vandige løsninger er denne likevekten for α-aminosyrer nesten fullstendig forskjøvet mot tautomeren med en bipolar struktur. For glycin i en vandig løsning er innholdet av en tautomer med en bipolar ionisk struktur 223 000 ganger større enn for en annen tautomer.
På grunn av denne strukturelle egenskapen viser α-aminosyremolekyler sure egenskaper på grunn av ammoniumgruppen (NH 3 +), og basiske på grunn av den ioniserte karboksylgruppen (-COO-), som fungerer som amfolytter:

Som alle amfolytter er α-aminosyrer svake elektrolytter.
I følge den protolytiske teorien er syrer, baser og amfolytter protolitter, og prosessen med overføring av et proton fra en syre til en base kalles protolyse og forklares med at disse to stoffene har ulik affinitet for protoner. En syre-base-interaksjon involverer alltid to konjugerte syre-base-par, og protonoverføring skjer alltid mot dannelse av svakere syrer, inkludert konjugerte. Hvis tilbøyeligheten til reaktantene til å samhandle med et proton er tilsvarende, da protolytisk likevekt.
Protolytisk, eller syre-base, balanse etablert som et resultat av konkurranse om et proton(H+) mellom baser av interagerende konjugerte syre-base-par(NA, A- Og VN+, V). Den protolytiske likevekten skifter alltid mot dannelsen av en svakere syre:

Den protolytiske likevekten kan skjematisk representeres ved følgende diagram:

Protonoverføring skjer alltid fra en sterk syre Til til anion av en svak syre, som er ledsaget av fortrengning av en svak syre fra saltet under påvirkning av en sterkere syre.
Protolytisk likevekt observeres under ionisering av svake elektrolytter i vann (avsnitt 7.2). Således er ioniseringen av en svak syre i vandige løsninger en konsekvens av konkurranse om et proton mellom anionen til den svake syren og vann, som fungerer som en base, dvs. en protonakseptor. Denne prosessen er reversibel og er preget av en likevektskonstant K a:

Når en svak base interagerer med vann, fremmer sistnevnte, som fungerer som en protondonor, ioniseringen av denne basen, som er av likevektsnatur:
for svake elektrolyttsyrer og baser er preget av verdiene av surhetskonstanter K a og grunnleggende K b tilsvarende (avsnitt 7.2). Hvis disse konstantene karakteriserer den protolytiske interaksjonen av vann med en syre eller base av ett konjugatpar HA, A eller BH +, B, så er produktet av surhetskonstantene K a i grunnleggende Kb, komponenter i et gitt par er alltid lik det ioniske produktet av vann Kn 2 o = 1 * 10 -14 (ved 22 °C):
Disse uttrykkene lar oss erstatte basicitetskonstanten når det gjelder vandige løsninger Q eller grunnleggende indikator pKb svak base til surhetsgrad konstant K a eller surhetsgrad pK a konjugert syre av denne basen. I praksis, for å karakterisere de protolytiske egenskapene til en forbindelse, brukes vanligvis verdien rK a. Dermed styrken av ammoniakk i vann som base (pKb, = 4,76) kan karakteriseres ved surhetsindeksen til ammoniumionet NH4+, dvs. konjugatsyren: pKa (NH4+) = 14 - 4,76 - 9.24. Derfor, når det gjelder vandige løsninger, er det ikke behov for en spesiell tabell med konstanter eller indikatorer! basisitet, en enkelt surhetsskala presentert i tabellen er tilstrekkelig. 8.1, hvor egenskapene til baser er karakterisert ved konstanten K a eller surhetsindikator pK a deres konjugerte syrer. Den sterkeste syren i vandige løsninger er hydrogenkationet H+ (nærmere bestemt H3O+), og den sterkeste basen er OH- anionet. Omfanget pK a karakteriserer kvantitativt styrken til svake elektrolytter i vandige løsninger.
En svak syre er svakere, jo høyere dens pKa-verdi. En svak base er svakere, jo lavere pK-verdien til dens konjugerte syre er.
Betydning pK a er lik pH-verdien til en vandig løsning der en gitt svak elektrolytt er ionisert med 50 %: siden i dette tilfellet [A - ] = [HA], så K a= [H+] og pK a= pH. For eddiksyre i dens vandige løsning med pH = pK a (CH 3 COOH) = = 4,76, skjer likheten [CH 3 COO-] = [CH 3 COOH], og for en vandig løsning av ammoniakk er likheten = vil bli observert i en løsning med pH = pK og (NH4+) = 9,24.
I tillegg kommer verdien pK a lar deg bestemme pH-verdien til vandige løsninger der en gitt svak syre HA hovedsakelig finnes (99% eller mer) i form av et anion (A") - dette vil være i løsninger med pH > pKa+ 2; eller i form av molekyler (NA) - i løsninger med pH< pK a - 2. I intervallet ArH = pK a ± 2 en svak elektrolytt i vandige løsninger finnes i både ionisert og ikke-ionisert form i forholdet [A-]/[HA] fra 100:1 til 1: 100 hhv.

De gitte relasjonene tillater, å vite verdien pK a biosubstrat, bestemme hvilken form det vil være i ved en bestemt pH-verdi i kroppens vannsystemer. I tillegg kunnskap om størrelsen pK a av en svak elektrolytt lar deg beregne pH til vandige løsninger av denne elektrolytten hvis konsentrasjonen er kjent.
I følge Lowry-Bronsted-teorien er syrer stoffer som kan donere et proton, baser er stoffer som aksepterer et proton:
Hvis B er en sterk base, så er det en svak syre. Med hjelpen kan du karakterisere graden av dissosiasjon av en syre eller konjugert syre. Sammen med surhetskonstanten er det også begrepet basicitetskonstanten og dens tilsvarende
![]()
Ifølge Lewis teori er syrer forbindelser som kan akseptere og baser kan donere et par elektroner.
I vid forstand er syrer forbindelser som forsyner et kation, i et spesielt tilfelle et proton, eller aksepterer et par elektroner med et atom eller en gruppe atomer, etc.).
Baser aksepterer et kation, i et spesielt tilfelle et proton, eller gir et elektronpar med et atom eller en gruppe atomer
Surheten eller basiciteten til et stoff manifesteres i prosessen med interaksjon med et annet stoff, spesielt med et løsningsmiddel, og er derfor relativt.
Mange stoffer har amfotere egenskaper. For eksempel er vann, alkoholer og syrer i stand til å donere et proton når de interagerer med baser, og aksepterer det med syrer. I fravær av syrer og baser manifesteres den doble naturen til slike forbindelser i autoprotolyse:
Dissosiasjon av en syre i et løsningsmiddel betyr overføring av et proton til løsningsmidlet:
![]()
I denne forbindelse uttrykkes styrken til syren ved dissosiasjonskonstanten, som kun er karakteristisk for et gitt løsningsmiddel. Protonoverføring skjer bare i sterkt ioniserende og solvaterende løsningsmidler, som vann.
Graden av syredissosiasjon under overgangen fra et vandig til et organisk medium avtar med 4-6 størrelsesordener.
Sterkt solvaterende og ioniserende løsningsmidler nøytraliserer styrken til syrer, mens ikke-polare og lav-iolære løsningsmidler, som interagerer med dem på nivå med hydrogenbindinger, har en differensierende effekt. I sistnevnte tilfelle blir forskjellene i syrestyrke større.
I inerte, ikke-polare løsningsmidler er sannsynligheten for protonabstraksjon svært lav, selv om bindingen på grunn av interne elektroniske effekter kan være sterkt polarisert. Under slike forhold manifesterer sure egenskaper seg i selvassosiasjon av HA-molekyler eller i assosiasjon med protonakseptorer - baser. I sistnevnte tilfelle er surhetsmålet assosiasjonskonstanten med en hvilken som helst base valgt som standard. For eksempel er assosiasjonskonstanten for benzosyre og difenylguanidin i benzen
Protoniseringskraften til en syre uttrykkes også gjennom surhetsfunksjonen, som karakteriserer likevektstilstanden under kompleks dannelse av syrer og baser i organiske løsemidler. Indikatorer som endrer farge avhengig av syrens styrke brukes oftest som baser, noe som gjør det mulig å studere systemet med spektroskopiske metoder. I dette tilfellet er det viktig at båndene til assosierte frie baser identifiseres i spekteret.
Så, i et introduksjonsmedium, danner syrer og baser solvatiserte ioner, i et organisk medium - ionepar og deres tilknyttede.
Nært i betydningen begrepet assosiasjon er begrepet kompleksering: på grunn av donor-akseptor- og dativ-interaksjoner kan elektron-donor-akseptorkomplekser, også kalt ladningsoverføringskomplekser, dannes fra ioner og molekyler
Typer elektrondonorer: I) forbindelser med heteroatomer. som inneholder ensomme par av elektroner, etere, aminer, sulfider, jodider, etc. For eksempel: dietyleter fra lampn. ljodid
2) forbindelser som inneholder - bindinger, etylener, acetylener, benzen og dets derivater og andre aromatiske systemer;
3) forbindelser som er i stand til å overføre elektroner - alkaner, sykloalkaner:

Typer elektronakseptorer: 1) metallforbindelser som inneholder en ledig orbital (K-orbital): halogenider, etc., metallioner
2) forbindelser som er i stand til å akseptere et par elektroner per ledig antibindende halogen, blandede halogener
3) forbindelser med -bindinger med sterkt elektronegative substituenter, som deltar i kompleksdannelse på grunn av antibindende tetracyanetylen trinitrobenzen
Dermed kan enten giveren samhandle med den ledige akseptoren, og danne en ny MO med en reduksjon i energien til systemet:

I organisk kjemi er -komplekser av størst betydning og -komplekser er preget av ustabilitetskonstanter, som i hovedsak er konstantene for deres dissosiasjon.
Dissosiasjons- og assosiasjonskonstantene til syrer og baser beskriver fortsatt ikke deres egenskaper fullt nok. En viktig rolle i å forstå mange kjemiske prosesser, og spesielt fenomenet katalyse, ble spilt av begrepet harde og myke syrer og baser (prinsippet
ZHMKO). I samsvar med dette konseptet samhandler relaterte syrer og baser mest effektivt: en myk syre med en myk base, en hard med en hard.
Tegn på harde syrer og baser (tabell 8): 1) liten størrelse på ionet eller molekylet; 2) høy elektronegativitet; 3) lokalisert ladning; 4) lav polariserbarhet; 5) laveste ledige orbitaler (LVO) av syrer har høy energi; 6) de høyest fylte orbitalene (HFO) av basene har lav energi.
Ifølge Lewis vurderes de sure og basiske egenskapene til organiske forbindelser ut fra deres evne til å akseptere eller gi et elektronpar og deretter danne en binding. Et atom som aksepterer et elektronpar er en elektronakseptor, og en forbindelse som inneholder et slikt atom bør klassifiseres som en syre. Atomet som gir et elektronpar er en elektrondonor, og forbindelsen som inneholder et slikt atom er en base.
Spesifikt kan Lewis-syrer være et atom, molekyl eller kation: et proton, halogenider av elementer fra den andre og tredje gruppen i det periodiske systemet, overgangsmetallhalogenider - BF3, ZnCl2, AlCl3, FeCl3, FeBr3, TiCl4, SnCl4, SbCl5, metallkationer, svovelsyreanhydrid - SO3, karbokation. Lewis-baser inkluderer aminer (RNH2, R2NH, R3N), alkoholer ROH, etere ROR
Ifølge Brønsted-Lowry er syrer stoffer som kan donere et proton, og baser er stoffer som kan ta imot et proton.
Konjugert syre og base:
HCN (sur) og CN- (base)
NH3 (base) og NH4+ (syre)
Syre-base (eller protolytisk) likevekt er en likevekt der et proton (H+) er involvert.
HCOOH + H 2 O D H 3 O + + HCOO -
syre2 base1
H2O + NH3D NH4+ + OH-.
syre1 base2 konjugat konjugat
syre2 base1
7. Typer isomeri i organisk kjemi. Strukturell, romlig og optisk isomeri. Kiralitet. Layout og konfigurasjon. R, S, Z, E – nomenklaturer.
Det er to typer isomerisme: strukturell og romlig (stereoisomerisme). Strukturelle isomerer skiller seg fra hverandre etter rekkefølgen av bindinger av atomer i molekylet, stereo-isomerer - ved arrangementet av atomer i rommet med samme rekkefølge av bindinger mellom dem.
Strukturell isomerisme: karbonskjelett-isomerisme, posisjonsisomerisme, isomerisme av ulike klasser av organiske forbindelser (interklasse-isomerisme).
Strukturell isomeri
Isomerisme av karbonskjelettet
 Posisjonell isomerisme skyldes forskjellige posisjoner av multippelbindingen, substituenten og funksjonell gruppe med det samme karbonskjelettet til molekylet:
Posisjonell isomerisme skyldes forskjellige posisjoner av multippelbindingen, substituenten og funksjonell gruppe med det samme karbonskjelettet til molekylet:
Romlig isomeri
Romlig isomeri er delt inn i to typer: geometrisk og optisk.
Geometrisk isomeri er karakteristisk for forbindelser som inneholder dobbeltbindinger og sykliske forbindelser. Siden fri rotasjon av atomer rundt en dobbeltbinding eller i en ring er umulig, kan substituentene være lokalisert enten på samme side av planet til dobbeltbindingen eller ringen (cis-posisjon) eller på motsatte sider (trans-posisjon).
 Optisk isomeri oppstår når et molekyl er uforenlig med bildet i et speil. Dette er mulig når karbonatomet i molekylet har fire forskjellige substituenter. Dette atomet kalles asymmetrisk.
Optisk isomeri oppstår når et molekyl er uforenlig med bildet i et speil. Dette er mulig når karbonatomet i molekylet har fire forskjellige substituenter. Dette atomet kalles asymmetrisk.
KIRALITET, egenskapen til et objekt å være uforenlig med bildet i et ideelt plan speil.
Ulike romlige strukturer som oppstår på grunn av rotasjon rundt enkle bindinger uten å krenke molekylets integritet (uten å bryte kjemiske bindinger) kalles KONFORMASJONER.
Struktur av alkaner. Sp3 er tilstanden til karbon. Kjennetegn på C-C og CH-bindinger. Prinsippet om fri rotasjon. Konfirmasjon. Metoder for representasjon og nomenklatur. Fysiske egenskaper til alkaner.
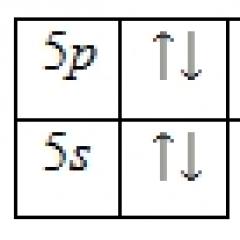
 Alle karbonatomer i alkanmolekyler er i tilstanden sp 3 -hybridisering, vinkelen mellom C-C-bindingene er 109°28", derfor har molekylene til normale alkaner med et stort antall karbonatomer en sikksakkstruktur (sikksakk). Lengden på C-C-bindingen i mettede hydrokarboner er 0,154 nm
Alle karbonatomer i alkanmolekyler er i tilstanden sp 3 -hybridisering, vinkelen mellom C-C-bindingene er 109°28", derfor har molekylene til normale alkaner med et stort antall karbonatomer en sikksakkstruktur (sikksakk). Lengden på C-C-bindingen i mettede hydrokarboner er 0,154 nm
C-C-bindingen er kovalent ikke-polar. CH-bindingen er kovalent og svakt polar, siden C og H er nære i elektronegativitet.
Fysiske egenskaper
Under normale forhold er de fire første medlemmene av den homologe serien av alkaner gasser, C 5 - C 17 er væsker, og starter fra C 18 er faste stoffer. Smelte- og kokepunktene til alkaner av deres tetthet øker med økende molekylvekt. Alle alkaner er lettere enn vann og er uløselige i det, men de er løselige i ikke-polare løsningsmidler (for eksempel benzen) og er i seg selv gode løsningsmidler.
· Smelte- og kokepunkt synker fra mindre forgrenet til mer forgrenet.
· Gassformige alkaner brenner med en fargeløs eller lyseblå flamme og avgir store mengder varme.
Rotasjon av atomer rundt s-bindingen vil ikke føre til at den brytes. Som et resultat av intramolekylær rotasjon langs C–C s-bindinger, kan alkanmolekyler, som starter med etan C 2 H 6, anta forskjellige geometriske former.
Ulike romlige former av et molekyl som forvandles til hverandre ved å rotere rundt C–C s-bindinger kalles konformasjoner eller roterende isomerer(konformatorer).
Rotasjonsisomerer av et molekyl er dets energisk ulik tilstand. Deres interkonvertering skjer raskt og konstant som et resultat av termisk bevegelse. Derfor kan ikke roterende isomerer isoleres i individuell form, men deres eksistens er bevist ved fysiske metoder.
alkaner
.
metan, etan, propan, butan
-en
9. Hydrokarboner. Klassifisering. Mettede hydrokarboner av metanserien. Homolog serie. Nomenklatur. Isomerisme. Radikale. Naturlige kilder. Fischer-Tropsch syntese. Fremstillingsmetoder (fra alkener, karboksylsyrer, halogenderivater, ved Wurtz-reaksjonen)
Det generelle (generiske) navnet på mettede hydrokarboner er alkaner
.
Navnene på de fire første medlemmene av den homologe metan-serien er trivielle: metan, etan, propan, butan
. Fra og med den femte er navnene avledet fra greske tall med tillegg av et suffiks -en
Radikaler (hydrokarbonradikaler) har også sin egen nomenklatur. Monovalente radikaler kalles alkyler
og er betegnet med bokstaven R eller Alk.
Deres generelle formel er C n H 2n+ 1 .
Navnene på radikalene er bygd opp av navnene på de tilsvarende hydrokarboner ved å erstatte suffikset -enå suffikse -il(metan - metyl, etan - etyl, propan - propyl, etc.).
Toverdige radikaler navngis ved å erstatte suffikset -en på -iliden(unntak er metylenradikalet = CH 2).
Treverdige radikaler har suffikset -ilidin
Isomerisme. Alkaner er preget av strukturell isomerisme. Hvis et alkanmolekyl inneholder mer enn tre karbonatomer, kan rekkefølgen på forbindelsen deres være annerledes. En av isomerene av butan ( n-butan) inneholder en uforgrenet karbonkjede, og den andre, isobutan, inneholder en forgrenet (isostruktur).
Den viktigste kilden til alkaner i naturen er naturgass, mineralske hydrokarbonråvarer - olje og tilhørende petroleumsgasser.
Alkaner kan fremstilles ved Wurtz-reaksjonen, som involverer virkningen av metallisk natrium på monohalogenderivater av hydrokarboner.
2CH 3 –CH 2 Br (etylbromid) + 2Na ––> CH 3 –CH 2 –CH 2 –CH 3 (butan) + 2NaBr
· Fra alkener
CnH2n + H2 → CnH2n+2
Fischer-Tropsch syntese
nCO + (2n+1)H 2 → C n H 2n+2 + nH 2 O
Tabellen viser at disse hydrokarbonene skiller seg fra hverandre i antall grupper - CH2- En slik serie med lignende strukturer, som har lignende kjemiske egenskaper og skiller seg fra hverandre i antall av disse gruppene kalles en homolog serie. Og stoffene som utgjør den kalles homologer.
| Formel | Navn |
| CH 4 | metan |
| C2H6 | etan |
| C3H 8 | propan |
| C4H10 | butan |
| C4H10 | isobutan |
| C5H12 | pentan |
| C5H12 | isopentan |
| C5H12 | neopentan |
| C6H14 | heksan |
| C 7 H 16 | heptan |
| C10H 22 | dekanus |
10. Mettede hydrokarboner (alkaner). Kjemiske og fysiske egenskaper: radikale substitusjonsreaksjoner. Halogenering, nitridering, sulfoklorering, sulfoksidering. Konseptet med kjedereaksjoner.
Fysiske egenskaper
Under normale forhold er de fire første medlemmene av den homologe serien av alkaner gasser, C 5 - C 17 er væsker, og starter fra C 18 er faste stoffer. Smelte- og kokepunktene til alkaner av deres tetthet øker med økende molekylvekt. Alle alkaner er lettere enn vann og er uløselige i det, men de er løselige i ikke-polare løsningsmidler (for eksempel benzen) og er i seg selv gode løsningsmidler.
Ifølge Lewis vurderes de sure og basiske egenskapene til organiske forbindelser ut fra deres evne til å akseptere eller gi et elektronpar og deretter danne en binding. Et atom som aksepterer et elektronpar er en elektronakseptor, og en forbindelse som inneholder et slikt atom bør klassifiseres som en syre. Atomet som gir et elektronpar er en elektrondonor, og forbindelsen som inneholder et slikt atom er en base.
Spesifikt kan Lewis-syrer være et atom, molekyl eller kation: et proton, halogenider av elementer fra den andre og tredje gruppen i det periodiske systemet, overgangsmetallhalogenider - BF3, ZnCl2, AlCl3, FeCl3, FeBr3, TiCl4, SnCl4, SbCl5, metallkationer, svovelsyreanhydrid - SO3, karbokation. Lewis-baser inkluderer aminer (RNH2, R2NH, R3N), alkoholer ROH, etere ROR
Ifølge Brønsted-Lowry er syrer stoffer som kan donere et proton, og baser er stoffer som kan ta imot et proton.
Konjugert syre og base:
HCN (sur) og CN- (base)
NH3 (base) og NH4+ (syre)
Syre-base (eller protolytisk) likevekt er en likevekt der et proton (H+) er involvert.
HCOOH + H 2 O D H 3 O + + HCOO -
syre2 base1
H2O + NH3D NH4+ + OH-.
syre1 base2 konjugat konjugat
syre2 base1
7. Typer isomeri i organisk kjemi. Strukturell, romlig og optisk isomeri. Kiralitet. Layout og konfigurasjon. R, S, Z, E – nomenklaturer.
Det er to typer isomerisme: strukturell og romlig (stereoisomerisme). Strukturelle isomerer skiller seg fra hverandre etter rekkefølgen av bindinger av atomer i molekylet, stereo-isomerer - ved arrangementet av atomer i rommet med samme rekkefølge av bindinger mellom dem.
Strukturell isomerisme: karbonskjelett-isomerisme, posisjonsisomerisme, isomerisme av ulike klasser av organiske forbindelser (interklasse-isomerisme).
Strukturell isomeri
Isomerisme av karbonskjelettet
 Posisjonell isomerisme skyldes forskjellige posisjoner av multippelbindingen, substituenten og funksjonell gruppe med det samme karbonskjelettet til molekylet:
Posisjonell isomerisme skyldes forskjellige posisjoner av multippelbindingen, substituenten og funksjonell gruppe med det samme karbonskjelettet til molekylet:
Romlig isomeri
Romlig isomeri er delt inn i to typer: geometrisk og optisk.
 Geometrisk isomeri er karakteristisk for forbindelser som inneholder dobbeltbindinger og sykliske forbindelser. Siden fri rotasjon av atomer rundt en dobbeltbinding eller i en ring er umulig, kan substituentene være lokalisert enten på samme side av planet til dobbeltbindingen eller ringen (cis-posisjon) eller på motsatte sider (trans-posisjon).
Geometrisk isomeri er karakteristisk for forbindelser som inneholder dobbeltbindinger og sykliske forbindelser. Siden fri rotasjon av atomer rundt en dobbeltbinding eller i en ring er umulig, kan substituentene være lokalisert enten på samme side av planet til dobbeltbindingen eller ringen (cis-posisjon) eller på motsatte sider (trans-posisjon).

 Optisk isomeri oppstår når et molekyl er uforenlig med bildet i et speil. Dette er mulig når karbonatomet i molekylet har fire forskjellige substituenter. Dette atomet kalles asymmetrisk.
Optisk isomeri oppstår når et molekyl er uforenlig med bildet i et speil. Dette er mulig når karbonatomet i molekylet har fire forskjellige substituenter. Dette atomet kalles asymmetrisk.
KIRALITET, egenskapen til et objekt å være uforenlig med bildet i et ideelt plan speil.
Ulike romlige strukturer som oppstår på grunn av rotasjon rundt enkle bindinger uten å krenke molekylets integritet (uten å bryte kjemiske bindinger) kalles KONFORMASJONER.
Struktur av alkaner. Sp3 er tilstanden til karbon. Kjennetegn på C-C og CH-bindinger. Prinsippet om fri rotasjon. Konfirmasjon. Metoder for representasjon og nomenklatur. Fysiske egenskaper til alkaner.