Strukturen til telluratomet. Tellur. Beskrivelse av tellur. Egenskaper til tellur Hvilken familie tilhører tellur?
DEFINISJON
Tellur lokalisert i den femte perioden av VI-gruppen til hoved (A) undergruppen av det periodiske systemet.
Refererer til elementer s-familier. Metalloid. Betegnelse - Te. Serienummer - 52. Relativ atommasse - 127,60 amu.
Elektronisk struktur av telluratomet
Et telluratom består av en positivt ladet kjerne (+52), inni denne er det 52 protoner og 76 nøytroner, og 52 elektroner beveger seg rundt i fem baner.
Figur 1. Skjematisk struktur av et telluratom.
Fordelingen av elektroner mellom orbitaler er som følger:
52Te) 2) 8) 18) 18) 6 ;
1s 2 2s 2 2s 6 3s 2 3s 6 3d 10 4s 2 4s 6 4d 10 5s 2 5s 4 .
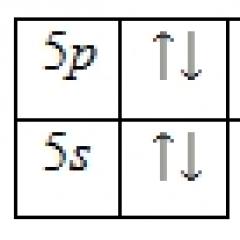
Det ytre energinivået til telluratomet inneholder 6 elektroner, som er valenselektroner. Energidiagrammet for grunntilstanden har følgende form:

Valenselektronene til et telluratom kan karakteriseres av et sett med fire kvantetall: n(hovedkvante), l(orbital), m l(magnetisk) og s(snurre rundt):
|
Undernivå |
||||
Eksempler på problemløsning
EKSEMPEL 1
For partiklene S +6, S 0, S +4 og S -2 vil altså det totale antallet elektroner i elektronskall være henholdsvis 10, 16, 12 og 18. Da vil tabellen se slik ut:
EKSEMPEL 2
For partiklene C +4, Al +3, F og C 0 vil altså det totale antallet elektroner i elektronskall være lik henholdsvis 2, 10, 10 og 6. Da vil tabellen se slik ut:
|
tellur element, tellur Wikipedia
Tellur / Tellur (Te), 52
(molar masse)
127,60(3) a. e.m. (g/mol)
(+6e) 56.211 (−2e) pm
2.1 (Pauling-skala)
6, +4 , +2, −2
(første elektron)
869,0 (9,01) kJ/mol (eV)
17,91 kJ/mol
49,8 kJ/mol
25,8 J/(K mol)
20,5 cm³/mol
sekskantet
(300 K) 14,3 W/(m K)
| 52 | |
| Te 127,60 | |
| 4d105s25p4 | |
Tellur- kjemisk element i den 16. gruppen (i henhold til den utdaterte klassifiseringen - hovedundergruppen til gruppe VI, kalkogener), 5. periode i det periodiske systemet, har atomnummer 52; angitt med symbolet Te(lat. Tellur), tilhører familien av metalloider.
- 1. Historie
- 2 Opprinnelsen til navnet
- 3 Å være i naturen
- 3.1 Innskuddstyper
- 4 Kvittering
- 4.1 Priser
- 5 Fysiske egenskaper
- 6 Kjemiske egenskaper
- 7 isotoper
- 8 Søknad
- 8.1 Legeringer
- 8.2 Termoelektriske materialer
- 8.3 Halvledere med smale gap
- 8.4 Superledning ved høy temperatur
- 8.5 Gummiproduksjon
- 8.6 Produksjon av kalkogenidglass
- 8.7 Lyskilder
- 8.8 CD-RW
- 9 Biologisk rolle
- 9.1 Fysiologisk effekt
- 10 notater
- 11 lenker
Historie
Den ble først oppdaget i 1782 i gullmalmene i Transylvania av gruveinspektør Franz Joseph Müller (senere baron von Reichenstein), på territoriet til Østerrike-Ungarn. I 1798 isolerte Martin Heinrich Klaproth tellur og bestemte dets viktigste egenskaper.
opprinnelse til navnet
Fra latin tellus, genitiv telluris, jord.
Å være i naturen
Innholdet i jordskorpen er 1·10−6 % av massen. Omtrent 100 tellurmineraler er kjent. De vanligste telluridene er kobber, bly, sink, sølv og gull. En isomorf blanding av tellur er observert i mange sulfider, men Te - S isomorfismen er mindre uttalt enn i Se - S-serien, og sulfider inneholder en begrenset blanding av tellur. Blant tellurmineraler er altaitt (PbTe), sylvanitt (AgAuTe4), kalaveritt (AuTe2), hessitt (Ag2Te), krenneritt, petsitt (Ag3AuTe2), mutmannitt, montbreuite (Au2Te3), nagiagitt (4S2), tetradymite (B) av spesielt betydning. Det er oksygenforbindelser av tellur, for eksempel TeO2 - tellur oker.
Native tellur forekommer også sammen med selen og svovel (japansk tellurisk svovel inneholder 0,17 % Te og 0,06 % Se).
Typer innskudd
De fleste av de nevnte mineralene er utviklet i lavtemperatur-gull-sølvforekomster, hvor de vanligvis isoleres etter hoveddelen av sulfider sammen med naturlig gull, sulfosalter av sølv, bly og også med vismutmineraler. Til tross for utviklingen av et stort antall tellurmineraler, er hoveddelen av tellur som utvinnes av industrien en del av sulfider av andre metaller. Spesielt tellur, i litt mindre grad enn selen, er inkludert i sammensetningen av koparkis i kobber-nikkel-forekomster av magmatisk opprinnelse, så vel som kopiritt utviklet i hydrotermiske kobberkis. Tellur finnes også i pyritt, kalkopiritt, molybdenitt og galena av porfyrkobbermalmforekomster, polymetalliske forekomster av Altai-typen, galena av bly-sinkavsetninger assosiert med skarns, sulfid-kobolt, antimon-kvikksølv og noen andre. Tellurinnholdet i molybdenitt varierer fra 8-53 g/t, i kopiritt 9-31 g/t, i svovelkis - opptil 70 g/t.
Kvittering
Hovedkilden er slam fra elektrolytisk raffinering av kobber og bly. Slammet brennes, telluren forblir i slagg, som vaskes med saltsyre. Tellur isoleres fra den resulterende saltsyreløsningen ved å føre svoveldioksid SO2 gjennom den.
Svovelsyre tilsettes for å skille selen og tellur. I dette tilfellet faller tellurdioksid TeO2 ut, og H2SeO3 forblir i løsning.
Tellur reduseres fra TeO2-oksid med kull.
For å rense tellur fra svovel og selen brukes dets evne, under påvirkning av et reduksjonsmiddel (Al, Zn) i et alkalisk medium, til å omdannes til løselig dinatriumditellurid Na2Te2:
For å felle ut tellur føres luft eller oksygen gjennom løsningen:
For å oppnå tellur av spesiell renhet, kloreres det
Det resulterende tetrakloridet renses ved destillasjon eller rektifisering. Tetrakloridet blir deretter hydrolysert med vann:
,og den resulterende TeO2 reduseres med hydrogen:
Priser
Tellur er et sjeldent grunnstoff, og betydelig etterspørsel med et lite produksjonsvolum bestemmer den høye prisen (omtrent $200–300 per kg, avhengig av renhet), men til tross for dette utvides bruksområdet stadig.
Fysiske egenskaper
Tellur er et sprøtt, sølvhvitt stoff med en metallisk glans. i tynne lag, når de utsettes for lys, rød-brun, i par, gyllen-gul. Ved oppvarming blir det plastikk. Krystallgitteret er sekskantet. Den termiske ekspansjonskoeffisienten er 1,68·10-5 K−1. Diamagnetisk. Halvleder med et båndgap på 0,34 eV, type ledningsevne - p under normale forhold og ved forhøyede temperaturer, n - ved lave temperaturer (overgangsgrense - fra minus 80 til minus 100 ° C, avhengig av renhet).
Kjemiske egenskaper
I kjemiske forbindelser viser tellur oksidasjonstilstander –2; +2; +4; +6. Det er en analog av svovel og selen, men er kjemisk mindre aktiv enn svovel. Det oppløses i alkalier, er mottakelig for virkningen av salpetersyre og svovelsyre, men er dårlig løselig i fortynnet saltsyre. Tellurmetall begynner å reagere med vann ved 100 °C.
Med oksygen danner det forbindelser TeO, TeO2, TeO3. i pulverform oksiderer det i luft selv ved romtemperatur, og danner TeO2-oksid. Når den varmes opp i luft, brenner den og danner TeO2 - en sterk forbindelse som er mindre flyktig enn tellur i seg selv. Denne egenskapen brukes til å rense tellur fra oksider, som reduseres med flytende hydrogen ved en temperatur på 500-600 °C. Tellurdioksid er dårlig løselig i vann, men løselig i sure og alkaliske løsninger.
I smeltet tilstand er tellur ganske inert, så grafitt og kvarts brukes som beholdermaterialer når det smeltes.
Tellur danner en forbindelse med hydrogen ved oppvarming, reagerer lett med halogener, og interagerer med svovel og fosfor og metaller. Når den reagerer med konsentrert svovelsyre, danner den sulfitt. Danner svake syrer: hydrotellursyre (H2Te), tellursyre (H2TeO3) og tellursyre (H6TeO6), hvorav de fleste saltene er dårlig løselige i vann.
Isotoper
Hovedartikkel: Isotoper av tellurDet er 38 kjente nuklider og 18 kjernefysiske isomerer av tellur med atomnummer fra 105 til 142. Tellur er det letteste grunnstoffet, hvis kjente isotoper er utsatt for alfa-forfall (isotoper fra 106Te til 110Te). Atommassen til tellur (127,60 g/mol) overstiger atommassen til det neste grunnstoffet, jod (126,90 g/mol).
Åtte isotoper av tellur forekommer i naturen. Seks av dem, 120Te, 122Te, 123Te, 124Te, 125Te og 126Te, er stabile. De resterende to - 128Te og 130Te - er radioaktive, begge gjennomgår dobbelt beta-forfall, og blir til xenon-isotop henholdsvis 128Xe og 130Xe. Stabile isotoper utgjør bare 33,3 % av den totale mengden tellur som finnes i naturen, noe som er muliggjort av de ekstremt lange halveringstidene til naturlige radioaktive isotoper. De varierer fra 7,9·1020 til 2,2·1024 år. Isotopen 128Te har den lengste bekreftede halveringstiden for noen radionuklid - 2,2 1024 år eller 2,2 septillioner år, som er omtrent 160 billioner ganger universets beregnede alder.
applikasjon
Legeringer
Tellur brukes i produksjon av blylegeringer med økt duktilitet og styrke (brukes for eksempel ved produksjon av kabler). Med innføring av 0,05 % tellur reduseres tapet av bly på grunn av oppløsning under påvirkning av svovelsyre med 10 ganger, og dette brukes i produksjonen av blysyrebatterier. Det er også viktig at bly legert med tellur ikke mykner når det behandles av plastisk deformasjon, og dette gjør det mulig å bruke teknologien for å produsere batteriplatestrømsamlere ved bruk av kaldskjæringsmetoden og øke batteriets levetid og spesifikke egenskaper betydelig. .
Termoelektriske materialer
Vismut tellurid enkrystallDens rolle er også stor i produksjonen av halvledermaterialer og spesielt tellurider av bly, vismut, antimon og cesium. I de kommende årene vil produksjonen av lantanidtellurider, deres legeringer og legeringer med metallselenider bli svært viktig for produksjon av termoelektriske generatorer med svært høy (opptil 72-78%) effektivitet, som vil gjøre det mulig å bruke dem i energisektoren og i bilindustrien.
For eksempel ble det nylig oppdaget en svært høy termisk emf i mangantellurid (500 μV/K) og i kombinasjon med vismut, antimon og lantanidselenider, noe som gjør det mulig ikke bare å oppnå en meget høy effektivitet i termogeneratorer, men også å implementere det i ett trinn halvlederkjøleskap nedkjøling til kryogene (temperaturnivå av flytende nitrogen) temperaturer og enda lavere. Det beste tellurbaserte materialet for produksjon av halvlederkjøleskap de siste årene har vært en legering av tellur, vismut og cesium, som gjorde det mulig å oppnå rekordavkjøling ned til -237 °C. Samtidig, som et termoelektrisk materiale, er en tellur-selen-legering (70 % selen), som har en termo-EMF-koeffisient på ca. 1200 μV/K, lovende.
Halvledere med smale gap
CRT (kadmium-kvikksølv-tellur) legeringer har også fått helt eksepsjonell betydning, som har fantastiske egenskaper for å oppdage stråling fra rakettoppskytinger og observere fienden fra verdensrommet gjennom atmosfæriske vinduer (skydekke spiller ingen rolle). MCT er et av de dyreste materialene i den moderne elektronikkindustrien.
Høy temperatur superledning
En rekke tellurholdige systemer har nylig oppdaget at det eksisterer tre (muligens fire) faser i dem, der superledning ikke forsvinner ved en temperatur litt over kokepunktet til flytende nitrogen.
Gummiproduksjon
Et eget bruksområde for tellur er bruken i prosessen med gummivulkanisering.
Produksjon av kalkogenidglass
Tellur brukes til smelting av spesielle glasskvaliteter (hvor det brukes i form av dioksid); spesielle glass dopet med sjeldne jordmetaller brukes som aktive stoffer i optiske kvantegeneratorer.
I tillegg er noen tellurbaserte briller halvledere, en egenskap som brukes i elektronikk.
Spesielle grader av tellurglass (fordelene med slikt glass er gjennomsiktighet, smelteevne og elektrisk ledningsevne) brukes i konstruksjonen av spesielt kjemisk utstyr (reaktorer).
Kilder til lys
Tellur finner begrenset bruk i produksjonen av lamper med sine damp - de har et spekter som er veldig nært solens.
CD-RW
Tellurlegering brukes i overskrivbare CD-plater (spesielt Mitsubishi Chemical Corporation-merket "Verbatim") for å lage et deformerbart reflekterende lag.
Biologisk rolle
Mikromengder tellur finnes alltid i levende organismer; dens biologiske rolle er ikke klar.
Fysiologisk virkning
Tellur og dets flyktige forbindelser er giftige. Hvis det kommer inn i kroppen, forårsaker det kvalme, bronkitt og lungebetennelse. MPC i luft varierer for ulike forbindelser 0,007-0,01 mg/m³, i vann 0,001-0,01 mg/l. Kreftfremkallende virkning av tellur er ikke bekreftet.
Generelt er tellurforbindelser mindre giftige enn selenforbindelser.
Ved forgiftning skilles tellur ut fra kroppen i form av illeluktende flyktige organotellurforbindelser - alkyltellurider, hovedsakelig dimetyltellurid (CH3)2Te. Lukten deres minner om hvitløk, så når selv små mengder tellur kommer inn i kroppen, får luften som en person puster ut denne lukten, som er et viktig symptom på tellurforgiftning.
Notater
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O'Connor, Thomas Walczyk, Shige Yoneda, Xiang-Kun Zhu. Atomvekter av grunnstoffene 2011 (IUPAC Technical Report) // Pure and Applied Chemistry. - 2013. - Vol. 85, nei. 5. - P. 1047-1078. - DOI:10.1351/PAC-REP-13-03-02.
- Tellur: elektronegativiteter (engelsk). WebElements. Hentet 5. august 2010.
- Leddicotte, G. W. (1961), "The radiochemistry of tellurium," Nuclear science series, Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council, s. 5,
- Redaksjon: Zefirov N. S. (sjefredaktør). Kjemisk leksikon: i 5 bind - Moskva: Soviet Encyclopedia, 1995. - T. 4. - S. 514. - 639 s. - 20 000 eksemplarer. - ISBN 5-85270-039-8.
- WebElements periodiske system for grunnstoffene | Tellur | krystallstrukturer
- Glinka N. L. Generell kjemi. - M.: "Kjemi", 1977, revidert. - S. 395. - 720 s.
- 1 2 3 4 Tellurium - artikkel fra Great Soviet Encyclopedia
- 1 2 G. Audi, O. Bersillon, J. Blachot og A. H. Wapstra (2003). "NUBASE-evalueringen av kjernefysiske og forfallsegenskaper." Kjernefysikk A 729 : 3–128. DOI:10.1016/j.nuclphysa.2003.11.001. Bibcode: 2003NuPhA.729....3A.
- Tellur-123 isotopen ble ansett som radioaktiv (β−aktiv med en halveringstid på 6·1014 år), men etter ytterligere målinger ble den funnet å være stabil innenfor eksperimentets følsomhet.
- 2,2 kvadrillioner år - på lang skala.
- Tellur. International Program on Chemical Safety (28. januar 1998). Hentet 12. januar 2007. Arkivert fra originalen 4. august 2012.
- Wright, P.L. (1966). "Komparativ metabolisme av selen og tellur hos sau og svin". AJP – Legacy 211 (1): 6–10. PMID 5911055.
- (1989) "Tellur-rus". Klinische Wochenschrift 67 (22): 1152–5. DOI:10.1007/BF01726117. PMID 2586020.
- Taylor, Andrew (1996). "Biokjemi av tellur". Biologisk sporelementforskning 55 (3): 231–239. DOI:10.1007/BF02785282. PMID 9096851.
Linker
- Tellur på Webelements
- Tellur på Popular Chemical Elements Library
| Tilkoblinger tellur | |
|---|---|
|
Tellurheksafluorid (TeF6) Tellurdioksyd (TeO2) Natriumorthotellurat (Na6TeO6) Ammoniumtellurat ((NH4)2TeO4) Beryllium tellurid (BeTe) Vismut(III) tellurid (Bi2Te3) Dikalium tellurid) (Kid2Turid) (Kid2T tellurid) (K2Turid) ) Tinntellurid (SnTe) Kvikksølvtellurid (HgTe) Blytellurid (PbTe) Sinktellurid (ZnTe) Kaliumtelluritt (K2TeO3) Natriumtelluritt (Na2TeO3) Tellursyre (H2TeO4 2H2O) Tellurtellurid (H2TeO3) Tellur (H2TeO3) Tellur (H2TeO4 2H2O) Tellur (H2T4T4 tellur) eBr4) Kaliumtetrahydroorthotellurat K2H4TeO6 Tellurtetrajodid (TeI4) Tellurtetrafluorid (TeF4) Tellurtetraklorid (TeCl4) Tellurtrioksid (TeO3) Dikaliumtritellurid (K2Te3) |
| Periodisk system for kjemiske elementer av D. I. Mendeleev | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | Han | ||||||||||||||||||||||||||||||
| 2 | Li | Være | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | NB | Mo | Tc | Ru | Rh | Pd | Ag | Cd | I | Sn | Sb | Te | Jeg | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Er | Cm | Bk | Jfr | Es | Fm | MD | Nei | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | UBP | Ubh | ||||||||||||||||||||||||
tellur Wikipedia, tellur Kharkov, tellur element, tellurium, tellur foto, telluritt, tellurium, tellur sorokin, tellur sorokin nedlasting, tellurocracy
Tellur informasjon om
Tellur er et kjemisk element i gruppe 16 (i henhold til den utdaterte klassifiseringen - hovedundergruppen til gruppe VI, kalkogener), periode 5 i det periodiske systemet, har atomnummer 52; betegnet med symbolet Te (lat. Tellur), tilhører familien av metalloider.
Innholdet i jordskorpen er 1·10-6 % av massen. Omtrent 100 tellurmineraler er kjent. De vanligste telluridene er kobber, bly, sink, sølv og gull.
En isomorf blanding av tellur er observert i mange sulfider, men Te - S isomorfismen er mindre uttalt enn i Se - S-serien, og sulfider inneholder en begrenset blanding av tellur. Blant tellurmineraler er altaitt (PbTe), sylvanitt (AgAuTe4), kalaveritt (AuTe2), hessitt (Ag2Te), krenneritt [(Au, Ag)Te], petsitt (Ag3AuTe2), mutmannitt [(Ag, Au)Te] av spesiell viktighet, montbreuite (Au2Te3), nagiagitt (4S5), tetradymitt (Bi2Te2S). Det er oksygenforbindelser av tellur, for eksempel TeO2 - tellur oker. Native tellur forekommer også sammen med selen og svovel (japansk tellurisk svovel inneholder 0,17 % Te og 0,06 % Se).
Reserver ved tellurforekomster i 2012, tonn *
| Peru | 3,600.0 |
| USA | 3,500.0 |
| Canada | 800.0 |
| Andre land | 16,100.0 |
| Totale beholdninger | 24,000.0 |
* Data fra US Geological Survey
Hovedkilden til tellur er slam som produseres under elektrolytisk rensing av blister (anodisk) kobber. For hver 500 tonn kobbermalm er det vanligvis ett pund (0,45 kg) tellur. Tellur produseres primært i USA, Kina, Belgia, Russland, Japan og Canada.
Anodeslurry inneholder selenider og tellurider av edle metaller i sammensetninger med formelen M2Se eller M2Te (M = Cu, Ag, Au). Ved temperaturer på 500 °C varmes anodeslammet opp med natriumkarbonat i nærvær av luft. Metallioner reduseres til metaller mens tellurid omdannes til natriumtelluritt - M2Te + O2 + Na2CO3 > Na2TeO3 + 2M + CO2.
Telluritter lekker fra blandinger med vann og er vanligvis tilstede som hydrotelluritter HTeO3– i løsning. Selenitter dannes også under denne prosessen, men de kan separeres ved å tilsette svovelsyre. Hydrotelluritter omdannes til uløselig tellurdioksid, mens selenitter forblir i løsning - HTeO3- + ОH– + H2SO4 > TeO2 + SO42- + 2H2O.
Reduksjon til metall gjøres enten ved elektrolyse eller ved omsetning av tellurdioksid med svoveldioksid i svovelsyre - TeO2 + 2 SO2 + 2H2O > Te + SO42- + 4H+.
Kommersiell kvalitet tellur selges vanligvis som et pulver og er også tilgjengelig i form av plater, ingots eller stenger.
Den største forbrukeren av tellur er metallurgi, hvor det brukes i jern, kobber og blylegeringer. Tilsetning av tellur til rustfritt stål og kobber gjør disse metallene mer bearbeidbare. Tilsetningen av tellur gjør det mulig å oppnå formbart støpejern, som når det smeltes, har fordelene til grått støpejern: flytende støping, støpeegenskaper og bearbeidbarhet. I bly forbedrer tellur styrke og holdbarhet og reduserer den korrosive effekten av svovelsyre.
Halvledere og elektronikk. Kadmiumtellurid (CdTe) brukes i solceller. Tester fra Renewable Energy Laboratory i USA har vist at dette materialet gir mange fordeler for driften av en ny generasjon solceller. Massiv kommersiell produksjon av solceller ved bruk av CdTe de siste årene har ført til en betydelig økning i etterspørselen etter tellur. Hvis noe av kadmiumet i CdTe erstattes med sink, dannes forholdet (Cd,Zn), som brukes i solid state røntgensensorer.
CRT (kadmium-kvikksølv-tellur) legeringer har fått helt eksepsjonell betydning, som har fantastiske egenskaper for å oppdage stråling fra rakettoppskytinger og observere fienden fra verdensrommet gjennom atmosfæriske vinduer (skydekke spiller ingen rolle). MCT er et av de dyreste materialene i den moderne elektronikkindustrien.
Organotellurid som etan-tellurid, dietyltellurid, diisopropyltellurid, dietyl- og metyltellurid, allyltellurid brukes som grunnlag for organometallisk vekstfaseepitaksi for å produsere flerlags halvlederforbindelser.
En rekke tellurholdige systemer har nylig oppdaget at det eksisterer tre (muligens fire) faser i dem, der superledning ikke forsvinner ved en temperatur litt over kokepunktet til flytende nitrogen.
Tellur som telluroksid brukes til å lage lag med overskrivbare optiske plater, inkludert Compact Discs ReWritable (CD-RW), ReWritable Blu-ray Digital Video Discs og ReWritable (DVD-RW).
Tellur brukes i nye faseendringsminnebrikker utviklet av Intel. Vismuttellurid (Bi2Te3) og blytellurid brukes i elementer av termoelektriske enheter. Blytellurid brukes også i infrarøde sensorer.
Andre bruksområder. Tellur brukes til å farge keramikk. Fenomenet med en sterk økning i optisk brytning etter tilsetning av selenider og tellurider til glass brukes i produksjon av glassfiber for telekommunikasjon. Blandinger av selen og tellur brukes med bariumperoksid som oksidasjonsmiddel i forsinkelsespulver for elektriske sprengningshetter.
Organiske tellurider brukes som initiatorer for radikal polymerisering; elektronrike mono- og ditellurider har antioksidantaktivitet. Tellur kan brukes i stedet for svovel eller selen for å vulkanisere gummi. Gummi produsert på denne måten viser forbedret termisk motstand. Telluritter brukes til å identifisere patogenene som er ansvarlige for difteri.
Tellurforbruket i land rundt om i verden er fordelt som følger: Kina - 80-100 tonn, Russland - 10 tonn, USA - 50-60 tonn. Totalt forbrukes det rundt 400 tonn tellur årlig i verden som helhet. Tabellen nedenfor gir omtrentlige data om tellurproduksjon i verden (data fra USGS, ulike anmeldelser og artikler på markedet).
Tellurproduksjon i verden, tonn*
| år | 2008 | 2009 | 2010 | 2011 | 2012 |
| Belgia | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 |
| Canada | 19.0 | 16.0 | 8.0 | 6.0 | 6.0 |
| Kina | 65.0 | 60.0 | 65.0 | 70.0 | 70.0 |
| Japan | 46.5 | 49.2 | 47.0 | 40.0 | 35.0 |
| Kasakhstan | 18.0 | 17.0 | 18.0 | 18.0 | 17.0 |
| Peru | 28.0 | 7.0 | -- | -- | -- |
| Russland | 34.0 | 33.0 | 34.0 | 34.0 | 35.0 |
| USA | 50.0 | 50.0 | 50.0 | 50.0 | 45.0 |
| Andre land | 79.5 | 97.8 | 128.0 | 132.0 | 122.0 |
| Total | 390.0 | 380.0 | 400.0 | 400.0 | 380.0 |
* Data fra US Geological Survey
Tellur er et sjeldent grunnstoff, og betydelig etterspørsel med et lite produksjonsvolum bestemmer den høye prisen (omtrent $200-300 per kg, avhengig av renhet), men til tross for dette utvides bruksområdet stadig.
Prisen på tellur i 2000 var omtrent 30 dollar per kilo. Mellom 2004 og 2011 økte tellurprisene kontinuerlig, med unntak av 2009. I løpet av disse årene ble prisen på tellur bestemt av en betydelig økning i etterspørselen og begrenset tilbud. I 2011 nådde prisen på tellur 350 dollar per kilo. I 2012 falt imidlertid tellurprisene kraftig til omtrent 150 dollar per kilo.
Tellurmarkedet står for tiden overfor en rekke utfordringer. Som et biprodukt av kobberproduksjon er tellurmarkedet svært avhengig av trender i hovedmarkedet (kobber). En nedgang i kobberproduksjonen sammen med bruk av nye alternative teknologier for å produsere dette metallet vil for eksempel påvirke tilførselsvolumene av tellur.
Siden forsyningsvolumer er i tvil, skyter prisen på materialet i været. I følge mange markedsprognoser vil prisen på tellur stige igjen i løpet av de neste 2-3 årene. Det er kjent at det finnes en rekke forskjellige tellurerstatningsprodukter på markedet, som allerede begynner å bli brukt på grunn av mangel på forsyning. Men som eksperter bemerker, har ingen av erstatningene de samme egenskapene som tellur. I tillegg kan en potensiell økning i etterspørselen etter tellur skyldes utviklingen i tynnfilmsektoren for solenergi.
Tellur – kjemisk grunnstoff som tilhører den 16. gruppen, som ligger i det periodiske systemet, atomnummer 52 og utpekt av den latinske Te - spesiell identifikasjon. Grunnstoffet tilhører metalloidene. Tellurformel — 4d10 5s2 5p4.
Tellur - element har en hvit-sølv fargetone og en metallisk glans og skjør struktur. Ved høye temperaturer, som mange metaller, blir tellur duktil.
Opprinnelsen til tellur
Grunnstoffet ble oppdaget i gullgruver i fjellene i Transylvania. Menneskeheten kjenner til minst hundre mineraler som inneholder tellur. Spesielt er disse sølv, gull, kobber og sink. Det finnes ulike tellurforbindelser, for eksempel er dette noen typer oker. I sin rene form, i ett innskudd kan du finne selen, tellur og svovel, som indikerer muligheten for at elementet er naturlig.

Alle de nevnte mineralene finnes oftere i samme forekomst med sølv, bly og vismut. I industrielle omgivelser, for det meste tellur er kjemisk isolert fra andre metaller, til tross for at hovedmineralene er ganske vanlige. Spesielt er det inneholdt i tilstrekkelige mengder i kalkopiritt, som er en del av nikkel-kobber og kobberkis.
I tillegg kan det finnes i molybdenitt og galena, det finnes også i kobbermalm, polymetalliske avsetninger og bly-sinkavsetninger. Disse mineralene inneholder også sulfid- og antimonbergarter som inneholder kobolt og kvikksølv.
For det meste i industrien utvinnes tellur fra slam, som dannes ved elektrolytisk raffinering av kobber og bly. Under behandlingen brennes slammet, og de brente restene inneholder et visst tellurinnhold. For å isolere det nødvendige elementet, vaskes slagrene med saltsyre.

For å skille metallet fra den resulterende syreløsningen, må svoveldioksid føres gjennom det. Oppnådd på denne måten telluroksid, behandles med kull for å oppnå et rent element fra det. For videre rensing brukes en kloreringsprosedyre.
Dette gir tetraklorid, som må renses ved destillasjon eller rektifisering. Deretter blir det hydrolysert, og det resulterende tellurhydroksid reduseres med hydrogen.
Bruk av tellur
Dette metallet brukes til fremstilling av mange forskjellige materialer (kobber, bly, jern), så metallurgiindustrien er dens viktigste forbruker. Tellur gjør rustfritt stål og kobber mer brukbart. Å legge til dette elementet i formbart støpejern gir det de positive egenskapene til grått støpejern.
Dens støpekvaliteter og bearbeidbarhet er forbedret. Det er i stand til å forbedre de fysiske egenskapene til bly betydelig, og redusere negativ korrosjon fra svovelsyre under behandlingen.

Tellur er mye brukt i halvlederenheter og elektronikk. Spesielt brukes det til å produsere solceller. Bruken av tellur åpner for brede muligheter i anvendelsen av disse avanserte teknologiene. Prosentandelen av produksjon av slikt utstyr har økt betydelig de siste årene. Dette førte til en merkbar økning i omsetningen av tellur på verdensmarkedet.
Metallet brukes, inkludert i romteknologisk utvikling, spesielt er dette legeringer med tilsetning av tellur, som har unike egenskaper. De brukes i teknologier for å oppdage stråling etterlatt av romfartøy.
Av denne grunn er den dyre legeringen i stor grad etterspurt i militærindustrien, for å spore fienden i verdensrommet. I tillegg til denne blandingen selen – tellur er en del av forsinkelsespulveret i detonatorhetter for eksplosive enheter produsert av militære fabrikker.

Ulike tellurforbindelser brukes i produksjonen av halvlederforbindelser med flerlagsstruktur. Mange forbindelser som inkluderer tellur viser bemerkelsesverdig superledningsevne.
Tellur fungerer også til fordel for vanlige mennesker. Spesielt brukes metalloksid i produksjonen av CD-plater for å lage et overskrivbart tynt lag på dem. Det er også til stede i noen mikrokretser, for eksempel de som produseres av Intel. Vismuttellurid er inkludert i mange termoelektriske enheter og infrarøde sensorer.
Dette metallet brukes også ved maling av keramiske produkter. Ved produksjon av glassfiber for informasjonskommunikasjon (TV, Internett, etc.), er deltakelsen av tellur i kabelproduksjon basert på den positive egenskapen til tellurider og selenider for å øke optisk brytning når de tilsettes til glass.

Vulkanisering av gummi innebærer også bruk av stoffer nær metall - selen eller svovel, som om mulig kan erstattes av tellur. Gummi med tillegg vil vise mye bedre kvaliteter. Tellur har også funnet sin nisje innen medisin - det brukes i diagnostisering av difteri.
Tellurpris
Når det gjelder forbruk av dette sjeldne jordmetallet i verden, er Kina på førsteplass, Russland på andreplass og USA på tredjeplass. Totalt forbruk er 400 tonn metall per år. Tellur selges vanligvis i form av pulver, staver eller.
På grunn av de små produksjonsvolumene, på grunn av det relativt lille innholdet i bergarter, er prisen på tellur ganske høy. Omtrent, hvis du ikke tar hensyn til konstante prisstigninger for tellurium, kjøp Den kan selges på verdensmarkedet for 200-300 dollar per kilo metall. Prisen avhenger også av graden av rensing av metallet fra uønskede urenheter.
Men til tross for utilgjengeligheten til dette unike elementet, er det alltid stor etterspørsel etter det, med konstante veksttrender. Hvert år utvides utvalget av områder som krever bruk av tellur og dets forbindelser.
Det er lett å følge trenden med stigende priser på tellur ved å sammenligne prisene i begynnelsen av 2000, da den var $30 per 1 kg, og ti år senere, da den nådde $350. Og til tross for at den et år senere fortsatt falt, er det en alvorlig tendens til at prisene stiger, på grunn av fall i tellurproduksjonsvolumene.

Faktum er at tellurmarkedet direkte avhenger av produksjonsvolumet, siden tellur er et av biproduktene under utvinningen. For øyeblikket har kobbermarkedet redusert omsetningen betydelig, og nye teknologier for produksjonen har dukket opp, hvis funksjoner vil påvirke volumet av ytterligere tellur som produseres betydelig.
Dette vil helt sikkert påvirke forsyningene, og naturligvis prisene. Ifølge estimater er det ventet en ny prisøkning om et par år. Til tross for at tellur har visse analoger i industrien, har de ikke så verdifulle egenskaper.
Denne situasjonen på verdensmarkedet er slett ikke gunstig for mange produsenter hvis produksjon involverer tellur. Spesielt er dette produsenter av solcellepaneler, hvis produkter har fått økende popularitet de siste årene.
17,91 kJ/mol
49,8 kJ/mol
sekskantet
en =4,457 c =5,929
(300 K) 14,3 W/(m K)
Native tellur forekommer også sammen med selen og svovel (japansk tellurisk svovel inneholder 0,17 % Te og 0,06 % Se).
Typer innskudd
De fleste av de nevnte mineralene er utviklet i lavtemperatur-gull-sølvforekomster, hvor de vanligvis er isolert etter hoveddelen av sulfider sammen med naturlig gull, sulfosalter av sølv, bly og også med vismutmineraler. Til tross for utviklingen av et stort antall tellurmineraler, er hoveddelen av tellur som utvinnes av industrien en del av sulfider av andre metaller. Spesielt tellur, i litt mindre grad enn selen, er inkludert i sammensetningen av koparkis i kobber-nikkel-forekomster av magmatisk opprinnelse, så vel som kopiritt utviklet i hydrotermiske kobberkis. Tellur finnes også i pyritt, kalkopiritt, molybdenitt og galena av porfyrkobbermalmforekomster, polymetalliske forekomster av Altai-typen, galena av bly-sinkavsetninger assosiert med skarns, sulfid-kobolt, antimon-kvikksølv og noen andre. Tellurinnholdet i molybdenitt varierer fra 8-53 g/t, i kopiritt 9-31 g/t, i svovelkis - opptil 70 g/t.
Kvittering
Kjemiske egenskaper
I kjemiske forbindelser viser tellur oksidasjonstilstander –2; +2; +4; +6. Det er en analog av svovel og selen, men er kjemisk mindre aktiv enn svovel. Det oppløses i alkalier, er mottakelig for virkningen av salpetersyre og svovelsyre, men er dårlig løselig i fortynnet saltsyre. Tellurmetall begynner å reagere med vann ved 100 °C.
Med oksygen danner det forbindelser TeO, TeO 2, TeO 3. I pulverform oksiderer det i luft selv ved romtemperatur, og danner TeO 2 oksid. Når det varmes opp i luft, brenner det, og danner TeO 2 - en sterk forbindelse som er mindre flyktig enn tellur i seg selv. Denne egenskapen brukes til å rense tellur fra oksider, som reduseres med flytende hydrogen ved en temperatur på 500-600 °C. Tellurdioksid er dårlig løselig i vann, men løselig i sure og alkaliske løsninger.
I smeltet tilstand er tellur ganske inert, så grafitt og kvarts brukes som beholdermaterialer når det smeltes.
Tellur danner en forbindelse med hydrogen ved oppvarming, reagerer lett med halogener og interagerer med svovel, fosfor og metaller. Når den reagerer med konsentrert svovelsyre, danner den sulfitt. Danner svake syrer: hydrotellursyre (H 2 Te), tellursyre (H 2 TeO 3) og tellursyre (H 6 TeO 6), hvorav de fleste saltene er dårlig løselige i vann.
Isotoper
applikasjon
Legeringer
Tellur brukes i produksjon av blylegeringer med økt duktilitet og styrke (brukes for eksempel ved produksjon av kabler). Med innføring av 0,05 % tellur reduseres tapet av bly på grunn av oppløsning under påvirkning av svovelsyre med 10 ganger, og dette brukes i produksjonen av blysyrebatterier. Det er også viktig at bly legert med tellur ikke mykner når det behandles av plastisk deformasjon, og dette gjør det mulig å bruke teknologien for å produsere batteriplatestrømsamlere ved bruk av kaldskjæringsmetoden og øke batteriets levetid og spesifikke egenskaper betydelig. .
Legeringssammensetningen CZT (kadmiumsinktelluride, CdZnTe) brukes i produksjonen av røntgen- og gammastrålingsdetektorer som opererer ved romtemperatur.
Termoelektriske materialer
Dens rolle er også stor i produksjonen av halvledermaterialer og spesielt tellurider av bly, vismut, antimon og cesium. I de kommende årene vil produksjonen av lantanidtellurider, deres legeringer og legeringer med metallselenider bli svært viktig for produksjon av termoelektriske generatorer med svært høy (opptil 72-78%) effektivitet, som vil gjøre det mulig å bruke dem i energisektoren og i bilindustrien.
For eksempel ble det nylig oppdaget en svært høy termisk emf i mangantellurid (500 μV/K) og i kombinasjon med vismut, antimon og lantanidselenider, noe som gjør det mulig ikke bare å oppnå en meget høy effektivitet i termogeneratorer, men også å implementere det i ett trinn halvlederkjøleskap nedkjøling til kryogene (temperaturnivå av flytende nitrogen) temperaturer og enda lavere. Det beste tellurbaserte materialet for produksjon av halvlederkjøleskap de siste årene har vært en legering av tellur, vismut og cesium, som gjorde det mulig å oppnå rekordavkjøling ned til -237 °C. Samtidig er tellur-selen-legering (70 % selen), som har en termo-EMF-koeffisient på ca. 1200 μV/K, lovende som termoelektrisk materiale.
Halvledere med smale gap
CRT (kadmium - tellur) legeringer har også fått helt eksepsjonell betydning, som har fantastiske egenskaper for å oppdage stråling fra rakettoppskytinger og observere fienden fra verdensrommet gjennom atmosfæriske vinduer (skydekke spiller ingen rolle). MCT er et av de dyreste materialene i den moderne elektronikkindustrien.
Høy temperatur superledning
En rekke tellurholdige systemer har nylig oppdaget at det eksisterer tre (muligens fire) faser i dem, der superledning ikke forsvinner ved en temperatur litt over kokepunktet til flytende nitrogen.
Gummiproduksjon
Et eget bruksområde for tellur er bruken i prosessen med gummivulkanisering.
Produksjon av kalkogenidglass
Tellur brukes til smelting av spesielle glasskvaliteter (hvor det brukes i form av dioksid); spesielle glass dopet med sjeldne jordmetaller brukes som aktive stoffer i optiske kvantegeneratorer.
I tillegg er noen tellurbaserte briller halvledere, en egenskap som brukes i elektronikk.
Spesielle grader av tellurglass (fordelene med slikt glass er gjennomsiktighet, smelteevne og elektrisk ledningsevne) brukes i konstruksjonen av spesielt kjemisk utstyr (reaktorer).
Tellur finner begrenset bruk i produksjonen av lamper med sine damp - de har et spekter som er veldig nært solens.
CD-RW
Tellurlegering brukes i overskrivbare CD-plater (spesielt Mitsubishi Chemical Corporation-merket "Verbatim") for å lage et deformerbart reflekterende lag.
Biologisk rolle
Fysiologisk virkning
Tellur og dets flyktige forbindelser er giftige. Hvis det kommer inn i kroppen, forårsaker det kvalme, bronkitt og lungebetennelse. MPC i luft varierer for ulike forbindelser 0,007-0,01 mg/m³, i vann 0,001-0,01 mg/l. Kreftfremkallende virkning av tellur er ikke bekreftet.
Ved forgiftning skilles tellur ut fra kroppen i form av illeluktende flyktige organotellurforbindelser - alkyltellurider, hovedsakelig dimetyltellurid (CH 3) 2 Te. Lukten deres ligner lukten av hvitløk, derfor, når selv små mengder tellur kommer inn i kroppen, får luften som en person puster ut denne lukten, som er et viktig symptom på tellurforgiftning.
Skriv en anmeldelse om artikkelen "Tellurium"
Notater
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O'Connor, Thomas Walczyk, Shige Yoneda, Xiang-Kun Zhu.(engelsk) // Pure and Applied Chemistry. - 2013. - Vol. 85, nei. 5 . - S. 1047-1078. - DOI:10.1351/PAC-REP-13-03-02.
- (Engelsk) . WebElements. Hentet 5. august 2010.
- Leddicotte, G.W. (1961),
, Nuclear science series, Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council, s. 5 ,
- Redaksjon: Zefirov N. S. (sjefredaktør). Kjemisk leksikon: i 5 bind - Moskva: Soviet Encyclopedia, 1995. - T. 4. - S. 514. - 639 s. - 20 000 eksemplarer. - ISBN 5-85270-039-8.
- Glinka N.L. Generell kjemi. - M.: "Kjemi", 1977, revidert. - S. 395. - 720 s.
- Tellur- artikkel fra Great Soviet Encyclopedia
- G. Audi, O. Bersillon, J. Blachot og A. H. Wapstra (2003). "". Kjernefysikk A 729 : 3–128. DOI:10.1016/j.nuclphysa.2003.11.001. Bibcode:.
- Tellur-123 isotopen ble ansett som radioaktiv (β − -aktiv med en halveringstid på 6·10 14 år), men etter ytterligere målinger ble den funnet å være stabil innenfor eksperimentets følsomhet.
- 2,2 kvadrillioner år - på lang skala.
- . International Program on Chemical Safety (28. januar 1998). Hentet 12. januar 2007. .
- Wright, P.L. (1966). "". AJP – Legacy 211 (1): 6–10. PMID 5911055.
- (1989) "Tellur-rus". Klinische Wochenschrift 67 (22): 1152–5. DOI:10.1007/BF01726117. PMID 2586020.
- Taylor, Andrew (1996). "Biokjemi av tellur". Biologisk sporelementforskning 55 (3): 231–239. DOI:10.1007/BF02785282. PMID 9096851.
Linker
| Periodisk system for kjemiske elementer av D. I. Mendeleev | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Te | ||||||||||||||||||||||||||||||||
| Alkaliske jordmetaller | ||||||||||||||||||||||||||||||||
Utdrag som karakteriserer Tellur
Om kvelden ga Napoleon, mellom to ordre - den ene om å levere de forberedte falske russiske sedlene for import til Russland så snart som mulig, og den andre om å skyte sakseren, i hvis avlyttede brev informasjon om ordrer til den franske hæren ble funnet - gitt en tredje ordre - om inkluderingen av den polske obersten, som unødvendig kastet seg i elven, inn i æreskohorten (Legion d'honneur), som Napoleon var leder for.Qnos vult perdere – dementat. [Den han vil ødelegge, han vil frata ham sinnet hans (lat.)]
I mellomtiden hadde den russiske keiseren allerede bodd i Vilna i mer enn en måned, og laget anmeldelser og manøvrer. Ingenting var klart for krigen som alle forventet og som keiseren kom fra St. Petersburg for å forberede seg på. Det var ingen generell handlingsplan. Tvilen om hvilken plan, av alle de som ble foreslått, skulle vedtas, ble bare enda mer intensivert etter keiserens månedlange opphold i hovedleiligheten. De tre hærene hadde hver sin øverstkommanderende, men det var ingen felles sjef over alle hærene, og keiseren påtok seg ikke denne tittelen.
Jo lenger keiseren bodde i Vilna, jo mindre og mindre forberedte de seg på krig, lei av å vente på den. Alle ambisjonene til folket rundt suverenen så ut til å bare være rettet mot å få suverenen til å glemme den kommende krigen, mens de hadde en hyggelig tid.
Etter mange baller og høytider blant de polske magnatene, blant hoffmennene og suverenen selv, kom i juni en av de polske generaladjutantene til suverenen på ideen om å gi en middag og ball til suverenen på vegne av sin general. adjutanter. Denne ideen ble med glede akseptert av alle. Keiseren var enig. Generalens adjutanter samlet inn penger ved abonnement. Den personen som kunne være mest behagelig for suverenen ble invitert til å være vertinne for ballet. Grev Bennigsen, en grunneier i Vilna-provinsen, tilbød landstedet sitt for denne høytiden, og 13. juni var det planlagt middag, ball, båttur og fyrverkeri på Zakret, grev Bennigsens landsted.
På samme dag som Napoleon ga ordre om å krysse Neman og hans avanserte tropper, presset kosakkene tilbake, krysset den russiske grensen, tilbrakte Alexander kvelden ved Bennigsens dacha - på et ball gitt av generalens adjutanter.
Det var en munter, strålende ferie; eksperter i bransjen sa at sjelden så mange skjønnheter samlet på ett sted. Grevinne Bezukhova, sammen med andre russiske damer som kom for suverenen fra St. Petersburg til Vilna, var på dette ballet og formørket de sofistikerte polske damene med sin tunge, såkalte russiske skjønnhet. Hun ble lagt merke til, og suverenen hedret henne med en dans.
Boris Drubetskoy, en garcon (en ungkar), som han sa, etter å ha forlatt sin kone i Moskva, var også på dette ballet, og selv om han ikke var generaladjutant, var han deltaker for en stor sum i abonnementet på ballet. Boris var nå en rik mann, langt fremme i ære, som ikke lenger søkte patronage, men stod på jevnt fot med de høyeste av sine jevnaldrende.
Klokken tolv om natten danset de fortsatt. Helen, som ikke hadde en verdig gentleman, tilbød selv mazurkaen til Boris. De satt i det tredje paret. Boris, som kjølig så på Helens blanke bare skuldre som stakk ut fra hennes mørke gasbind og gullkjole, snakket om gamle bekjente, og samtidig, ubemerket av seg selv og andre, sluttet han aldri et sekund å se på suverenen, som var i samme rom. Keiseren danset ikke; han sto i døråpningen og stanset først det ene eller det andre med de milde ordene som han alene visste å si.
I begynnelsen av mazurkaen så Boris at generaladjutant Balashev, en av de nærmeste personene til suverenen, nærmet seg ham og sto uhøflig nær suverenen, som snakket med en polsk dame. Etter å ha snakket med damen, så suverenen spørrende ut, og tilsynelatende innså han at Balashev handlet på denne måten bare fordi det var viktige grunner, nikket lett til damen og snudde seg mot Balashev. Så snart Balashev begynte å snakke, ble det uttrykt overraskelse i suverenens ansikt. Han tok Balashev i armen og gikk med ham gjennom gangen, ubevisst ryddet tre favner bred vei på begge sider av dem som sto til side foran ham. Boris la merke til Arakcheevs begeistrede ansikt mens suverenen gikk med Balashev. Arakcheev, som så fra under øyenbrynene på suverenen og snorket den røde nesen hans, beveget seg ut av mengden, som om han forventet at suverenen ville vende seg til ham. (Boris innså at Arakcheev var sjalu på Balashev og var misfornøyd med at noen åpenbart viktige nyheter ikke ble formidlet til suverenen gjennom ham.)
Men suverenen og Balashev gikk, uten å legge merke til Arakcheev, gjennom utgangsdøren inn i den opplyste hagen. Arakcheev, som holdt sverdet sitt og så seg sint rundt, gikk omtrent tjue skritt bak dem.
Mens Boris fortsatte å lage mazurkafigurer, ble han stadig plaget av tanken på hvilke nyheter Balashev hadde brakt og hvordan han skulle finne ut om det før andre.
I figuren der han måtte velge damer, hvisket til Helen at han ville ta med seg grevinne Pototskaya, som så ut til å ha gått ut på balkongen, gled han føttene langs parkettgulvet, løp ut utgangsdøren og ut i hagen og , og la merke til at suverenen kom inn på terrassen med Balashev , stoppet. Keiseren og Balashev gikk mot døren. Boris, i all hast, som om han ikke hadde tid til å bevege seg bort, presset seg respektfullt mot overliggeren og bøyde hodet.
Med følelsen av en personlig fornærmet mann avsluttet keiseren følgende ord:
- Gå inn i Russland uten å erklære krig. "Jeg vil slutte fred bare når ikke en eneste væpnet fiende er igjen på mitt land," sa han. Det virket for Boris som om suverenen var fornøyd med å uttrykke disse ordene: han var fornøyd med uttrykksformen til tankene sine, men var misfornøyd med det faktum at Boris hørte dem.
– Slik at ingen vet noe! – la suverenen til og rynket pannen. Boris innså at dette gjaldt ham, og lukket øynene og bøyde hodet lett. Keiseren gikk igjen inn i hallen og ble ved ballet i omtrent en halv time.
Boris var den første som fikk vite nyhetene om franske troppers kryssing av Neman, og takket være dette fikk han muligheten til å vise noen viktige personer at han visste mange ting skjult for andre, og gjennom dette fikk han muligheten til å stige høyere i meningen til disse personene.
Den uventede nyheten om franskmennene som krysset Neman var spesielt uventede etter en måned med uoppfylt forventning, og på et ball! I det første minuttet etter å ha mottatt nyheten, fant keiseren under påvirkning av indignasjon og fornærmelse det som senere ble berømt, et ordtak som han selv likte og fullt ut uttrykte følelsene sine. Da han kom hjem fra ballet, sendte suverenen ved to-tiden om morgenen bud på sekretær Shishkov og beordret å skrive en ordre til troppene og et reskript til feltmarskalk prins Saltykov, der han absolutt krevde at ordene ble plassert om at han ville ikke slutte fred før minst én av den væpnede franskmannen vil forbli på russisk jord.
Dagen etter ble følgende brev skrevet til Napoleon.
«Monsieur mon frere. J"ai appris hier que malgre la loyaute avec laquelle j"ai maintenu mes engagements envers Votre Majeste, ses troupes ont franchis les frontieres de la Russie, et je recois a l"instant de Petersbourg une note par laquelle le comte Lauriston, pour cause de cette aggresjon, annonce que Votre Majeste s"est consideree comme en etat de guerre avec moi des le moment ou le prince Kourakine a fait la demande de ses passports. Les motiver sur lesquels le duc de Bassano fondait son refus de les lui delivrer, n "auraient jamais pu me faire supposer que cette demarche servirait jamais de pretexte a l" aggresjon. En effet cet ambassadeur n"y a jamais ete autorise comme il l"a declare lui meme, et aussitot que j"en fus informe, je lui ai fait connaitre combien je le desapprouvais en lui donnant l"ordre de rester a son poste. Si Votre Majeste n"est pas intentionnee de verser le sang de nos peuples pour un malentendu de ce genre et qu"elle consente a retirer ses troupes du territoire russe, je regarderai ce qui s"est passe comme non avenu, et un accommodement entre nous sera mulig. Dans le cas contraire, Votre Majeste, je me verrai force de repousser une attaque que rien n"a provoquee de ma part. Il depend encore de Votre Majeste d"eviter a l"humanite les calamites d"une nouvelle guerre.
Je suis, etc.
(signe) Alexandre.»
["Min herre bror! I går gikk det opp for meg at til tross for den rettframme jeg overholdt mine forpliktelser overfor Deres keiserlige majestet, krysset troppene deres de russiske grensene, og først nå har jeg mottatt et notat fra St. Petersburg, hvormed grev Lauriston informerer meg om denne invasjonen. , at Deres Majestet anser deg selv for å være på fiendtlig vilkår med meg fra den tiden prins Kurakin krevde passene hans. Årsakene til at hertugen av Bassano baserte sitt avslag på å utstede disse passene kunne aldri ha fått meg til å anta at handlingen til min ambassadør tjente som årsak til angrepet. Og faktisk hadde han ikke en befaling fra meg om å gjøre dette, slik han selv kunngjorde; og så snart jeg fikk vite om dette, uttrykte jeg umiddelbart min misnøye til prins Kurakin, og beordret ham til å utføre pliktene som ble betrodd ham som før. Hvis Deres Majestet ikke er tilbøyelig til å utgyte blodet til våre undersåtter på grunn av en slik misforståelse og hvis dere godtar å trekke troppene deres fra russiske eiendeler, så vil jeg ignorere alt som har skjedd, og en avtale mellom oss vil være mulig. Ellers vil jeg bli tvunget til å slå tilbake et angrep som ikke ble fremprovosert av noe fra min side. Deres Majestet, du har fortsatt muligheten til å redde menneskeheten fra en ny krigs svøpe.
(signert) Alexander." ]
Den 13. juni, klokken to om morgenen, beordret suverenen, som kalte Balashev til seg og leste ham brevet til Napoleon, ham til å ta dette brevet og personlig overlevere det til den franske keiseren. Da han sendte Balashev bort, gjentok suverenen igjen ordene for ham om at han ikke ville slutte fred før minst en væpnet fiende forble på russisk jord, og beordret at disse ordene skulle overbringes til Napoleon uten feil. Keiseren skrev ikke disse ordene i brevet, fordi han følte med sin takt at disse ordene var ubeleilige å formidle i det øyeblikket det siste forsøket på forsoning ble gjort; men han beordret absolutt Balashev å overlate dem til Napoleon personlig.
Etter å ha reist natt til 13. til 14. juni, ankom Balashev, akkompagnert av en trompetist og to kosakker, ved daggry til landsbyen Rykonty, til de franske utpostene på denne siden av Neman. Han ble stoppet av franske kavalerivaktposter.
En fransk hussar-underoffiser, i en rød uniform og en raggete hatt, ropte til Balashev da han nærmet seg, og beordret ham om å stoppe. Balashev stoppet ikke umiddelbart, men fortsatte å gå langs veien.
Underoffiseren, rynket pannen og mumlet en slags forbannelse, rykket frem med brystet på hesten mot Balashev, tok opp sabelen og ropte frekt til den russiske generalen og spurte ham: er han døv, at han ikke hører hva som er blir sagt til ham. Balashev identifiserte seg selv. Underoffiseren sendte soldaten til offiseren.
Uten å ta hensyn til Balashev, begynte underoffiseren å snakke med kameratene om hans regimentsvirksomhet og så ikke på den russiske generalen.
Det var uvanlig merkelig for Balashev, etter å ha vært nær den høyeste makten og makten, etter en samtale for tre timer siden med suverenen og generelt vant til æresbevisninger fra hans tjeneste, å se her, på russisk jord, denne fiendtlige og, viktigst, respektløs holdning til seg selv av brutal force.
Solen begynte akkurat å stå opp bak skyene; luften var frisk og duggvåt. På veien ble flokken drevet ut av bygda. På jordene, en etter en, som bobler i vann, sprakk lerkene til liv med en tutelyd.
Balashev så seg rundt ham og ventet på ankomsten til en offiser fra landsbyen. De russiske kosakkene, trompetisten og de franske husarene så stille på hverandre fra tid til annen.
En fransk husar-oberst, tilsynelatende rett opp av sengen, red ut av landsbyen på en vakker, velnært grå hest, akkompagnert av to husarer. Offiseren, soldatene og hestene deres bar en følelse av tilfredshet og panache.
Dette var første gang av felttoget, da troppene fortsatt var i god orden, nesten lik inspeksjonen, fredelig aktivitet, bare med et snev av smart krigerskhet i klær og med en moralsk konnotasjon av moroa og bedriften som alltid følger med begynnelsen av kampanjer.
Den franske obersten hadde problemer med å holde tilbake et gjesp, men var høflig og forsto tilsynelatende den fulle betydningen av Balashev. Han førte ham forbi soldatene sine ved lenken og sa at hans ønske om å bli presentert for keiseren trolig ville bli oppfylt umiddelbart, siden den keiserlige leiligheten, så vidt han visste, ikke var langt unna.
De kjørte gjennom landsbyen Rykonty, forbi franske husarer som koblet til stolper, vaktposter og soldater som hilste obersten sin og nysgjerrig undersøkte den russiske uniformen, og kjørte ut til den andre siden av landsbyen. I følge obersten var divisjonssjefen to kilometer unna, som ville ta imot Balashev og se ham til bestemmelsesstedet.
Solen hadde allerede stått opp og skinte muntert på det lyse grøntområdet.
De hadde nettopp forlatt tavernaen på fjellet da en gruppe ryttere dukket opp under fjellet for å møte dem, foran som, på en svart hest med sele som skinnet i solen, red en høy mann i hatt med fjær og svart hår krøllet til skuldrene, i en rød kappe og med lange ben stukket ut fremover, som den franske turen. Denne mannen galopperte mot Balashev, med fjærene, steinene og gullflettet hans skinnende og flagrende i den lyse junisolen.
Balashev var allerede to hester unna rytteren som galopperte mot ham med et høytidelig teatralsk ansikt i armbånd, fjær, halskjeder og gull, da Yulner, den franske obersten, respektfullt hvisket: «Le roi de Naples». [Kongen av Napoli.] Det var faktisk Murat, nå kalt kongen av Napoli. Selv om det var helt uforståelig hvorfor han var napolitansk konge, ble han kalt det, og han var selv overbevist om dette og hadde derfor en mer høytidelig og viktig fremtoning enn før. Han var så sikker på at han virkelig var den napolitanske kongen at like før han dro fra Napoli, mens han gikk med sin kone gjennom gatene i Napoli, ropte flere italienere til ham: «Viva il re!» [Leve leve! kongen! (italiensk) ] han snudde seg mot sin kone med et trist smil og sa: «Les malheureux, ils ne savent pas que je les quitte demain! [Ufornøyde mennesker, de vet ikke at jeg forlater dem i morgen!]
Men til tross for det faktum at han fullt og fast trodde at han var den napolitanske kongen, og at han angret på sorgen til undersåttene som ble forlatt av ham, nylig, etter at han ble beordret til å gå inn i tjenesten igjen, og spesielt etter møtet med Napoleon i Danzig, da den opphøyde svogeren fortalte ham: "Je vous ai fait Roi pour regner a maniere, mais pas a la votre," [Jeg gjorde deg til konge for å regjere ikke på sin egen måte, men på min.] - han begynte muntert på en oppgave som var kjent for ham, og som en velnært, men ikke feit hest egnet til tjeneste, kjente han seg selv i selen, begynte å leke i skaftet og etter å ha tømt seg så fargerikt og dyrt som mulig, munter og fornøyd, galopperte, uten å vite hvor eller hvorfor, langs veiene Polen.