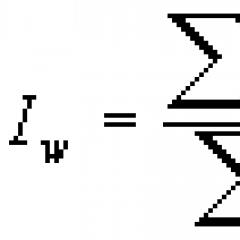Varmekapasitet til luft kcal m3. Bestemmelse av varmekapasiteten til luft. Luftfuktighet. Varmekapasitet og entalpi av luft
Hoved fysiske egenskaper luft: lufttetthet, dens dynamiske og kinematiske viskositet, spesifikk varmekapasitet, termisk ledningsevne, termisk diffusivitet, Prandtl-tall og entropi. Luftens egenskaper er gitt i tabeller avhengig av temperatur ved normalt atmosfærisk trykk.
Lufttetthet avhengig av temperatur
En detaljert tabell over tetthetsverdier for tørr luft ved forskjellige temperaturer og normalt atmosfærisk trykk er presentert. Hva er tettheten til luft? Luftens tetthet kan bestemmes analytisk ved å dele dens masse med volumet den opptar. under gitte forhold (trykk, temperatur og fuktighet). Du kan også beregne tettheten ved hjelp av formelen for den ideelle gassligningen for tilstanden. For å gjøre dette må du vite det absolutte trykket og temperaturen til luften, samt dens gasskonstant og molarvolum. Denne ligningen lar deg beregne den tørre tettheten til luft.
På praksis, for å finne ut hva luftens tetthet er ved forskjellige temperaturer, er det praktisk å bruke ferdige bord. For eksempel den gitte tabellen med tetthetsverdier atmosfærisk luft avhengig av temperaturen. Lufttettheten i tabellen er uttrykt i kilogram per kubikkmeter og er gitt i temperaturområdet fra minus 50 til 1200 grader Celsius ved normalt atmosfærisk trykk (101325 Pa).
| t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 |
|---|---|---|---|---|---|---|---|
| -50 | 1,584 | 20 | 1,205 | 150 | 0,835 | 600 | 0,404 |
| -45 | 1,549 | 30 | 1,165 | 160 | 0,815 | 650 | 0,383 |
| -40 | 1,515 | 40 | 1,128 | 170 | 0,797 | 700 | 0,362 |
| -35 | 1,484 | 50 | 1,093 | 180 | 0,779 | 750 | 0,346 |
| -30 | 1,453 | 60 | 1,06 | 190 | 0,763 | 800 | 0,329 |
| -25 | 1,424 | 70 | 1,029 | 200 | 0,746 | 850 | 0,315 |
| -20 | 1,395 | 80 | 1 | 250 | 0,674 | 900 | 0,301 |
| -15 | 1,369 | 90 | 0,972 | 300 | 0,615 | 950 | 0,289 |
| -10 | 1,342 | 100 | 0,946 | 350 | 0,566 | 1000 | 0,277 |
| -5 | 1,318 | 110 | 0,922 | 400 | 0,524 | 1050 | 0,267 |
| 0 | 1,293 | 120 | 0,898 | 450 | 0,49 | 1100 | 0,257 |
| 10 | 1,247 | 130 | 0,876 | 500 | 0,456 | 1150 | 0,248 |
| 15 | 1,226 | 140 | 0,854 | 550 | 0,43 | 1200 | 0,239 |
Ved 25°C har luft en tetthet på 1,185 kg/m3. Ved oppvarming reduseres lufttettheten - luften utvider seg (dets spesifikke volum øker). Når temperaturen øker, for eksempel til 1200°C, oppnås en svært lav lufttetthet, lik 0,239 kg/m 3, som er 5 ganger mindre enn verdien ved romtemperatur. Generelt tillater reduksjon under oppvarming at en prosess som naturlig konveksjon finner sted og brukes for eksempel innen luftfart.
Hvis vi sammenligner tettheten av luft i forhold til , så er luft tre størrelsesordener lettere - ved en temperatur på 4°C er tettheten av vann 1000 kg/m3, og luftens tetthet er 1,27 kg/m3. Det er også nødvendig å merke seg verdien av lufttetthet under normale forhold. Normale forhold for gasser er de der temperaturen er 0°C og trykket er lik normalt atmosfærisk trykk. I følge tabellen, lufttetthet under normale forhold (ved NL) er 1,293 kg/m 3.
Dynamisk og kinematisk viskositet av luft ved forskjellige temperaturer
Når du utfører termiske beregninger, er det nødvendig å vite verdien av luftviskositet (viskositetskoeffisient) ved forskjellige temperaturer. Denne verdien er nødvendig for å beregne Reynolds-, Grashof- og Rayleigh-tallene, hvis verdier bestemmer strømningsregimet til denne gassen. Tabellen viser verdiene til de dynamiske koeffisientene μ og kinematisk ν luftviskositet i temperaturområdet fra -50 til 1200°C ved atmosfærisk trykk.
Luftens viskositetskoeffisient øker betydelig med økende temperatur. For eksempel er den kinematiske viskositeten til luft lik 15,06 10 -6 m 2 /s ved en temperatur på 20 °C, og med en økning i temperaturen til 1200 °C blir luftens viskositet lik 233,7 10 -6 m 2 /s, det vil si at den øker 15,5 ganger! Den dynamiske viskositeten til luft ved en temperatur på 20°C er 18,1·10 -6 Pa·s.
Når luft varmes opp, øker verdiene for både kinematisk og dynamisk viskositet. Disse to mengdene er relatert til hverandre gjennom lufttettheten, hvis verdi avtar når denne gassen varmes opp. En økning i den kinematiske og dynamiske viskositeten til luft (så vel som andre gasser) ved oppvarming er assosiert med en mer intens vibrasjon av luftmolekyler rundt deres likevektstilstand (ifølge MKT).
| t, °С | μ·106, Pa·s | ν·10 6, m 2 /s | t, °С | μ·106, Pa·s | ν·10 6, m 2 /s | t, °С | μ·106, Pa·s | ν·10 6, m 2 /s |
|---|---|---|---|---|---|---|---|---|
| -50 | 14,6 | 9,23 | 70 | 20,6 | 20,02 | 350 | 31,4 | 55,46 |
| -45 | 14,9 | 9,64 | 80 | 21,1 | 21,09 | 400 | 33 | 63,09 |
| -40 | 15,2 | 10,04 | 90 | 21,5 | 22,1 | 450 | 34,6 | 69,28 |
| -35 | 15,5 | 10,42 | 100 | 21,9 | 23,13 | 500 | 36,2 | 79,38 |
| -30 | 15,7 | 10,8 | 110 | 22,4 | 24,3 | 550 | 37,7 | 88,14 |
| -25 | 16 | 11,21 | 120 | 22,8 | 25,45 | 600 | 39,1 | 96,89 |
| -20 | 16,2 | 11,61 | 130 | 23,3 | 26,63 | 650 | 40,5 | 106,15 |
| -15 | 16,5 | 12,02 | 140 | 23,7 | 27,8 | 700 | 41,8 | 115,4 |
| -10 | 16,7 | 12,43 | 150 | 24,1 | 28,95 | 750 | 43,1 | 125,1 |
| -5 | 17 | 12,86 | 160 | 24,5 | 30,09 | 800 | 44,3 | 134,8 |
| 0 | 17,2 | 13,28 | 170 | 24,9 | 31,29 | 850 | 45,5 | 145 |
| 10 | 17,6 | 14,16 | 180 | 25,3 | 32,49 | 900 | 46,7 | 155,1 |
| 15 | 17,9 | 14,61 | 190 | 25,7 | 33,67 | 950 | 47,9 | 166,1 |
| 20 | 18,1 | 15,06 | 200 | 26 | 34,85 | 1000 | 49 | 177,1 |
| 30 | 18,6 | 16 | 225 | 26,7 | 37,73 | 1050 | 50,1 | 188,2 |
| 40 | 19,1 | 16,96 | 250 | 27,4 | 40,61 | 1100 | 51,2 | 199,3 |
| 50 | 19,6 | 17,95 | 300 | 29,7 | 48,33 | 1150 | 52,4 | 216,5 |
| 60 | 20,1 | 18,97 | 325 | 30,6 | 51,9 | 1200 | 53,5 | 233,7 |
Merk: Vær forsiktig! Luftviskositet er gitt til styrken 10 6 .
Spesifikk varmekapasitet til luft ved temperaturer fra -50 til 1200°C
En tabell over den spesifikke varmekapasiteten til luft ved forskjellige temperaturer er presentert. Varmekapasiteten i tabellen er gitt ved konstant trykk (isobar varmekapasitet til luft) i temperaturområdet fra minus 50 til 1200°C for luft i tørr tilstand. Hva er den spesifikke varmekapasiteten til luft? Den spesifikke varmekapasiteten bestemmer mengden varme som må tilføres ett kilo luft ved konstant trykk for å øke temperaturen med 1 grad. For eksempel, ved 20 °C, for å varme 1 kg av denne gassen med 1 °C i en isobar prosess, kreves det 1005 J varme.
Den spesifikke varmekapasiteten til luft øker med økende temperatur. Imidlertid er avhengigheten av luftens massevarmekapasitet på temperaturen ikke lineær. I området fra -50 til 120 °C endres dens verdi praktisk talt ikke - under disse forholdene er den gjennomsnittlige varmekapasiteten til luft 1010 J/(kg grader). I følge tabellen kan man se at temperaturen begynner å ha en betydelig effekt fra en verdi på 130°C. Imidlertid påvirker lufttemperaturen dens spesifikke varmekapasitet mye mindre enn dens viskositet. Ved oppvarming fra 0 til 1200°C øker således luftens varmekapasitet bare 1,2 ganger - fra 1005 til 1210 J/(kg grader).
Det skal bemerkes at varmekapasiteten til fuktig luft er høyere enn for tørr luft. Sammenligner vi luft er det åpenbart at vann har en høyere verdi og vanninnholdet i luft fører til en økning i spesifikk varmekapasitet.
| t, °С | C p , J/(kg grader) | t, °С | C p , J/(kg grader) | t, °С | C p , J/(kg grader) | t, °С | C p , J/(kg grader) |
|---|---|---|---|---|---|---|---|
| -50 | 1013 | 20 | 1005 | 150 | 1015 | 600 | 1114 |
| -45 | 1013 | 30 | 1005 | 160 | 1017 | 650 | 1125 |
| -40 | 1013 | 40 | 1005 | 170 | 1020 | 700 | 1135 |
| -35 | 1013 | 50 | 1005 | 180 | 1022 | 750 | 1146 |
| -30 | 1013 | 60 | 1005 | 190 | 1024 | 800 | 1156 |
| -25 | 1011 | 70 | 1009 | 200 | 1026 | 850 | 1164 |
| -20 | 1009 | 80 | 1009 | 250 | 1037 | 900 | 1172 |
| -15 | 1009 | 90 | 1009 | 300 | 1047 | 950 | 1179 |
| -10 | 1009 | 100 | 1009 | 350 | 1058 | 1000 | 1185 |
| -5 | 1007 | 110 | 1009 | 400 | 1068 | 1050 | 1191 |
| 0 | 1005 | 120 | 1009 | 450 | 1081 | 1100 | 1197 |
| 10 | 1005 | 130 | 1011 | 500 | 1093 | 1150 | 1204 |
| 15 | 1005 | 140 | 1013 | 550 | 1104 | 1200 | 1210 |
Termisk ledningsevne, termisk diffusivitet, Prandtl antall luft
Tabellen viser fysiske egenskaper til atmosfærisk luft som termisk ledningsevne, termisk diffusivitet og dens Prandtl-tall avhengig av temperatur. Termofysiske egenskaper til luft er gitt i området fra -50 til 1200°C for tørr luft. I henhold til tabellen kan det sees at de indikerte egenskapene til luft avhenger betydelig av temperaturen og temperaturavhengigheten til de betraktede egenskapene til denne gassen er forskjellig.
Laboratoriearbeid nr. 1
Definisjon av masseisobar
varmekapasitet til luft
Varmekapasitet er varmen som må legges til en enhetsmengde av et stoff for å varme det opp med 1 K. En enhetsmengde av et stoff kan måles i kilogram, kubikkmeter under normale fysiske forhold og kilomol. En kilomol gass er massen til en gass i kilogram, numerisk lik dens molekylvekt. Dermed er det tre typer varmekapasiteter: masse c, J/(kg⋅K); volumetrisk s′, J/(m3⋅K) og molar, J/(kmol⋅K). Siden en kilomol gass har en masse μ ganger større enn ett kilo, er det ikke innført en egen betegnelse for molar varmekapasitet. Sammenheng mellom varmekapasiteter:
hvor = 22,4 m3/kmol er volumet av en kilomol av en ideell gass under normale fysiske forhold; – gasstetthet under normale fysiske forhold, kg/m3.
Den sanne varmekapasiteten til en gass er avledet av varme med hensyn til temperatur:
Varmen som tilføres gassen avhenger av den termodynamiske prosessen. Det kan bestemmes av termodynamikkens første lov for isokoriske og isobariske prosesser:
Her er varmen som tilføres 1 kg gass i en isobar prosess; - endring i den indre energien til gassen; – arbeid av gasser mot ytre krefter.
I hovedsak formulerer formel (4) termodynamikkens første lov, hvorfra Mayers ligning følger:
Hvis vi setter = 1 K, vil det si at den fysiske betydningen av gasskonstanten er arbeidet som utføres av 1 kg gass i en isobarisk prosess når temperaturen endres med 1 K.
Mayers ligning for 1 kilomol gass har formen
hvor = 8314 J/(kmol⋅K) er den universelle gasskonstanten.
I tillegg til Mayer-ligningen, er den isobare og isokoriske massevarmekapasiteten til gasser relatert til hverandre gjennom den adiabatiske eksponenten k (tabell 1):
Tabell 1.1
Verdier av adiabatiske eksponenter for ideelle gasser
Atomisitet av gasser | |
Monatomiske gasser | |
Diatomiske gasser | |
Tri- og polyatomiske gasser |
MÅL MED ARBEIDET
Konsolidering av teoretisk kunnskap om termodynamikkens grunnleggende lover. Praktisk utvikling av metoden for å bestemme luftens varmekapasitet basert på energibalansen.
Eksperimentell bestemmelse av luftens spesifikke massevarmekapasitet og sammenligning av det oppnådde resultatet med referanseverdien.
1.1. Beskrivelse av laboratorieoppsettet
Installasjonen (fig. 1.1) består av et messingrør 1 med innvendig diameter d =
= 0,022 m, i enden av denne er det en elektrisk varmeovn med varmeisolasjon 10. En luftstrøm beveger seg inne i røret, som tilføres 3. Luftstrømmen kan reguleres ved å endre viftehastigheten. Rør 1 inneholder et fulltrykksrør 4 og statisk overtrykk 5, som er koblet til trykkmåler 6 og 7. I tillegg er det installert et termoelement 8 i rør 1, som kan bevege seg langs tverrsnittet samtidig med fulltrykksrøret. Størrelsen på termoelementets emf bestemmes av potensiometer 9. Oppvarming av luften som beveger seg gjennom røret reguleres ved hjelp av en laboratorieautotransformator 12 ved å endre kraften til varmeren, som bestemmes av avlesningene til amperemeter 14 og voltmeter 13. Temperaturen på luften ved utløpet av varmeren bestemmes av termometer 15.
1.2. EKSPERIMENTELL PROSEDYRE
Varmestrømmen til varmeren, W:
hvor I – gjeldende, A; U – spenning, V; = 0,96; =
= 0,94 – varmetapskoeffisient.

Fig.1.1. Eksperimentelt oppsettdiagram:
1 - rør; 2 - forvirrer; 3 - vifte; 4 - rør for måling av dynamisk trykk;
5 - rør; 6, 7 – differensialtrykkmålere; 8 - termoelement; 9 - potensiometer; 10 - isolasjon;
11 - elektrisk varmeapparat; 12 - laboratorie autotransformator; 13 - voltmeter;
14 – amperemeter; 15 – termometer
Varmestrøm absorbert av luft, W:
hvor m – masseluftstrøm, kg/s; – eksperimentell, masseisobarisk varmekapasitet til luft, J/(kg K); – lufttemperatur ved utgangen fra varmeseksjonen og ved inngangen til denne, °C.
Luftmassemengde, kg/s:
![]() . (1.10)
. (1.10)
Her er gjennomsnittlig lufthastighet i røret, m/s; d – rørets indre diameter, m; – lufttetthet ved temperatur, som finnes av formelen kg/m3:
![]() , (1.11)
, (1.11)
hvor = 1.293 kg/m3 – lufttetthet under normale fysiske forhold; B – trykk, mm. rt. st; – overskytende statisk lufttrykk i røret, mm. vann Kunst.
Lufthastigheter bestemmes av dynamisk trykk i fire like seksjoner, m/s:
hvor er det dynamiske trykket, mm. vann Kunst. (kgf/m2); g = 9,81 m/s2 – akselerasjon av fritt fall.
Gjennomsnittlig lufthastighet i rørtverrsnittet, m/s:
Den gjennomsnittlige isobariske massevarmekapasiteten til luft bestemmes fra formel (1.9), der varmestrømmen erstattes fra ligning (1.8). Den nøyaktige verdien av varmekapasiteten til luft ved gjennomsnittlig lufttemperatur er funnet fra tabellen over gjennomsnittlige varmekapasiteter eller fra den empiriske formelen, J/(kg⋅K):
![]() . (1.14)
. (1.14)
Relativ feil i eksperimentet, %:
![]() . (1.15)
. (1.15)
1.3. Gjennomføring av eksperimentet og bearbeiding
måleresultater
Eksperimentet utføres i følgende rekkefølge.
1. Laboratoriestativet slås på og etter å ha etablert en stasjonær modus, blir følgende avlesninger tatt:
Dynamisk lufttrykk ved fire punkter med like rørseksjoner;
For høyt statisk lufttrykk i røret;
Strøm I, A og spenning U, V;
Innløpslufttemperatur, °C (termoelement 8);
Utløpstemperatur, °C (termometer 15);
Barometertrykk B, mm. rt. Kunst.
Eksperimentet gjentas for neste modus. Måleresultatene er lagt inn i tabell 1.2. Beregninger er utført i tabell. 1.3.
Tabell 1.2
Måletabell
Navn på mengde | |||
Luftinntakstemperatur, °C | |||
Utgangslufttemperatur, °C |
|||
Dynamisk lufttrykk, mm. vann Kunst. | |||
For høyt statisk lufttrykk, mm. vann Kunst. |
|||
Barometertrykk B, mm. rt. Kunst. |
|||
Spenning U, V |
Tabell 1.3
Beregningstabell
Navn på mengder |
|
|||
Dynamisk trykk, N/m2 | ||||
Gjennomsnittlig innløpstemperatur, °C |
Under spesifikk varmekapasitet stoffer forstår mengden varme som må legges til eller trekkes fra en stoffenhet (1 kg, 1 m 3, 1 mol) for å endre temperaturen med én grad.
Avhengig av enheten til et gitt stoff, skilles følgende spesifikke varmekapasiteter ut:
Massevarmekapasitet MED, referert til 1 kg gass, J/(kg∙K);
Molar varmekapasitet µС, referert til 1 kmol gass, J/(kmol∙K);
Volumetrisk varmekapasitet MED', referert til 1 m 3 gass, J/(m 3 ∙K).
Spesifikke varmekapasiteter er relatert til hverandre ved forholdet:
Hvor υ n- spesifikt volum av gass under normale forhold (n.s.), m 3 /kg; µ - molar masse av gass, kg/kmol.
Varmekapasiteten til en ideell gass avhenger av arten av prosessen med å tilføre (eller fjerne) varme, på atomiteten til gassen og temperaturen (varmekapasiteten til ekte gasser avhenger også av trykk).
Forholdet mellom masse isobarisk Med P og isokorisk CV varmekapasitet er etablert av Mayer-ligningen:
C P - C V = R, (1.2)
Hvor R – gasskonstant, J/(kg∙K).
Når en ideell gass varmes opp i et lukket kar med konstant volum, brukes varme kun på å endre bevegelsesenergien til molekylene, og når den varmes opp ved konstant trykk, på grunn av gassens ekspansjon, utføres det samtidig arbeid mot ytre krefter .
For molar varmekapasitet har Mayers ligning formen:
µС р - µС v = µR, (1.3)
Hvor µR=8314J/(kmol∙K) – universell gasskonstant.
Ideelt gassvolum V n, redusert til normale forhold, bestemmes ut fra følgende forhold:
![]() (1.4)
(1.4)
Hvor R n– trykk under normale forhold, R n= 101325 Pa = 760 mmHg; Tn– temperatur under normale forhold, Tn= 273,15 K; P t, V t, T t– driftstrykk, volum og temperatur på gassen.
Forholdet mellom isobar og isokorisk varmekapasitet er angitt med k og ring adiabatisk indeks:
![]() (1.5)
(1.5)
Fra (1.2) og tatt i betraktning (1.5) får vi:
For nøyaktige beregninger bestemmes den gjennomsnittlige varmekapasiteten av formelen:
![]() (1.7)
(1.7)
I termiske beregninger av forskjellig utstyr bestemmes ofte mengden varme som kreves for å varme eller avkjøle gasser:
Q = C∙m∙(t 2 - t 1), (1.8)
Q = C′∙V n∙(t 2 - t 1), (1.9)
Hvor V n– volum gass ved standardforhold, m3.
Q = µC∙ν∙(t 2 - t 1), (1.10)
Hvor ν – mengde gass, kmol.
Varmekapasitet. Bruke varmekapasitet til å beskrive prosesser i lukkede systemer
I henhold til ligning (4.56) kan varme bestemmes hvis endringen i entropien S i systemet er kjent. Det faktum at entropi ikke kan måles direkte skaper imidlertid noen komplikasjoner, spesielt når man beskriver isokoriske og isobariske prosesser. Det er behov for å bestemme mengden varme ved å bruke en mengde målt eksperimentelt.
Denne verdien kan være varmekapasiteten til systemet. Den mest generelle definisjonen av varmekapasitet følger av uttrykket for termodynamikkens første lov (5.2), (5.3). Basert på det, bestemmes enhver kapasitet til systemet C med hensyn til arbeid av type m av ligningen
C m = dA m / dP m = P m d e g m / dP m , (5,42)
hvor C m er systemkapasiteten;
P m og g m er henholdsvis generalisert potensial og tilstandskoordinat av type m.
Verdien C m viser hvor mye arbeid av type m som må gjøres under gitte forhold for å endre det mnd generaliserte potensialet til systemet med dets måleenhet.
Konseptet med kapasiteten til et system i forhold til et bestemt arbeid innen termodynamikk er mye brukt bare når man beskriver den termiske interaksjonen mellom systemet og miljøet.
Kapasiteten til systemet i forhold til varme kalles varmekapasitet og er gitt av likheten
C = d e Q / dT = Td e S varme / dT. (5,43)
Dermed, Varmekapasitet kan defineres som mengden varme som må gis til et system for å endre temperaturen med én Kelvin.
Varmekapasitet, som intern energi og entalpi, er en omfattende mengde proporsjonal med mengden materie. I praksis brukes varmekapasiteten per masseenhet av et stoff - spesifikk varmekapasitet, og varmekapasiteten per mol av stoffet, – molar varmekapasitet. Spesifikk varmekapasitet i SI uttrykkes i J/(kg K), og molar kapasitet i J/(mol K).
Spesifikke og molare varmekapasiteter er relatert av forholdet:
C mol = C slag M, (5,44)
hvor M er molekylvekten til stoffet.
Skille sann (differensiell) varmekapasitet, bestemt fra ligning (5.43) og representerer den elementære økningen av varme med en uendelig liten endring i temperaturen, og gjennomsnittlig varmekapasitet, som er forholdet mellom den totale varmemengden og den totale temperaturendringen i en gitt prosess:
Q/DT. (5,45)
Forholdet mellom sann og gjennomsnittlig spesifikk varmekapasitet etableres av forholdet
Ved konstant trykk eller volum får varme og følgelig varmekapasitet egenskapene til en tilstandsfunksjon, dvs. bli kjennetegn ved systemet. Det er disse varmekapasitetene - isobarisk C P (ved konstant trykk) og isokorisk C V (ved konstant volum) som er mest brukt innen termodynamikk.
Hvis systemet varmes opp med et konstant volum, skrives den isokoriske varmekapasiteten C V i samsvar med uttrykk (5.27) på formen
C V = ![]() . (5.48)
. (5.48)
Hvis systemet varmes opp ved konstant trykk, vises den isobariske varmekapasiteten С Р i samsvar med ligning (5.32) i skjemaet
C P = ![]() . (5.49)
. (5.49)
For å finne sammenhengen mellom С Р og С V, er det nødvendig å differensiere uttrykk (5.31) med hensyn til temperatur. For ett mol av en ideell gass kan dette uttrykket, tatt i betraktning ligning (5.18), representeres som
H = U + pV = U + RT. (5,50)
dH/dT = dU/dT + R, (5,51)
og forskjellen mellom isobarisk og isokorisk varmekapasitet for en mol av en ideell gass er numerisk lik den universelle gasskonstanten R:
C R - C V = R . (5,52)
Varmekapasiteten ved konstant trykk er alltid større enn varmekapasiteten ved konstant volum, siden oppvarming av et stoff ved konstant trykk er ledsaget av arbeidet med gassekspansjon.
Ved å bruke uttrykket for den indre energien til en ideell monatomisk gass (5.21), får vi verdien av dens varmekapasitet for én mol av en ideell monatomisk gass:
C V = dU/dT = d(3/2 RT)dT = 3/2 R » 12,5 J/(mol K); (5,53)
C P = 3/2R + R = 5/2 R » 20,8 J/(mol K). (5,54)
For monoatomiske ideelle gasser er altså ikke CV og C p avhengig av temperatur, siden all tilført termisk energi bare brukes på akselererende translasjonsbevegelse. For polyatomiske molekyler, sammen med en endring i translasjonsbevegelse, kan en endring i rotasjons- og vibrasjonsintramolekylær bevegelse også forekomme. For diatomiske molekyler blir det vanligvis tatt hensyn til ytterligere rotasjonsbevegelse, som et resultat av at de numeriske verdiene for deres varmekapasitet er:
C V = 5/2 R » 20,8 J/(mol K); (5,55)
Cp = 5/2 R + R = 7/2 R » 29,1 J/(mol K). (5,56)
Underveis vil vi berøre varmekapasiteten til stoffer i andre (unntatt gassformige) aggregeringstilstander. For å estimere varmekapasiteten til faste kjemiske forbindelser, brukes ofte den omtrentlige Neumann- og Kopp-additivitetsregelen, ifølge hvilken den molare varmekapasiteten til kjemiske forbindelser i fast tilstand er lik summen av atomvarmekapasiteten til elementene som inngår i en gitt forbindelse. Dermed varmekapasiteten til et kompleks kjemisk forbindelse Tatt i betraktning Dulong og Petit-regelen, kan den estimeres som følger:
C V = 25n J/(mol K), (5,57)
hvor n er antall atomer i molekylene til forbindelsene.
Varmekapasiteten til væsker og faste stoffer nær smeltepunktet (krystallisering) er nesten like. Nær det normale kokepunktet har de fleste organiske væsker en spesifikk varmekapasitet på 1700 - 2100 J/kg K. I intervallene mellom disse faseovergangstemperaturene kan væskens varmekapasitet variere betydelig (avhengig av temperatur). Generelt er avhengigheten av varmekapasiteten til faste stoffer av temperatur i området 0 – 290 K i de fleste tilfeller godt formidlet av den semi-empiriske Debye-ligningen (for krystallgitter) i lavtemperaturområdet
C P » C V = eT 3, (5,58)
hvor proporsjonalitetskoeffisienten (e) avhenger av stoffets natur (empirisk konstant).
Avhengigheten av varmekapasiteten til gasser, væsker og faste stoffer av temperatur ved vanlige og høye temperaturer uttrykkes vanligvis ved hjelp av empiriske ligninger i form av potensserier:
C P = a + bT + cT2 (5,59)
C P = a + bT + c"T -2, (5,60)
hvor a, b, c og c" er empiriske temperaturkoeffisienter.
For å gå tilbake til beskrivelsen av prosesser i lukkede systemer ved bruk av varmekapasitetsmetoden, la oss skrive noen av ligningene gitt i avsnitt 5.1 i en litt annen form.
Isokorisk prosess. Uttrykker vi intern energi (5.27) i form av varmekapasitet, får vi
dU V = dQ V = U 2 – U 1 = C V dT = C V dT . (5,61)
Når man tar i betraktning det faktum at varmekapasiteten til en ideell gass ikke er avhengig av temperatur, kan ligning (5.61) skrives som følger:
DU V = Q V = U 2 - U 1 = C V DT . (5,62)
For å beregne verdien av integralet (5.61) for ekte mono- og polyatomiske gasser, må du kjenne til den spesifikke formen for funksjonell avhengighet C V = f(T) type (5.59) eller (5.60).
Isobarisk prosess. For den gassformige tilstanden til et stoff er termodynamikkens første lov (5.29) for denne prosessen, tatt i betraktning ekspansjonsarbeidet (5.35) og bruk av varmekapasitetsmetoden, skrevet som følger:
Q P = C V DT + RDT = C P DT = DH (5,63)
Q Р = DH Р = H 2 – H 1 = C Р dT. (5,64)
Hvis systemet er en ideell gass og varmekapasiteten С Р ikke er avhengig av temperaturen, blir relasjon (5.64) (5.63). For å løse ligning (5.64), som beskriver en reell gass, er det nødvendig å kjenne den spesifikke formen til avhengigheten C p = f(T).
Isotermisk prosess. Endring i den indre energien til en ideell gass i en prosess som skjer ved konstant temperatur
dU T = C V dT = 0. (5,65)
Adiabatisk prosess. Siden dU = C V dT, så for ett mol av en ideell gass er endringen i indre energi og arbeidet som er utført lik, henholdsvis:
DU = C V dT = C V (T 2 - T 1); (5,66)
En pels = -DU = C V (T 1 - T 2). (5,67)
Analyse av ligninger som karakteriserer ulike termodynamiske prosesser under betingelsene: 1) p = const; 2) V = const; 3) T = const og 4) dQ = 0 viser at alle kan representeres av den generelle ligningen:
pV n = konst. (5,68)
I denne ligningen kan "n"-indikatoren ta verdier fra 0 til ¥ for forskjellige prosesser:
1. isobarisk (n = 0);
2. isotermisk (n = 1);
3. isokorisk (n = ¥);
4. adiabatisk (n = g; hvor g = C P /C V – adiabatisk koeffisient).
De resulterende relasjonene er gyldige for en ideell gass og representerer en konsekvens av dens tilstandsligning, og prosessene som vurderes er spesielle og begrensende manifestasjoner av virkelige prosesser. Virkelige prosesser er som regel mellomliggende, forekommer ved vilkårlige verdier på "n" og kalles polytropiske prosesser.
Hvis vi sammenligner arbeidet med utvidelse av en ideell gass produsert i de betraktede termodynamiske prosessene med volumendringen fra V 1 til V 2, så, som det kan sees fra fig. 5.2 utføres det største ekspansjonsarbeidet i en isobar prosess, mindre i en isoterm prosess, og enda mindre i en adiabatisk prosess. For en isokorisk prosess er arbeidet null.
Ris. 5.2. P = f (V) – avhengighet for ulike termodynamiske prosesser (skyggelagte områder karakteriserer ekspansjonsarbeidet i den tilsvarende prosessen)
Den russiske føderasjonen Protokoll til USSR State Standard
GSSSD 8-79 Flytende og gassformig luft. Tetthet, entalpi, entropi og isobar varmekapasitet ved temperaturer 70-1500 K og trykk 0,1-100 MPa
sett bokmerke
sett bokmerke
STANDARD TJENESTE FOR STANDARDREFERANSEDATA
Standard referansedatatabeller
LUFT ER FLYTENDE OG GASSET. TETTHET, ENTALPI, ENTROPI OG ISOBARISK VARMEKAPASITET VED TEMPERATURER 70-1500 K OG TRYKK 0,1-100 MPa
Tabeller med standard referansedata
Flytende og gassformig luft Tetthet, entalpi, entropi og isobar varmekapasitet ved temperaturer fra 70 til 1500 K og trykk fra 0,1 til 100 MPa
UTVIKLET av All-Union Scientific Research Institute of Metrological Service, Odessa Institute of Marine Engineers, Moscow Order of Lenin Energy Institute
ANBEFALT FOR GODKJENNING av den sovjetiske nasjonale komiteen for innsamling og evaluering av numeriske data innen vitenskap og teknologi i presidiet til USSR Academy of Sciences; All-Union Scientific Research Center Sivil tjeneste standard referansedata
GODKJENT av SSSSD-ekspertkommisjonen bestående av:
Ph.D. tech. Sciences N.E. Gnezdilova, Dr. Tech.. Sciences I.F. Golubeva, doktor i kjemi. Sciences L.V. Gurvich, doktor i ingeniørfag. Sciences B.A. Rabinovich, doktor i ingeniørfag. Sciences A.M. Sirota
FORBEREDT FOR GODKJENNING av All-Union Scientific Research Centre of the State Service of Standard Reference Data
Bruk av standard referansedata er obligatorisk i alle sektorer av den nasjonale økonomien
Disse tabellene inneholder de viktigste praktiske verdiene for tetthet, entalpi, entropi og isobarisk varmekapasitet til flytende og gassformig luft.
Beregningen av tabeller er basert på følgende prinsipper:
1. En tilstandsligning som viser pålitelige eksperimentelle data med høy nøyaktighet på , , -avhengigheten kan gi en pålitelig beregning av kalori- og akustiske egenskaper ved bruk av kjente termodynamiske sammenhenger.
2. Gjennomsnittskoeffisienter stort nummer tilstandsligninger, ekvivalente når det gjelder nøyaktigheten av beskrivelsen av den første informasjonen, lar oss oppnå en ligning som reflekterer hele den termodynamiske overflaten (for et utvalgt sett med eksperimentelle data blant ligninger av den aksepterte typen). Slik gjennomsnittsberegning gjør det mulig å estimere den mulige tilfeldige feilen i de beregnede verdiene av termiske, kaloriske og akustiske mengder, uten å ta hensyn til påvirkningen av den systematiske feilen til eksperimentelle , , -data og feilen forårsaket av valget av form for tilstandsligningen.
Den gjennomsnittlige tilstandsligningen for flytende og gassformig luft har formen
Hvor ; ; .
Ligningen er satt sammen basert på de mest pålitelige eksperimentelle tetthetsverdiene oppnådd i verkene og dekker temperaturområdet 65-873 K og trykk på 0,01-228 MPa. De eksperimentelle dataene er beskrevet ved en ligning med en gjennomsnittlig kvadratfeil på 0,11 %. Koeffisientene til den gjennomsnittlige tilstandsligningen ble oppnådd som et resultat av å behandle et system med 53 ligninger som tilsvarer nøyaktigheten til beskrivelsen av eksperimentelle data. I beregningene ble følgende verdier for gasskonstanten og kritiske parametere tatt: 287,1 J/(kg K); 132,5 K; 0,00316 m/kg.
Koeffisienter for den gjennomsnittlige lufttilstandsligningen:
Entalpi, entropi og isobar varmekapasitet ble bestemt ved å bruke formlene
Hvor , , er entalpi, entropi og isokorisk varmekapasitet i den ideelle gasstilstanden. Verdiene til og bestemmes ut fra relasjonene
Hvor og er entalpi og entropi ved temperatur; - sublimasjonsvarme ved 0 K; - konstant (0 i dette arbeidet).
Verdien av sublimeringsvarmen til luft ble beregnet basert på data om sublimeringsvarmen til komponentene og er lik 253,4 kJ/kg (i beregningene ble det antatt at luft ikke inneholder CO og består av 78,11 % N, 20,96 % O og 0,93 % Ar etter volum). Verdiene av entalpi og entropi ved en temperatur på 100 K, som er et hjelpereferansepunkt ved integrering av ligningen for , er henholdsvis 3,48115 kJ/kg og 20,0824 kJ/(kg K).
Den isobariske varmekapasiteten i den ideelle gasstilstanden er lånt fra verket og tilnærmet med et polynom
Rotmiddelkvadratfeilen for tilnærming av de innledende dataene i temperaturområdet 50-2000 K er 0,009%, maksimum er omtrent 0,02%.
Tilfeldige feil av beregnede verdier beregnes med en konfidenssannsynlighet på 0,997 ved å bruke formelen
Hvor er gjennomsnittsverdien av den termodynamiske funksjonen; - verdien av den samme funksjonen oppnådd av den th ligningen fra et system som inneholder ligninger.
Tabell 1-4 viser verdiene av de termodynamiske funksjonene til luft, og tabeller 5-8 viser tilsvarende tilfeldige feil. Feilverdiene i tabell 5-8 er presentert for deler av isobarene, og verdiene for mellomliggende isobare kan oppnås med akseptabel nøyaktighet ved lineær interpolasjon. Tilfeldige feil i de beregnede verdiene gjenspeiler spredningen av sistnevnte i forhold til den gjennomsnittlige tilstandsligningen; for tetthet er de betydelig mindre enn den gjennomsnittlige kvadratfeilen i beskrivelsen av den opprinnelige matrisen av eksperimentelle data, som fungerer som et integrert estimat og inkluderer store avvik for noen data preget av spredning.
Tabell 1
Lufttetthet
Fortsettelse
Kg/m, at , MPa, |
|||||||||||
tabell 2
Entalpi av luft
Fortsettelse
KJ/kg, at , MPa, |
|||||||||||
Tabell 3
Entropi av luft
Fortsettelse
KJ/(kg, K), at , MPa, |
|||||||||||
Tabell 4
Isobarisk varmekapasitet til luft
________________
* Teksten i dokumentet tilsvarer originalen. - Databaseprodusentens notat.
Fortsettelse
KJ/(kg, K), at , MPa, |
|||||||||||
Tabell 5. Gjennomsnittlig kvadratisk tilfeldig feil av beregnede tetthetsverdier
, %, at , MPa |
|||||||||||||
Tabell 6. Root mean square tilfeldige feil av beregnede entalpiverdier
KJ/kg, at , MPa |
||||||||||||||||
På grunn av bruken av den viriale formen til tilstandsligningen, later ikke tabellene til å nøyaktig beskrive de termodynamiske egenskapene i nærheten av det kritiske punktet (126-139 K, 190-440 kg/m).
Informasjon om eksperimentelle studier av de termodynamiske egenskapene til luft, metoder for å kompilere tilstandsligningen og beregningstabeller, konsistensen av beregnede verdier med eksperimentelle data, samt mer detaljerte tabeller som inneholder tilleggsinformasjon om isokorisk varmekapasitet, lydhastighet, fordampningsvarme, strupeeffekt, enkelte derivater og egenskaper på koke- og kondensasjonskurver er gitt i arbeidet.
BIBLIOGRAFI
1. Nolborn L., Schultre N. die Druckwage und die Isothermen von Luft, Argon und Helium Zwischen 0 og 200 °C. - Ann. Phys. 1915 m, Bd 47, N 16, S.1089-1111.
2. Michels A., Wassenaar T., Van Seventer W. Isotermer av luft mellom 0 °C og 75 °C og ved trykk opp til 2200 atm. -Appl. Sci. Res., 1953, vol. 4, nr. 1, s. 52-56.
3. Kompressibilitetsisotermer av luft ved temperaturer mellom -25 °C og -155 °C og ved tettheter opp til 560 Amagats (trykk opp til 1000 atmosfærer) / Michels A.. Wassenaar T., Levelt J.M., De Graaff W. - Appl. . Sci. Res., 1954, vol. A 4, N 5-6, s. 381-392.
4. Eksperimentell studie av spesifikke luftvolumer/Vukalovich M.P., Zubarev V.N., Aleksandrov A.A., Kozlov A.D. - Termisk kraftteknikk, 1968, N 1, s. 70-73.
5. Romberg N. Neue Messungen der thermischen ler Luft bei tiefen Temperaturen and die Berechnung der kalorischen mit Hilfe des Kihara-Potentials. - VDl-Vorschungsheft, 1971, - N 543, S.1-35.
6. Blanke W. Messung der thermischen von Luft im Zweiphasengebiet und Seiner Umgebung. Dissertation zur Erlangung des Grades eines Doctor-Ingenieurs/. Bohum., 1973.
7. Måling av lufttetthet ved temperaturer 78-190 K opp til et trykk på 600 bar / Wasserman A.A., Golovsky E.A., Mitsevich E.P., Tsymarny V.A., M., 1975. (Deponert i VINITI 28.07 .736 N 72).
8. Landolt N., R. Zahlenwerte und Funktionen aus Physik, Chemie, Astronomic, Geophysik und Technik. Berlin., Springer Verlag, 1961, Bd.2.
9. Tabeller over termiske egenskaper til gasser. Wachington, Gov. trykk, off., 1955, XI. (U.S. Dep. of commerce. NBS. Girc. 564).
10. Termodynamiske egenskaper til luft/Sychev V.V., Wasserman A.A., Kozlov A.D. og andre. M., Standards Publishing House, 1978.
Transportenergi (kaldtransport) Luftfuktighet. Varmekapasitet og entalpi av luftLuftfuktighet. Varmekapasitet og entalpi av luft
Atmosfærisk luft er en blanding av tørr luft og vanndamp (fra 0,2 % til 2,6 %). Dermed kan luften nesten alltid betraktes som fuktig.
Den mekaniske blandingen av tørr luft og vanndamp kalles fuktig luft eller en luft-dampblanding. Maksimalt mulig innhold av dampaktig fuktighet i luften m p.n. avhenger av temperaturen t og trykk P blandinger. Når det endres t Og P luften kan gå fra i utgangspunktet umettet til en tilstand av metning med vanndamp, og deretter vil overflødig fuktighet begynne å felle ut i gassvolumet og på de omsluttende flatene i form av tåke, frost eller snø.
Hovedparametrene som karakteriserer tilstanden til fuktig luft er: temperatur, trykk, spesifikt volum, fuktighetsinnhold, absolutt og relativ fuktighet, molekylvekt, gasskonstant, varmekapasitet og entalpi.
I henhold til Daltons lov for gassblandinger totalt trykk av fuktig luft (P) er summen av partialtrykkene til tørr luft P c og vanndamp P p: P = P c + P p.
På samme måte vil volumet V og massen m av fuktig luft bestemmes av relasjonene:
V = V c + V p, m = m c + m p.
Tetthet Og spesifikt volum fuktig luft (v) definert:
![]()
Molekylvekt av fuktig luft:
![]()
hvor B er barometertrykk.
Siden luftfuktigheten øker kontinuerlig under tørkeprosessen, og mengden tørr luft i damp-luftblandingen forblir konstant, bedømmes tørkeprosessen etter hvordan mengden vanndamp per 1 kg tørr luft endres, og alle indikatorer for damp-luftblanding (varmekapasitet, fuktighetsinnhold, entalpi osv.) refererer til 1 kg tørr luft som befinner seg i fuktig luft.
d = m p / m c, g/kg, eller, X = m p / m c.
Absolutt luftfuktighet- masse damp i 1 m 3 fuktig luft. Denne verdien er numerisk lik .
Relativ fuktighet - er forholdet mellom den absolutte fuktigheten til umettet luft og den absolutte fuktigheten til mettet luft under gitte forhold:
her, men oftere er relativ fuktighet angitt i prosent.
For tettheten av fuktig luft er følgende forhold gyldig:
Spesifikk varme fuktig luft:
c = c c + c p ×d/1000 = c c + c p ×X, kJ/(kg × °C),
hvor c c er den spesifikke varmekapasiteten til tørr luft, c c = 1,0;
c p - spesifikk varmekapasitet til damp; med n = 1,8.
Varmekapasiteten til tørr luft ved konstant trykk og små temperaturområder (opptil 100 o C) for omtrentlige beregninger kan betraktes som konstant, lik 1,0048 kJ/(kg × ° C). For overhetet damp kan den gjennomsnittlige isobariske varmekapasiteten ved atmosfærisk trykk og lave grader av overoppheting også tas som konstant og lik 1,96 kJ/(kg×K).
Entalpi (i) av fuktig luft- dette er en av hovedparametrene, som er mye brukt i beregninger av tørkeinstallasjoner, hovedsakelig for å bestemme varmen brukt på å fordampe fuktighet fra materialene som tørkes. Entalpien til fuktig luft refereres til ett kilo tørr luft i en damp-luftblanding og bestemmes som summen av entalpiene av tørr luft og vanndamp, dvs.
i = i c + i p ×Х, kJ/kg.
Ved beregning av entalpien til blandinger må utgangspunktet for entalpiene til hver komponent være det samme. For beregninger av fuktig luft kan vi anta at entalpien til vann er null ved 0 o C, da teller vi også entalpien til tørr luft fra 0 o C, det vil si i in = c i *t = 1,0048t.