Metodat e inxhinierisë gjenetike për prodhimin e proteinave. Proteina të reja të krijuara gjenetikisht të bazuara në antitrupa rekombinantë kundër TNF Efimov Grigory Aleksandrovich. Studimi i vetive biologjike të sensorit fluoreshent Vhh41-KTNFin vitro dhe in vivo
Dërgoni punën tuaj të mirë në bazën e njohurive është e thjeshtë. Përdorni formularin e mëposhtëm
Studentët, studentët e diplomuar, shkencëtarët e rinj që përdorin bazën e njohurive në studimet dhe punën e tyre do t'ju jenë shumë mirënjohës.
Postuar ne http://www.allbest.ru/
Puna e kursit
disiplina: Bioteknologji bujqësore
me temën: "Inxhinieria e proteinave"
- Ese
- Prezantimi
- I. Inxhinieria e proteinave
- 1.1 Koncepti i inxhinierisë së proteinave. Historia e zhvillimit
- II. Shembuj të proteinave të krijuara
- 3.3 Disa arritje të inxhinierisë së proteinave.
- konkluzioni
- Bibliografi
Tema: Inxhinieria e proteinave.
Fjalët kyçe: bioteknologji, inxhinieri gjenetike, proteina, kodi gjenetik, gjen, ADN, ARN, ATP, peptide, epitop.
Qëllimi i punës së kursit: të studiohet koncepti i "inxhinierisë së proteinave" dhe mundësitë e mundshme të përdorimit të saj.
Mundësitë e mundshme të inxhinierisë së proteinave:
1. Duke ndryshuar forcën e lidhjes së substancës që konvertohet - substratit - në enzimë, është e mundur të rritet efikasiteti i përgjithshëm katalitik i reaksionit enzimatik.
2. Duke rritur qëndrueshmërinë e proteinës në një gamë të gjerë temperaturash dhe aciditeti, ajo mund të përdoret në kushte në të cilat proteina origjinale denatyrohet dhe humbet aktivitetin e saj.
3. Duke krijuar proteina që mund të funksionojnë në tretës anhidër, është e mundur të kryhen reaksione katalitike në kushte jofiziologjike.
4. Duke ndryshuar qendrën katalitike të një enzime, ju mund të rrisni specifikën e saj dhe të zvogëloni numrin e reaksioneve anësore të padëshiruara
5. Duke rritur rezistencën e proteinës ndaj enzimave që e shpërbëjnë atë, procedura për pastrimin e saj mund të thjeshtohet.
6. Duke ndryshuar një proteinë në mënyrë që ajo të mund të funksionojë pa përbërësin e saj të zakonshëm jo-aminoacid (vitaminë, atom metali etj.), ajo mund të përdoret në disa procese të vazhdueshme teknologjike.
7. Duke ndryshuar strukturën e seksioneve rregullatore të enzimës, është e mundur të zvogëlohet shkalla e frenimit të saj nga produkti i reaksionit enzimatik sipas llojit të reagimeve negative dhe në këtë mënyrë të rritet rendimenti i produktit.
8. Është e mundur të krijohet një proteinë hibride që ka funksionet e dy ose më shumë proteinave.
9. Është e mundur të krijohet një proteinë hibride, një nga seksionet e së cilës lehtëson çlirimin e proteinës hibride nga qeliza e kultivuar ose nxjerrjen e saj nga përzierja.
Prezantimi
Që nga kohra të lashta, bioteknologjia është përdorur kryesisht në industrinë ushqimore dhe të lehta: në prodhimin e verës, buke, fermentimin e produkteve të qumështit, në përpunimin e lirit dhe lëkurës, bazuar në përdorimin e mikroorganizmave. Në dekadat e fundit, mundësitë e bioteknologjisë janë zgjeruar jashtëzakonisht shumë. Kjo për faktin se metodat e tij janë më fitimprurëse se ato konvencionale për arsyen e thjeshtë se në organizmat e gjallë, reaksionet biokimike të katalizuara nga enzimat ndodhin në kushte optimale (temperaturë dhe presion), janë më produktive, miqësore me mjedisin dhe nuk kërkojnë kimikate. reagentë që helmojnë mjedisin.
Objektet e bioteknologjisë janë përfaqësues të shumtë të grupeve të organizmave të gjallë - mikroorganizma (viruse, baktere, protozoa, maja), bimë, kafshë, si dhe qeliza të izoluara prej tyre dhe përbërës nënqelizor (organele) dhe madje edhe enzima. Bioteknologjia bazohet në proceset fiziologjike dhe biokimike që ndodhin në sistemet e gjalla, të cilat rezultojnë në çlirimin e energjisë, sintezën dhe zbërthimin e produkteve metabolike dhe formimin e përbërësve kimikë dhe strukturorë të qelizës.
Drejtimi kryesor i bioteknologjisë është prodhimi, duke përdorur mikroorganizma dhe qeliza eukariote të kultivuara, të përbërjeve biologjikisht aktive (enzima, vitamina, hormone), medikamente (antibiotikë, vaksina, serume, antitrupa shumë specifikë, etj.), si dhe përbërës të vlefshëm ( aditivët e ushqimit, për shembull, aminoacidet thelbësore, proteinat e ushqimit, etj.).
Metodat e inxhinierisë gjenetike kanë bërë të mundur sintetizimin në sasi industriale të hormoneve si insulina dhe somatotropina (hormoni i rritjes), të cilat janë të nevojshme për trajtimin e sëmundjeve gjenetike të njeriut.
Bioteknologjia zgjidh jo vetëm probleme specifike të shkencës dhe prodhimit. Ai ka një detyrë metodologjike më globale - zgjeron dhe përshpejton shkallën e ndikimit njerëzor në natyrën e gjallë dhe promovon përshtatjen e sistemeve të gjalla me kushtet e ekzistencës njerëzore, d.m.th., në noosferë. Bioteknologjia, pra, vepron si një faktor i fuqishëm në evolucionin adaptiv antropogjen.
Bioteknologjia, inxhinieria gjenetike dhe qelizore kanë perspektiva premtuese. Ndërsa shfaqen gjithnjë e më shumë vektorë të rinj, njerëzit do t'i përdorin ato për të futur gjenet e nevojshme në qelizat e bimëve, kafshëve dhe njerëzve. Kjo do të bëjë të mundur që gradualisht të shpëtojmë nga shumë sëmundje të trashëguara të njeriut, të detyrojë qelizat të sintetizojnë barnat e nevojshme dhe përbërjet biologjikisht aktive, dhe më pas drejtpërdrejt proteinat dhe aminoacidet thelbësore të përdorura në ushqim. Duke përdorur metoda tashmë të zotëruara nga natyra, bioteknologët shpresojnë të marrin hidrogjen përmes fotosintezës - karburanti më miqësor ndaj mjedisit i së ardhmes, energjinë elektrike, dhe të shndërrojnë azotin atmosferik në amoniak në kushte normale.
Vetitë fizike dhe kimike të proteinave natyrore shpesh nuk i plotësojnë kushtet në të cilat këto proteina do të përdoren nga njerëzit. Kërkohet një ndryshim në strukturën e saj primare, e cila do të sigurojë formimin e një proteine me një strukturë hapësinore të ndryshme nga ajo e mëparshme dhe veti të reja fiziko-kimike, duke e lejuar atë të kryejë funksionet e qenësishme të proteinës natyrore në kushte të tjera. Inxhinieria e proteinave merret me ndërtimin e proteinave.
Një fushë tjetër e aplikimit të inxhinierisë së proteinave është krijimi i proteinave që mund të neutralizojnë substancat dhe mikroorganizmat që mund të përdoren për sulme kimike dhe biologjike. Për shembull, enzimat hidrolazë janë të afta të neutralizojnë si gazet nervore ashtu edhe pesticidet e përdorura në bujqësi. Për më tepër, prodhimi, ruajtja dhe përdorimi i enzimave nuk është i rrezikshëm për mjedisin dhe shëndetin e njeriut.
Për të marrë një proteinë të ndryshuar, përdoren metoda të kimisë kombinuese dhe kryhet mutagjeneza e drejtuar - duke futur ndryshime specifike në sekuencat koduese të ADN-së, duke çuar në ndryshime të caktuara në sekuencat e aminoacideve. Për të hartuar në mënyrë efektive një proteinë me vetitë e dëshiruara, është e nevojshme të njihen modelet e formimit të strukturës hapësinore të proteinës, nga e cila varen vetitë dhe funksionet e saj fiziko-kimike, domethënë është e nevojshme të dihet se si është struktura primare e proteinës. , secila prej mbetjeve të aminoacideve të saj ndikon në vetitë dhe funksionet e proteinës. Fatkeqësisht, për shumicën e proteinave struktura terciare është e panjohur; nuk dihet gjithmonë se cili aminoacid ose sekuencë aminoacidesh duhet të ndryshohet për të marrë një proteinë me vetitë e dëshiruara. Tashmë, shkencëtarët duke përdorur analizën kompjuterike mund të parashikojnë vetitë e shumë proteinave bazuar në sekuencën e mbetjeve të tyre të aminoacideve. Një analizë e tillë do të thjeshtojë shumë procedurën për krijimin e proteinave të dëshiruara. Ndërkohë, për të marrë një proteinë të modifikuar me vetitë e dëshiruara, ato kryesisht shkojnë në një mënyrë tjetër: marrin disa gjene mutant dhe gjejnë produktin proteinik të njërit prej tyre që ka vetitë e dëshiruara.
Qasje të ndryshme eksperimentale përdoren për mutagjenezën e drejtuar nga vendi. Pasi ka marrë gjenin e modifikuar, ai integrohet në një konstrukt gjenetik dhe futet në qelizat prokariote ose eukariote që sintetizojnë proteinën e koduar nga ky konstrukt gjenetik.
I. Inxhinieria e proteinave
1.1 Koncepti i inxhinierisë së proteinave. Historia e zhvillimit
Inxhinieria e proteinave është një degë e bioteknologjisë që merret me zhvillimin e proteinave të dobishme ose të vlefshme. Kjo është një disiplinë relativisht e re që fokusohet në studimin e palosjes së proteinave dhe parimet e modifikimit dhe krijimit të proteinave.
Ekzistojnë dy strategji kryesore për inxhinierinë e proteinave: modifikimi i drejtuar i proteinave dhe evolucioni i drejtuar. Këto metoda nuk përjashtojnë njëra-tjetrën; studiuesit shpesh përdorin të dyja. Në të ardhmen, njohuritë më të hollësishme të strukturës dhe funksionit të proteinave, si dhe përparimet në teknologjinë e lartë, mund të zgjerojnë ndjeshëm mundësitë e inxhinierisë së proteinave. Si rezultat, edhe aminoacidet e panatyrshme mund të inkorporohen falë një metode të re që lejon aminoacidet e reja të përfshihen në kodin gjenetik.
Inxhinieria e proteinave filloi në kryqëzimin e fizikës dhe kimisë së proteinave dhe inxhinierisë gjenetike. Ai zgjidh problemin e krijimit të molekulave të proteinave të modifikuara ose hibride me karakteristika të specifikuara. Një mënyrë e natyrshme për të zbatuar një detyrë të tillë është të parashikoni strukturën e gjenit që kodon proteinën e ndryshuar, të kryeni sintezën, klonimin dhe shprehjen e saj në qelizat marrëse.
Modifikimi i parë i kontrolluar i proteinave u krye në mesin e viteve '60 nga Koshland dhe Bender. Për të zëvendësuar grupin hidroksil me një grup sulfhidril në qendrën aktive të proteazës, subtilisin, ata përdorën një metodë modifikimi kimik. Sidoqoftë, siç doli, një tiolsubtilisinë e tillë nuk ruan aktivitetin e proteazës.
Kimikisht, një proteinë është një lloj molekule e vetme, e cila është një zinxhir ose polimer poliaminoacid. Ai përbëhet nga sekuenca aminoacide të 20 llojeve. Pasi mësuan strukturën e proteinave, njerëzit shtruan pyetjen: a është e mundur të hartohen sekuenca krejtësisht të reja aminoacide në mënyrë që ato të kryejnë funksionet që njerëzit kanë nevojë shumë më mirë se proteinat e zakonshme? Emri Protein Engineering ishte i përshtatshëm për këtë ide.
Njerëzit filluan të mendojnë për një inxhinieri të tillë që në vitet 50 të shekullit të 20-të. Kjo ndodhi menjëherë pas deshifrimit të sekuencave të para të aminoacideve të proteinave. Në shumë laboratorë anembanë botës, janë bërë përpjekje për të dyfishuar natyrën dhe për të sintetizuar kimikisht sekuenca të dhëna absolutisht arbitrare të poliaminoacideve.
Kimisti B. Merrifield ia doli më shumë në këtë. Ky amerikan arriti të zhvillojë një metodë jashtëzakonisht efektive për sintezën e zinxhirëve të poliaminoacideve. Për këtë, Merrifield u nderua me Çmimin Nobel në Kimi në 1984.
Figura 1. Skema se si funksionon inxhinieria e proteinave.
Amerikani filloi të sintetizonte peptide të shkurtra, duke përfshirë hormonet. Në të njëjtën kohë, ai ndërtoi një automat - një "robot kimik" - detyra e të cilit ishte të prodhonte proteina artificiale. Roboti bëri bujë në qarqet shkencore. Megjithatë, shpejt u bë e qartë se produktet e tij nuk mund të konkurronin me atë që prodhon natyra.
Roboti nuk mundi të riprodhonte me saktësi sekuencat e aminoacideve, domethënë bëri gabime. Ai sintetizoi një zinxhir me një sekuencë, dhe tjetrin me një pak të modifikuar. Në një qelizë, të gjitha molekulat e një proteine janë në mënyrë ideale të ngjashme me njëra-tjetrën, domethënë sekuencat e tyre janë absolutisht identike.
Kishte një problem tjetër. Edhe ato molekula që roboti sintetizoi në mënyrë korrekte nuk morën formën hapësinore të nevojshme për funksionimin e enzimës. Kështu, përpjekja për të zëvendësuar natyrën me metodat e zakonshme të kimisë organike çoi në një sukses shumë modest.
Shkencëtarët mund të mësonin vetëm nga natyra, duke kërkuar modifikimet e nevojshme të proteinave. Çështja këtu është se në natyrë ka vazhdimisht mutacione që çojnë në ndryshime në sekuencat e aminoacideve të proteinave. Nëse zgjidhni mutantët me vetitë e nevojshme që përpunojnë një substrat të veçantë në mënyrë më efikase, atëherë mund të izoloni nga një mutant i tillë një enzimë të ndryshuar, falë së cilës qeliza fiton veti të reja. Por ky proces kërkon një periudhë shumë të gjatë kohore.
Gjithçka ndryshoi kur u shfaq inxhinieria gjenetike. Falë saj, ata filluan të krijojnë gjene artificiale me çdo sekuencë nukleotide. Këto gjene u futën në molekulat vektoriale të përgatitura dhe ADN-ja u fut në baktere ose maja. Atje, një kopje e ARN-së u mor nga gjeni artificial. Si rezultat, u prodhua proteina e nevojshme. Gabimet në sintezën e tij u përjashtuan. Gjëja kryesore ishte të zgjidhej sekuenca e duhur e ADN-së dhe më pas vetë sistemi enzimë i qelizës e bëri punën e tij në mënyrë të përsosur. Kështu, mund të konkludojmë se inxhinieria gjenetike i ka hapur rrugën inxhinierisë së proteinave në formën e saj më radikale.
1.2 Strategjitë e inxhinierisë së proteinave
Modifikimi i synuar i proteinave. Në modifikimin e synuar të proteinës, shkencëtari përdor njohuri të hollësishme të strukturës dhe funksionit të proteinës për të bërë ndryshimet e dëshiruara. Në përgjithësi, kjo metodë ka avantazhin e të qenit të lirë dhe teknikisht të pakomplikuar, pasi teknika e mutagjenezës së drejtuar nga vendi është e zhvilluar mirë. Megjithatë, disavantazhi kryesor i saj është se informacioni për strukturën e detajuar të një proteine shpesh mungon, madje edhe kur struktura dihet, mund të jetë shumë e vështirë të parashikohet efekti i mutacioneve të ndryshme.
Algoritmet e softuerit të modifikimit të proteinave përpiqen të identifikojnë sekuenca të reja aminoacide që kërkojnë pak energji për të formuar një strukturë të synuar të paracaktuar. Ndërsa sekuenca që duhet gjetur është e madhe, kërkesa më e vështirë për modifikimin e proteinave është një mënyrë e shpejtë, por e saktë, për të identifikuar dhe përcaktuar sekuencën optimale, në krahasim me sekuencat e ngjashme nënoptimale.
Evolucioni i drejtuar. Në evolucionin e drejtuar, mutagjeneza e rastësishme aplikohet në një proteinë dhe bëhet përzgjedhja për të zgjedhur variante që kanë cilësi të caktuara. Më pas, aplikohen më shumë raunde mutacioni dhe përzgjedhjeje. Kjo metodë imiton evolucionin natyror dhe përgjithësisht prodhon rezultate superiore për modifikimin e drejtuar.
Një teknikë shtesë e njohur si përzierja e ADN-së përzihet dhe identifikon pjesë të varianteve të suksesshme për të prodhuar rezultate më të mira. Ky proces imiton rikombinimet që ndodhin natyrshëm gjatë riprodhimit seksual. Avantazhi i evolucionit të drejtuar është se ai nuk kërkon njohuri paraprake të strukturës së proteinave dhe as nuk është e nevojshme të jetë në gjendje të parashikohet se çfarë efekti do të ketë një mutacion i caktuar. Në të vërtetë, rezultatet e eksperimenteve të evolucionit të drejtuar janë befasuese sepse ndryshimet e dëshiruara shpesh shkaktohen nga mutacione që nuk duhet të kenë një efekt të tillë. Disavantazhi është se kjo metodë kërkon qarkullim të lartë, gjë që nuk është e mundur për të gjitha proteinat. Sasi të mëdha të ADN-së rekombinante duhet të mutohen dhe produktet duhet të kontrollohen për cilësinë e dëshiruar. Numri i madh i opsioneve shpesh kërkon blerjen e robotikës për të automatizuar procesin. Përveç kësaj, nuk është gjithmonë e lehtë të kontrollosh për të gjitha cilësitë e interesit.
II. Shembuj të proteinave të krijuara
Inxhinieria e proteinave mund të bazohet në modifikimin kimik të një proteine të përfunduar ose në metodat e inxhinierisë gjenetike që bëjnë të mundur marrjen e versioneve të modifikuara të proteinave natyrore.
Dizajni i një katalizatori specifik biologjik kryhet duke marrë parasysh si specifikën e proteinës ashtu edhe aktivitetin katalitik të kompleksit organometalik. Këtu janë shembuj të modifikimeve të tilla të kryera për të marrë "komplekse bioorganike gjysmë sintetike". Mioglobina e balenës së spermës është e aftë të lidhë oksigjenin, por nuk ka aktivitet biokatalitik. Si rezultat i kombinimit të kësaj biomolekule me tre komplekse të transferimit të elektroneve që përmbajnë rutenium, të cilat lidhen me mbetjet e histidinës në sipërfaqen e molekulave të proteinave, formohet një kompleks që është i aftë të reduktojë oksigjenin duke oksiduar njëkohësisht një sërë substratesh organike, si p.sh. si askorbat, në një shkallë pothuajse të njëjtë si për askorbat oksidazën natyrale. Në parim, proteinat mund të modifikohen në mënyra të tjera. Konsideroni papain, për shembull. Është një nga enzimat proteolitike të studiuara mirë për të cilën është përcaktuar një strukturë tredimensionale. Pranë mbetjes së cisteinës-25 në sipërfaqen e molekulës së proteinës ekziston një brazdë e zgjeruar në të cilën ndodh reaksioni i proteolizës. Ky vend mund të alkilohet nga një derivat i flavinit pa ndryshuar aksesueshmërinë e vendit potencial të lidhjes së substratit. Flavopapaina të tilla të modifikuara u përdorën për oksidimin e M-alkil-1,4-dihidronikotinamideve dhe aktiviteti katalitik i disa prej këtyre proteinave të modifikuara ishte dukshëm më i lartë se ai i dehidrogjenazave natyrale flavoprotein-NADH. Kështu, u bë e mundur të krijohej një enzimë gjysmë sintetike shumë efektive. Përdorimi i flavinave me zëvendësues shumë aktivë dhe të pozicionuar që tërheqin elektron mund të bëjë të mundur zhvillimin e katalizatorëve efektivë për reduktimin e amidit të nikotinës.
Përparimet e mëdha të arritura kohët e fundit në sintezën kimike të ADN-së kanë hapur mundësi thelbësisht të reja për inxhinierinë e proteinave: dizajnimin e proteinave unike që nuk gjenden në natyrë. Kjo kërkon zhvillim të mëtejshëm të teknologjisë, në mënyrë që ndryshimi i gjeneve duke përdorur metoda të inxhinierisë gjenetike të çojë në ndryshime të parashikueshme në proteina, në një përmirësim të karakteristikave të tyre funksionale të përcaktuara mirë: numri i qarkullimit, Km për një substrat specifik, stabiliteti termik, temperatura optimale, stabiliteti dhe Aktiviteti në tretës jo ujor, specifika e substratit dhe reaksionit, kërkesa për kofaktorë, pH optimale, rezistenca e proteazës, rregullimi alosterik, pesha molekulare dhe struktura e nënnjësive. Në mënyrë tipike, një përmirësim i tillë është arritur përmes mutagjenezës dhe përzgjedhjes, dhe së fundmi përmes modifikimit dhe imobilizimit kimik. Për të hartuar me sukses një lloj specifik të molekulës së proteinës, është e nevojshme të identifikohen një sërë modelesh themelore që lidhin veçoritë strukturore të proteinave dhe vetitë e tyre të dëshiruara. Kështu, duke ditur strukturën e saktë kristalore të molekulës së proteinës në studim, është e mundur të identifikohen ato pjesë të saj që duhet të modifikohen në mënyrë specifike për të rritur aktivitetin e saj katalitik. Një modifikim i tillë mund të konsistojë në ndryshimin e sekuencës së aminoacideve të proteinës.
Një shembull tjetër është zbatimi i mutagjenezës specifike të vendit. Kjo ndodh si më poshtë. Gjeni për proteinën që i intereson studiuesit klonohet dhe futet në një bartës të përshtatshëm gjenetik. Pastaj sintetizohet një abetare oligonukleotide me mutacionin e dëshiruar, sekuenca e së cilës, e përbërë nga dhjetë deri në pesëmbëdhjetë nukleotide, është mjaft homologe me një rajon të caktuar të gjenit natyror dhe për këtë arsye është në gjendje të formojë një strukturë hibride me të. Ky primer sintetik përdoret nga polimerazat për të nisur sintezën e një kopjeje plotësuese të vektorit, e cila më pas ndahet nga origjinali dhe përdoret për sintezën e kontrolluar të proteinës mutant. Një qasje alternative bazohet në ndarjen e zinxhirit, heqjen e vendit që do të ndryshohet dhe zëvendësimin e tij me një analog sintetik me sekuencën e dëshiruar të nukleotideve.
Tyrosyl-tRNA sintetaza katalizon reaksionin e aminoacilimit të tirozinës tRNA, i cili përfshin aktivizimin e tirozinës nga ATP për të formuar tirozil adenilat. Gjeni për këtë enzimë, i izoluar nga Bacillus stearothermophilus, u fut në bakteriofagun M13. Vetitë katalitike të enzimës, veçanërisht aftësia e saj për të lidhur substratin, u ndryshuan më pas nga modifikimi specifik i vendit. Kështu, treonina-51 u zëvendësua nga alanina. Kjo rezultoi në një rritje të dyfishtë të lidhjes së substratit, me sa duket për shkak të pamundësisë për të formuar një lidhje hidrogjeni midis kësaj mbetjeje dhe adenilatit tirozil. Kur zëvendësohet alanina me prolinën, konfigurimi i molekulës së enzimës prishet, por aftësia për të lidhur substratin rritet njëqindfish, pasi ndërveprimi i tij me histidinën-48 lehtësohet. Ndryshime të ngjashme specifike të zonës janë marrë në β-laktamazën dhe zakonisht shoqërohen me inaktivizimin e enzimës. Zëvendësimi i serinës-70 me cisteinë çon në formimin e p-tiollaktamazës, konstanta lidhëse e së cilës nuk ndryshon nga ajo e enzimës natyrore, por aktiviteti ndaj penicilinës është vetëm 1-2%. Megjithatë, aktiviteti i kësaj enzime mutant kundër disa cefalosporinave të aktivizuara nuk është më i vogël se aktiviteti fillestar ose madje e tejkalon atë; këto proteina janë gjithashtu më rezistente ndaj proteazave.
Mutacionet specifike të vendit përdoren tani për të testuar përshtatshmërinë e studimeve strukturore. Në disa raste, ata ishin në gjendje të tregonin se stabiliteti strukturor i një proteine dhe aktiviteti i saj katalitik mund të shkëputen. Një sasi e mjaftueshme informacioni është grumbulluar mbi marrëdhënien midis stabilitetit të strukturës së proteinave dhe funksionit të saj; ne mund të jemi në gjendje të rregullojmë aktivitetin e katalizatorëve biologjikë dhe të krijojmë analoge plotësisht sintetike të tyre. Kohët e fundit, u shfaq një punë që raportoi klonimin e gjenit të parë të enzimës sintetike që kodon fragmentin aktiv të molekulës së ribonukleazës.
III. Aplikimet e Inxhinierisë së Proteinave
Teknologjia e inxhinierisë së proteinave përdoret (shpesh në kombinim me metodën e ADN-së rekombinante) për të përmirësuar vetitë e proteinave ekzistuese (enzimat, antitrupat, receptorët qelizor) dhe për të krijuar proteina të reja që nuk ekzistojnë në natyrë. Proteinat e tilla përdoren për të krijuar ilaçe, në përpunimin e ushqimit dhe në prodhimin industrial.
Aktualisht, aplikimi më i popullarizuar i inxhinierisë së proteinave është modifikimi i vetive katalitike të enzimave për të zhvilluar procese industriale "miqësore ndaj mjedisit". Nga pikëpamja mjedisore, enzimat janë më të pranueshmet nga të gjithë katalizatorët e përdorur në industri. Kjo sigurohet nga aftësia e biokatalizatorëve për t'u tretur në ujë dhe për të funksionuar plotësisht në një mjedis me pH neutral dhe në temperatura relativisht të ulëta. Përveç kësaj, për shkak të specifikës së tyre të lartë, përdorimi i biokatalizatorëve rezulton në shumë pak nënprodukte të padëshiruara të prodhimit. Proceset industriale miqësore me mjedisin dhe kursimin e energjisë duke përdorur biokatalizatorë janë futur prej kohësh në mënyrë aktive në industrinë kimike, tekstile, farmaceutike, pulpë dhe letre, ushqim, energji dhe fusha të tjera të industrisë moderne.
Megjithatë, disa karakteristika të biokatalizatorëve e bëjnë përdorimin e tyre të papranueshëm në disa raste. Për shembull, shumica e enzimave shpërbëhen kur temperatura rritet. Shkencëtarët po përpiqen të kapërcejnë pengesa të tilla dhe të rrisin stabilitetin e enzimave në kushte të vështira prodhimi duke përdorur teknikat e inxhinierisë së proteinave.
Përveç aplikimeve industriale, inxhinieria e proteinave ka gjetur një vend të denjë në zhvillimet mjekësore. Studiuesit sintetizojnë proteina që mund të lidhen dhe neutralizojnë viruset dhe gjenet mutante që shkaktojnë tumore; krijimi i vaksinave shumë efektive dhe studimi i proteinave të receptorit të sipërfaqes qelizore, të cilat shpesh janë objektiva për farmaceutikë. Shkencëtarët e ushqimit përdorin inxhinierinë e proteinave për të përmirësuar vetitë e ruajtjes së proteinave me bazë bimore dhe agjentëve xhelatorë ose agjentëve trashësues.
3.1 Bibliotekat e peptideve dhe epitopeve
Në një organizëm të gjallë, shumica e proceseve biologjike kontrollohen përmes ndërveprimeve specifike proteinë-proteinë ose proteinë-acid nukleik. Procese të tilla përfshijnë, për shembull, rregullimin e transkriptimit të gjeneve nën ndikimin e faktorëve të ndryshëm proteinikë, ndërveprimin e ligandëve të proteinave me receptorët në sipërfaqen e qelizave, si dhe lidhjen specifike të antigjeneve nga antitrupat përkatës. Kuptimi i mekanizmave molekularë të ndërveprimit të ligandëve të proteinave me receptorët ka një rëndësi të madhe themelore dhe të aplikueshme. Në veçanti, zhvillimi i barnave të reja proteinike zakonisht fillon me identifikimin e sekuencës fillestare të aminoacideve që ka aktivitetin e kërkuar biologjik (e ashtuquajtura sekuencë "plumb"). Sidoqoftë, peptidet me një sekuencë aminoacide bazë mund të kenë gjithashtu veti biologjike të padëshirueshme: aktivitet të ulët, toksicitet, stabilitet të ulët në trup, etj.
Para ardhjes së bibliotekave peptide, përmirësimi i vetive të tyre biologjike u krye me sintezë sekuenciale të një numri të madh analogësh dhe testimi i aktivitetit të tyre biologjik, i cili kërkonte shumë kohë dhe para. Vitet e fundit, është bërë e mundur të krijohen mijëra peptide të ndryshme në një kohë të shkurtër duke përdorur sintetizues automatikë. Metodat e zhvilluara të mutagjenezës së synuar kanë bërë gjithashtu të mundur zgjerimin në mënyrë dramatike të numrit të proteinave të marra njëkohësisht dhe të testuara në mënyrë sekuenciale për aktivitetin biologjik. Megjithatë, vetëm qasjet e zhvilluara kohët e fundit për krijimin e bibliotekave të peptideve kanë çuar në prodhimin e miliona sekuencave të aminoacideve të nevojshme për shqyrtim efektiv për të identifikuar midis tyre peptidet që plotësojnë më mirë kriteret. Biblioteka të tilla përdoren për të studiuar ndërveprimin e antitrupave me antigjenet, për të marrë frenues të rinj enzimë dhe agjentë antimikrobikë, për të dizajnuar molekula me aktivitetin e dëshiruar biologjik ose për t'u dhënë proteinave veti të reja, siç janë antitrupat.
Në bazë të metodave të përgatitjes, bibliotekat e peptideve ndahen në tre grupe. Grupi i parë përfshin bibliotekat e marra duke përdorur sintezën kimike të peptideve, në të cilat peptide individuale janë të imobilizuara në mikrobartës. Me këtë qasje, pas shtimit të aminoacideve të njëpasnjëshme në përzierjet individuale të reaksionit te peptidet e imobilizuara në mikrobartës, përmbajtja e të gjitha përzierjeve të reaksionit kombinohet dhe ndahet në pjesë të reja, të cilat përdoren në fazën tjetër të shtimit të mbetjeve të reja të aminoacideve. Pas një sërë hapash të tillë, peptidet sintetizohen që përmbajnë sekuencat e aminoacideve të përdorura në sintezë në të gjitha llojet e kombinimeve të rastësishme.
Bibliotekat e peptideve të imobilizuara në mikrobartës kanë një pengesë domethënëse: ato kërkojnë përdorimin e receptorëve të pastruar në formë të tretshme gjatë ekzaminimit. Në të njëjtën kohë, në shumicën e rasteve, receptorët e lidhur me membranën përdoren më shpesh në testet biologjike të kryera për kërkime bazë dhe farmakologjike. Sipas metodës së dytë, bibliotekat e peptideve përftohen duke përdorur sintezën e peptideve në fazë të ngurtë, në të cilën në secilën fazë të shtimit kimik të aminoacidit të ardhshëm në zinxhirët peptidikë në rritje, përdoren përzierje ekuimolare të të gjithë ose disa aminoacideve pararendëse. Në fazën përfundimtare të sintezës, peptidet ndahen nga transportuesi, d.m.th. duke i kthyer në formë të tretshme. Qasja e tretë për ndërtimin e bibliotekave peptide, të cilën po e përshkruajmë tani, u bë e realizueshme pikërisht falë zhvillimit të metodave të inxhinierisë gjenetike. Ai ilustron në mënyrë të përsosur aftësitë e metodave të tilla dhe është padyshim një përparim i madh në zbatimin e tyre. Në këtë drejtim, ne do të shqyrtojmë më në detaje rezultatet e përdorimit të bibliotekave peptide në studimin e epitopeve (përcaktuesve antigjenikë) të proteinave.
Teknologjia e inxhinierisë gjenetike për prodhimin e proteinave hibride ka bërë të mundur zhvillimin e një metode efektive për prodhimin e peptideve të shkurtra për të analizuar aktivitetin e tyre biologjik. Ashtu si në rastin e bibliotekave të gjeneve, bibliotekat e peptideve të marra me metoda të inxhinierisë gjenetike përfaqësojnë një grup të madh (shpesh shterues) të peptideve të shkurtra. Dy vëzhgime të fundit bëjnë të mundur që të konsiderohet një bibliotekë e peptideve njëkohësisht dhe si një bibliotekë epitopësh proteinash. Së pari, peptidet e shkurtra mund të përfshijnë të gjitha mbetjet esenciale të aminoacideve që luajnë një rol të madh në ndërveprimin e antitrupave dhe ato janë në gjendje të imitojnë përcaktues të mëdhenj antigjenikë të proteinave. Së dyti, në shumicën e rasteve, lidhjet jokovalente të formuara midis disa mbetjeve më të rëndësishme të aminoacideve të ligandëve të proteinave dhe receptorëve të tyre japin një kontribut të madh në energjinë totale të ndërveprimit ligand-receptor. Duke pasur parasysh këtë, çdo peptid mund të konsiderohet një ligand i mundshëm, hapten ose pjesë e përcaktuesit antigjenik të polipeptideve më të mëdha, dhe çdo bibliotekë peptide mund të konsiderohet një bibliotekë epitopësh proteinash ose ligandësh të mundshëm për receptorët përkatës të proteinave.
Biblioteka e peptideve e përftuar si rezultat i zbatimit të qasjes së tretë, në formën e saj moderne, është një grup prej dhjetëra apo edhe qindra miliona sekuencash të shkurtra të ndryshme të aminoacideve që shprehen në sipërfaqen e virioneve bakteriofag si pjesë e tyre. proteinat strukturore. Kjo bëhet e mundur falë futjes së gjeneve hibride rekombinante që kodojnë proteinat strukturore të ndryshuara të virioneve të tij në gjenomën e bakterofagëve duke përdorur metoda të inxhinierisë gjenetike. (Kjo metodë njihet si shfaqja e fagut.) Si rezultat i shprehjes së gjeneve të tilla, formohen proteina hibride, në skajet N ose C të të cilave janë të pranishme sekuenca shtesë aminoacide.
Bibliotekat e peptideve dhe epitopeve do të gjejnë përdorimin e tyre gjithashtu në studimet e mekanizmave të përgjigjes imune humorale, si dhe sëmundjet e sistemit imunitar. Në veçanti, shumica e sëmundjeve autoimune shoqërohen nga formimi i autoantitrupave kundër antigjeneve të trupit. Këto antitrupa në shumë raste shërbejnë si shënues specifikë të një sëmundjeje të veçantë autoimune. Duke përdorur një bibliotekë epitopësh, në parim, është e mundur të merren shënues peptidësh, me ndihmën e të cilëve do të ishte e mundur të monitorohej specifika e autoantitrupave gjatë zhvillimit të një procesi patologjik si në një organizëm individual ashtu edhe në një grup pacientësh. dhe, përveç kësaj, për të përcaktuar specifikën e autoantitrupave në sëmundjet me etiologji të panjohur.
Bibliotekat e peptideve dhe epitopeve mund të përdoren gjithashtu për shqyrtimin e serumeve imune për të identifikuar peptidet që ndërveprojnë në mënyrë specifike me antitrupat mbrojtës. Peptide të tilla do të imitojnë përcaktuesit antigjenikë të organizmave patogjenë dhe do të shërbejnë si objektiva për antitrupat mbrojtës të trupit. Kjo do të lejojë përdorimin e peptideve të tilla për vaksinimin e pacientëve të cilëve u mungojnë antitrupat kundër patogjenëve përkatës. Studimi i epitopeve duke përdorur bibliotekat peptide është një rast i veçantë i një prej fushave të shumta të përdorimit të tyre në studimet e aplikuara dhe themelore të ndërveprimit të ligandëve dhe receptorëve. Përmirësimi i mëtejshëm i kësaj qasjeje duhet të lehtësojë krijimin e barnave të reja të bazuara në peptide të shkurtra dhe të jetë i dobishëm në studimet themelore të mekanizmave të ndërveprimeve protein-proteinë.
3.2 Proteinat raportuese në proteinat e shkrirjes
Në një rast tjetër, proteinat e shkrirjes përdoren për të marrë nivele të larta të shprehjes së peptideve të shkurtra në qelizat bakteriale për shkak të stabilizimit të këtyre peptideve brenda proteinave të shkrirjes. Proteinat hibride përdoren shpesh për të identifikuar dhe pastruar proteinat rekombinante të vështira për t'u zbuluar. Për shembull, duke bashkuar galaktozidazën në fundin C të proteinës në studim si një proteinë raportuese, është e mundur të pastrohet proteina rekombinante bazuar në aktivitetin e galaktozidazës, duke përcaktuar përcaktuesit e saj antigjenikë me metoda imunokimike. Duke kombinuar fragmente të ADN-së që përmbajnë korniza të hapura leximi (ORF) me gjenet e proteinave raportuese, është e mundur të pastrohen proteina të tilla hibride bazuar në aktivitetin e proteinës raportuese dhe t'i përdorin ato për imunizimin e kafshëve laboratorike. Antitrupat që rezultojnë përdoren më pas për të pastruar proteinën vendase, e cila përfshin polipeptidin rekombinant të koduar nga ORF, dhe në këtë mënyrë identifikon fragmentin e gjenit të klonuar.
Me ndihmën e proteinave hibride, zgjidhet edhe problemi i kundërt i klonimit të një gjeni të panjohur, ndaj produktit proteinik të të cilit ka antitrupa. Në këtë rast, një bibliotekë kloni e sekuencave nukleotide që përfaqësojnë ORF të gjeneve të panjohura është ndërtuar në vektorë që lejojnë që ORF të klonohet të lidhet në të njëjtën kornizë leximi me gjenin raportues. Proteinat hibride të formuara si rezultat i shprehjes së këtyre gjeneve rekombinante identifikohen duke përdorur antitrupa duke përdorur metoda të imuno-analizimit enzimë. Gjenet hibride që kombinojnë proteinat e sekretuara dhe proteinat raportuese bëjnë të mundur studimin në mënyra të reja të mekanizmave të sekretimit, si dhe lokalizimin dhe lëvizjen e proteinave të sekretuara në inde.
3.3 Disa arritje të inxhinierisë së proteinave
1. Me zëvendësimin e disa mbetjeve aminoacide të lizozimës së bakteriofagut T4 me cisteinë, u përftua një enzimë me një numër të madh lidhjesh disulfide, për shkak të së cilës kjo enzimë e ruajti aktivitetin e saj në një temperaturë më të lartë.
2. Zëvendësimi i një mbetjeje cisteine me një mbetje serine në molekulën e β-interferonit njerëzor, të sintetizuar nga Escherichia coli, parandaloi formimin e komplekseve ndërmolekulare, të cilat reduktuan aktivitetin antiviral të këtij ilaçi përafërsisht 10 herë.
3. Zëvendësimi i mbetjes së treoninës me një mbetje proline në molekulën e enzimës tyrosyl-tRNA sintetazë e rriti aktivitetin katalitik të kësaj enzime dhjetëfish: ajo filloi të lidhte shpejt tirozinën në tARN që e transferon këtë aminoacid në ribozom gjatë përkthimit.
4. Subtilisinat janë enzima të pasura me serinë që shpërbëjnë proteinat. Ato sekretohen nga shumë baktere dhe përdoren gjerësisht nga njerëzit për biodegradim. Ata lidhin fort atomet e kalciumit, duke rritur qëndrueshmërinë e tyre. Megjithatë, në proceset industriale ekzistojnë komponime kimike që lidhin kalciumin, pas së cilës subtilisinat humbasin aktivitetin e tyre. Duke ndryshuar gjenin, shkencëtarët hoqën aminoacidet nga enzima që janë të përfshira në lidhjen e kalciumit dhe zëvendësuan një aminoacid me një tjetër për të rritur stabilitetin e subtilisinës. Enzima e modifikuar doli të jetë e qëndrueshme dhe funksionalisht aktive në kushte afër atyre industriale.
5. U tregua mundësia e krijimit të një enzime që funksionon si një enzimë kufizuese që copëton ADN-në në vende të përcaktuara rreptësisht. Shkencëtarët krijuan një proteinë hibride, një fragment i së cilës njohu një sekuencë specifike të mbetjeve nukleotide në një molekulë të ADN-së dhe tjetri ADN-në e fragmentuar në këtë rajon.
6. Aktivizuesi i plazminogenit të indeve është një enzimë që përdoret klinikisht për të shpërndarë mpiksjen e gjakut. Fatkeqësisht, eliminohet shpejt nga sistemi i qarkullimit të gjakut dhe duhet të administrohet në mënyrë të përsëritur ose në doza të mëdha, gjë që çon në efekte anësore. Duke futur tre mutacione të synuara në gjenin e kësaj enzime, ne përftuam një enzimë jetëgjatë me afinitet të shtuar për fibrinën e degraduar dhe me të njëjtin aktivitet fibrinolitik si enzima origjinale.
7. Duke zëvendësuar një aminoacid në molekulën e insulinës, shkencëtarët siguruan që kur ky hormon administrohej në mënyrë subkutane te pacientët me diabet, ndryshimi i përqendrimit të këtij hormoni në gjak ishte afër atij fiziologjik që ndodh pas ngrënies.
8. Janë tre klasa interferonesh që kanë aktivitet antiviral dhe antikancerogjen, por shfaqin specifika të ndryshme. Ishte joshëse të krijohej një interferon hibrid që do të kishte vetitë e tre llojeve të interferoneve. U krijuan gjenet hibride që përfshinin fragmente të gjeneve natyrale të interferonit të disa llojeve. Disa nga këto gjene, duke u integruar në qelizat bakteriale, siguruan sintezën e interferoneve hibride me aktivitet më të madh antikancerogjen sesa molekulat mëmë.
9. Hormoni natyror i rritjes njerëzore lidhet jo vetëm me receptorin e këtij hormoni, por edhe me receptorin e një hormoni tjetër - prolaktinës. Për të shmangur efektet anësore të padëshiruara gjatë trajtimit, shkencëtarët vendosën të eliminojnë mundësinë e ngjitjes së hormonit të rritjes në receptorin e prolaktinës. Ata e arritën këtë duke zëvendësuar disa aminoacide në strukturën parësore të hormonit të rritjes duke përdorur inxhinierinë gjenetike.
10. Gjatë zhvillimit të ilaçeve kundër infeksionit HIV, shkencëtarët morën një proteinë hibride, një fragment i së cilës siguronte lidhjen specifike të kësaj proteine vetëm me limfocitet e prekura nga virusi, një fragment tjetër kryente depërtimin e proteinës hibride në qelizën e prekur, dhe një fragment tjetër ndërpreu sintezën e proteinave në qelizën e prekur, gjë që çoi në vdekjen e saj.
Proteinat janë objektivat kryesore të barnave. Aktualisht dihen rreth 500 objektiva për veprimin e drogës. Në vitet në vijim, numri i tyre do të shkojë në 10 mijë, çka do të bëjë të mundur krijimin e barnave të reja, më efektive dhe të sigurta. Kohët e fundit, janë zhvilluar qasje thelbësisht të reja për zbulimin e drogës: jo proteinat e vetme, por komplekset e tyre, ndërveprimet protein-proteinë dhe palosja e proteinave konsiderohen si objektiva.
konkluzioni
Teknologjia e inxhinierisë së proteinave përdoret (shpesh në kombinim me metodën e ADN-së rekombinante) për të përmirësuar vetitë e proteinave ekzistuese (enzimat, antitrupat, receptorët qelizor) dhe për të krijuar proteina të reja që nuk ekzistojnë në natyrë. Proteinat e tilla përdoren për të krijuar ilaçe, në përpunimin e ushqimit dhe në prodhimin industrial.
Aktualisht, aplikimi më i popullarizuar i inxhinierisë së proteinave është modifikimi i vetive katalitike të enzimave për të zhvilluar procese industriale "miqësore ndaj mjedisit". Nga pikëpamja mjedisore, enzimat janë më të pranueshmet nga të gjithë katalizatorët e përdorur në industri. Kjo sigurohet nga aftësia e biokatalizatorëve për t'u tretur në ujë dhe për të funksionuar plotësisht në një mjedis me pH neutral dhe në temperatura relativisht të ulëta. Përveç kësaj, për shkak të specifikës së tyre të lartë, përdorimi i biokatalizatorëve rezulton në shumë pak nënprodukte të padëshiruara të prodhimit. Proceset industriale miqësore me mjedisin dhe kursimin e energjisë duke përdorur biokatalizatorë janë futur prej kohësh në mënyrë aktive në industrinë kimike, tekstile, farmaceutike, pulpë dhe letre, ushqim, energji dhe fusha të tjera të industrisë moderne.
Megjithatë, disa karakteristika të biokatalizatorëve e bëjnë përdorimin e tyre të papranueshëm në disa raste. Për shembull, shumica e enzimave shpërbëhen kur temperatura rritet. Shkencëtarët po përpiqen të kapërcejnë pengesa të tilla dhe të rrisin stabilitetin e enzimave në kushte të vështira prodhimi duke përdorur teknikat e inxhinierisë së proteinave.
Përveç aplikimeve industriale, inxhinieria e proteinave ka gjetur një vend të denjë në zhvillimet mjekësore. Studiuesit sintetizojnë proteina që mund të lidhen dhe neutralizojnë viruset dhe gjenet mutante që shkaktojnë tumore; krijimi i vaksinave shumë efektive dhe studimi i proteinave të receptorit të sipërfaqes qelizore, të cilat shpesh janë objektiva për farmaceutikë. Shkencëtarët e ushqimit përdorin inxhinierinë e proteinave për të përmirësuar vetitë e ruajtjes së proteinave me bazë bimore dhe agjentëve xhelatorë ose agjentëve trashësues.
Një fushë tjetër e aplikimit të inxhinierisë së proteinave është krijimi i proteinave që mund të neutralizojnë substancat dhe mikroorganizmat që mund të përdoren për sulme kimike dhe biologjike. Për shembull, enzimat hidrolazë janë të afta të neutralizojnë si gazet nervore ashtu edhe pesticidet e përdorura në bujqësi. Për më tepër, prodhimi, ruajtja dhe përdorimi i enzimave nuk është i rrezikshëm për mjedisin dhe shëndetin e njeriut.
modifikuar mutagjeneza e inxhinierisë së proteinave
Bibliografi
1. Inxhinieria e proteinave.
2. Inxhinieria e proteinave. Misteret e gjenetikës. /Vyacheslav Markin // Sekrete, gjëegjëza, fakte.
3. Inxhinieria e proteinave. // Enciklopedia e Madhe Ruse.
4. Inxhinieria e proteinave. // Manuali i kimistit 21.
5. Inxhinieria e proteinave dhe efektiviteti i barnave.
6. Inxhinieria e proteinave. / A.I. Kornelyuk // Biopolimere dhe qeliza.
7. Inxhinieria e proteinave do të përmirësojë efektivitetin e barnave. // Mekanika popullore.
8. Inxhinieria e proteinave. Marrja e insulinës. // Biofile - revistë shkencore dhe informative.
9. Bioteknologji. Drejtimet dhe arritjet kryesore. // Biologji për aplikantët dhe mësuesit.
10. Bogdanov A.A., Mednikov B.M. Fuqia mbi gjenin / A. A. Bogdanov, B. M. Mednikov - M.: Arsimi, 1989 - f.208
11. Inxhinieri gjenetike. // Shëndeti.
12. Gjenet dhe kimistët. // Gjenetika.
13. Glick B., Pasternak J. Bioteknologjia molekulare. Parimet dhe zbatimi / B. Glick, J. Pasternak. - M.: Mir, 2002.
14. Fusha të tjera të aplikimit të inxhinierisë gjenetike. / L.V. Timoschenko, M.V. Chubik // Mjekësia - lajme dhe teknologji.
15. Egorova T.A., Klunova S.M., Zhivukhin E.A. Bazat e bioteknologjisë. / T.A. Egorova, S.M. Klunova, E.A. Zhivukhin - M., 2003.
16. Inxhinieria e proteinave. // Kimia dhe bioteknologjia.
17. Patrushev L.I. Shprehja e gjeneve / L.I. Patrushev - M.: Nauka, 2000. - 496 f.
18. Patrushev L.I. Sistemet gjenetike artificiale. T. 1: Inxhinieri gjenetike dhe proteinike. /L.I. Patrushev - M.: Nauka, 2004. - 526 f.
19. Rybchin V.N. Bazat e inxhinierisë gjenetike: Tekst mësimor për universitete/V.N. Rybchin - Shën Petersburg: Shtëpia botuese e Universitetit Shtetëror Teknik të Shën Petersburgut, 2002. - 522 f.
20. Stepanov V.M. Biologji Molekulare. Strukturat dhe funksionet e proteinave. / V.M. Stepanov - M.: Shkolla e Lartë, 1996.
21. Teknologjitë e bioteknologjisë: inxhinieria e proteinave, nanobioteknologjia, biosensorët dhe bioçipet. / Evgenia Ryabtseva // "Bioteknologjia Tregtare" - revistë në internet.
22. Chernavsky D.S., Chernavskaya N.M. Proteina është një makinë. Strukturat makromolekulare biologjike. / D.S. Chernavsky, N. M. Chernavskaya - M.: Shtëpia Botuese e Universitetit Shtetëror të Moskës, 1999.
23. Schultz G.E., Schirmer R.H. Parimet e organizimit strukturor të proteinave. / G.E. Schultz, R.H. Schirmer - M.: Mir, 1982.
24. Brannigan J.A., Wilkinson A.J. Inxhinieria e proteinave 20 vjet më vonë // Nature Reviews. Biologjia e qelizave molekulare. 2002. Vëll. 3. Nr.12;
25. Inxhinieria e proteinave. // Wikipedia, enciklopedia e lirë.
Postuar në Allbest.ru
Dokumente të ngjashme
Thelbi dhe detyrat e inxhinierisë gjenetike, historia e zhvillimit të saj. Qëllimet e krijimit të organizmave të modifikuar gjenetikisht. Ndotja kimike si pasojë e OMGJ-ve. Marrja e insulinës humane si arritja më e rëndësishme në fushën e organizmave të modifikuar gjenetikisht.
abstrakt, shtuar 18.04.2013
Shfaqja e bioteknologjisë. Drejtimet kryesore të bioteknologjisë. Bioenergjia si degë e bioteknologjisë. Arritjet praktike të bioteknologjisë. Historia e inxhinierisë gjenetike. Qëllimet, metodat dhe enzimat e inxhinierisë gjenetike. Arritjet e inxhinierisë gjenetike.
abstrakt, shtuar 23.07.2008
Mundësitë e inxhinierisë gjenetike të bimëve. Krijimi i bimëve rezistente ndaj herbicideve. Rritja e efikasitetit të fotosintezës dhe fiksimit biologjik të azotit. Përmirësimi i cilësisë së proteinave të ruajtjes. Rreziqet mjedisore, mjekësore dhe socio-ekonomike të inxhinierisë gjenetike.
test, shtuar më 15.12.2011
Thelbi i inxhinierisë gjenetike, metodat për identifikimin e organizmave transgjenikë; prodhimi dhe teknologjia e OMGJ-ve, dallimi nga mbarështimi tradicional, avantazhet dhe disavantazhet. Gjendja dhe perspektivat për zhvillimin e tregut të mallrave të modifikuara gjenetikisht në botë.
puna e kursit, shtuar 20.11.2010
Inxhinieria gjenetike është një metodë e bioteknologjisë që merret me kërkime në ristrukturimin e gjenotipeve. Mundësitë e inxhinierisë gjenetike. Perspektivat për inxhinierinë gjenetike. Ulja e rrezikut të lidhur me teknologjitë gjenetike.
abstrakt, shtuar 09/04/2007
Inxhinieria gjenetike: historia e origjinës, karakteristikat e përgjithshme, avantazhet dhe disavantazhet. Njohja me metodat më të fundit të inxhinierisë gjenetike dhe përdorimi i tyre në mjekësi. Zhvillimi i inxhinierisë gjenetike në fushën e blegtorisë dhe blegtorisë. Eksperimentet në minjtë.
puna e kursit, shtuar 07/11/2012
Sekuenca e teknikave të inxhinierisë gjenetike të përdorura për të krijuar organizma të modifikuar gjenetikisht. Klasifikimi i llojeve kryesore të enzimave kufizuese të përdorura për fragmentimin e ADN-së. Enzimat që sintetizojnë ADN-në në një shabllon të ADN-së ose ARN-së.
prezantim, shtuar 27.04.2014
Thelbi i inxhinierisë gjenetike dhe qelizore. Detyrat kryesore të modifikimit gjenetik të bimëve, analiza e dëmshmërisë së konsumit të tyre si ushqim. Karakteristikat e hibridizimit të qelizave bimore dhe shtazore. Mekanizmi i marrjes së substancave medicinale duke përdorur inxhinierinë gjenetike.
prezantim, shtuar 26.01.2014
puna e kursit, shtuar 05/10/2011
Bazat dhe teknikat e klonimit të ADN-së. Fazat e inxhinierisë gjenetike të baktereve. Zhvillimi i inxhinierisë gjenetike të bimëve. Transformimi gjenetik dhe përmirësimi i bimëve duke përdorur agrobakteret, burimet e gjeneve. Siguria e bimëve të modifikuara gjenetikisht.
Kimikisht, një proteinë është një lloj molekule e vetme, e cila është një zinxhir ose polimer poliaminoacid. Ai përbëhet nga sekuenca aminoacide të 20 llojeve. Pasi mësuan strukturën e proteinave, njerëzit shtruan pyetjen: a është e mundur të hartohen sekuenca krejtësisht të reja aminoacide në mënyrë që ato të kryejnë funksionet që njerëzit kanë nevojë shumë më mirë se proteinat e zakonshme? Emri më i mirë për këtë ide të guximshme ishte inxhinieri proteinash.
Njerëzit filluan të mendojnë për një inxhinieri të tillë që në vitet 50 të shekullit të 20-të. Kjo ndodhi menjëherë pas deshifrimit të sekuencave të para të aminoacideve të proteinave. Në shumë laboratorë anembanë botës, janë bërë përpjekje për të dyfishuar natyrën dhe për të sintetizuar kimikisht sekuenca të dhëna absolutisht arbitrare të poliaminoacideve.
Kimisti B. Merrifield ia doli më shumë në këtë. Ky amerikan arriti të zhvillojë një metodë jashtëzakonisht efektive për sintezën e zinxhirëve të poliaminoacideve. Për këtë, Merrifield u nderua me Çmimin Nobel në Kimi në 1984.
Amerikani filloi të sintetizonte peptide të shkurtra, duke përfshirë hormonet. Në të njëjtën kohë, ai ndërtoi një automat - një "robot kimik" - detyra e të cilit ishte të prodhonte proteina artificiale. Roboti bëri bujë në qarqet shkencore. Megjithatë, shpejt u bë e qartë se produktet e tij nuk mund të konkurronin me atë që prodhon natyra.
Roboti nuk mundi të riprodhonte me saktësi sekuencat e aminoacideve, domethënë bëri gabime. Ai sintetizoi një zinxhir me një sekuencë dhe një tjetër me një sekuencë paksa të ndryshme. Në një qelizë, të gjitha molekulat e një proteine janë në mënyrë ideale të ngjashme me njëra-tjetrën, domethënë sekuencat e tyre janë absolutisht identike.
Kishte një problem tjetër. Edhe ato molekula që roboti sintetizoi në mënyrë korrekte nuk morën formën hapësinore të nevojshme për funksionimin e enzimës. Kështu, përpjekja për të zëvendësuar natyrën me metodat e zakonshme të kimisë organike çoi në një sukses shumë modest.
Shkencëtarët mund të mësonin vetëm nga natyra, duke kërkuar modifikimet e nevojshme të proteinave. Çështja këtu është se në natyrë ka vazhdimisht mutacione që çojnë në ndryshime në sekuencat e aminoacideve të proteinave.
Nëse zgjidhni mutantët me vetitë e nevojshme, të themi, ata që përpunojnë një substrat të veçantë në mënyrë më efikase, atëherë mund të izoloni nga një mutant i tillë një enzimë të ndryshuar, falë së cilës qeliza fiton veti të reja. Por ky proces kërkon një periudhë shumë të gjatë kohore.
Gjithçka ndryshoi kur u shfaq inxhinieria gjenetike. Falë saj, ata filluan të krijojnë gjene artificiale me çdo sekuencë nukleotide. Këto gjene u futën në molekulat vektoriale të përgatitura dhe ADN-ja u fut në baktere ose maja. Atje, një kopje e ARN-së u mor nga gjeni artificial. Si rezultat, u prodhua proteina e nevojshme. Gabimet në sintezën e tij u përjashtuan. Gjëja kryesore ishte të zgjidhej sekuenca e duhur e ADN-së dhe më pas vetë sistemi enzimë i qelizës e bëri punën e tij në mënyrë të përsosur.
Kështu, mund të konkludojmë se inxhinieria gjenetike i ka hapur rrugën inxhinierisë së proteinave në formën e saj më radikale. Për shembull, ne zgjodhëm një proteinë dhe donim të zëvendësonim një mbetje aminoacide në të me një tjetër.
Para se të filloni punën e zëvendësimit, duhet të përgatisni një vektor të ADN-së. Kjo është ADN virale ose plazmide me gjenin për proteinën që na intereson të integruar në të. Ju gjithashtu duhet të dini sekuencën nukleotide të gjenit dhe sekuencën e aminoacideve të proteinës së koduar. Kjo e fundit përcaktohet nga e para duke përdorur një tabelë kodi gjenetik.
Duke përdorur tabelën, është gjithashtu e lehtë të përcaktohet se çfarë ndryshimesh minimale duhet të bëhen në përbërjen e gjenit, në mënyrë që ai të fillojë të kodojë jo origjinalin, por një proteinë të modifikuar me kërkesën tonë. Le të themi se në mes të një gjeni ju duhet të zëvendësoni guaninën me timinë.
Për shkak të një gjëje kaq të vogël, nuk ka nevojë të risintetizohet i gjithë gjeni. Sintetizohet vetëm një fragment i vogël nukleotidesh, plotësues me rajonin në mes të të cilit ndodhet nukleotidi i guaninës i zgjedhur për zëvendësim.
Fragmenti që rezulton përzihet me një vektor të ADN-së (ADN rrethore), i cili përmban gjenin që na nevojitet. Unaza e ADN-së dhe fragmenti i sintetizuar krijojnë një seksion të spirales së dyfishtë Watson-Crick. Në të, çifti qendror "shtyhet" nga spiralen e dyfishtë, pasi formohet nga nukleotide reciprokisht jo plotësuese.
Shtoni katër dNTP dhe ADN polimerazë në tretësirë. Ky i fundit, duke përdorur një fragment të mbërthyer në një unazë të vetme, e plotëson atë në një unazë të plotë në përputhje të plotë me parimin e komplementaritetit.
Si rezultat, marrim ADN vektoriale pothuajse normale. Mund të futet në një qelizë maja ose bakteriale për riprodhim. E vetmja gjë është se kjo ADN ndryshon nga vektori origjinal në një çift jo plotësues. Me fjalë të tjera, spiralen e vektorit të ADN-së nuk është plotësisht e përsosur.
Në aktin e parë të dyfishimit të vektorit që rezulton së bashku me bakteret që e mbartin atë, secila prej molekulave të ADN-së bijë do të bëhet një spirale e përsosur e dyfishtë përgjatë gjithë gjatësisë së saj. Sidoqoftë, njëra nga molekulat bija mbart çiftin origjinal nukleotid, dhe tjetra ka një vektor mutant në këtë vend, në bazë të të cilit fitohet proteina mutante me interes për ne.
Kështu, inxhinieria e proteinave krijon një përzierje qelizash. Disa prej tyre mbajnë vektorin origjinal me një gjen jomutant, ndërsa qelizat e tjera mbajnë gjenin mutant. Mbetet për të zgjedhur nga kjo përzierje pikërisht ato qeliza në të cilat ndodhet gjeni mutant.
Metodat e inxhinierisë gjenetike, në veçanti klonimi i gjeneve individuale ose pjesëve të tyre, si dhe sekuenca e ADN-së, kanë bërë të mundur përmirësimin e ndjeshëm të metodologjisë së mutagjenezës, duke eliminuar disavantazhet kryesore të metodave klasike për nxitjen e mutacioneve në gjenom. Analiza gjenetike klasike përfshin efektin e një faktori mutagjen in vivo në të gjithë gjenomin, si rezultat i të cilit lindin mutacione të rastësishme në të, shpesh të shumëfishta, gjë që e ndërlikon shumë identifikimin e mutantëve. Individët mutant identifikohen nga karakteristikat fenotipike të ndryshuara dhe natyra e mutacionit mund të përcaktohet pas sekuencës së ADN-së. Mutagjeneza moderne e lokalizuar, në fakt, përfshin veprime të kundërta: së pari, gjeni i interesit ose segmenti i tij klonohet, struktura e tij përcaktohet gjatë sekuencës dhe më pas bëhen ndryshimet e nevojshme në përbërjen e tij in vitro. Pasojat e mutacionit të induktuar përcaktohen pas futjes së gjenit mutant në organizmin origjinal.
Versioni më i thjeshtë i mutagjenezës së lokalizuar konsiston në trajtimin e një fragmenti të klonuar të ADN-së me një nga faktorët mutagjenë, por rezultati i një ekspozimi të tillë do të jetë gjithashtu ndryshime të rastësishme në strukturën e fragmentit. Metodat më të besueshme dhe më të përdorura të mutagjenezës së lokalizuar kryhen pa përdorimin e faktorëve mutagjenë. Ndër llojet e mutacioneve mbizotërojnë delecionet, insertimet dhe zëvendësimet e nukleotideve.
Fshirjet. Këto lloj mutacionesh në mutagjenezën e lokalizuar fitohen duke përdorur endonukleazat. Përdoren si endonukleazat kufizuese ashtu edhe ato jospecifike. Rasti më i thjeshtë i përdorimit të enzimave kufizuese është të copëtohet një gjenom duke përdorur një enzimë kufizuese që prezanton disa ndërprerje për të formuar skajet ngjitëse. Fragmentet që rezultojnë mbyllen përsëri në një unazë duke përdorur ligazën e ADN-së, e cila mund të çojë në formimin e molekulave që nuk përmbajnë një nga segmentet e ADN-së. Kjo qasje prodhon fshirje të gjera dhe zakonisht përdoret në eksperimentet paraprake për të përcaktuar funksionin e seksioneve relativisht të mëdha të ADN-së së klonuar.
Fshirje të vogla merren si më poshtë. Fragmenti i klonuar ndahet brenda vektorit në vendin e duhur duke përdorur një enzimë restriksioni (Fig. 21.1). Molekula lineare që rezulton trajtohet me ekzonukleazë III, e cila hidrolizon një varg të ADN-së,
duke filluar nga fundi 3'. Rezultati është një grup molekulash me bishta 5' me një fije floku me gjatësi të ndryshme. Këto bishta hidrolizohen nga nukleaza S1 specifike për ssDNA dhe formohen delecione në ADN. Ju gjithashtu mund të përdorni ekzonukleazën Bal 31, e cila katalizon degradimin e të dy vargjeve, duke filluar nga skajet e molekulave lineare të ADN-së. Ecuria e reaksioneve nukleotike rregullohet duke ndryshuar kohën e inkubacionit, temperaturën dhe përqendrimin e enzimës, duke nxitur formimin e delecioneve me gjatësi të ndryshme. Variantet e fshirjes që rezultojnë të ADN-së lineare shpesh pajisen me lidhës përpara ciklimit, në mënyrë që vendet e kufizimit të jenë të pranishme në rajonin e fshirjes. Ka modifikime të tjera të metodave të përshkruara.
Futje (futje). Për të marrë insertime, ADN-ja e klonuar tretet me një enzimë kufizuese ose endonukleazë jospecifike, dhe më pas fragmentet që rezultojnë lidhen në prani të segmentit që kërkohet të futet në ADN. Më shpesh, polilinkers të sintetizuar kimikisht përdoren si segmente të tilla (Kapitulli 20).
Futjet, si fshirjet, mund të prishin integritetin e një gjeni ose strukturën e rajoneve të tij rregullatore, duke rezultuar në sintezën e një proteine të dëmtuar (në rastin e fshirjeve të zgjatura ose zhvendosjeve të kornizës, zakonisht joaktive) ose ndryshime në procesin e transkriptimit të gjenit. me interes. Në këtë mënyrë, shpesh përftohen mutantët rregullues dhe ndërtohen vektorët e shprehjes (Kapitulli 20).
Mutacione pikash . Këto mutacione janë zëvendësime të nukleotideve. Për t'i marrë ato, mund të përdoren disa qasje: deaminimi i citozinës, inkorporimi i analogëve të nukleotideve, inkorporimi i gabuar i nukleotideve gjatë riparimit të boshllëqeve, etj.
Metoda e parë bazohet në faktin se mbetjet e citozinës në ADN me një fije floku mund të deaminohen për të formuar uracil nga trajtimi me jone bisulfite. Rajonet me një fije floku në ADN zakonisht fitohen pranë vendeve kufizuese, për shembull, nga veprimi i ekzonukleazës III. Pas trajtimit të bisulfitit, boshllëqet me një fije floku mbushen duke përdorur ADN polimerazën dhe skajet lidhen. Në vendet ku u formua uridilat në vend të citidilatit gjatë deaminimit, adenilati do të zërë pozicionin plotësues dhe gjatë replikimit të një molekule të tillë çifti GC do të zëvendësohet nga një çift AT.
Një qasje tjetër për nxitjen e zëvendësimeve është trajtimi i ADN-së së klonuar me një enzimë kufizuese në prani të bromidit të etidiumit, i cili futet midis rrafsheve të çifteve të bazave dhe prish strukturën e dupleksit. Si rezultat, formohet vetëm një ndarje e vetme e ADN-së. Një hendek i vogël krijohet në vendin e thyerjes së një fije floku dhe më pas riparohet në prani të ADN polimerazës, dATP, dGTP, dCTP dhe N-4-hidroksicitozinës trifosfat në vend të dTTP. Hidroksicitozin trifosfati përfshihet në zinxhir në vend të timidilatit, por gjatë replikimit të ADN-së çiftëzohet njësoj mirë me adenilatin dhe guanilatin. Si rezultat i përfshirjes së guanilate pas një raundi shtesë replikimi, zëvendësimi AT→GC do të ndodhë në këtë vend (Fig. 21.2). Meqenëse në këtë metodë zëvendësimi i nukleotideve kryhet nga brenda
vendi i kufizimit, bëhet e mundur lehtësisht dallimi midis vektorëve me sekuencën origjinale dhe atyre mutant. Për ta bërë këtë, mjafton t'i trajtoni ato me enzimën kufizuese të përdorur në eksperiment: molekulat mutante nuk do t'i nënshtrohen ndarjes.
Një metodë e ngjashme bazohet në përdorimin e vetëm tre nga katër nukleotidet e mundshme kur mbushet një boshllëk me një fije floku me ADN polimerazë. Në shumicën e rasteve, enzima ndalon në pikën e molekulës ku shfaqet nukleotidi plotësues ndaj atij që mungon. Megjithatë, herë pas here ADN polimeraza bën një gabim dhe ndez një nga tre nukleotidet e pranishme. Kjo çon në formimin e molekulave unazore, të cilat përmbajnë baza azotike jo-plotësuese të paçiftuara. Kur vektorë të tillë futen në qelizat bakteriale, disa nga molekulat do t'i nënshtrohen riparimit të një dëmtimi të tillë. Si rezultat, në gjysmën e molekulave pas replikimit, sekuenca origjinale do të rikthehet, dhe në gjysmën tjetër mutacioni do të rregullohet. Molekulat mutante mund të dallohen duke përdorur metodën e përshkruar më sipër.
Mutagjeneza specifike e vendit. Metodat e karakterizuara të mutagjenezës së lokalizuar ndryshojnë në atë që vendet ku ndodhin mutacionet zgjidhen në mënyrë të rastësishme. Në të njëjtën kohë, teknika e mutagjenezës specifike të vendit bën të mundur futjen e mutacioneve në një rajon të përcaktuar saktësisht të gjenit. Kjo bëhet duke përdorur oligonukleotide sintetike (të marra nga sinteza kimike) me një sekuencë të caktuar. Metoda është e përshtatshme në atë që nuk kërkon praninë e vendeve të përshtatshme të kufizimit. Metoda bazohet në formimin e heteroduplekseve midis një oligonukleotidi sintetik që përmban një mutacion dhe ADN-së me një fije floku plotësuese në vektor.
Veproni si më poshtë. Një oligonukleotid i vogël (8-20 monomere) sintetizohet, plotësues i pjesës së gjenit në të cilin ata duan të marrin një mutacion. Një ose më shumë zëvendësime të nukleotideve lejohen në rajonin qendror të oligonukleotidit. Gjeni në studim ose fragmenti i tij klonohet si pjesë e një vektori të bazuar në fagun M13 për të marrë ADN rekombinante rrethore njëvargëshe. Vektorët rekombinantë përzihen dhe kalohen me oligonukleotide. Ndodh hibridizimi i oligonukleotidit me rajonin komplementar, ndërsa nukleotidet jo komplementare mbeten të paçiftuara. Oligonukleotidi vepron si një primer në një reaksion polimerazë që përfshin ADN polimerazën in vitro. Unaza mbyllet nga ligazat. Molekula rrethore që rezulton futet në qelizat E. coli, ku ndodh riparimi i pjesshëm i vendeve të riprodhimit mutant. Frekuenca e mutacioneve zakonisht varion nga 1 në 50%. Përzgjedhja e qelizave që përmbajnë molekula mutante të ADN-së mund të bëhet në disa mënyra, ndër të cilat përparësi është metoda e përdorimit të një oligonukleotidi të etiketuar në mënyrë radioaktive, i cili përdoret për mutagjenezë. Në këtë rast, ky nukleotid shërben si sondë. Parimi i përdorimit të një sondë të tillë bazohet në faktin se ajo është plotësisht plotësuese me ADN-në mutant dhe pjesërisht plotësuese me ADN-në e tipit të egër. Është e mundur të zgjidhen kushte të tilla hibridizimi (kryesisht temperatura) që hibridizimi i sondës së etiketuar të jetë i qëndrueshëm vetëm me sekuencën mutant të ADN-së, e cila mund të zbulohet me anë të autoradiografisë.
Metoda e mutagjenezës specifike të vendit është veçanërisht e vlefshme sepse ju lejon të izoloni mutacionet pa kontrolluar manifestimin e tyre fenotipik. Kjo metodë hap mundësi të reja për studimin e funksioneve të elementeve rregullatore të gjeneve, ju lejon të ndryshoni "forcën" e promotorëve, të optimizoni vendet e lidhjes së ribozomeve, etj. Një nga aplikimet kryesore të kësaj metodologjie është inxhinieri proteinash.
Inxhinieria e proteinave. Kjo frazë tregon një sërë teknikash metodologjike që bëjnë të mundur rindërtimin e një molekule proteine me futjen e synuar të mutacioneve të duhura në një gjen strukturor (mutagjenezë specifike të vendit) dhe, rrjedhimisht, zëvendësimet e dëshiruara të aminoacideve në strukturën parësore të proteinës.
Një shembull ilustrues i ndërtimit të proteinave më aktive janë eksperimentet e Fershtit dhe bashkëpunëtorëve me enzimën tyrosyl-tRNA sintetazë nga bakteret Bacillus stearothermophilus. Analiza e pasojave të zëvendësimeve të aminoacideve në zonën aktive të kësaj enzime çoi në përfundimin se heqja e grupeve që formojnë lidhje të dobëta hidrogjeni me substratin mund të përmirësojë afinitetin e tij për substratin. U zbulua se treonina-51 (zë pozicionin 51 në peptid) formon një lidhje të gjatë dhe të dobët hidrogjeni me oksigjenin e unazës së ribozës kur lidh adenilat tirozil. Në të njëjtën kohë, u zbulua se prolina zë të njëjtin pozicion në bakteret E. coli. Mutagjeneza specifike e gjenit që përcakton strukturën e sintetazës tyrosyl-tRNA B. stearothermophilus bëri të mundur zëvendësimin thr-51→pro -51 në peptid. Si rezultat, lidhja e ATP në qendrën aktive të enzimës u përmirësua ndjeshëm, dhe aktiviteti i tij katalitik u rrit 25 herë.
Një shembull tjetër, jo më pak domethënës i rindërtimit të proteinave me rëndësi praktike është modifikimi i subtilisinës nga Bacillus amyloliquefaciens, i kryer nga Estell et al. Subtilisinat janë proteinaza serine të sekretuara nga bacilet në mjedisin e jashtëm. Këto enzima prodhohen në një shkallë të madhe nga industria e bioteknologjisë dhe përdoren gjerësisht në detergjentë. Disavantazhi i subtilisinave është një rënie e mprehtë e aktivitetit proteolitik nën ndikimin e agjentëve oksidues, përfshirë ato që përmbahen në pluhurat larës. Qëllimi i rindërtimit të molekulës BPN subtilisin ishte stabilizimi i saj kundër oksidimit kimik.
Në eksperimentet paraprake, u zbulua se në prani të peroksidit të hidrogjenit, subtilisin redukton shpejt aktivitetin për shkak të oksidimit të mbetjes metionine-222, e cila shndërrohet në sulfoksidin përkatës. Duke përdorur metoda të mutagjenezës specifike të vendit, kjo mbetje metionine u zëvendësua me të gjitha 19 aminoacidet e tjera proteinike. Plazmidet me gjene mutante u futën në shtame me delecione në gjenet përkatëse dhe u analizuan vetitë e subtilisinave të prodhuara. Mutantët me serinë dhe alaninë222 rezultuan të jenë mjaft të qëndrueshëm ndaj veprimit të peroksidit. Mutanti më aktiv ishte ai që përmbante mbetjen e cisteinës-222; aktiviteti i tij specifik ishte 38% më i lartë se ai i llojit të egër.
Në mënyrë të ngjashme, ishte e mundur të rritet aktiviteti i b-interferonit. Arritje të tjera të inxhinierisë së proteinave përfshijnë studime në sqarimin e aktivitetit transformues të onkoproteinave; ndryshimi i qëndrueshmërisë termike të enzimave, për shembull, marrja e reninës termolabile dhe a-amilazës termostabile; rritja e efikasitetit të lidhjes së insulinës nga receptori përkatës i membranës plazmatike për shkak të zëvendësimit të histidinës me aspartat në pozicionin 10 të zinxhirit b të hormonit, si dhe shumë shembuj të tjerë. Një numër i madh i produkteve të inxhinierisë proteinike tashmë kanë gjetur aplikim praktik në proceset e prodhimit.
1.1 Koncepti i inxhinierisë së proteinave. Historia e zhvillimit
Inxhinieria e proteinave është një degë e bioteknologjisë që merret me zhvillimin e proteinave të dobishme ose të vlefshme. Kjo është një disiplinë relativisht e re që fokusohet në studimin e palosjes së proteinave dhe parimet e modifikimit dhe krijimit të proteinave.
Ekzistojnë dy strategji kryesore për inxhinierinë e proteinave: modifikimi i drejtuar i proteinave dhe evolucioni i drejtuar. Këto metoda nuk përjashtojnë njëra-tjetrën; studiuesit shpesh përdorin të dyja. Në të ardhmen, njohuritë më të hollësishme të strukturës dhe funksionit të proteinave, si dhe përparimet në teknologjinë e lartë, mund të zgjerojnë ndjeshëm mundësitë e inxhinierisë së proteinave. Si rezultat, edhe aminoacidet e panatyrshme mund të inkorporohen falë një metode të re që lejon aminoacidet e reja të përfshihen në kodin gjenetik.
Inxhinieria e proteinave filloi në kryqëzimin e fizikës dhe kimisë së proteinave dhe inxhinierisë gjenetike. Ai zgjidh problemin e krijimit të molekulave të proteinave të modifikuara ose hibride me karakteristika të specifikuara. Një mënyrë e natyrshme për të zbatuar një detyrë të tillë është të parashikoni strukturën e gjenit që kodon proteinën e ndryshuar, të kryeni sintezën, klonimin dhe shprehjen e saj në qelizat marrëse.
Modifikimi i parë i kontrolluar i proteinave u krye në mesin e viteve '60 nga Koshland dhe Bender. Për të zëvendësuar grupin hidroksil me një grup sulfhidril në qendrën aktive të proteazës, subtilisin, ata përdorën një metodë modifikimi kimik. Sidoqoftë, siç doli, një tiolsubtilisinë e tillë nuk ruan aktivitetin e proteazës.
Kimikisht, një proteinë është një lloj molekule e vetme, e cila është një zinxhir ose polimer poliaminoacid. Ai përbëhet nga sekuenca aminoacide të 20 llojeve. Pasi mësuan strukturën e proteinave, njerëzit shtruan pyetjen: a është e mundur të hartohen sekuenca krejtësisht të reja aminoacide në mënyrë që ato të kryejnë funksionet që njerëzit kanë nevojë shumë më mirë se proteinat e zakonshme? Emri Protein Engineering ishte i përshtatshëm për këtë ide.
Njerëzit filluan të mendojnë për një inxhinieri të tillë që në vitet 50 të shekullit të 20-të. Kjo ndodhi menjëherë pas deshifrimit të sekuencave të para të aminoacideve të proteinave. Në shumë laboratorë anembanë botës, janë bërë përpjekje për të dyfishuar natyrën dhe për të sintetizuar kimikisht sekuenca të dhëna absolutisht arbitrare të poliaminoacideve.
Kimisti B. Merrifield ia doli më shumë në këtë. Ky amerikan arriti të zhvillojë një metodë jashtëzakonisht efektive për sintezën e zinxhirëve të poliaminoacideve. Për këtë, Merrifield u nderua me Çmimin Nobel në Kimi në 1984.
Figura 1. Skema se si funksionon inxhinieria e proteinave.
Amerikani filloi të sintetizonte peptide të shkurtra, duke përfshirë hormonet. Në të njëjtën kohë, ai ndërtoi një automat - një "robot kimik" - detyra e të cilit ishte të prodhonte proteina artificiale. Roboti bëri bujë në qarqet shkencore. Megjithatë, shpejt u bë e qartë se produktet e tij nuk mund të konkurronin me atë që prodhon natyra.
Roboti nuk mundi të riprodhonte me saktësi sekuencat e aminoacideve, domethënë bëri gabime. Ai sintetizoi një zinxhir me një sekuencë, dhe tjetrin me një pak të modifikuar. Në një qelizë, të gjitha molekulat e një proteine janë në mënyrë ideale të ngjashme me njëra-tjetrën, domethënë sekuencat e tyre janë absolutisht identike.
Kishte një problem tjetër. Edhe ato molekula që roboti sintetizoi në mënyrë korrekte nuk morën formën hapësinore të nevojshme për funksionimin e enzimës. Kështu, përpjekja për të zëvendësuar natyrën me metodat e zakonshme të kimisë organike çoi në një sukses shumë modest.
Shkencëtarët mund të mësonin vetëm nga natyra, duke kërkuar modifikimet e nevojshme të proteinave. Çështja këtu është se në natyrë ka vazhdimisht mutacione që çojnë në ndryshime në sekuencat e aminoacideve të proteinave. Nëse zgjidhni mutantët me vetitë e nevojshme që përpunojnë një substrat të veçantë në mënyrë më efikase, atëherë mund të izoloni nga një mutant i tillë një enzimë të ndryshuar, falë së cilës qeliza fiton veti të reja. Por ky proces kërkon një periudhë shumë të gjatë kohore.
Gjithçka ndryshoi kur u shfaq inxhinieria gjenetike. Falë saj, ata filluan të krijojnë gjene artificiale me çdo sekuencë nukleotide. Këto gjene u futën në molekulat vektoriale të përgatitura dhe ADN-ja u fut në baktere ose maja. Atje, një kopje e ARN-së u mor nga gjeni artificial. Si rezultat, u prodhua proteina e nevojshme. Gabimet në sintezën e tij u përjashtuan. Gjëja kryesore ishte të zgjidhej sekuenca e duhur e ADN-së dhe më pas vetë sistemi enzimë i qelizës e bëri punën e tij në mënyrë të përsosur. Kështu, mund të konkludojmë se inxhinieria gjenetike i ka hapur rrugën inxhinierisë së proteinave në formën e saj më radikale.
Inxhinieria e proteinave
Modifikimi i synuar i proteinave. Në modifikimin e synuar të proteinës, shkencëtari përdor njohuri të hollësishme të strukturës dhe funksionit të proteinës për të bërë ndryshimet e dëshiruara. Në përgjithësi, kjo metodë ka avantazhin...
Inxhinieria e proteinave
Teknologjia e inxhinierisë së proteinave përdoret (shpesh në kombinim me metodën e ADN-së rekombinante) për të përmirësuar vetitë e proteinave ekzistuese (enzimat, antitrupat, receptorët qelizor) dhe për të krijuar proteina të reja që nuk ekzistojnë në natyrë...
Inxhinieria e proteinave
1. Me zëvendësimin e disa mbetjeve aminoacide të lizozimës së bakteriofagut T4 me cisteinë, u përftua një enzimë me një numër të madh lidhjesh disulfide, për shkak të së cilës kjo enzimë e ruajti aktivitetin e saj në një temperaturë më të lartë. 2...
Llojet dhe speciet
Aristoteli përdori termin "specie" për të përshkruar kafshë të ngjashme. Pas shfaqjes së veprave të D. Ray (1686) dhe veçanërisht C. Linnaeus (1751--1762), koncepti i specieve u vendos fort në biologji si kryesori...
Aktivitet më i lartë nervor në moshën e rritur
Funksionimi i trurit mbeti një mister i pazgjidhur për njerëzimin për shumë vite. Jo vetëm klerikët, por edhe shkencëtarët që pretendonin idealizëm, lidhnin të gjitha proceset mendore në trup me një shpirt misterioz...
Algoritmet gjenetike në problemin e optimizimit të parametrave realë
Ajo që quhet algoritmi standard gjenetik u përshkrua dhe u eksplorua për herë të parë në detaje në veprën e de Jongh...
Inxhinieri gjenetike
Inxhinieria gjenetike u shfaq falë punës së shumë studiuesve në degë të ndryshme të biokimisë dhe gjenetikës molekulare. Për shumë vite, proteinat konsideroheshin si klasa kryesore e makromolekulave. Madje kishte një supozim...
Përdorimi i inxhinierisë gjenetike në trajtimin e sëmundjeve dhe krijimin e ilaçeve
Inxhinieria gjenetike u shfaq falë punës së shumë studiuesve në degë të ndryshme të biokimisë dhe gjenetikës molekulare...
Historia e gjenetikës
Pas përhapjes së gjerë të mësimeve të Çarls Darvinit, një nga kritikët e parë që vuri në dukje një pikë të dobët në teori ishte studiuesi skocez F. Jenkins. Në 1867, ai vuri në dukje se në teorinë e Darvinit nuk kishte qartësi në çështjen e ...
Konceptet për zhvillimin e teknologjive dhe energjisë moderne
Për të lehtësuar punën fizike, që nga kohërat e lashta, janë shpikur pajisje, mekanizma dhe makina të ndryshme që rrisin aftësitë mekanike të njeriut. Por vetëm disa mekanizma e ndihmuan një person të kryente punë...
Karakteristikat e klonimit
Racat e pulave dhe shpërndarja moderne e tyre
Bujqësia e shpendëve në shumicën e vendeve të botës zë një pozitë udhëheqëse në mesin e degëve të tjera të prodhimit bujqësor, duke i siguruar popullatës produkte ushqimore dietike shumë të vlefshme (vezë, mish, mëlçi të shijshme yndyrore)...
Problemi i ekzistencës së njerëzimit nën dritën e teorisë së noosferës së Vernadsky
Bazuar në vëzhgimet e fenomeneve natyrore, ideja se qeniet e gjalla ndërveprojnë me mjedisin e jashtëm dhe ndikojnë në ndryshimet e tij lindi shumë kohë më parë...
Citogjenetika si shkencë
Citogjenetika është shkenca e bazës materiale të trashëgimisë. Ajo studion veçoritë e strukturës, riprodhimin, rikombinimin, ndryshimet dhe funksionimin e strukturave gjenetike të qelizës, shpërndarjen e tyre në mitozë...
Evolucioni i grupeve të organizmave
Teoria evolucionare është doktrina e modeleve të përgjithshme dhe forcave lëvizëse të zhvillimit historik të natyrës së gjallë. Qëllimi i këtij mësimi: të identifikojë modelet e zhvillimit të botës organike për menaxhimin e mëvonshëm të këtij procesi...

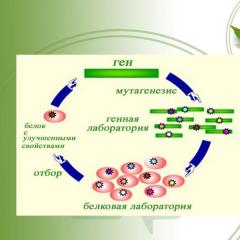
Inxhinieria e proteinave 6 Një grup metodash dhe qasjesh për studimin e proteinave dhe marrjen e proteinave me veti të reja DETYRAT KRYESORE Krijoni një bibliotekë kloni të sekuencave të nukleotideve dhe aminoacideve. Hetoni efektet e zëvendësimeve të vetme të mbetjeve të aminoacideve në palosjen dhe funksionet e proteinave Zhvilloni metoda për modifikimin efektiv proteinave për t'u dhënë atyre vetitë e nevojshme Zhvilloni metoda dhe qasje për shqyrtimin dhe përzgjedhjen e proteinave me vetitë e kërkuara


Dizajni racional Dizajni racional Nevoja për njohuri për organizimin hapësinor të proteinës Nevoja për njohuri për ndërveprimet brenda dhe ndërmolekulare Papërsosmëria e metodave dhe pajisjeve një drejtim që synon krijimin e proteinave të reja de novo nga dizajni i tyre hapësinor

Evolucioni i drejtuar i molekulave të proteinave është një drejtim që synon krijimin e proteinave të reja përmes përzgjedhjes 1 duke marrë një bibliotekë të sekuencave të rastësishme të aminoacideve 2 duke përzgjedhur zinxhirët polipeptidë që kanë të paktën një shkallë të vogël të vetive të kërkuara 3 duke përdorur mutagjenezën e rastësishme duke marrë një bibliotekë të re të proteinave që janë përdoret në raundin tjetër të përzgjedhjes ose duke përdorur konstruksione të modifikuara gjenetikisht që shprehin proteina të reja

Evolucioni i drejtuar i molekulave të proteinave (opsionet) ridizajnimi racional duke përdorur mutagjenezë të drejtuar zëvendëson mbetjet specifike të aminoacideve në qendrën aktive të inxhinierisë enzimë të sipërfaqeve të proteinave duke përdorur mutacione që ndryshojnë seksionet e zinxhirit polipeptid në afërsi të mbetjeve të aminoacideve që janë afër njëri-tjetrit në sipërfaqja e globulës së proteinës, por e vendosur në një distancë të konsiderueshme në zinxhirin polipeptid larg njëri-tjetrit

Ekzaminimi dhe përzgjedhja e proteinave me veti të specifikuara shqyrtimi i rastësishëm i përmirësuar përzgjedhja e shqyrtimit secila proteinë ekzaminohet për praninë e vetive të kërkuara; përzgjedhja e proteinave nga biblioteka ndodh në mënyrë të rastësishme, secila proteinë ekzaminohet për praninë e vetive të kërkuara; zgjedhja e proteinave nga biblioteka ndodh rastësisht; është e mundur nëse objektet që përbëjnë bibliotekën ndryshojnë në mënyrë fenotipike (për shembull, në prani të aktivitetit enzimatik); krijohen kushte për ruajtjen selektive të përbërësve të bibliotekës që kanë veti të caktuara (fagu, shfaqja e qelizave); krijohen kushte për ruajtjen selektive të përbërësve të bibliotekës; të cilat kanë veti të caktuara (fagu, shfaqja e qelizave) zbulimi i një proteine me vetitë e kërkuara midis një numri të madh makromolekulash që përbëjnë biblioteka e klonit që rezulton


Shfaqja e fagut Qëllimi është shfaqja e proteinave të huaja në sipërfaqen e fagut Metoda është zhvilluar në vitin 1985 për bakteriofagun filamentoz M13. (gjenet pIII dhe pVIII janë vende të përshtatshme të synuara për futjen e një fragmenti të huaj cDNA) Qëllimi është ekspozimi i proteinave të huaja në sipërfaqen e fagut Metoda është zhvilluar në 1985 për bakteriofagun filamentoz M13. (gjenet pIII dhe pVIII janë vende të përshtatshme objektive për futjen e një fragmenti të huaj cDNA) është ndërtuar një gjen hibrid i përbërë nga sekuencat koduese të proteinës së synuar dhe një nga proteinat e mbështjellësit të fagut nga bakteriofagu; E. coli infektohet gjatë fagut. asambleja; proteinat hibride përfshihen në grimcën e fagut

Fag ndihmës fagmid Gjenomi i fagut Infeksioni i E.coli me një fag ndihmës Qelizat E.coli të transformuara me një bibliotekë plazmide/fagmide infektohen me një fag ndihmës për të marrë grimca fag në sipërfaqen e së cilës ekspozohen variante të ndryshme të proteinës së synuar E. qelizat coli të transformuara me një bibliotekë plazmide/fagemide, infektohen me një fag ndihmës për të marrë grimca fagu në sipërfaqen e të cilave ekspozohen variante të ndryshme të proteinës së synuar.


Perspektivat për përdorimin praktik të inxhinierisë proteinike Mjekësia: *për prodhimin e barnave të reja; për krijimin e mjeteve diagnostikuese dhe prodhimin e vaksinave; *për studimin e mekanizmave të reagimit imunitar, si dhe sëmundjeve të sistemit imunitar Ekologjia: *për marrjen e biokatalizatorëve në formën e qelizave të plota me enzima të imobilizuara në sipërfaqen e tyre; *për marrjen e biosensorëve për diagnostikim dhe monitorim mjedisor; *për krijimin e bio adsorbentëve për largimin e substancave toksike dhe joneve të metaleve të rënda nga mjedisi

Matja e glukozës duke përdorur një elektrodë enzimë (paraqitje skematike e eksperimentit të L. Clark). Oksidimi i glukozës nga enzima glukozë oksidazë në prani të oksigjenit: glukozë + O 2 H 2 O 2 + glukono-1,5-lakton. H 2 O 2 zvogëlohet në elektrodën e platinit në një potencial prej +700 mV; rryma që rrjedh në qark është proporcionale me përqendrimin e peroksidit të hidrogjenit (d.m.th., indirekt, glukozës).