Koncepti i teorisë së fushës kristalore. Modelet e lidhjes kimike. Teoria e fushës së kristalit. Komplekset me rrotullim të ulët dhe të lartë
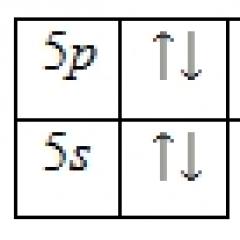
Fushë e dobët fushë e fortë
Fusha e mesme
Frac34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
Ligandët e fushës së dobët me elementë të serisë 3d formojnë komplekse me rrotullim të lartë dhe ligandë me fushë të fortë formojnë komplekse me rrotullim të ulët. Dallimi midis tyre ndikon në strukturën elektronike të komplekseve vetëm për konfigurimet d 4 – d 7:
3+ d 5 3– d 5
kompleks me rrotullim të lartë kompleks me rrotullim të ulët
H 2 O – ligand i fushës së dobët CN – – ligand i fushës së fortë
Komplekset me rrotullim të ulët janë gjithmonë më të qëndrueshëm se komplekset me rrotullim të lartë. Ligandët e fushës së mesme, në varësi të kushteve (ngarkesa dhe natyra e atomit qendror), mund të formojnë komplekse me rrotullim të lartë dhe me rrotullim të ulët.
Shembull. Bazuar në TCP, bëni një supozim për strukturën elektronike të joneve heksaamine kobalt(II) (Δo = 21600 cm–1, P = 21000 cm–1) dhe heksaamine kobalt (III) (Δo = 9500 cm–1, P = 22500 cm–1).
Amoniaku është një ligand me fushë të mesme dhe, në varësi të shkallës së oksidimit të metalit, mund të formojë komplekse me rrotullim të lartë dhe me rrotullim të ulët. Le të zbulojmë se cilat komplekse do të jenë energjikisht më të qëndrueshme për kobaltin (II) dhe kobaltin (III). Për ta bërë këtë, krahasoni ESC të çdo joni në një fushë të fortë dhe të dobët:
(a) 3+, d 6

fushë e fortë fushë e dobët
ESKP (fushë e fortë) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 cm –1
ESKP (fushë e dobët) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 cm – 1
Fitimi i energjisë është më i madh në rastin e një kompleksi me rrotullim të ulët.
(b) 2+ , d 7

fushë e fortë fushë e dobët
ESKP (fushë e fortë) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 cm–1
ESKP (fushë e dobët) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 cm – 1
Fitimi i energjisë është më i madh në rastin e një kompleksi me rrotullim të lartë.
Kështu, joni 3+ është me rrotullim të ulët dhe joni 2+ është me rrotullim të lartë.
ESC rritet me rritjen Δo, megjithatë, është i ndryshëm për gjendjet me rrotullim të lartë dhe me rrotullim të ulët (Fig. 1.28. Varësia e ESC për komplekset me rrotullim të lartë dhe me rrotullim të ulët me konfigurim d 6 në vlerën Δo = 10Dq Rajoni në të cilin ekzistenca e të dy shteteve është e mundur është e hijezuar). Rajoni pranë pikës së kryqëzimit të këtyre dy linjave korrespondon me komplekset që mund të ekzistojnë si në gjendjet me rrotullim të lartë ashtu edhe në atë të ulët.
Një shembull është kompleksi i tiocianatit të hekurit (II) me 1,10-fenantroline, i cili është me spin të lartë (paramagnetik) në temperatura të ulëta dhe me rrotullim të ulët (diamagnetik) në temperatura të larta (M. Marchivie, P. Guionneau, J. A. K. Howard , G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, v. 124, f. 194). Ndryshimi në shumësi shoqërohet me një ndryshim në distancat ndëratomike dhe gjeometrinë e mjedisit të koordinimit: kompleksi me rrotullim të ulët është një tetëkëndor i rregullt dhe kompleksi me rrotullim të lartë është një i shtrembëruar. Kalimi i kundërt në gjendjen e rrotullimit të lartë është i mundur nën ndikimin e presioneve të larta ose rrezatimit. Aktualisht, disa dhjetëra sisteme të tilla janë të njohura.
Duke folur për vetitë σ-donator dhe π-pranues të ligandit, ne shkuam përtej TCP, duke përdorur qasjet e metodës orbitale molekulare të aplikuar për komponimet komplekse (Vëllimi 1). Kujtojmë se fotografia e ndarjes së orbitaleve d është një fragment i skemës së përgjithshme të orbitaleve molekulare në një kompleks tetëedral, ku orbitalet t 2g konsiderohen si jo-lidhëse, dhe p.sh. si antilidhëse (Fig. Vëllimi 1) .
Formimi i lidhjeve në një kompleks oktaedral pa lidhje π përfshin orbitalet s-, p- dhe d të metalit dhe një orbitale nga çdo ligand. Nga 15 orbitale atomike, formohen 15 orbitale molekulare, gjashtë prej tyre (a 1 g, t 1 u, e g (fusnotim: shkronja në përcaktimin e orbitaleve tregon shkallën e degjenerimit të tyre: t - tre herë të degjeneruara, e - dyfish i degjeneruar, a - jo i degjeneruar, dhe prania e një qendre simetrie: g - simetrike, u - asimetrike)) σ-lidhja, tre (t 2 g) - jo-lidhje, dhe gjashtë (p.sh. g *, t 1 u *, një 1 g *) σ-lirim. Orbitalet lidhëse janë më afër në energji me orbitalet e ligandit, ndërsa orbitalet jolidhëse janë të lokalizuara kryesisht në atomin e metalit. Energjia d xy , d xz , d yz (t 2 g) e orbitaleve metalike praktikisht nuk ndryshon gjatë formimit të kompleksit.
Prania e një orbitale vakante me energji të ulët në ligand, e ngjashme në simetri me orbitalet metalike, çon në një ulje të energjisë së orbitaleve t 2g, praktikisht pa ndikuar p.sh., duke rritur kështu Δo (Fig. 1.29. Fragmente të MO diagrami për kompleksin e kobaltit (III) me ligand-dhurues σ (a) dhe σ-dhurues, ligand-pranues (b)).
Efekti Jahn-Teller. Në vitin 1937, Yang dhe Teller vërtetuan teoremën sipas së cilës çdo molekulë jolineare në një gjendje elektronike të degjeneruar është e paqëndrueshme dhe spontanisht i nënshtrohet një shtrembërimi që ul simetrinë e saj dhe çon në heqjen e degjenerimit. Teorema parashikon vetëm faktin e heqjes së degjenerimit, por nuk tregon se si do të hiqet. Bazuar në këtë teoremë, u shpjegua shtrembërimi i gjeometrisë oktaedrale të një numri kompleksesh dhe vetë fakti i pranisë së një shtrembërimi të tillë u quajt efekti Jahn-Teller. Le të shohim një shembull. Komplekset e bakrit (II) me konfigurimin d9, si rregull, nuk paraqesin një tetëkëndor të rregullt, por janë të zgjatur ose të ngjeshur përgjatë njërit prej akseve (Fig. 1.30. Shtrembërimi i gjeometrisë tetëkëndësh në komplekset e bakrit (II). Le të shqyrtojmë rastin e një oktaedri prolate. Heqja e ligandëve të vendosur përgjatë boshtit z shkakton heqjen e degjenerimit për shkak të një ndryshimi në energjitë e orbitaleve. Orbitalet e drejtuara përgjatë boshtit z (d xz, d yz, d z 2) ndërveprojnë më dobët me orbitalet e ligandëve në krahasim me orbitalet që nuk kanë një komponent z (d xy, d x 2 -y 2), dhe për këtë arsye ulin energjinë e tyre. Një çift orbitalesh me të njëjtën simetri, me një komponent z (d xz, d yz), mbetet i degjeneruar dhe fiton energji të shtuar. (Fig. 1.31. Ndryshimi i energjive të d-orbitaleve kur oktaedri është i shtrembëruar). Efekti Jahn-Teller manifestohet më fuqishëm në komplekset me orbitale të mbushura në mënyrë të pabarabartë, domethënë me konfigurime t 2g 3 e g 1 (që korrespondon me jonin d 4 në një fushë të dobët: CrCl 2, K 3 MnF 6) dhe t 2g 6 e g 3 ( korrespondon me jonin d 9: pothuajse të gjitha komplekset e bakrit (II)) dhe t 2g 6 e g 1 (korrespondon me jonin d 7 në një fushë të fortë, e rrallë, K 3 NiF 6). Një efekt i parëndësishëm Jahn-Teller është tipik për komplekset me orbitale t 2g të mbushura në mënyrë të pabarabartë, domethënë për konfigurimet elektronike t 2g 1 (d 1), t 2g 2 (d 2), t 2g 4 (d 4 në një fushë të fortë) , t 2g 5 (d 5 në një fushë të fortë), t 2g 5 e g 1 (d 6 në një fushë të dobët), t 2g 5 e g 2 (d 7 në një fushë të dobët). Jonet me konfigurime d 3 dhe d 5 në një fushë të dobët, d 3 dhe d 6 në një fushë të fortë, d 8 dhe d 10 nuk janë në asnjë rrethanë Jahn-Teller.
Efekti Jahn-Teller manifestohet në pabarazinë e gjatësisë së lidhjeve në shumë komplekse bakri (II) dhe manganit (III) dhe në një ndryshim jomonotonik në konstantat e stabilitetit hap pas hapi të komplekseve. Për shembull, në klorurin anhidrik të bakrit (II), atomi i bakrit është i rrethuar nga gjashtë atome klori, katër prej të cilave ndodhen në një distancë prej 0,230 nm, dhe dy të tjerët janë të vendosur në një distancë prej 0,295 nm prej tij.
Komplekset e bakrit (II) (Cl 2, (C 6 H 5 SO 3) 2, etj.) janë të njohura, të përbëra nga disa jone kristalografikisht joekuivalente Jahn-Teller, secili me llojin e vet të shtrembërimit, të cilët shndërrohen në njëri-tjetrin, duke ndryshuar distanca metal-ligand aq e shpejtë sa në përgjithësi të gjitha distancat metal-ligandë duken të jenë të njëjta. Ky rast u thirr efekt dinamik ose pulsues Jahn-Teller(P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214).
Megjithatë, efekti Jahn-Teller nuk është një ligj universal. Aktualisht, njihen jone komplekse me një konfigurim Jahn-Teller, të cilët janë oktaedra të pashtrembëruara: 4–, 3+.
Ndarja në fusha me simetri të ndryshme nga oktaedrale.
Përveç atyre oktaedrale, ka shumë komplekse të njohura me një gjeometri të ndryshme - rrafsh katror, tetraedral, trigonal-piramidal, katror-piramidal, linear, etj. Ndarja në secilën prej këtyre fushave është e ndryshme nga oktaedri; përcaktohet nga simetria e shumëfaqëshit të koordinimit.
Komplekset katror-planare mund të konsiderohen si një rast ekstrem i shtrembërimit tetragonal të gjeometrisë oktaedrale, kur ligandët e vendosur përgjatë njërit prej boshteve koordinative hiqen deri në pafundësi (Fig. 1.27b). Emërtimet e orbitaleve janë paraqitur në figurë. Komplekset planare-katrore janë më tipike për jonet me konfigurim elektronik d 8 – Ni 2+, Pd 2+, Pt 2+, Au 3+. Stabiliteti i tyre rritet ndjeshëm me rritjen e Δ, domethënë kur lëvizin nga elementët e serisë 3d në elementë të rëndë të tranzicionit. Kështu, për shembull, nëse paladiumi, platini dhe ari kanë pothuajse të gjitha komplekset me një numër koordinimi prej katër katrorësh, atëherë nikeli formon komplekse katrore planare vetëm me ligandë me fushë të lartë: 2–, Ni(dmg) 2. Komplekset e nikelit (II) me ligandë me fushë të ulët, si halogjenët, kanë një gjeometri tetraedrale.
Disa komplekse metalike të tranzicionit katror-planar formojnë zinxhirë në formë të ngurtë me ligandë lidhës, për shembull Pt-CN-Pt në K 2 Br 0.3, ku atomet e platinit janë pjesërisht në gjendjen e oksidimit +4. Aftësia e lartë depërtuese e orbitaleve 5d siguron mbivendosjen e tyre me formimin e një brezi të vetëm energjetik dhe, rrjedhimisht, përçueshmërinë metalike në drejtim të zinxhirit. Komplekse të tilla molekulare janë të afta të përcjellin rrymë elektrike dhe aktualisht janë duke u studiuar intensivisht.
Në një fushë të simetrisë tetraedrale, orbitalet d xy , d yz , d xz kanë energjinë maksimale, ato quhen t 2 -orbitale dhe energjia minimale është orbitalet d x 2 –y 2 dhe d z 2, ato shënohen e . Për shkak të pranisë së një numri më të vogël ligandësh dhe rregullimit të ndryshëm të tyre, fusha tetraedrale (Fig. 1.32. Krahasimi i çarjeve në fushat tetraedrale dhe tetëedrale) rezulton të jetë 2.25 herë më e dobët se ajo tetëedrale: .
Shumica e komplekseve tetraedrale janë me rrotullim të lartë. (Shënimi - Disa shembuj të komplekseve tetraedrale me rrotullim të ulët janë të njohura, për shembull, Cr(N(Si(CH 3) 3) 2) 3 NO (kromi(II), d 4 ; D. C. Bradley, Chem Ber., 1979, 11, 393); CoL 4, ku L është 1-norbornil (kobalt(IV), d 5; E. K: Brune, D. S. Richeson, K. H. Theopold, Chem. Commun., 1986 , 1491)). Stabilizimi maksimal i mjedisit tetraedral nga fusha kristalore arrihet me konfigurimet d 2 (FeO 4 2–, MnO 4 3–) dhe d 7 (2–). Për shkak të energjisë relativisht të ulët të stabilizimit, komplekset tetraedrale formohen më shpesh nga jonet me konfigurime d 0 (TiCl 4, MnO 4 -, CrO 4 2-), d 5 në një fushë të dobët (FeCl 4 -) dhe d 10 (ZnCl 4 2–) me ESKP zero, si dhe jone metalike jo-kalimtare (AlCl 4 –). Formimi i komplekseve tetraedrale në krahasim me ato oktaedrale shpesh favorizohet nga faktori sterik, për shembull, joni është më i qëndrueshëm se 3–.
Përdorimi i TCP për të shpjeguar stabilitetin e komplekseve. Seriali Irving-Williams. Teoria e fushës kristalore bën të mundur shpjegimin e natyrës jo monotonike të ndryshimeve në energjitë e rrjetës kristalore të oksideve dhe halogjenëve, konstanteve të qëndrueshmërisë së komplekseve, etj. Rendi i ndryshimit në energjitë e hidratimit të kationeve me ngarkesë të dyfishtë të metaleve 3d në përgjithësi përkon me natyrën e ndryshimeve në ESC në komplekset me rrotullim të lartë (Fig. 1.33. Ndryshimi në energjinë e hidratimit të metaleve të kationeve me ngarkesë të dyfishtë të serisë 3d (a) dhe ndryshimi në ESC në komplekset me rrotullim të lartë (b) ), sa më i fortë të jetë stabilizimi nga fusha kristalore, aq më i madh është hidratimi. Dihet që konstantet e zëvendësimit të një molekule uji nga një ligand me fushë të dobët L
2+ + L x– = (2-x)+ + H 2 O
bindjuni serisë Irving-Williams: Mn 2+< Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ < Zn 2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Efekt nefeloaksetic. U zbulua se zmbrapsja e ndërsjellë e elektroneve d dobësohet kur atomi vendoset në fushën e ligandëve. Ky efekt i ligandit mbi d-elektronet e atomit të metalit quhet efekt nefeloauxetic nga fjalët greke νεφελη - re dhe αυξανω - rritje. Seria e ligandëve, e rregulluar në mënyrë që të rrisë ndikimin e tyre në orbitalet metalike, pothuajse plotësisht korrespondon me serinë spektrokimike. Arsyeja e efektit nefeloksetik është mbivendosja e orbitaleve d të metalit me orbitalet e ligandëve, për shkak të së cilës reja d zgjerohet në hapësirë. Prania e këtij efekti tregon qartë kufizimet e modelit më të thjeshtë elektrostatik - teoria e fushës kristalore, e cila supozon se linjadat janë ngarkesa negative pikash.
Teoria e fushës së ligandit. Teoria e fushës kristalore u zhvillua nga Bethe në 1929. Aktualisht, ajo përdoret gjerësisht në një formë të modifikuar me korrigjime për disa kovalencë të lidhjes metal-ligand. Kjo teori quhet teoria e fushës së ligandit. Prania e një kontributi kovalent ndryshon energjinë e orbitaleve metalike në krahasim me atë të llogaritur nga TCP. Përqindja e kovalencës merret parasysh duke futur faktorë korrigjues që bëjnë të mundur barazimin e vlerave eksperimentale me ato të llogaritura.
Ngjyrosja e komplekseve.
Ngjyra e komplekseve të elementeve të tranzicionit d shoqërohet me kalimin e elektroneve nga një orbital d në tjetrin. Kjo ilustrohet qartë nga shembulli i jonit Ti 3+, i diskutuar në vëllimin e parë të tekstit shkollor. Duke thithur energjinë që korrespondon me pjesët blu dhe jeshile të spektrit të dukshëm, i vetmi d-elektron në jonin Ti 3+ lëviz në orbitalin eg (Fig. 1.35. Spektri i jonit 3+). Ngjyra e jonit është për shkak të ngjyrave shtesë - të kuqe dhe vjollcë. (Shënimi - Lexuesi i vëmendshëm do të vërejë njëfarë asimetrie të brezit të përthithjes. Është pasojë e një ndarjeje të lehtë të nivelit t 2g të shkaktuar nga efekti Jahn-Teller). Një diagram që tregon ngjyrat plotësuese dhe i cili është i njohur për çdo artist është paraqitur në fletën e dytë të librit shkollor. Energjia e tranzicionit, e shprehur në centimetra reciproke (1000 cm –1 = 12 kJ), korrespondon me parametrin e ndarjes Δο - më së shpeshti përcaktohet nga spektri elektronik. Gjatësia e valës është në përpjesëtim të zhdrejtë me energjinë:
 .
.
Në rastin e komplekseve me një numër të madh elektronesh, pamja e spektrit bëhet më e ndërlikuar dhe në të shfaqen breza shtesë. Kjo për faktin se gjendja e ngacmuar t 2g 1 e g 1 mund të realizohet në disa mënyra, varësisht se në cilat dy orbitale d ndodhen elektronet. Për shembull, një gjendje në të cilën elektronet zënë orbitale d xy dhe d x 2 –y 2 do të jetë më e lartë në energji se një gjendje d xy 1 d z 2 1 për shkak të zmbrapsjes më të madhe të elektroneve përgjatë boshtit x. Energjia që i korrespondon brezit me energjinë më të ulët është e barabartë me parametrin e ndarjes Δo.
Për të përshkruar më në detaje spektrat elektronike, është e nevojshme të prezantohen disa koncepte. Le ta quajmë mikrogjendje çdo rregullim të elektroneve në një nënnivel. Numri i mikrogjendeve N, në të cilat n elektrone zënë x orbitale, është i barabartë me

Çdo mikroshtet karakterizohet nga vlerat e veta të rrotullimit dhe momentit këndor. Një grup mikrogjendesh me energji identike quhet afati, për shembull, 3 P, 5 D, 1 S. Indeksi dixhital tregon shumëfishimin, i cili llogaritet si:
shumëfishi = numri i elektroneve të paçiftuara në gjendjen bazë + 1.
Emrat e termave lexohen me një tregues të shumëfishtë: "treshe P", "kuintet D", "njëshe S". Shkronja tregon momentin e përgjithshëm këndor L të një atomi ose joni, i cili është i barabartë me vlerën maksimale të shumës së momentit këndor m l të orbitaleve individuale të zëna nga elektronet. Për shembull, joni Ti 3+ përmban një d-elektron, numri i mikrogjendjeve është N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (pasi për orbitalin d m l = –2, –1, 0, 1, 2, numri i elektroneve është 1, prandaj shuma maksimale m l është e barabartë me vlerën më të madhe të m l), shumëfishimi 1 + 1 = 2. Prandaj, termi i gjendjes bazë (me energjinë më të ulët) është 2 D. Në rastin e një joni me konfigurim elektronik d 2 N = (2´5)!/2!( 2'5 – 2)! = 45, L = 3(F) (pasi për orbitalin d m l = –2, –1, 0, 1, 2, numri i elektroneve është 2, prandaj, shuma maksimale e dy vlerave më të mëdha është e barabartë me m l), shumëfishimi 2 + 1 = 3. Për rrjedhojë, termi i mikrogjendjes së tokës është 3 F. Me një rregullim të ndryshëm të dy elektroneve në nënnivelin d, arrihen gjendjet e përshkruara me terma të tjerë - 3 P, 1 G , 1 D, 1 S, etj. Marrëdhënia midis vlerave numerike të L dhe simboleve alfabetike është dhënë më poshtë:
L = 0 1 2 3 4 5 6 7
Në mënyrë të ngjashme, ne mund të nxjerrim termat e gjendjeve bazë dhe të ngacmuara për jonet e tjera të elementeve d (Tabela 1.5.). Ju lutemi vini re se termat për jonet me konfigurim d n dhe d 10-n janë të njëjta.
Tabela. 1.5.
Kushtet e tokës dhe gjendjet më të afërta të ngacmuara për konfigurime të ndryshme të elektroneve d.
Termat ndahen në fushën oktaedrale si orbitale, të shënuara me shkronja të ngjashme. Termat D ndahen në komponentë T 2 g dhe Eg, si d-orbitalet, termat F - në T 1 g, T 2 g dhe A 2 g, si f-orbitalet. Termat S dhe P nuk ndahen fare. Mundësitë për kalimin e elektroneve ndërmjet gjendjeve të ndryshme janë të kufizuara nga rregullat e përzgjedhjes. Kështu, në komplekset lejohen vetëm kalimet ndërmjet gjendjeve me të njëjtën shumësi. Çdo tranzicion i tillë korrespondon me një brez në spektrin e absorbimit. Si shembull, merrni parasysh spektrin elektronik të kompleksit 3+ (Fig. 1.36. Spektri elektronik i kompleksit 3+). Të tre brezat janë për shkak të tre tranzicioneve elektronike: 4 A 2 g ® 4 T 2 g, 4 A 2 g ® 4 T 1 g, 4 A 2 g ® 4 T 1 g (P). Kalimi me energjinë më të ulët korrespondon me vlerën e parametrit të ndarjes: Δo = 17400 cm–1. Kompleksi thith dritën në pjesët e kuqe (17400 cm–1) dhe blu (23000 cm–1) të spektrit të dukshëm dhe në atë afër ultravjollcë (37800 cm–1), prandaj, ka një ngjyrë vjollce.
Sipas rregullit të Laportit, kalimet midis shteteve me të njëjtin barazi, të cilat përfshijnë tranzicione s-s, p-p, d-d, f-f, nuk kanë gjasa, ose, në gjuhën e spektroskopisë, ato janë të ndaluara në komplekset oktaedrale. Tranzicionet e ndaluara janë të mundshme, por ndodhin me intensitet të ulët. Kjo është arsyeja pse kripërat e metaleve kalimtare kanë një ngjyrë të dukshme vetëm në tretësirat e koncentruara. Është shumë herë më e dobët se ngjyra e permanganatit ose e dikromatit, jonet e të cilave nuk përmbajnë elektrone d.
Rregulli i Laportit është i zbatueshëm vetëm në rastin e komplekseve që kanë një qendër simetrie. Kur oktaedri shtrembërohet, qendra e simetrisë zhduket, ndalimi i Laportit hiqet dhe shfaqet ngjyra. Për shembull, joni 3+ është i pangjyrë, por tretësirat e kripërave të hekurit (III) janë shpesh të verdhë-portokalli për shkak të hidrolizës që çon në formimin e grimcave asimetrike me një mjedis tetëkëndor të shtrembëruar.
Ngjyra e komplekseve, përveç kalimeve d-d nga një d-orbital metalik në tjetrin (nga t 2g në eg në komplekset oktaedrale), përcaktohet nga dy faktorë të tjerë: kalimet nga orbitalet e ligandit në orbitalet metalike (ato quhen transferim ngarkese. ) dhe kalimet brenda orbitaleve të ligandës. Këto kalime nuk bien nën sundimin e Laportes dhe, për rrjedhojë, kanë intensitet të lartë.
Brezi i transferimit të ngarkesës është i pranishëm në spektrin elektronik të çdo përbërjeje, megjithatë, në disa raste është në pjesën ultravjollcë të spektrit dhe nuk perceptohet nga ne si ngjyrë. Nëse diferenca midis energjive të orbitaleve të ligandës dhe orbitaleve metalike zvogëlohet, brezi i transferimit të ngarkesës bie në pjesën e dukshme të spektrit. Është transferimi i ngarkesës që shpjegon ngjyrën intensive të permanganatit, dikromatit, sulfurit të merkurit, perokso komplekseve të titanit (IV) dhe shumë komponimeve të tjera me d-orbitale boshe. Në disa raste, nën ndikimin e dritës, transferimi i ngarkesës nga orbitalet e ligandit në orbitalet e metalit ndodh në mënyrë të pakthyeshme, domethënë shoqërohet nga një proces kimik. Një shembull është dekompozimi fotokimik i halogjeneve të argjendit, i cili është baza e fotografisë bardh e zi: Ag + Br – ¾® Ag 0 + Br 0 .
Në spektrin elektronik të permanganatit të kaliumit, vërehen katër breza, që korrespondojnë me kalimet e elektroneve nga orbitalet jolidhëse të lokalizuara kryesisht në ligand (orbitalet a 1, t 2 σ dhe orbitalet e, t 1, t 2 π) në e*, t2 '' orbitalet antilidhëse orbitale të lokalizuara në atomin e metalit ((Fig. 1.37. Diagrami energjetik i jonit tetraedral MnO 4 - me lidhje π. Tranzicionet e elektroneve tregohen me shigjeta):
ν 1 , Mn(e*) ¾ O(t 1) 17700 cm –1
ν 2 , Mn(t 2'') ¾ O(t 1) 29500 cm –1
ν 3 , Mn(e*) ¾ O(t 2) 30300 cm –1
ν 4 , Mn(t 2'') ¾ O(t 2) 44400 cm –1
Brezi me energjinë më të ulët bie në pjesën e dukshme të spektrit (λ = 107/17700 = 565 nm), që korrespondon me thithjen e dritës së gjelbër dhe transmetimin e dritës së kuqe të kuqe.
3. Mekanizmat e reaksioneve që përfshijnë komponime komplekse.
Shumica dërrmuese e proceseve kimike ndodhin si një zinxhir vijues i disa fazave elementare, dhe ekuacioni i reagimit mbart vetëm informacione rreth produkteve kryesore përfundimtare të reaksionit. Kjo sekuencë e transformimeve elementare në rrugën nga substancat fillestare te produktet quhet një mekanizëm. Komponimet e ndërmjetme, zakonisht të paqëndrueshme, përmes të cilave kalon rruga nga reaktantët te produktet quhen ndërmjetëse. Çdo ndërmjetës ka një jetëgjatësi të caktuar, zakonisht jashtëzakonisht të shkurtër, deri në 10 -14 s. Në profilin energjetik të reaksionit ajo korrespondon me një minimum (Fig. a) (Fig. 1.38. Profilet energjetike të një reaksioni që vazhdon përmes: (a) të ndërmjetme, (b) gjendjes së tranzicionit.). Si rregull, ndërmjetësit mund të zbulohen në një përzierje reaksioni me metoda spektrale, dhe vetëm në raste të rralla ato mund të izolohen në formë individuale. Prandaj, informacioni kryesor rreth mekanizmit të reaksionit zakonisht merret përmes studimit të kinetikës së tij - përcaktimit të konstantave të shpejtësisë dhe llogaritjes së parametrave të aktivizimit (entalpi, entropi, vëllim). Në këtë rast, mekanizmi është një model që është në përputhje me të dhënat kinetike, një model që mund të përmirësohet, modifikohet, rishikohet.
Në disa reaksione, ndërmjetësit nuk formohen, dhe kalimi nga reaktantët në produkte ndodh në mënyrë sekuenciale - njëri prej atomeve hiqet gradualisht, dhe tjetri afrohet. Në këtë rast, thuhet se reagimi do të vazhdojë gjendje tranzicioni ose kompleks i aktivizuar. Ajo korrespondon me një maksimum në profilin energjetik të reaksionit (Fig. B).
Shtimi: Komplekset labile dhe inerte
Stabiliteti termodinamik i një grimce përcaktohet nga ndryshimi i energjisë Gibbs për reaksionin e disociimit të saj, ose nga vlera e konstantës së qëndrueshmërisë së këtij procesi. Stabiliteti kinetik tregon se sa shpejt një grimcë e caktuar ndërvepron me grimcat e tjera ose i nënshtrohet kalbjes. Konsiderohet një grimcë kimike inerte, nëse reagon me një gjysmë jete më shumë se 1 minutë. Grimcat që reagojnë me shpejtësi më të lartë quhen labile. Duhet mbajtur mend se qëndrueshmëria kinetike dhe termodinamike nuk varen nga njëra-tjetra, domethënë, e njëjta substancë mund të ketë një konstante stabiliteti të lartë dhe në të njëjtën kohë të jetë inerte, ose, anasjelltas, e paqëndrueshme. Disa shembuj të tillë janë dhënë në tabelën 1.6.
Tabela 1.6. Konstantat e stabilitetit dhe ritmet e zëvendësimit të ligandit në ciano-komplekset e disa metaleve.
Henry Taube tregoi lidhjen midis stabilitetit kinetik të komplekseve oktaedrale dhe konfigurimit elektronik të jonit qendror në fushën tetëedrale. Sipas Taube, komplekset e mëposhtme janë të paqëndrueshme:
· zotërojnë të paktën një orbitale të zbrazët t 2g - ata mund ta përdorin atë në reaksione sipas mekanizmit asociativ (A, I a), ose
· duke pasur të paktën një elektron në orbitalin p.sh. - kjo nxit reaksionin nga mekanizmi disociativ (D, I d), sepse Heqja e një elektroni nga orbitalja eg ul energjinë e gjendjes së tranzicionit.
Kështu, komplekset oktaedrale të kromit (III) (t 2g 3), komplekset me rrotullim të ulët të hekurit (II) (t 2g 6) dhe hekurit (III) (t 2g 5), si dhe komplekset e 4d-, 5d- Elementet e tranzicionit klasifikohen si inerte me numrin e elektroneve d më shumë se dy.
FUNDI I SHTESJES
Ende nuk është zhvilluar një klasifikim i unifikuar i reaksioneve inorganike. Në mënyrë konvencionale, ne mund të propozojmë skemën e mëposhtme (Fig. 1.39. Skema që ilustron klasifikimin e reaksioneve inorganike):
1) Reaksionet e zëvendësimit, shtimit ose eliminimit të ligandëve ndikojnë në një ndryshim në sferën e koordinimit të metalit,
2) Reaksionet redoks shoqërohen me një ndryshim në konfigurimin elektronik të metalit, por nuk ndikojnë në mjedisin e tij koordinues,
3) Reaksionet e ligandëve të koordinuar përfshijnë një ndryshim në ligand pa ndryshuar sferën e koordinimit të kompleksit.
Reaksionet e zëvendësimit. Në një kuptim të gjerë, reaksionet e zëvendësimit nënkuptojnë proceset e zëvendësimit të disa ligandëve në sferën e koordinimit të një metali me të tjerët. Reaksione të tilla mund të ndodhin ose me ose pa një ndryshim në gjendjen e oksidimit. Pas klasifikimit të mësipërm, ne do ta përdorim këtë term vetëm në lidhje me reaksionet që ndodhin pa ndryshim në gjendjet e oksidimit.
Klasifikimi i reaksioneve të zëvendësimit në kiminë inorganike u zhvillua nga Langford dhe Grey. Ai bazohet në përcaktimin e të ashtuquajturit mekanizëm kufizues, dhe jo në përshkrimin e një mekanizmi specifik. Fillimisht përcaktohet mekanizmi stekiometrik dhe më pas ai i brendshëm. Mekanizmi stoikiometrikështë një sekuencë e fazave elementare në kalimin nga substancat fillestare në produkte. Mund të jetë dissociativ (D), asociativ (A) dhe shkëmbim (këmbim reciprok, I). Proceset disociative dhe asociative përfaqësojnë, si të thuash, dy raste kufizuese, drejtpërdrejt të kundërta me njëra-tjetrën. Të dy proceset ndodhin në dy faza përmes formimit të një ndërmjetësi.
Disociative (D)
Procesi është me dy faza, në rastin kufizues ai vazhdon përmes një ndërmjetësi me një përqendrim të reduktuar:
ML 6 + L, + Y ¾® ML 5 Y
Shoqërues (A)
Procesi është me dy faza, i karakterizuar nga formimi i një ndërmjetësi me një përqendrim të shtuar:
ML 6 + Y, ¾® ML 5 Y + L
Shkëmbim i ndërsjellë (I)
Shumica e reaksioneve të shkëmbimit zhvillohen përmes këtij mekanizmi. Procesi është njëfazor dhe nuk shoqërohet me formimin e një ndërmjetësi. Në gjendjen e tranzicionit, reagjenti dhe grupi largues lidhen me qendrën e reagimit, hyjnë në sferën e tij më të afërt të koordinimit dhe gjatë reagimit një grup zhvendoset nga një tjetër, ndodh një shkëmbim i dy ligandëve:
ML 6 + Y ML 5 Y + L.
Gjendja e tranzicionit është ose një kompleks i sferës së jashtme ose, në rastin e ligandëve të ngarkuar, një çift jonik MX 5 L + Y - .
Mekanizmi i brendshëm (a ose d) karakterizon procesin e zëvendësimit të ligandit në nivel molekular. Ai tregon se cili nga dy proceset - formimi ose këputja e një lidhjeje në gjendjen e tranzicionit - është kufizues. Nëse shpejtësia e reaksionit përcaktohet nga formimi i një lidhjeje ndërmjet qendrës së reaksionit dhe reagjentit, flasim për aktivizim asociativ. Përndryshe, kur faktori kufizues është këputja e lidhjes ndërmjet qendrës së reagimit dhe grupit largues, procesi vazhdon me aktivizim disociativ. Duke iu kthyer mekanizmit stekiometrik, është e lehtë të vërehet se procesi disociativ gjithmonë korrespondon me aktivizimin disociativ, dhe procesi shoqërues korrespondon gjithmonë me aktivizimin asociativ, domethënë koncepti i një mekanizmi të brendshëm rezulton të jetë informues vetëm në rastin e një mekanizëm shkëmbimi i ndërsjellë - mund të ndodhë si me aktivizimin disociativ (I d) ashtu edhe me aktivizimin asociativ (I a). Në rastin e mekanizmit të shkëmbimit reciprok me aktivizim shoqërues (Ia), shpejtësia e reaksionit varet nga natyra e Y. Në gjendjen e tranzicionit, atomi i metalit është i lidhur ngushtë si me grupin largues ashtu edhe me nukleofilin sulmues. Një shembull është procesi i zëvendësimit të një atomi klori me brom dhe jod në një kompleks platini me dietilentriaminë (dien):
Y - ¾¾® + + Cl -
Y = Br, I shpejtësitë ndryshojnë shumë.
Në rastin e mekanizmit të shkëmbimit reciprok me aktivizim disociues (I d), shpejtësia e reaksionit nuk varet nga natyra e reagentit Y. Grupet sulmuese dhe larguese në gjendjen e tranzicionit janë të lidhura dobët me jonin qendror. Ky mekanizëm përdoret për të zëvendësuar ujin me aminë në komplekset ujore të shumë metaleve në tranzicion, për shembull, nikel:
2+ + Y ¾¾® 2+ + H 2 O
Y = NH 3, shpejtësitë py janë të afërta.
Studimi i mekanizmave të reaksioneve të zëvendësimit në komplekset e shumë metaleve është vetëm në fazën fillestare. Informacion gjithëpërfshirës është marrë vetëm për komplekset katror-planare të platinit dhe komplekset oktaedrale të kromit (III) dhe kobaltit (III). Mund të konsiderohet e vendosur fort se në komplekset e platinit (II), zëvendësimi ndodh sipas mekanizmit shoqërues (A, Ia) përmes një gjendje të ndërmjetme ose kalimtare në formën e një bipiramide trigonale. Komplekset oktaedrale të kobaltit (III) reagojnë në mënyrë disociative (mekanizmat D, I d). Shembuj specifikë të reaksioneve të tilla do të merren parasysh gjatë përshkrimit të kimisë së këtyre elementeve.
Reaksionet redoks. Shumica e proceseve redoks janë një kombinim kompleks i fazave elementare individuale, secila prej të cilave përfshin transferimin e një ose, shumë më rrallë, të dy elektroneve. Transferimi i njëkohshëm i një numri më të madh elektronesh në tretësirë është i pamundur.
Transferimi me një elektron mund të ndodhë përmes njërit prej dy mekanizmave: sferës së jashtme, domethënë me anë të tunelit, ose sferës së brendshme, përmes një ligandi lidhës. Mekanizmi intrasferik realizohet në komplekse që përmbajnë halide, jone hidroksid dhe grupe karboksil që mund të veprojnë si ura midis metaleve. Një shembull është reaksioni midis joneve pentamine klorokobalt (III) dhe heksaakakrom (II). Procesi mund të ndahet përafërsisht në tre faza: formimi i një kompleksi heterometalik me një jon klorur lidhës, transferimi i elektroneve dhe zbërthimi i kompleksit urë. Joni 2+ që rezulton, duke qenë i paqëndrueshëm, shndërrohet menjëherë në një kompleks ujor dhe inerti [(H 2 O) 5 CrCl] 2+ nuk ndërvepron me ujin:

Nëse nuk ka grimca në sistem që mund të veprojnë si ura, procesi vazhdon në sferën e jashtme:
2+ + 3+ = 3+ + 2+ .
Është veçanërisht e nevojshme të theksohen reaksionet e shtimit oksidativ dhe eliminimit reduktiv, të diskutuara në kapitullin 6.
Reaksionet e ligandëve të koordinuar. Ky grup reaksionesh përfshin proceset e modifikimit të ligandëve të koordinuara nga një jon metalik. Për shembull, komplekset diketonate, si diketonet e lira, mund të nitratohen, acilohen ose halogjenohen. Shembulli më interesant dhe i pazakontë i reagimeve të ligandëve të koordinuar është sinteza e shabllonit- një metodë unike e "montimit" të një ligandi në një jon metalik. Një shembull është sinteza e ftalocianineve nga nitrili i acidit ftalik, i cili ndodh në prani të joneve të bakrit (II), dhe sinteza e një baze makrokociklike Schiff nga 2-aminobenzaldehidi, i cili ndodh në prani të joneve të nikelit (II):

Në mungesë të metalit, procesi vazhdon në një rrugë tjetër, dhe produkti i dëshiruar është i pranishëm vetëm në një sasi të vogël në përzierjen e reaksionit. Joni metalik vepron në sintezën e shabllonit si një matricë ("shabllon"), duke stabilizuar një nga produktet që janë në ekuilibër me njëri-tjetrin dhe duke e zhvendosur ekuilibrin drejt formimit të tij. Për shembull, në reaksionin X + Y ¾® formohet një përzierje e produkteve A dhe B, në të cilën mbizotëron B, e cila ka një energji më të ulët. Në prani të një joni metalik, substanca A mbizotëron në produktet e reaksionit në formën e një kompleksi me M (Fig. 1.40. Diagrami energjetik i bashkëveprimit të X dhe Y në mungesë të një joni metalik (majtas) dhe në të. prania (b)).
Pyetje dhe detyra
1. Cili nga komponimet e mëposhtme ka strukturë perovskite? BaTiO 3, LiNbO 3, LaCrO 3, FeTiO 3, Na 2 WO 4, CuLa 2 O 4, La 2 MgRuO 6. Tabela e rrezeve jonike është dhënë në shtojcë. Mbani në mend se në fazat komplekse të oksidit, pozicionet B mund të përmbajnë katione të dy metaleve të ndryshme.
2. Duke përdorur TCP, përcaktoni nëse spinelet e mëposhtëm do të jenë të drejtë ose të përmbysur: ZnFe 2 O 4, CoFe 2 O 4, Co 3 O 4, Mn 3 O 4, CuRh 2 O 4.
3. Jon tiocianate SCN - ka dy qendra dhuruese - të forta dhe të buta. Parashikoni se çfarë strukture do të kenë komplekset tiocianate të kalciumit dhe bakrit(I). Pse nuk është e mundur të merret tiocianat bakri (II)?
4. Spektri i aquajonit Cr 2+ (termi i gjendjes bazë 5 D) ka dy breza (Fig. 1.41. Spektri i joneve akuatike Cr 2+), megjithëse midis termave të gjendjeve më të afërta të ngacmuara nuk ka asnjë me të njëjtën shumësi. Çfarë e shpjegon këtë? Çfarë ngjyre ka ky jon?
5. Duke përdorur vlerat Δο më poshtë, llogaritni ESC për komplekset e mëposhtme në kJ/mol:
(a) 2–, Δο = 15000 cm–1,
(b) 2+, Δο = 13000 cm–1,
(c) 2–, Δο (për 4–)= 21000 cm–1,
Merrni energjinë e çiftëzimit të barabartë me 19000 cm –1, 1 kJ/mol = 83 cm –1. Llogaritni momentet magnetike të tyre (komponenti i rrotullimit).
6. Duke përdorur TCP, shpjegoni pse joni CN – reagon me jonin heksakuanikel (III) për të formuar heksacianoferrat (II), dhe me jonin heksakuanikel (II) për të formuar tetracianonikkelat (II).
7. Më poshtë janë konstantat e reaksionit për zëvendësimin sekuencial të ujit në kompleksin ujorë të bakrit(II) me amoniak: K 1 = 2´10 4 , K 2 = 4´10 3 , K 3 = 1´10 3 , K 4 = 2´10 2, K5 = 3´10 –1, K6<< 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. Si ndryshon ngurtësia e kationeve kur lëvizin përgjatë një rreshti 3d? A është kjo në përputhje me rendin e ndryshimit në konstantet e qëndrueshmërisë së komplekseve (seri Irving-Williams, Fig. 1.34).
9. Shpjegoni pse joni hekzakuatik (III) është i pangjyrë dhe tretësirat e kripërave të hekurit (III) janë të ngjyrosura.
10. Sugjeroni një mekanizëm për reaksionin 3– + 3– = 4– + 2–, nëse dihet se futja e jonit tiocianat në tretësirë çon në një ndryshim në shpejtësinë e reaksionit dhe shpejtësia është praktikisht e pavarur nga prania e amoniakut. Jepni një shpjegim për këto fakte.
Koncepti i ndryshimeve në strukturën elektronike të joneve të metaleve në tranzicion nën veprimin e fushës elektrike të grimcave të ngarkuara që i rrethon u propozua nga Becquerel dhe u zhvillua më tej nga H.A. Bethe dhe J. Van Vleck në fillim XX V. Këto koncepte u zbatuan në përshkrimin e strukturës elektronike dhe vetive të komponimeve komplekse vetëm në mes XX shekulli nga H. Hartmann dhe modeli u quajt “teoria e fushës kristalore” (CFT).
Dispozitat bazë të TCH për komplekset e tranzicionit d metalet Fig. 24):
1. - Kompleksi ekziston dhe është i qëndrueshëm për shkak të ndërveprimit elektrostatik të agjentit kompleks me ligandët.
2. - Ligandët konsiderohen pa marrë parasysh strukturën e tyre elektronike si ngarkesa pikash ose dipole.
3. - Nën ndikimin e fushës elektrike të ligandëve, valenca degjenerohet pesëfish ( n -1) d orbitalet ndahen në varësi të simetrisë së mjedisit të ligandit.
4. - Shpërndarja e elektroneve të valencës metalike ndërmjet ndarjes ( n -1) d orbitalet varet nga raporti i energjisë së çiftëzimit dhe energjisë së ndarjes.
Merrni parasysh, për shembull, ndryshimin në energjinë e pesëfishtë të degjeneruar ( n -1) d orbitalet e jonit metalik qendror M n+ , e vendosur në qendër të koordinatave, nën ndikimin e fushës oktaedrale të ligandëve të ngarkuar negativisht [ ML 6] z , të vendosura në akset koordinative (Fig. 25). Si rezultat i zmbrapsjes së elektroneve të valencës së metalit nga ligandët e ngarkuar negativisht me një shpërndarje uniforme të ngarkesës negative rreth metalit (fushë elektrike sferike simetrike), energjia e të pesë d orbitalet do të rriten me sasinë E 0 në krahasim me M të lirë n+ jon. Sepse d orbitalet kanë orientime të ndryshme hapësinore, atëherë me përqendrimin e ngarkesave negative në ligandët e vendosur në akset koordinative, rritja e energjisë së tyre ndryshon. Nxitja e Energjisë d z 2 dhe d x 2- y 2 orbitalet e drejtuara drejt ligandëve në akset koordinative kanë një rritje më të madhe të energjisë dxy, dxz dhe dyz orbitalet e drejtuara ndërmjet boshteve koordinative.
Energjia e ndarjespesëfish i degjeneruar ( n -1) orbitalet në degjenerim të dyfishtë d x 2- y 2, z 2 orbitalet dhe degjenerohen trefish d xy, xz, yz orbitalet quhen (Fig. 26) Parametri i ndarjes së fushës së kristalit. Që nga energjia e ndarjes d orbitalet në fushën oktaedrale të ligandëve nuk ndryshojnë në krahasim me fushën elektrike sferike simetrike, pastaj rritja e energjisë së të dyve d x 2- y 2, z 2 orbitalet ndodhin në 0.6D 0 dhe një rënie në energjinë e tre d xy , xz , yz orbitalet me 0,4 D 0 .
Për të treguar shkallën e degjenerimit dhe simetrisë së orbitaleve metalike të ndara nën ndikimin e fushës elektrike të ligandëve, përdoren simbole të veçanta. Degjenerim i trefishtë dhe simetrik në lidhje me qendrën e simetrisë dhe rrotullimit rreth boshteve koordinative d xy , xz , yz t 2 g ", ndërsa dyfish i degjeneruar dhe gjithashtu simetrik në lidhje me qendrën e simetrisë d x 2- y 2, z 2 orbitalet përcaktohen me simbolin " p.sh " Kështu, nën ndikimin e fushës elektrike oktaedrale të ligandëve, degjenerohet pesëfish ( n -1) d orbitalet e agjentit kompleks ndahen ne ato te trefishta dhe dyfish te degjeneruara te energjive te ndryshme t 2 g dhe e g orbitale.
Një konsideratë e ngjashme e ndryshimit të energjisë së pesëfishtë të degjeneruar ( n -1) d orbitalet e një joni të lirë metalik në një mjedis tetraedral të ligandëve në [ ML 4 ]z komplekset tregon (Fig. 27) ndarjen e tyre gjithashtu në dyfish (e) dhe trefish ( t ) orbitalet e degjeneruara, megjithatë, me pozicion të kundërt të energjisë. Abonim " g " kur caktohet "e" dhe " t » orbitalet nuk tregohen pasi kompleksi tetraedral nuk ka një qendër simetrie. Një ulje e numrit të ligandëve të një kompleksi tetrahedral në krahasim me një kompleks oktaedral çon në një ulje natyrale të parametrit të ndarjes së fushës kristalore:D T = 4/9 D RRETH .
Zvogëlimi i simetrisë së mjedisit ligand të metalit, për shembull, shtrembërimi tetragonal i tetëkëndëshit [ ML 6] z komplekset e lidhura me shtrirjen e lidhjeve metal-ligand me ligandë boshtore [ ML 4 X 2 ] z dhe formimi në rastin kufizues të rrafsh-katrorit [ ML 4 ]z komplekse, çon (Fig. 28) në ndarje shtesë të valencës ( n -1) d orbitalet metalike.
Mbushja e ndarjes ( n -1) d orbitalet metalike ndodhin në përputhje me parimet e Paulit dhe energjinë minimale. Për komplekset oktaedrale me d 1, d 2 dhe d 3 konfigurimi elektronik i metalit, elektronet valente, në përputhje me rregullin e Hundit, popullohen t 2 g orbitale me rrotullime paralele, që çojnë në t 2 g 1, t 2 g 2 dhe t 2 g 3 struktura elektronike e komplekseve.
Për metalet me d 4 konfigurimi elektronik, tre elektrone gjithashtu popullohen t 2 g orbitale me rrotullime paralele. Popullsia e elektronit të katërt varet nga kostot e energjisë për vlerën e energjisë së çiftëzimit spin (E sp.-sp.) gjatë popullimit t 2 g orbitale me rrotullim antiparalel dhe shkelje të rregullit të Hundit, ose tejkalim i energjisë së ndarjes nga fusha kristaloreD o pas check-in p.sh orbitale me rrotullim paralel në përputhje me rregullin e Hundit. Në rastin e parë, formohet një kompleks me t 2 g 4 Struktura elektronike dhe shumëfishimi i reduktuar i rrotullimit në krahasim me metalin e lirë 2 S +1 = 3 (S - rrotullimi total), i quajtur me rrotullim të ulët. Kur rregulli i Hundit plotësohet dhe elektroni i katërt popullohet p.sh orbitalet, formohet një kompleks me t 2 g 3 e g 1 struktura elektronike dhe shumëfishi i rrotullimit të lirë si metal 2 S +1 = 5. Komplekse të tilla quhen me rrotullim të lartë.
Në mënyrë të ngjashme, kur shpërndahet valenca d5, d6 dhe d7 elektronet metalike t 2 g dhe p.sh orbitalet e komplekseve oktadrik në varësi të raportit E sp.-sp. DheD O Formimi i dy llojeve të komplekseve është i mundur:
Në E sp.-sp. > D O Formohen komplekse me rrotullim të lartë me strukturë elektronike të metalit t 2 g 3 e g 2 , t 2 g 4 e g 2 , t 2 g 5 e g 2 sipas rregullit të Hundit dhe shumëfishimit të rrotullimit të lirë të ngjashëm me metalin - 2 S +1 = 6, 5, 4;
E sp.-sp.< D O Formohen komplekse me rrotullim të ulët me strukturë elektronike të metalit t 2 g 5 e g 0 , t 2 g 6 e g 0 , t 2 g 6 e g 1 dhe shumëfishim më i ulët i rrotullimit në krahasim me metalin e lirë 2 S +1 = 2, 1, 2.
Komplekset metalike me d 8, d 9 dhe d 10 konfigurimi elektronik karakterizohet nga një lloj i shpërndarjes së elektroneve - t 2 g 6 e g 2 , t 2 g 6 e g 3 , t 2 g 6 e g 4 me shumësi rrotullimi të ngjashme me metalin e lirë: 2 S +1 = 3, 2 dhe 0.
Pra parametriD, duke karakterizuar ndarjen ( n -1) d orbitalet metalike nën ndikimin e fushës elektrike të ligandëve është një nga karakteristikat kryesore të ndryshimeve në vetitë e komplekseve në krahasim me një jon metalik të lirë. Është vlera e parametritDpërcakton për një numër konfigurimesh elektronike të metalit përcakton mundësinë e formimit të komplekseve me rrotullim të lartë ose të ulët me shpërndarje të ndryshme elektronesh mbi orbitalet e ndarë dhe veti të ndryshme.
Vlera e parametrit të ndarjes së fushës kristaloreDvaret nga natyra e metalit të agjentit kompleks, ligandët që e rrethojnë atë dhe pozicioni i tyre hapësinor rreth agjentit kompleks:
1. Ligandet sipas rendit të rritjes së parametritDpër komplekset e të njëjtit metal dhe strukturës së ngjashme gjeometrike janë të vendosura në të ashtuquajturat seri spektrokimike: une -< Br - < Cl - < F - < OH - < C 2 O 4 2- ~ H 2 O < NCS - < NH 3 ~ En < NO 2 - < CN - < CO . Në fillim të rreshtit ka ligandë "fushë të dobët" - jone halide, jone hidroksid dhe oksalate, ujë, të cilët formojnë komplekse kryesisht me rrotullim të lartë. Ligandët në anën e djathtë të serisë: jonet e monoksidit të karbonit, cianidit dhe nitritit quhen ligandë "të fushës së lartë" dhe karakterizohen në mënyrë tipike nga formimi i komplekseve me rrotullim të ulët. Për ligandët në mes të serisë - joni tiocianat, amoniaku, etilendiamina, në varësi të natyrës së metalit, formohen komplekse me rrotullim të lartë ose të ulët.
2. Rritja e efikasitetit të fushës elektrike të ligandëve në d orbitalet metalike me rritjen e madhësisë së tyre në rreshtin 3 d<< 4 d < 5 d , si dhe një rritje në shkallën e oksidimit të metalit çon në një rritje të parametritD në serinë: Mn(II)< Ni (II ) < Co (II ) < Fe (II ) < V (II ) < Fe (III ) < Co (III ) < Mn (IV ) < Mo (III ) < Rh (III ) < Ru (III ) < Pd (IV ) < Ir (III ) < Pt (IV ).
3. Parametri Dpër komplekset tetraedrale është vetëm 4/9 e parametritDkomplekset oktaedrale.
Komplekse "të rënda" 4 d dhe 5 d metalet, pothuajse pavarësisht nga natyra e ligandëve, formojnë komplekse kryesisht me rrotullim të ulët, ndërsa formimi i komplekseve me rrotullim të ulët ose të lartë është "i lehtë" 3 d metalet përcaktohet kryesisht nga forca e fushës së ligandit.
Në ndryshim nga MMS, teoria e fushës kristalore për të justifikuar ndryshimin në vetitë magnetike të komplekseve të të njëjtit jon metalik me mjedise të ndryshme ligande, për shembull, diamagnetike [ Fe(CN ) 6 ] 4- dhe paramagnetike [ Fe(H2O ) 6 ] 2+ nuk përdor hipotezën e tyre intraorbitale ( d 2 sp 3 hibridizimi) dhe orbital i jashtëm ( sp 3 d 2 hibridizimi) struktura. Dallimi në vetitë magnetike përcaktohet nga natyra me rrotullim të ulët dhe të lartë të shpërndarjes së elektroneve 6 valente. Fe (II ) me ndarje t 2 g dhe p.sh orbitalet (Fig. 29). Duke qenë ligandë të fortë dhe të dobët të fushës, formohen jonet e cianidit dhe molekulat e ujit Fe (II ) komplekset me rrotullim të ulët dhe të lartë me t 2 g 6 e g 0 dhe t 2 g 4 e g 2 shpërndarja e elektroneve, e cila përcakton diamagnetizmin [ Fe(CN ) 6 ] 4- dhe paramagnetizmi [ Fe(H2O ) 6 ] 2+ komplekse.
Ndarja e pesëfishtë të degjeneruar ( n -1) d orbitalet metalike në komplekse dhe ndryshimet e parametraveDnë varësi të natyrës së ligandëve, ai përcakton ngjyrën karakteristike të komplekseve si në gjendje të ngurtë ashtu edhe në tretësirë. Kur kompleksi thith rrezatimin elektromagnetik në rajonin e dukshëm të spektrit (400-750) nm, energjia e kuanteve të të cilit është E e barabartë me vlerën D, transferimi i elektroneve ndodh nga t 2 g në p.sh orbitalet. Është rrezatimi elektromagnetik i paabsorbuar i zonës së dukshme të spektrit që përcakton ngjyrën e kompleksit në përputhje me "rrethin e ngjyrave të Njutonit" (Fig. 30), duke treguar ngjyrat primare dhe dytësore të rrezatimit të dukshëm.
Aquacomplex titan ( III) [Ti (H 2 O) 6] 3+ c t 2 g 1 e g 0 shpërndarja elektronike si rezultat i fotoeksitimit, që korrespondon me kalimin e elektronit në energji më të lartë e g orbitale:
3+ (t 2g 1 e g 0) + hn= * 3+ (t 2g 0 e g 1)
thith kuantet e dritës në rajonin e verdhë të spektrit, gjë që çon në ngjyrën e tij vjollce. Një ndryshim në mjedisin e ligandit të jonit metalik në përputhje me pozicionin e ligandit në serinë spektrokimike çon në një ndryshim të parametritDdhe, si pasojë e kësaj, në një ndryshim në energjinë dhe gjatësinë e valës së kuanteve të zhytur nga kompleksi dhe në ngjyrën karakteristike të kompleksit - për shembull, në serinë [ CuCl 4 ] 2- , [ Cu (H 2 O ) 4 ] 2+ , [ Cu (NH 3 ) 4 ] 2+ ngjyra e komplekseve ndryshon nga jeshile në blu dhe vjollcë.
Së bashku me energjinë e ndarjes së fushës kristaloreD, gjithashtu luan një rol të rëndësishëm në TCH energjia e stabilizimit të fushës kristalore(ESKP) - fitimi i energjisë gjatë shpërndarjes së elektroneve midis atyre të ndarë në kompleks ( n -1) d orbitalet metalike krahasuar me energjinë e pesëfishtë të degjenerimit ( n -1) d orbitalet metalike në një fushë elektrike sferike ekuivalente (Fig. 31, 32).
ESCP e komplekseve oktadral dhe tetrahedral.|
Mn+ |
Komplekset oktaedrale |
Komplekset tetraedrale |
|
|
Rrotullim i ulët |
Rrotullim i lartë |
Rrotullim i lartë |
|
|
0.4 D o |
0.6 D T |
||
|
0.8 D o |
1.2 D T |
||
|
1.2 D o |
0.8 D T |
||
|
d 4 |
1.6 D o |
0.6 D o |
0.4 D T |
|
d 5 |
2.0 D o |
0 D o |
0 D T |
|
d 6 |
2.4 D o |
0.4 D o |
0.6 D T |
|
d 7 |
1.8 D o |
0.8 D o |
1.2 D T |
|
d 8 |
1.2 D o |
0.8 D T |
|
|
d 9 |
0.6 D o |
0.4 D T |
|
|
d 10 |
0 D o |
||
Një vlerësim i vlerës EXP të kompleksit merret në bazë të diagrameve të ndarjes ( n -1) d orbitalet metalike në fushën elektrike të ligandëve, që tregojnë një ulje ose rritje të energjisë së sistemit në krahasim me një fushë elektrike sferike kur elektronet popullohen ndahen ( n -1) d orbitalet. Për oktaedralin [ ML 6] z komplekset (Fig. 32) popullata e çdo elektroni t 2 g orbitalet çojnë në një fitim të energjisë së sistemit me 0.4D oh, check-in p.sh kërkon shpenzim energjetik 0.6D O . Për tetraedralin [ ML 4 ]z komplekse me pozicione të kundërta energjetike e dhe t orbitalet metalike - pushtimi i çdo elektroni me ndarje e dhe t orbitalet shoqërohen me një ulje dhe rritje të energjisë së sistemit me 0.6D t dhe 0.4 D T .
Duke qenë një reflektim i stabilitetit termodinamik të komplekseve, vlerësimet e vlerave të tyre ESCR janë në përputhje me të dhënat eksperimentale mbi ndryshimet në energjinë e rrjetës kristalore për komplekset heksafluoride me rrotullim të lartë 3 d metale (Fig. 33).
Vlerat ESC na lejojnë të përcaktojmë izomerin më të preferuar të koordinimit (Fig. 34), për shembull [ Cu (NH 3 ) 6 ][ NiCl 4 ] ose [ Ni (NH 3 ) 6 ][ CuCl 4 ]. Për ta bërë këtë, llogaritni ndryshimin në ESC për kationin kompleks dhe anionin e izomerëve. Vlera ESCR [ Cu (NH 3 ) 6 ] 2+ dhe [NiCl 4 ] 2- është 0,6 D o dhe 0.8 D T përkatësisht. Duke marrë parasysh atëD t = 4/9 D o , ndryshimi midis vlerave ESCP [ Cu (NH 3 ) 6 ] 2+ dhe [NiCl 4 ] 2- do të jetë 19/45D o . Në mënyrë të ngjashme, vlerat e ESKP [ Ni (NH 3 ) 6 ] 2+ dhe [CuCl 4 ] 2- është 1,2 D o dhe 0.4 D T , dhe diferenca mes tyre është 28/45D o . Diferenca e madhe kation kompleks ESCP [ Ni (NH 3 ) 6 ] 2+ dhe anionin [CuCl 4 ] 2- krahasuar me [ Cu (NH 3 ) 6 ] 2+ dhe [NiCl 4 ] 2- tregon një formim më të preferuar të izomerit të përbërjes [ Ni (NH 3 ) 6 ][ CuCl 4 ].
Së bashku me vetitë magnetike dhe optike të ndikimit të strukturës elektronike të metalit në stabilitetin termodinamik të komplekseve, TKP parashikon një shtrembërim të strukturës gjeometrike të komplekseve me një shpërndarje të pabarabartë të elektroneve mbi ndarjen ( n -1) d orbitalet metalike (Fig. 35). Në ndryshim nga struktura e rregullt oktaedrale [ Co (CN) 6 ] 3- s t 2 g 6 e g 0 shpërndarja elektronike, shtrembërimi tetragonal i një kompleksi të ngjashëm [ Cu (CN) 6 ] 4- s t 2 g 6 e g 3 shpërndarje elektronike që përmban 3 elektrone në degjenerim 2-fish p.sh orbitalet, çon në shndërrimin efektiv të oktaedralit në një kompleks katror-planar:
4- = 2- + 2CN - .
Të gjitha sa më sipër tregojnë se thjeshtësia relative dhe aftësitë e gjera të TCT për shpjegimin dhe parashikimin e vetive fiziko-kimike të komplekseve përcaktojnë popullaritetin e madh të këtij modeli për përshkrimin e lidhjeve kimike në përbërjet komplekse. Në të njëjtën kohë, duke u fokusuar në ndryshimet në strukturën elektronike të metalit gjatë formimit të kompleksit, TCP nuk merr parasysh strukturën elektronike të ligandëve, duke i konsideruar ato si ngarkesa negative pikash ose dipole. Kjo çon në një numër kufizimesh të TCP kur përshkruan strukturën elektronike të komplekseve. Për shembull, në kuadrin e TCP është e vështirë të shpjegohet pozicioni i një numri ligandësh dhe metalesh në seritë spektrokimike, i cili shoqërohet me një shkallë të caktuar kovalence dhe mundësinë e formimit të lidhjeve të shumta metal-ligand. Këto kufizime eliminohen kur merret parasysh struktura elektronike e përbërjeve komplekse duke përdorur metodën më komplekse dhe më pak vizuale të orbitaleve molekulare.
Teoria e lidhjes së valencës ishte e para nga teoritë mekanike kuantike të përdorura për të shpjeguar përafërsisht natyrën e lidhjeve kimike në përbërjet komplekse. Zbatimi i saj bazohej në idenë e mekanizmi dhurues-pranues formimi i lidhjeve kovalente midis ligandit dhe agjentit kompleks. Ligand numëron grimca dhuruese, të aftë për të transferuar një palë elektrone pranues – agjent kompleksues, i cili siguron qeliza kuantike të lira (orbitalet atomike) të niveleve të saj të energjisë për formimin e lidhjeve.
Për formimin e lidhjeve kovalente midis agjentit kompleks dhe ligandëve, është e nevojshme që bosh s-, fq- ose d-orbitalet atomike të agjentit kompleks kanë pësuar hibridizimi një lloj të caktuar. Orbitalet hibride zënë një pozicion të caktuar në hapësirë, dhe numri i tyre korrespondon me numri i koordinimit agjent kompleksues.
Kjo ndodh shpesh duke kombinuar elektrone të paçiftuara agjent kompleksues në çifte, i cili lejon lirimin e një numri të caktuar të qelizave kuantike - orbitaleve atomike, të cilat më pas marrin pjesë në hibridizimin dhe formimin e lidhjeve kimike.
Çiftet e vetme të elektroneve të ligandëve ndërveprojnë me orbitalet hibride të agjentit kompleks, dhe mbivendosje orbitalet përkatëse të agjentit kompleks dhe ligandit me shfaqjen e densitetit të rritur të elektroneve në hapësirën ndërbërthamore. Çiftet elektronike të agjentit kompleks, nga ana tjetër, ndërveprojnë me orbitalet atomike vakante të ligandit, forcimi i lidhjes nëpërmjet mekanizmit dhanor. Kështu, lidhja kimike në përbërjet komplekse është e zakonshme kovalente lidhje e mjaftueshme të qëndrueshme Dhe energjikisht të favorshme.
Çiftet e elektroneve të vendosura në orbitalet hibride të agjentit kompleks priren të zënë një pozicion në hapësirë në të cilën zmbrapsja e tyre reciproke është minimale. Kjo çon në strukturën jonet dhe molekulat komplekse duket se janë në një varësi të caktuar nga lloji i hibridizimit.
Le të shqyrtojmë formimin e disa komplekseve nga këndvështrimi i teorisë së lidhjeve të valencës. Para së gjithash, vërejmë se orbitalet e valencës së atomeve të agjentëve kompleks janë të afërt në energji:
E (n- 1)d » E ns » E n.p. » E nd
|
Lloji i hibridizimit |
Gjeometria e kompleksit |
||
|
lineare |
-
|
||
|
trekëndëshi |
- |
||
|
katërkëndësh |
2-
|
||
|
2-
|
|||
|
sp 3 d(z 2) |
bipiramida trigonale |
||
|
sp 3 d(x 2 - y 2) |
piramidë katrore |
3-
|
|
|
sp 3 d 2 , |
3+ |
||
|
sp 3 d 3 |
bipiramida pesëkëndëshe |
4-
|
Për shembull, kationi 2+ përfshin agjentin kompleksues zink(II). Predha elektronike e këtij joni konvencional ka formulën 3 d 10 4s 0 4fq 0 dhe mund të përshkruhet në mënyrë konvencionale si më poshtë:
Vend i lirë 4 s- dhe 4 fq-orbitalet e atomit të zinkut (II) formojnë katër sp Orbitalet 3 hibride të orientuara drejt kulmeve të tetraedrit.
Çdo molekulë amoniaku ka një palë të vetme elektronesh në atomin e azotit. Orbitalet e atomeve të azotit që përmbajnë çifte të vetme elektronesh mbivendosen me sp 3-Orbitale hibride të zinkut (II), duke formuar një kation kompleks tetraedral të zinkut tetraaminë (II) 2+:
Meqenëse joni 2+ nuk ka elektrone të paçiftuar, ai shfaqet diamagnetike Vetitë.
Joni tetrakloromanganat (II) 2- përmban pesë elektrone të paçiftuara për 3 d-orbitalet dhe të lira 4 s- dhe 4 fq-orbitalet. Formohen orbitalet vakante sp 3-orbitale hibride që mbivendosen me fq- orbitalet atomike të joneve të klorurit: 
Joni tetraedral 2- i përftuar kështu është paramagnetike, pasi përmban pesë elektrone të paçiftuara.
Përdorimi i një algoritmi konvencional të parashikimit lloji i hibridizimit të orbitaleve atomike në kuadrin e metodës së lidhjes valente mund të përcaktohet gjeometria e komplekseve me përbërje të ndryshme. Për ta bërë këtë, para së gjithash, është e nevojshme të shkruhet formula elektronike për nivelin e valencës dhe të ndërtohet një diagram i shpërndarjes së elektroneve mbi qelizat kuantike. Për shembull, për një atom nikel neutral:

Tranzicioni 4 s-elektrone për 3 d-transformimet e nënnivelit paramagnetike Atomi Ni 0 in diamagnetike grimca Ni*: 
Orbitalet vakante që rezultojnë i nënshtrohen hibridizimit, duke formuar një konfigurim tetraedral. E ndërtuar kështu tetraedral diamagnetike Kompleksi tetrakarbonilnikeli (CN = 4), i cili karakterizohet nga qëndrueshmëri e konsiderueshme.
Nëse agjenti kompleks është nikeli (II) me konfigurim elektronik 3 d 8 4s 0 4fq 0, atëherë nevoja për të lëvizur elektronet nga 4 s-Nënniveli përpara se hibridizimi të zhduket, pasi ka një numër të mjaftueshëm orbitalesh vakante për të realizuar numrin e koordinimit 4: 
Kjo strukturë ka një të paqëndrueshme paramagnetike kompleks tetrabromonikolat(II)-jon 2-. Megjithatë, kur kombinohen dy elektrone 3 d-Nënniveli në një çift dhe shndërrimi i njërës prej qelizave kuantike të këtij nënniveli në një të zbrazët ndryshon si llojin e hibridizimit ashtu edhe karakteristikat e kompleksit që rezulton: 
Lloji i hibridizimit dsp 2 dhe forma planare katrore e kompleksit realizohen me formimin e një stalle diamagnetike kompleks tetracianokolat(II)-jon 2- (CN = 4): 
Nëse sinteza e kompleksit të cianidit kryhet në kushte të ligandit të tepërt, mund të realizohet një numër koordinimi prej 5: 
E qëndrueshme diamagnetike Kompleksi pentacianokolat(II)-jon 3- ka formën e një piramide katrore: 
Kompleksi oktaedral nikel(II) 2+, megjithëse paramagnetike, por mjaft e qëndrueshme. Arsimi i tij është për shkak sp 3 d 2 -hibridizimi i orbitaleve atomike të nikelit: 
Nëse orbitalet atomike të jashtme d-nënnivel, kompleks, si rregull, në një masë të madhe paramagnetike dhe quhet e jashtme-orbitale ose me rrotullim të lartë. Struktura e komplekseve të tilla mund të korrespondojë me llojin e hibridizimit, për shembull, sp 3 d 2 .
Komplekse të tilla, gjatë formimit të të cilave bëhet hibridizimi me pjesëmarrjen e orbitaleve atomike të jashtme d-quhen nënnivele intra-orbitale ose me rrotullim të ulët dhe, si rregull, diamagnetike ose pak paramagnetike(të gjitha ose pothuajse të gjitha elektronet e agjentit kompleks janë çiftuar, dhe lloji i hibridizimit, p.sh. d 2 sp 3 ose dsp 2).
Gjatë ekzaminimit të komplekseve të hekurit (II), gjenden komplekse orbitale të jashtme dhe intraorbitale.


Diagrami më poshtë tregon se si janë formuar paramagnetike me rrotullim të lartë heksafluoroferrat (II)-jon 4- dhe diamagnetike me rrotullim të ulët jon hekscianoferrat (II) 4-.
Vetë teoria e lidhjeve të valencës nuk i përgjigjet pyetjes se çfarë lloj kompleksi formohet në secilin rast specifik, pasi kjo metodë nuk merr parasysh ndikimin e natyrës së ligandit. Prandaj, metoda e lidhjes së valencës duhet domosdoshmërisht të plotësohet me të dhëna për vetitë magnetike të kompleksit ose informacione mbi ndikimin e ligandit në natyrën e kompleksit të formuar.
.Teoria e fushës së kristalit zëvendësoi teorinë e lidhjeve të valencës në vitet 40 të shekullit të 20-të. Në formën e tij të pastër, aktualisht nuk përdoret, pasi nuk mund të shpjegojë formimin e lidhjeve kovalente në komponime komplekse dhe nuk merr parasysh gjendjen e vërtetë të ligandëve (për shembull, madhësitë e tyre aktuale) edhe në rastin e ndërveprimeve të afërta. thjesht elektrostatike.
Tashmë në mesin e viteve 50, teoria e thjeshtuar e fushës kristalore u zëvendësua nga një e përmirësuar teoria e fushës së ligandit, duke marrë parasysh natyrën kovalente të lidhjeve kimike midis agjentit kompleks dhe ligandit.
Megjithatë, qasja më e përgjithshme për shpjegimin e formimit të komponimeve komplekse jepet nga teoria molekulare orbitale(MO), e cila aktualisht mbizotëron mbi të gjitha të tjerat. Metoda orbitale molekulare siguron si ndërveprim thjesht elektrostatik në mungesë të orbitaleve atomike të mbivendosura, ashtu edhe të gjithë grupin e shkallëve të ndërmjetme të mbivendosjes.
Le të shohim konceptet themelore teoria e fushës kristalore, e cila, si teoria e lidhjeve valente, ruan ende rëndësinë e saj për përshkrimin cilësor të lidhjeve kimike në përbërjet komplekse për shkak të thjeshtësisë dhe qartësisë së saj të madhe.
Në teorinë e fushës kristalore, merret parasysh lidhja kimike midis agjentit kompleks dhe ligandit elektrostatike. Sipas kësaj teorie, ligandët janë të vendosur rreth agjentit kompleks në kulmet e poliedrave të rregullt ( poliedra) si tarifat me pikë. Teoria nuk merr parasysh vëllimin aktual të ligandit.
Ligandët, si ngarkesat me pikë, krijojnë rreth agjentit kompleks fushë elektrostatike("fushë kristalore", nëse marrim parasysh një kristal të një përbërje komplekse, ose fushë ligand), në të cilin nivelet e energjisë së agjentit kompleks dhe, mbi të gjitha, d-nënnivele po ndahen, dhe energjia e tyre ndryshon. Natyra e ndarjes, energjia e niveleve të reja të energjisë varet nga simetri rregullimi i ligandëve (oktaedral, tetraedral ose fushë tjetër kristalore). Kur molekulat H 2 O, NH 3 , CO dhe të tjera koordinohen si ligandë, ato konsiderohen si dipole, i orientuar me ngarkesë negative ndaj agjentit kompleks.
Le të shqyrtojmë rastin e një rregullimi oktaedral të ligandëve (për shembull, 3- ose 3+). Në qendër të oktaedrit ndodhet një atom kompleks M(+n) me elektrone në d-orbitalet atomike, dhe në kulmet e saj ka ligandë në formën e ngarkesave negative të pikës (për shembull, jonet F- ose molekula polare si NH 3). Në një jon konvencional M(+n) që nuk shoqërohet me ligandë, energjitë e të pesëve d-AO janë të njëjta (d.m.th. orbitalet atomike i degjeneruar).
Megjithatë, në fushën oktaedrale të ligandëve d-AO-të e agjentit kompleksues bien në të pabarabartë pozicion. Orbitalet atomike d(z 2) dhe d(x 2 -
y 2), të zgjatura përgjatë boshteve koordinative, afrohen më shumë me ligandët. Ndërmjet këtyre orbitaleve dhe ligandëve të vendosur në kulmet e oktaedrit, lindin dallime të rëndësishme forcat refuzuese, duke çuar në një rritje të energjisë orbitale. Me fjalë të tjera, këto orbitale atomike i nënshtrohen ekspozimi maksimal ndaj fushës së ligandit. Një burim i ngjeshur fort mund të shërbejë si një model fizik i një ndërveprimi të tillë. 

Tre të tjera d-AO - d(xy), d(xz) Dhe d(yz), të vendosura midis boshteve të koordinatave dhe ndërmjet ligandëve, janë në një distancë më të madhe prej tyre. Ndërveprimi i të tillëve d-AO me ligandë është minimale, prandaj edhe energjia d(xy), d(xz) Dhe d(yz)-AO zvogëlohet në krahasim me origjinalin. 

Kështu, pesëfish degjeneruar d-Agjent kompleksues AO, duke u futur fushë ligand oktaedral, i ekspozuar ndarja në dy grupe orbitalesh të reja - orbitale të degjeneruara trefish me energji më të ulët, d(xy), d(xz) Dhe d(yz), Dhe orbitale të dyfishta të degjeneruara me energji më të lartë d(z 2) dhe d(x 2 -
y 2). Këto grupe të reja d-orbitalet me më të ulëta Dhe energji më të lartë tregojnë d e dhe d g: 
Diferenca e energjisë dy nënnivele të reja d e dhe d g mori emrin parametri i ndarjes D0:
E 2 – E 1 = D0
Vendndodhja e dy te reja nënnivelet e energjisë d e dhe d g në krahasim me origjinalin ( d-AO) në diagramin e energjisë asimetrike:
(E 2 – E 0) > (E 0 – E 1).
Teoria mekanike kuantike e kërkon atë kur nivelet e reja të energjisë janë të mbushura plotësisht me elektrone, energjia totale mbetet e pandryshuar, d.m.th. ajo duhet të qëndrojë e barabartë me E 0 .
Me fjalë të tjera, barazia duhet të plotësohet
4(E 2 – E 0) = 6(E 0 – E 1),
ku 4 dhe 6 - maksimale numri i elektroneve për d g - dhe d e -AO. Nga kjo barazi rrjedh se
(E 2 – E 0) / (E 0 – E 1) = 3/2 dhe
(E 2 – E 1) / (E 0 – E 1 >) = 5/2, ose
D0/( E 0 – E 1) = 5/2, prej nga ( E 0 – E 1) = 2/5 ´ D 0 >. Vendosja e çdo elektroni nga gjashtë maksimumi i mundshëm në d e-orbitalet shkakton zvogëlohet (fitimet) energji me 2/5 D 0 . Përkundrazi, vendosja e çdo elektroni nga katër të mundshme në d g orbitalet shkaktojnë rrit (kosto) energji me 3/5 D 0 . Nëse popullohet me elektrone d e - dhe d g -orbitalet plotësisht, atëherë jo duke fituar energji nuk do të(ashtu siç nuk do të jetë konsumi shtesë i energjisë): 4 ´ 3/5 ´ D 0 - 6 ´ 2/5 ´ D 0 = 0. Por nëse origjinali d-AO është e populluar vetëm pjesërisht dhe përmban nga 1 deri në 6 elektrone, dhe këto elektrone vendosen vetëm në d e -AO, atëherë marrim fitim i konsiderueshëm i energjisë. Specifikimi i secilit ligand ndikon në fushën që krijon ky ligand - të fortë ose i dobët. Si fushë më e fortë ligandët se më shumë kuptimi parametri i ndarjes D0. Studimi i parametrit të ndarjes zakonisht bazohet në spektroskopike kërkimore. Gjatesite valore brezat e përthithjes komplekset l në gjendje kristalore ose në tretësirë, për shkak të kalimit të elektroneve nga d e - ndezur d g-AO, lidhur me parametri i ndarjes D 0 si më poshtë: n = 1/l; D ku është konstanta e Plankut h e barabartë me 6.626 ´ 10 - 34 J. s; Parametri i ndarjes, përveç llojit të ligandit, varet mbi shkallën e oksidimit Dhe natyrës agjent kompleksues. Në rritje e ngarkesës bërthamore i atomit kompleks formues D 0 rritet gjithashtu. Hexaamminiridium (III) 3+, hexaamminiridium (III) 3+, dhe heksaamminiridium (III) 3+ katione ( Z= 27, 45 dhe 77) karakterizohen nga parametra ndarës të barabartë me 22900, 34100 dhe 41000 cm -1. Varësia e D0 nga natyra e ligandëve është më e larmishme. Si rezultat i studimit të përbërjeve të shumta komplekse, u zbulua se për sa i përket aftësisë së tyre për të rritur parametrin e ndarjes së metaleve komplekse të vendosura në gjendjet e tyre të zakonshme të oksidimit, ligandët më të zakonshëm mund të renditen në vijim. seri spektrokimike, përgjatë së cilës vlera e D 0 rritet në mënyrë monotonike: Kështu, fusha elektrostatike më e fortë rreth agjentit kompleks dhe ndarja më e fortë d-AO shkaktohet nga ligandët NO 2, CN -
dhe CO. Le të shqyrtojmë mbi shpërndarjen e elektroneve d e - dhe d g-orbitalet në fushën oktaedrale të ligandëve. Regjistrimi d e - dhe d g-orbitalet ndodh në përputhje të plotë me Rregulli i Hundit Dhe Parimi Pauli. Në këtë rast, pavarësisht nga vlera e parametrit të ndarjes, tre elektronet e para janë të zëna nga qelizat kuantike. d e-niveli: Nëse numri i elektroneve për d- Ekzistojnë më shumë se tre nënnivele të agjentit kompleks; ekzistojnë dy mundësi për vendosjen e tyre në nënnivele të ndara. Në një vlerë të ulët të parametrit të ndarjes (fusha e dobët e ligandëve), elektronet kapërcejnë pengesën e energjisë që ndan d e - dhe d g-orbitalet; elektroni i katërt dhe më pas i pesti popullojnë qelizat kuantike d g-nënnivel. Me një fushë të fortë ligande dhe një vlerë të lartë D0, popullsia është e populluar nga elektronet e katërt dhe të pestë d g-nënniveli i përjashtuar; plotësimi në progres d e-orbitalet. Në ligandët e dobët të fushës duke populluar qelizat kuantike me 4 ose 5 elektrone rrotullime paralele, kështu që kompleksi që rezulton rezulton të jetë i fortë paramagnetike. Në një fushë të fortë ligande një dhe më pas formohen dy çifte elektronike në d e -nënnivel, pra paramagnetizmi kompleksi rezulton të jetë shumë më i dobët. Elektroni i gjashtë, i shtatë dhe i tetë në rastin e një fushe të dobët përfundojnë përsëri d e-nënniveli, duke plotësuar konfigurimet për çiftet e elektroneve (një në rast d 6, dy - d 7 dhe tre - d 8): Në rastin e një fushe të fortë ligande, elektroni i gjashtë popullohet d e -AO, që çon në diamagnetizëm kompleks, pas së cilës kalojnë elektronet e shtatë dhe të tetë d g-nënnivel: Natyrisht, me një konfigurim me tetë elektrone dallimet në strukturë ndërmjet komplekseve me ligandë i dobët Dhe fushat e forta zhduken. Okupimi i orbitaleve nga elektroni i nëntë dhe i dhjetë gjithashtu nuk ndryshon për komplekset e të dy llojeve: Le të kthehemi në shqyrtimin e strukturës elektronike të joneve komplekse tetëedrale 3+ dhe 3-. Sipas vendndodhjes në seritë spektrokimike, amoniaku NH 3 është një nga ligandët fushë e fortë
, dhe jon fluori F - – fushë e dobët
. Rrjedhimisht, pushtimi i orbitaleve atomike nga elektronet në këto komplekse do të ndodhë sipas skemës së mëposhtme: Në anionin 3, ligandët F- krijojnë një fushë të dobët kristalore (D 0 = 13000 cm - 1), dhe të gjitha elektronet e origjinalit 3 d 6 -SH.A. ndodhen në d e - dhe d g orbitale pa asnjë çiftim. Një jon kompleks është me rrotullim të lartë dhe përmban katër elektrone të paçiftëzuara, pra paramagnetike. Në jonin 3+, ligandët NH 3 krijojnë një fushë të fortë kristalore (D 0 = 22900 cm - 1), të gjitha 3 d 6 -elektronet vendosen në një më të favorshëm energjikisht d e-orbitalet. Transferimi i elektroneve nga d e - ndezur d g-orbitalet e pamundur sepse gjithashtu pengesë e lartë e energjisë. Prandaj, ky kation kompleks është rrotullim i ulët, nuk përmban elektrone të paçiftuara dhe diamagnetike. Në mënyrë të ngjashme, mund të paraqiten skemat për shpërndarjen e elektroneve mbi orbitalet në një fushë oktaedrale për jonet 2+ dhe 4-: Ligandët H 2 O krijojnë një fushë të dobët; shkëmbimi i elektroneve ndërmjet d e - dhe d g-orbitalet nuk shkakton ndonjë vështirësi dhe për këtë arsye numri i elektroneve të paçiftuara në jonin kompleks është i njëjtë si në jonin konvencional Fe + II. Kompleksi aku që rezulton është me rrotullim të lartë, paramagnetik. Shumë komponime komplekse në gjendje kristalore dhe tretësirë ujore janë me ngjyra të ndezura. Kështu, një tretësirë ujore që përmban 2+ katione ngjyroset me ngjyrë blu intensive, 3+ katione i japin tretësirës një ngjyrë vjollcë dhe 2+ katione i japin një ngjyrë të kuqe. Teoria e fushës kristalore bën të mundur shpjegimin e shfaqjes së një ngjyre ose një tjetër në përbërjet komplekse. Nëse drita kalon nëpër një tretësirë ose kampion kristalor të një lënde pjesë e dukshme e spektrit, atëherë, në parim, tre opsione për sjelljen fizike të kampionit janë të mundshme: nuk ka thithje të dritësçdo gjatësi vale (mostra e substancës pa ngjyrë, megjithëse mund të ketë breza absorbues në rajonin ultravjollcë të spektrit); thithjen e plotë të dritës në të gjithë gamën e gjatësisë valore (kampioni do të shfaqet e zezë); më në fund, thithjen e dritës vetëm gjatësi vale të caktuar(atëherë mostra do të ketë ngjyra plotësuese e absorbuar pjesë e ngushtë e spektrit). Kështu, përcaktohet ngjyra e tretësirës ose e kristaleve frekuenca e brezave të përthithjes drita e dukshme: Thithja e kuanteve të dritës nga komplekset (për shembull, ato me një strukturë oktaedrale) shpjegohet nga ndërveprimi i dritës me elektronet e vendosura në d e-nënniveli, i shoqëruar me kalimin e tyre në orbitalet vakante d g-nënnivel. Për shembull, kur kaloni dritën përmes një tretësire ujore që përmban katione heksaquatitanium (III) 3+, një brez absorbimi i dritës zbulohet në rajonin e verdhë-jeshile të spektrit (20300 cm - 1, l » 500 nm). Kjo është për shkak të kalimit të elektronit të vetëm të agjentit kompleks nga d e-AO në d g-nënnivel: Prandaj, një zgjidhje që përmban 3+ fiton një ngjyrë vjollce (përveç ngjyrës së verdhë-jeshile të zhytur). Një tretësirë e kripës së vanadiumit Cl 3 është e gjelbër. Kjo është edhe për shkak të tranzicionit përkatës të elektroneve kur thithin një pjesë të energjisë së rrezes së dritës. Në gjendjen bazë, me konfigurimin elektronik të vanadiumit (III) 3 d 2, dy elektrone të paçiftuara janë të zëna d e-niveli: Eshte vetem dy opsione për kalimin e dy elektroneve në d g -nënnivel: ose të dyja elektronet janë të zëna d g -AO, ose vetëm një prej tyre. Ndalohet çdo tranzicion tjetër i elektroneve që shoqërohet me një ulje të rrotullimit total. Nëse agjenti kompleksues ka një konfigurim elektronik d 0 ose d 10 atëherë tranzicionet e elektroneve Me d e - ndezur d g -nënnivel ose anasjelltas e pamundur qoftë sepse mungesa e elektroneve, qoftë sepse mungesa e orbitaleve vakante. Prandaj, tretësirat e komplekseve me agjentë të tillë kompleksues si Sc(III), Cu(I), Zn(II), Cd(II), etj., nuk thithin energji në pjesën e dukshme të spektrit dhe shfaqen pa ngjyrë: Selektiviteti i përthithjes së dritës varet jo vetëm nga agjent kompleksues Dhe gjendjen e tij të oksidimit, por edhe nga lloji i ligandëve. Kur zëvendësohen ligandët në anën e majtë të serisë spektrokimike në një përbërje komplekse me ligandë që krijojnë të fortë fushë elektrostatike e vëzhguar rrit fraksioni i energjisë së përthithur nga elektronet nga drita e transmetuar dhe, si pasojë, zvogëlohet gjatësia e valës së brezit përkatës të absorbimit. Kështu, një tretësirë ujore që përmban katione tetraakuakakri (II) 2+ është blu, dhe një tretësirë e sulfatit tetraaminebakrit (II) 2+ është shumë blu. ________________________ Përsëriteni: >>> Aplikacionet
Fitimi i energjisë për shkak të zgjidhje prioritare elektronet d quhen orbitalet e-atomike energjia e stabilizimit të kompleksit nga fusha ligande.
shpejtësia e dritës Me
= 3 ´ 10 10 cm/s.
Njësia D 0 është e njëjtë me atë të numrit të valës n: cm - 1, që përafërsisht korrespondon me 12 J/mol.
Në përbërjet komplekse që përfshijnë agjentë kompleksues të së njëjtës periudhë dhe në të njëjtën gjendje oksidimi, me të njëjtat ligandë, parametri i ndarjes është afërsisht i njëjtë. Me rritjen e shkallës së oksidimit të agjentit kompleks, vlera e D 0 rritet. Kështu, për komplekset akua 2+ dhe 2+, vlera e parametrit të ndarjes është 7800 dhe 10400 cm - 1, dhe për 3+ dhe 3+ - 13700 dhe 21000 cm - 1, përkatësisht.
I-Br - Kl - » NCS - JO 3 - F -Oh - H2O » H - NH 3 JO 2 -CN - "JO" CO. 









Në të kundërt, CN - ligandët shkaktojnë ndarje të konsiderueshme d-AO, në shumën 33000 cm - 1. Kjo do të thotë se ka një të fortë tendenca për të shpërndarë të gjitha elektronet në d e-orbitalet. Fitimi i Energjisë, e marrë me një popullsi të tillë orbitalesh, është shumë më e madhe se kostot e energjisë për shkak të çiftëzimit të elektroneve.


Kalimet e treguara të elektroneve që kanë marrë energji të tepërt korrespondojnë me brezi i përthithjes rreth 400 nm në spektrin e absorbimit të një tretësire të klorurit heksaquavanadium (III). Thithja e rajonit vjollcë-vjollcë të spektrit i jep një ngjyrë shtesë zgjidhjes - jeshile e ndezur.

Dhe John Van Vleck për të përshkruar gjendjet më të ulëta të kationeve të metaleve në tranzicion të rrethuar nga ligandë - si anione ashtu edhe molekula neutrale. Teoria e fushës kristalore u kombinua [dhe u rafinua] më tej me teorinë e orbitës molekulare (të delokalizuar) në një teori më të përgjithshme që merr parasysh kovalencën e pjesshme të lidhjes metal-ligand në përbërjet koordinuese.
Teoria e fushës kristalore lejon që dikush të parashikojë ose interpretojë spektrat e përthithjes optike dhe spektrat e rezonancës paramagnetike të elektroneve të kristaleve dhe komponimeve komplekse, si dhe entalpitë e hidratimit dhe stabilitetit në tretësirat e komplekseve të metaleve në tranzicion.
Rishikimi i teorisë së fushës së kristalit[ | ]
Sipas TCP, ndërveprimi midis një metali në tranzicion dhe ligandëve lind nga tërheqja midis kationit të metalit të ngarkuar pozitivisht dhe ngarkesës negative të elektroneve në orbitalet jolidhëse të ligandit. Teoria e konsideron ndryshimin në energjinë e pesë të degjeneruar d-orbitalet e rrethuara nga ngarkesat pikësore të ligandëve. Ndërsa ligandi i afrohet jonit metalik, elektronet e ligandit bëhen më afër disave d-orbitalet se të tjerët, duke shkaktuar një humbje të degjenerimit. Elektronet d-orbitalet dhe ligandët sprapsin njëri-tjetrin si ngarkesa me të njëjtën shenjë. Kështu, energjia e atyre d-elektronet që janë më afër ligandës bëhen më të larta se ato që janë më larg, gjë që çon në një ndarje të niveleve të energjisë d-orbitalet.
Faktorët e mëposhtëm ndikojnë në ndarjen:
- Natyra e jonit metalik.
- Shkalla e oksidimit të metalit. Sa më e lartë të jetë gjendja e oksidimit, aq më e lartë është energjia e ndarjes.
- Rregullimi i ligandëve rreth një joni metalik.
- Natyra e ligandëve që rrethojnë jonin metalik. Sa më i fortë të jetë efekti i ligandëve, aq më i madh është ndryshimi midis niveleve të energjisë së lartë dhe të ulët.
Lloji më i zakonshëm i koordinimit të ligandit është oktaedral, në të cilën gjashtë ligandë krijojnë një fushë kristalore me simetri tetëedrale rreth jonit metalik. Në mjedisin oktaedral të një joni metalik me një elektron në shtresën e jashtme, orbitalet d ndahen në dy grupe me një ndryshim në nivelet e energjisë Δ oct ( energjia e ndarjes), ndërsa energjia e orbitaleve dxy, dxz Dhe d yz do të jetë më e ulët se d z 2 dhe d x 2 -y 2, pasi orbitalet e grupit të parë janë të vendosura më larg nga ligandët dhe përjetojnë më pak zmbrapsje. Tre orbitalet me energji të ulët janë caktuar si t 2 g, dhe dy me të lartë - si p.sh.
Më të zakonshmet e radhës janë tetraedral komplekse në të cilat katër ligandë formojnë një tetraedron rreth një joni metalik. Në këtë rast d-orbitalet ndahen gjithashtu në dy grupe me një ndryshim në nivelet e energjisë Δ tetr. Ndryshe nga koordinimi oktaedral, orbitalet do të kenë energji të ulët d z 2 dhe d x 2 -y 2, dhe e lartë - d xy , d xz Dhe d yz. Për më tepër, meqenëse elektronet e ligandëve nuk janë drejtpërdrejt në drejtim d-orbitalet, energjia e ndarjes do të jetë më e ulët se me koordinimin oktaedral. Duke përdorur TCP mund të përshkruani gjithashtu plano-katrore dhe gjeometri të tjera kompleksesh.
Dallimi në nivelet e energjisë Δ midis dy ose më shumë grupeve të orbitaleve varet gjithashtu nga natyra e ligandëve. Disa ligandë shkaktojnë më pak ndarje se të tjerët, arsyet për të cilat shpjegohen. Seritë spektrokimike- një listë e fituar eksperimentalisht e ligandëve, e renditur në rend rritës Δ:
Gjendja e oksidimit të metalit ndikon gjithashtu στο Δ. Një metal me një gjendje më të lartë oksidimi tërheq ligandët më afër për shkak të një ndryshimi më të madh të ngarkesës. Ligandët më afër jonit metalik shkaktojnë më shumë ndarje.
Komplekset me rrotullim të ulët dhe të lartë[ | ]
Ligandët që shkaktojnë ndarje të madhe d-nivelet, të tilla si CN− dhe CO, quhen ligandë fushë e fortë. Në komplekset me ligandë të tillë, është e pafavorshme që elektronet të zënë orbitale me energji të lartë. Rrjedhimisht, orbitalet me energji të ulët mbushen plotësisht përpara se orbitalet me energji të lartë të fillojnë të mbushen. Komplekse të tilla quhen me rrotullim të ulët. Për shembull, NO 2 - është një ligand me fushë të lartë që prodhon ndarje të madhe. Te gjitha 5 d-elektronet e jonit oktaedral 3− do të vendosen në nivelin më të ulët t 2g .
Në të kundërt, ligandët që shkaktojnë ndarje të vogël, të tilla si I− dhe Br−, quhen ligandë. fushë e dobët. Në këtë rast, është më e lehtë të vendosësh elektrone në orbitale me energji të lartë sesa të vendosësh dy elektrone në të njëjtën orbitale me energji të ulët, sepse dy elektrone në të njëjtën orbitale sprapsin njëri-tjetrin dhe kostoja e energjisë e vendosjes së një elektroni të dytë në orbital është më e lartë se Δ. Kështu, përpara se të shfaqen elektronet e çiftëzuara, në secilën prej pesë d-orbitalet duhet të vendosen një elektron në një kohë në përputhje me rregullin e Hundit. Komplekse të tilla quhen me rrotullim të lartë. Për shembull, Br− është një ligand me fushë të dobët që shkakton pak ndarje. Te gjitha 5 d-orbitalet e jonit 3−, i cili gjithashtu ka 5 d-elektronet do të jenë të zëna nga një elektron.
Energjia e ndarjes për komplekset tetraedrale Δ tetr është afërsisht e barabartë me 4/9Δ tetor (për të njëjtin metal dhe ligandë). Si rezultat, ndryshimi në nivelet e energjisë d-orbitalet janë zakonisht nën energjinë e çiftëzimit të elektroneve, dhe komplekset tetraedrale janë zakonisht me spin të lartë.
Diagramet e shpërndarjes d-elektronet bëjnë të mundur parashikimin e vetive magnetike të përbërjeve koordinuese. Komplekset me elektrone të paçiftuara janë paramagnetike dhe tërhiqen nga një fushë magnetike, ndërsa komplekset pa janë diamagnetike dhe zmbrapsen dobët.
Energjia e stabilizimit të fushës kristalore[ | ]
Energjia e stabilizimit të fushës kristalore (CFE) është energjia e konfigurimit elektronik të një joni metalik në tranzicion në raport me energjinë mesatare të orbitaleve. Stabilizimi ndodh për shkak të faktit se në fushën e ligandit niveli i energjisë i disa orbitaleve është më i ulët se në një fushë hipotetike sferike, në të cilën të pesë d-orbitalet kanë të njëjtën forcë refuzuese dhe të gjitha d-orbitalet janë të degjeneruara. Për shembull, në rastin oktaedral niveli t 2 g më e ulët se niveli mesatar në një fushë sferike. Rrjedhimisht, nëse këto orbitale përmbajnë elektrone, atëherë joni metalik është më i qëndrueshëm në fushën e ligandit në krahasim me fushën sferike. Përkundrazi, niveli i energjisë i orbitaleve p.sh mbi mesataren, dhe elektronet që përmbahen në to reduktojnë stabilizimin.
Energjia e stabilizimit nga fusha oktaedrale
Ekzistojnë tre orbitale në një fushë tetëedrale t 2 g stabilizuar në raport me nivelin mesatar të energjisë me 2/5 oktavë Δ, dhe dy orbitalet p.sh destabilizuar me 3/5 Δ tetor. Më sipër ishin shembuj të dy konfigurimeve elektronike d 5 . Në shembullin e parë, ekziston një kompleks me rrotullim të ulët 3− me pesë elektrone brenda t 2 g. ESP-ja e tij është 5 × 2 / 5 Δ tetor = 2Δ tetor. Në shembullin e dytë, një kompleks me rrotullim të lartë 3− me ESKP (3 × 2 / 5 Δ oct) − (2 × 3 / 5 Δ oct) = 0. Në këtë rast, efekti stabilizues i elektroneve në orbitalet e nivelit të ulët neutralizohet nga efekti destabilizues i elektroneve në orbitalet e nivelit të lartë.
Diagramet e ndarjes së nivelit d nga një fushë kristali[ | ]
| oktaedral | pentagonal-bipiramidal | katror-antiprizmatik |
|---|---|---|
Teoria e fushës së kristalit zëvendësoi teorinë e lidhjeve të valencës në vitet 40 të shekullit të 20-të. Në formën e tij të pastër, aktualisht nuk përdoret, pasi nuk mund të shpjegojë formimin e lidhjeve kovalente në komponime komplekse dhe nuk merr parasysh gjendjen e vërtetë të ligandëve (për shembull, madhësitë e tyre aktuale) edhe në rastin e ndërveprimeve të afërta. thjesht elektrostatike.
Tashmë në mesin e viteve 50, teoria e thjeshtuar e fushës kristalore u zëvendësua nga një e përmirësuar teoria e fushës së ligandit, duke marrë parasysh natyrën kovalente të lidhjeve kimike midis agjentit kompleks dhe ligandit.
Megjithatë, qasja më e përgjithshme për shpjegimin e formimit të komponimeve komplekse jepet nga teoria molekulare orbitale(MO), e cila aktualisht mbizotëron mbi të gjitha të tjerat. Metoda orbitale molekulare siguron si ndërveprim thjesht elektrostatik në mungesë të orbitaleve atomike të mbivendosura, ashtu edhe të gjithë grupin e shkallëve të ndërmjetme të mbivendosjes.
Le të shohim konceptet themelore teoria e fushës kristalore, e cila, si teoria e lidhjeve valente, ruan ende rëndësinë e saj për përshkrimin cilësor të lidhjeve kimike në përbërjet komplekse për shkak të thjeshtësisë dhe qartësisë së saj të madhe.
Në teorinë e fushës kristalore, merret parasysh lidhja kimike midis agjentit kompleks dhe ligandit elektrostatike. Sipas kësaj teorie, ligandët janë të vendosur rreth agjentit kompleks në kulmet e poliedrave të rregullt ( poliedra) si tarifat me pikë. Teoria nuk merr parasysh vëllimin aktual të ligandit.
Ligandët, si ngarkesat me pikë, krijojnë rreth agjentit kompleks fushë elektrostatike("fushë kristalore", nëse marrim parasysh një kristal të një përbërje komplekse, ose fushë ligand), në të cilin nivelet e energjisë së agjentit kompleks dhe, mbi të gjitha, d-nënnivele po ndahen, dhe energjia e tyre ndryshon. Natyra e ndarjes, energjia e niveleve të reja të energjisë varet nga simetri rregullimi i ligandëve (oktaedral, tetraedral ose fushë tjetër kristalore). Kur molekulat H 2 O, NH 3 , CO dhe të tjera koordinohen si ligandë, ato konsiderohen si dipole, i orientuar me ngarkesë negative ndaj agjentit kompleks.
Merrni parasysh rastin e një rregullimi oktaedral të ligandëve (për shembull, -3 ose 3+). Në qendër të oktaedrit ka një jon kompleks M(+ n) me elektrone në d-orbitalet atomike, dhe në kulmet e saj ka ligandë në formën e ngarkesave negative të pikës (për shembull, jonet F- ose molekula polare si NH 3). Në një jon konvencional M(+ n), që nuk shoqërohet me ligandë, energjitë e të pesë d-AO janë të njëjta (d.m.th. orbitalet atomike i degjeneruar).
Megjithatë, në fushën oktaedrale të ligandëve d-AO-të e agjentit kompleksues bien në të pabarabartë pozicion. Orbitalet atomike d(z 2) dhe d(x 2 -y 2), të zgjatura përgjatë boshteve të koordinatave, vijnë më afër ligandëve. Ndërmjet këtyre orbitaleve dhe ligandëve të vendosur në kulmet e oktaedrit, lindin dallime të rëndësishme forcat refuzuese, duke çuar në një rritje të energjisë orbitale. Me fjalë të tjera, këto orbitale atomike i nënshtrohen ekspozimi maksimal ndaj fushës së ligandit. Një burim i ngjeshur fort mund të shërbejë si një model fizik i një ndërveprimi të tillë.
Tre të tjera d-AO - d(xy), d(xz) Dhe d(yz), të vendosura midis boshteve të koordinatave dhe ndërmjet ligandëve, janë në një distancë më të madhe prej tyre. Ndërveprimi i të tillëve d-AO me ligandë është minimale, prandaj edhe energjia d(xy), d(xz) Dhe d(yz)-AO zvogëlohet në krahasim me origjinalin.
Kështu, pesëfish degjeneruar d-Agjent kompleksues AO, duke u futur fushë ligand oktaedral, i ekspozuar ndarja në dy grupe orbitalesh të reja - orbitale të degjeneruara trefish me energji më të ulët, d(xy), d(xz) Dhe d(yz), Dhe orbitale të dyfishta të degjeneruara me energji më të lartë d(z 2) dhe d(x 2 -y 2). Këto grupe të reja d-orbitalet me më të ulëta Dhe energji më të lartë tregojnë dε dhe dγ:
d(z 2) dhe d(x 2 -y 2)
d(xy), d(xz),d(yz)
Diferenca e energjisë dy nënnivele të reja dε dhe dγ u emërua parametri i ndarjes Δ 0:
E 2 – E 1 = Δ 0 ≈ 0
Vendndodhja e dy te reja nënnivelet e energjisë dε dhe dγ në krahasim me origjinalin ( d-AO) në diagramin e energjisë asimetrike:
(E 2 – E 0) > (E 0 – E 1).
Teoria mekanike kuantike e kërkon atë kur nivelet e reja të energjisë janë të mbushura plotësisht me elektrone, energjia totale mbetet e pandryshuar, d.m.th. ajo duhet të qëndrojë e barabartë me E 0 .
Me fjalë të tjera, barazia duhet të plotësohet
4(E 2 – E 0) = 6(E 0 – E 1),
ku 4 dhe 6 - maksimale numri i elektroneve për dγ- dhe dε-AO. Nga kjo barazi rrjedh se
(E 2 – E 0) / (E 0 – E 1) = 3/2 dhe
(E 2 – E 1) / (E 0 – E 1) = 5/2, ose
Δ 0 / ( E 0 – E 1) = 5/2, prej nga ( E 0 – E 1) = 2/5Δ 0 .
Vendosja e çdo elektroni nga gjashtë maksimumi i mundshëm në dε orbitalet shkaktojnë zvogëlohet (fitimet) energji me 2/5 Δ 0 .
Përkundrazi, vendosja e çdo elektroni nga katër të mundshme në d orbitalet γ shkaktojnë rrit (kosto) energji me 3/5 Δ 0 .
Nëse popullohet me elektrone dε- dhe dγ-orbitalet plotësisht, atëherë jo duke fituar energji nuk do të(ashtu siç nuk do të jetë konsumi shtesë i energjisë).
Por nëse origjinali d-AO është e populluar vetëm pjesërisht dhe përmban nga 1 deri në 6 elektrone, dhe këto elektrone vendosen vetëm në dε-AO, atëherë marrim fitim i konsiderueshëm i energjisë.
Fitimi i energjisë për shkak të zgjidhje prioritare elektronet d quhen orbitalet ε-atomike energjia e stabilizimit të kompleksit nga fusha ligande.
Specifikimi i secilit ligand ndikon në fushën që krijon ky ligand - të fortë ose i dobët. Si fushë më e fortë ligandët se më shumë kuptimi parametri i ndarjes Δ 0 .
Studimi i parametrit të ndarjes zakonisht bazohet në spektroskopike kërkimore. Gjatesite valore brezat e përthithjes komplekset në gjendje kristalore ose në tretësirë, për shkak të transferimit të elektroneve nga dε- on dγ-AO, i lidhur me parametri i ndarjesΔ 0 si më poshtë:
λ = c / ν; Δ 0 = E 2 – E 1 = h ν = h · ( c / λ),
ku është konstanta e Plankut h e barabartë me 6,6260693 ∙ 10 -34 J s;
shpejtësia e dritës Me
= 3 · 10 10 cm/s.
NjësiaΔ 0 është i njëjtë me numrin e valës: cm -1, që përafërsisht korrespondon me 12 J/mol. Parametri i ndarjes, përveç llojit të ligandit, varet mbi shkallën e oksidimit Dhe natyrës agjent kompleksues.
Në përbërjet komplekse që përfshijnë agjentë kompleksues të së njëjtës periudhë dhe në të njëjtën gjendje oksidimi, me të njëjtat ligandë, parametri i ndarjes është afërsisht i njëjtë. Me rritjen e shkallës së oksidimit të agjentit kompleks, vlera Δ 0 rritet. Kështu, për komplekset akua 2+ dhe 2+ vlera e parametrit të ndarjes është 7800 dhe 10400 cm -1, dhe për 3+ dhe +3 13700 dhe 21000 cm -1, përkatësisht. Në rritje e ngarkesës bërthamore i atomit kompleksformues Δ 0 rritet gjithashtu. Hexaamminiridium (III) 3+, hexaamminiridium (III) 3+, dhe heksaamminiridium (III) 3+ katione ( Z= 27, 45 dhe 77) karakterizohen nga parametra ndarës të barabartë me 22900, 34100 dhe 41000 cm -1.
Varësia e Δ 0 nga natyra e ligandëve është më e larmishme. Si rezultat i studimit të përbërjeve të shumta komplekse, u zbulua se për sa i përket aftësisë së tyre për të rritur parametrin e ndarjes së metaleve komplekse të vendosura në gjendjet e tyre të zakonshme të oksidimit, ligandët më të zakonshëm mund të renditen në vijim. seri spektrokimike, përgjatë së cilës vlera Δ 0 rritet në mënyrë monotonike:
I > Br > Cl > NCS - ≈ NO 3 - > F - > OH - > H 2 O > H - > NH 3 > NO 2 - > CN - > JO > CO.
Kështu, fusha elektrostatike më e fortë rreth agjentit kompleks dhe ndarja më e fortë d-AO shkaktohet nga ligandët CN-, NO dhe CO. Le të shqyrtojmë mbi shpërndarjen e elektroneve dε- dhe dγ-orbitalet në fushën oktaedrale të ligandëve. Regjistrimi dε- dhe dγ-orbitalet ndodh në përputhje të plotë me Rregulli i Hundit Dhe Parimi Pauli. Në këtë rast, pavarësisht nga vlera e parametrit të ndarjes, tre elektronet e para janë të zëna nga qelizat kuantike. dε-nënniveli:
![]() dε
dε
Nëse numri i elektroneve për d- Ekzistojnë më shumë se tre nënnivele të agjentit kompleks; ekzistojnë dy mundësi për vendosjen e tyre në nënnivele të ndara. Në një vlerë të ulët të parametrit të ndarjes (fusha e dobët e ligandëve), elektronet kapërcejnë pengesën e energjisë që ndan dε- dhe dγ-orbitalet; elektroni i katërt dhe më pas i pesti popullojnë qelizat kuantike dγ-nënnivel.
![]() dε
dε
Me një fushë të fortë ligande dhe një vlerë të lartë Δ 0, popullsia e elektroneve të katërt dhe të pestë dγ-nënniveli është i përjashtuar; plotësimi në progres dε-orbitalet.
![]() dε
dε
Në ligandët e dobët të fushës duke populluar qelizat kuantike me 4 ose 5 elektrone rrotullime paralele, kështu që kompleksi që rezulton rezulton të jetë i fortë paramagnetike. Në një fushë të fortë ligande një dhe më pas formohen dy çifte elektronike në dε-nënnivel, pra paramagnetizmi kompleksi rezulton të jetë shumë më i dobët. Elektroni i gjashtë, i shtatë dhe i tetë në rastin e një fushe të dobët përfundojnë përsëri dγ-nënnivel, duke plotësuar konfigurimet për çiftet e elektroneve (një në rast d 6, dy - d 7 dhe tre - d 8):
![]() dε
dε
Në rastin e një fushe të fortë ligande, elektroni i gjashtë popullohet dε-AO, duke çuar në diamagnetizëm kompleks, pas së cilës kalojnë elektronet e shtatë dhe të tetë dγ-nënnivel:
![]() dε
dε
Natyrisht, me një konfigurim me tetë elektrone dallimet në strukturë ndërmjet komplekseve me ligandë i dobët Dhe fushat e forta zhduken. Okupimi i orbitaleve nga elektroni i nëntë dhe i dhjetë gjithashtu nuk ndryshon për komplekset e të dy llojeve:
![]() dε
dε
Le të kthehemi në shqyrtimin e strukturës elektronike të joneve komplekse oktaedrale 3+ dhe -3. Sipas vendndodhjes në seritë spektrokimike, amoniaku NH 3 është një nga ligandët fushë e fortë, dhe jon fluori F - – fushë e dobët. Në anionin -3, ligandët F- krijojnë një fushë të dobët kristalore (Δ 0 = 13000 cm -1), dhe të gjitha elektronet e origjinalit 3 d 6 -SH.A. ndodhen në dε- dhe d orbitale γ pa asnjë çiftim. Një jon kompleks është me rrotullim të lartë dhe përmban katër elektrone të paçiftëzuara, pra paramagnetike:

Në jonin 3+, ligandët NH 3 krijojnë një fushë të fortë kristalore (Δ 0 = 22900 cm -1), të gjitha 3 d 6 -elektronet vendosen në një më të favorshëm energjikisht dε-orbitalet. Transferimi i elektroneve nga dε- on dγ orbitale e pamundur sepse gjithashtu pengesë e lartë e energjisë. Prandaj, ky kation kompleks është rrotullim i ulët, nuk përmban elektrone të paçiftuara dhe diamagnetike:

Në mënyrë të ngjashme, mund të paraqiten skemat për shpërndarjen e elektroneve mbi orbitale në një fushë oktaedrale për jonet 2+ dhe -4:


Ligandët H 2 O krijojnë një fushë të dobët; shkëmbimi i elektroneve ndërmjet dε- dhe dγ-orbitalet nuk shkakton ndonjë vështirësi dhe për këtë arsye numri i elektroneve të paçiftuara në jonin kompleks është i njëjtë si në jonin konvencional Fe + II. Kompleksi aku që rezulton është me rrotullim të lartë, paramagnetik.
Në të kundërt, CN - ligandët shkaktojnë ndarje të konsiderueshme d-AO, me vlerë 33000 cm -1. Kjo do të thotë se ka një të fortë tendenca për të shpërndarë të gjitha elektronet në dε-orbitalet. Fitimi i Energjisë, e marrë me një popullsi të tillë orbitalesh, është shumë më e madhe se kostot e energjisë për shkak të çiftëzimit të elektroneve.
Nga këndvështrimi i metodës së lidhjes së valencës, hibridizimi i orbitaleve të valencës që formojnë një lidhje në kompleksin ujor përfshin d-Nënniveli i jashtëm AO (4 sp 3 d 2), dhe në rrotullim të ulët - d-Nënniveli i brendshëm i SHA (3 d 2 4sp 3).
Kështu, në komplekset me spin të lartë me ligandë me fushë të dobët, hibridizimi ndodh me pjesëmarrje d-AO e nënnivelit të jashtëm, dhe me rrotullim të ulët me ligandë me fushë të lartë - d- SHA të nënnivelit të brendshëm. Numri i elektroneve të paçiftuara në kompleks mund të përcaktohet nga rezonanca paramagnetike e elektroneve (EPR). Duke përdorur instrumente të kësaj metode, të quajtur spektrometra EPR, studiohen substancat paramagnetike.
Teoria e fushës kristalore bën të mundur shpjegimin e shfaqjes së një ngjyre ose një tjetër në përbërjet komplekse. Ndër komponimet komplekse, një numër i konsiderueshëm në gjendjen kristalore dhe tretësirën ujore dallohen nga ngjyra e tyre e ndritshme. Kështu, një tretësirë ujore që përmban 2+ katione ngjyroset intensivisht blu, 3+ katione i japin tretësirës një ngjyrë vjollce dhe 2+ katione i japin asaj një ngjyrë të kuqe. Nëse drita kalon nëpër një tretësirë ose kampion kristalor të një lënde pjesë e dukshme e spektrit, atëherë, në parim, tre opsione për sjelljen fizike të kampionit janë të mundshme: nuk ka thithje të dritësçdo gjatësi vale (mostra e substancës pa ngjyrë, megjithëse mund të ketë breza absorbues në rajonin ultravjollcë të spektrit); thithjen e plotë të dritës në të gjithë gamën e gjatësisë valore (kampioni do të shfaqet e zezë); më në fund, thithjen e dritës vetëm gjatësi vale të caktuar(atëherë mostra do të ketë ngjyra plotësuese e absorbuar pjesë e ngushtë e spektrit).

Kështu, përcaktohet ngjyra e tretësirës ose e kristaleve frekuenca e brezave të përthithjes dritë e dukshme. Thithja e kuanteve të dritës nga komplekset (për shembull, ato me një strukturë oktaedrale) shpjegohet nga ndërveprimi i dritës me elektronet e vendosura në dε-nënnivel, shoqëruar me kalimin e tyre në orbitale vakante dγ-nënnivel. Për shembull, kur kaloni dritën nëpër një tretësirë ujore që përmban katione heksaquatitanium (III) 3+, një brez absorbues drite zbulohet në rajonin e verdhë-jeshile të spektrit (20300 cm -1, λ=500 nm). Kjo është për shkak të kalimit të elektronit të vetëm të agjentit kompleks nga dε-AO on dγ-nënnivel:

Prandaj, një zgjidhje që përmban 3+ fiton një ngjyrë vjollce (përveç ngjyrës së verdhë-jeshile të zhytur). Një tretësirë e kripës së vanadiumit Cl 3 është e gjelbër. Kjo është edhe për shkak të tranzicionit përkatës të elektroneve kur thithin një pjesë të energjisë së rrezes së dritës. Në gjendjen bazë, me konfigurimin elektronik të vanadiumit (III) 3 d 2, dy elektrone të paçiftuara janë të zëna dε-nënniveli:

Eshte vetem dy opsione për kalimin e dy elektroneve në dγ-nënnivel: ose të dyja elektronet janë të zëna dγ-AO, ose vetëm një prej tyre. Ndalohet çdo tranzicion tjetër i elektroneve që shoqërohet me një ulje të rrotullimit total.
Kalimet e treguara të elektroneve që kanë marrë energji të tepërt korrespondojnë me brezi i përthithjes rreth 400 nm në spektrin e absorbimit të një tretësire të klorurit heksaquavanadium (III). Thithja e rajonit vjollcë-vjollcë të spektrit i jep një ngjyrë shtesë zgjidhjes - jeshile e ndezur. Nëse agjenti kompleksues ka një konfigurim elektronik d 0 ose d 10 atëherë tranzicionet e elektroneve Me dε- on dγ-nënnivel ose anasjelltas e pamundur qoftë sepse mungesa e elektroneve, qoftë sepse mungesa e orbitaleve vakante. Prandaj, zgjidhjet e komplekseve me agjentë komplekse si Sc(III) (3 d 0), Cu (I) (3 d 10), Zn(II) (3 d 10), Cd(II) (4 d 10), etj., nuk thithin energji në pjesën e dukshme të spektrit dhe shfaqen pa ngjyrë. Selektiviteti i përthithjes së dritës varet jo vetëm nga agjent kompleksues Dhe gjendjen e tij të oksidimit, por edhe nga lloji i ligandëve. Kur zëvendësohen ligandët në anën e majtë të serisë spektrokimike në një përbërje komplekse me ligandë që krijojnë të fortë fushë elektrostatike e vëzhguar rrit fraksioni i energjisë së përthithur nga elektronet nga drita e transmetuar dhe, si pasojë, zvogëlohet gjatësia e valës së brezit përkatës të absorbimit. Kështu, një tretësirë ujore që përmban katione tetraakuakakri (II) 2+ është blu, dhe një tretësirë e sulfatit tetraaminebakrit (II) 2+ është shumë blu.
Informacione të lidhura.