Asetilen uglevodorodlari (alkinlar). Kimyodan dars ishlanmasi (10-sinf) - Alkinlar. Asetilen, uni metan pirolizi va karbid usuli bilan olish. Asetilenning kimyoviy xossalari: yonishi, bromli suvning rangsizlanishi, vodorod xlorid qo'shilishi va hidratlanishi.
Tajriba sozlamalari va matn– fan nomzodi. Pavel Bespalov.
Asetilenning xlor bilan reaksiyasi
Silindrga oz miqdorda kaliy permanganat kristallarini to'kib tashlang va kaltsiy karbidining bir qismini tashlang. Keyin silindrga xlorid kislota quying. Idishda chaqnashlar kuzatiladi, silindrning devorlari kuyikish bilan qoplangan. Xlorid kislota kaliy permanganat bilan reaksiyaga kirishganda, xlor gazi ajralib chiqadi
16 HCI + 2KMnO 4 = 5CI 2 + 2 KCI + 2 MnCI 2 + 8H 2 O
Xlorid kislotasi bilan kaltsiy karbid asetilenni beradi
CaC 2 + 2HCI= C 2 H 2 + CaCI 2
Xlor va asetilen reaksiyaga kirishib, vodorod xlorid va uglerod hosil qiladi
C 2 H 2 + CI 2 = 2 C + 2 HC.I.
Uskunalar: silindr, spatula.
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling. Tajriba faqat tortish ostida amalga oshirilishi kerak. Tajribadan so'ng silindrni suv bilan to'ldiring.
Etilenning bromli suv bilan reaksiyasi
Biz etilenni etil spirti va konsentrlangan sulfat kislota aralashmasini qizdirish orqali olamiz. Chiqarilgan etilen bromning suvdagi eritmasidan o'tkaziladi, bu bromli suv deb ataladi. Bromli suv juda tez rangsizlanadi. Brom qo'sh bog'lanishda etilenga qo'shiladi. Bu 1,2-dibromoetan hosil qiladi.
CH 2 =CH 2 +Br 2 = CH 2 Br — CH 2 Br
Bromning suvli eritmasining rangsizlanish reaktsiyasi organik birikmalarning to'yinmaganligiga sifatli reaktsiya sifatida xizmat qiladi.
Uskunalar:
Xavfsizlik choralari.
Asetilenning bromli suv bilan reaksiyasi
Asetilen suvning kaltsiy karbidiga ta'sirida hosil bo'ladi. Chiqarilgan asetilenni bromli suvdan o'tkazamiz. Bromli suvning rangsizlanishini kuzatamiz. Brom uchlik bog'lanishda asetilenga qo'shiladi. Bunda molekulasida to'rtta brom atomi bo'lgan birikma - 1,1,2,2-tetrabrometan hosil bo'ladi.
CH ≡ CH + 2Br 2 = CHBr 2 — CHBr 2
Bromli suvning rangi o'zgarishi atsetilenning to'yinmaganligini isbotlaydi.
Uskunalar: Vurts kolbasi, ajratuvchi voronka, gaz chiqarish trubkasi, stakan yoki probirka, shtativ.
Xavfsizlik choralari. Tajriba tortish ostida o'tkazilishi kerak. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling.
Asetilenning kaliy permanganat eritmasi bilan reaksiyasi
Asetilen suvning kaltsiy karbidiga ta'sirida hosil bo'ladi. Asetilen kaliy permanganatning kislotalangan eritmasidan o'tkazilganda, biz eritmaning tez rangsizlanishini kuzatamiz. Asetilen oksidlanish mahsuloti, oksalat kislotasini hosil qilish uchun uchlik bog'lanish buzilgan joyda oksidlanadi. Ortiqcha kaliy permanganatda oksalat kislotasi karbonat angidrid va suvga oksidlanadi.
Kaliy permanganat eritmasining rangi o'zgarishi asetilenning to'yinmaganligidan dalolat beradi.
Uskunalar: Vurts kolbasi, ajratuvchi voronka, gaz chiqarish trubkasi, stakan, shtat.
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling.
Etilenning kaliy permanganat eritmasi bilan o'zaro ta'siri.
Biz etilenni etil spirti va konsentrlangan sulfat kislota aralashmasini qizdirish orqali olamiz. Chiqarilgan etilen bilan gaz chiqarish trubkasini kaliy permanganatning kislotali eritmasiga tushiramiz. Eritma tezda rangsizlanadi. Bunda etilen ikki atomli spirt etilen glikolga oksidlanadi.
CH 2 = CH 2 + [O] + H-OH =CH 2 U -CH 2 U
Bu reaktsiya qo'sh bog'lanishga sifatli reaktsiyadir.
Uskunalar: Vurts kolbasi, tushirish voronkasi, yuvish moslamasi, gaz chiqarish trubkasi, stakan yoki probirka, shtativ.
Xavfsizlik choralari.
Yonuvchan gazlar, konsentrlangan kislotalar va yonuvchan suyuqliklar bilan ishlash qoidalariga rioya qiling.
Asetilen va kislorod aralashmasining portlashi
Yontirilganda asetilen va kislorod aralashmasi katta kuch bilan portlaydi. Shuning uchun aralashmaning faqat kichik hajmlari bilan tajriba o'tkazish xavfsizdir - sovunli eritma bizga bu bilan yordam beradi. Suv va sovun eritmasi bilan chinni ohakga ozgina vodorod periks qo'shing. Olingan eritmaga katalizator, marganets dioksidi qo'shing. Kislorodning chiqishi darhol boshlanadi.
2H 2 O 2 = 2H 2 O + O 2
Ushbu aralashmaga kaltsiy karbidining kichik bo'lagini tushiring. Suv bilan reaksiyaga kirishganda u asetilen hosil qiladi.
CaC 2 + 2 H 2 O = C 2 H 2 + Ca(OH) 2
Eritma yuzasida sovun mavjudligi sababli, asetilen va kislorod aralashmasi bilan to'ldirilgan pufakchalar hosil bo'ladi. Pufakchalar yoqilganda, asetilen va kislorod aralashmasida kuchli portlashlar sodir bo'ladi.
Uskunalar: chinni ohak, mash'al.
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling. Aralashmaning faqat kichik hajmini yoqish mumkin.
Asetilenning yonishi
Kaltsiy karbid va suvdan asetilen olamiz. Kolbani gaz chiqarish trubkasi bo'lgan tiqin bilan yoping. Gaz chiqarish trubasining uchiga inyeksiya ignasi kiritiladi. Bir muncha vaqt o'tgach, atsetilen kolbadagi havoni to'liq siqib chiqargandan so'ng, biz chiqarilgan gazni yoqamiz. Asetilen oq, yorqin olov bilan yonadi. Asetilen yonganda karbonat angidrid va suv hosil bo'ladi.
2CH ≡ CH + 5O 2 → 4CO 2 + 2H 2 O
Probirkani yonayotgan asetilen alangasiga soling. Probirkada kuyik cho‘kadi. Kislorod etishmasligi bilan asetilen to'liq yonish uchun vaqt topa olmaydi va uglerodni kuyikish shaklida chiqaradi. Olovning yorqinligi asetilendagi uglerodning yuqori foizi va uning alangasining yuqori harorati bilan izohlanadi, unda yonmagan uglerod zarralari isitiladi.
Uskunalar: dumaloq tubli kolba, tibbiy shpritsdan igna bilan tiqin, shtativ.
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling. Asetilenni faqat tozalik uchun namuna olgandan keyin yoqish mumkin.
Etilenning yonishi
Biz etilenni etil spirti va konsentrlangan sulfat kislota aralashmasini qizdirish orqali olamiz. Aralash spirtning bir qismi va sulfat kislotaning uch qismidan tayyorlanadi. Sulfat kislota suvni olib tashlaydigan vosita rolini o'ynaydi. Aralash qizdirilganda etilen ajralib chiqadi.
C 2 H 5 OH = C 2 H 4 + H 2 O
Biz suvni almashtirish orqali etilenni silindrga yig'amiz. Etilen rangsiz gaz, suvda ozgina eriydi. Etilen havoda yonib, karbonat angidrid va suv hosil qiladi.
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
Uskunalar: Vurts kolbasi, ajratuvchi voronka, yuvish moslamasi, gaz chiqarish trubkasi, stend, ballon.
Xavfsizlik choralari. Yonuvchan gazlar, konsentrlangan kislotalar va yonuvchan suyuqliklar bilan ishlash qoidalariga rioya qiling.
Mis atsetilidini tayyorlash
Asetilen suvning kaltsiy karbidiga ta'sirida hosil bo'ladi. Asetilen molekulasidagi vodorod atomlari yuqori harakatchanlikka ega. Shuning uchun ular osongina metallar bilan almashtirilishi mumkin. Asetilenni mis (I) xloridning ammiak eritmasidan o'tkazamiz. Mis (I) atsetilidning qizil cho'kmasi hosil bo'ladi.
CH ≡ CH + 2CuCI → CuC ≡ CCu ↓ + 2 HCI
Uskunalar:
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling. Faqat oz miqdorda mis asetilidini oling. Quritilgan mis atsetilid juda xavfli portlovchi moddadir. Konsentrlangan xlorid kislotasi bilan ishlov berish orqali yo'q qilinadi.
Kumush atsetilidni tayyorlash
Asetilen suvning kaltsiy karbidiga ta'sirida hosil bo'ladi. Asetilen molekulasidagi vodorod atomlari yuqori harakatchanlikka ega. Shuning uchun ular osongina metallar bilan almashtirilishi mumkin. Asetilenni kumush oksidning ammiak eritmasidan o'tkazamiz. Kumush atsetilid cho'kmasi cho'kma hosil qiladi.
CH ≡ CH + Ag 2 O → AgC ≡ CAg ↓ + H 2 O
Uskunalar: Vurts kolbasi, ajratuvchi voronka, gaz chiqarish trubkasi, stakan yoki probirka, polipropilen voronka, filtr qog'ozi, shtativ.
Xavfsizlik choralari. Yonuvchan gazlar bilan ishlash qoidalariga rioya qiling. Faqat oz miqdorda kumush atsetilidni oling. Quritilgan kumush atsetilid juda xavfli portlovchi moddadir. Konsentrlangan xlorid kislotasi bilan ishlov berish orqali yo'q qilinadi.
Metall asetilenidlarning mo'rtligi
Metall asetilenidlar beqaror birikmalardir. Kumush atsetilid nam bo'lganda barqaror bo'ladi, quritilganda u osongina portlaydi. Biz kumush asetilenidni quritish uchun yonayotgan parchani keltiramiz - u portlaydi. Xuddi shunday tajribani mis (I) atsetilid bilan ham o‘tkazamiz. Kumush atsetilid singari, mis (I) atsetilid nam holatda barqaror, lekin quritilganda oson parchalanadi. Qurigan mis (I) atsetilidga olib kelingan yonayotgan parcha portlashga olib keladi. Shu bilan birga, yashil rangli olov paydo bo'ladi.
Uskunalar: yong'inga chidamli qistirma, parchalanish.
Xavfsizlik choralari. Faqat oz miqdorda kumush va mis atsetilidni olish va parchalash mumkin. Quritilgan kumush va mis asetilenidlari xavfli portlovchi moddalardir. Asetilenidlar konsentrlangan xlorid kislota bilan ishlov berish orqali yo'q qilinadi.
Kimyo dars ishlanma
10-sinf
8-dars
Dars mavzusi: Alkinlar. Asetilen, uni metan pirolizi va karbid usuli bilan olish. Asetilenning kimyoviy xossalari: yonishi, bromli suvning rangsizlanishi, vodorod xlorid qo'shilishi va hidratsiyasi. Xususiyatlari asosida asetilenni qo'llash. Vinilxloridning polimerlanish reaksiyasi. Polivinilxlorid va uning qo‘llanilishi.
Dars maqsadlari:
- Tadqiq qilingalkinlarning gomologik qatori vakillarining umumiy formulasi, nomenklaturasi, fizik xossalari, tuzilishi, alkinlarning gomologik qatorining birinchi vakili - atsetilenning kimyoviy xossalari, qo`llanilishi.
- Umumiy ta'lim qobiliyatlari va mantiqiy fikrlashni rivojlantirish.
Talabalarning kognitiv qiziqishini oshirish,organik kimyo bilimlarining ahamiyatini ko'rsating.
Dars turi: UPNZ
Axborot va uslubiy yordam: dars mavzusi bo'yicha slaydlar, diagrammalar, to'plam materiallari, jadvallar.
Darslik: Kimyo. Organik kimyo. 10-sinf (asosiy daraja).Rudzitis G.E., Feldman F.G.,15-nashr. - M.: 2012. - 192 b.
Talabalar faoliyatining xususiyatlari: frontal, individual, kengashda ishlash.
Nazorat turlari: Tadqiqot.
Darslar davomida
I. Darsning tashkiliy lahzasi
II. Bilimlarni yangilash
Asosiy tushunchalar bo'yicha so'rov:
Uglevodorodlar
To'yingan va to'yinmagan birikmalar
Alkinlar: qator formulasi, qatorning birinchi vakili, asosiy xossalari, tayyorlash usullari, qo'llanilishi.
III. Uy vazifasini tekshirish
IV. Yangi material taqdimoti
Alkinlar - to'yinmagan uglevodorodlar, ularning molekulalarida bitta C-C bog'laridan tashqari, bir uchlik C ni o'z ichiga oladi.≡ C-bog'.
Seriyaning umumiy formulasiBILAN n H 2n-2
Alc nomenklaturasining xususiyatlari Va yangi
Uglevodorodning alkenlar sinfiga mansubligi qo`shimcha orqali namoyon bo`ladi- ichida:
BILAN 2 N 2 CH≡ CHetin (atsetilen)
BILAN 3 N 4 CH≡ C-CH 3 propin
BILAN 4 N 6 CH≡ C-CH 2 -CH 3 butin - 1
va hokazo.
Birikmalarni nomlash qoidalari alkenlar bilan bir xil bo'lib qoladi, faqat qo'shimchasi bilan almashtiriladi-in .
Alken izomeriyasi
Uglerod zanjiri tuzilishining izomeriyasi.
Uchlik bog'lanish pozitsiyasining izomeriyasi.
Sinflararo izomeriya.
Strukturaviy izomeriya.
Izomerlarning har bir turiga misollar keltiring va ularni nomlang!
Molekulalar tuzilishining xususiyatlari (atsetilen misolida)
Asetilenda uglerod holatda bo'ladisp - gibridlanish(gibridlanish bittadan iboratsva 1p-orbital). Etilen molekulasidagi har bir uglerod atomi 2 gibridga egasp - orbitallar va ikkita gibrid bo'lmagan p-orbitallar. Gibrid orbitallarning o'qlari bir tekislikda joylashgan bo'lib, ular orasidagi burchak 180° ga teng.Har bir uglerod atomining bunday orbitallari boshqa uglerod atominiki bilan kesishadi.Vas-orbitallarikki suv quvur atomlari, shakllantirishσ -C-C va C-N ulanishlari.
Ta'lim sxemasi molekuladagi s bog'lar ace tilena

Uglerod atomlarining to'rtta gibrid bo'lmagan p-orbitallari tekislikka perpendikulyar joylashgan o'zaro perpendikulyar tekisliklarda ustma-ust tushadi.σ - ulanishlar. Bu ikkita hosil qiladiπ- kommunikatsiyalar.
BILAN ≡ C = σ + 2 π
Molekulada p bog`larning hosil bo`lish sxemasi uh tilena

Asetilen molekulasining tuzilishi

Jismoniy xususiyatlar
Asetilen gaz, havodan yengil, suvda ozgina eriydi, hidsiz. Havo bilan portlovchi aralashmalar hosil qiladi.
Alkinlar qatorida molekulyar massa ortishi bilan qaynash harorati ortadi.
Daftaringizdagi jadvalda asetilenning fizik xossalarini tasvirlab bering!
Kvitansiya
Asetilen ishlab chiqarish usullari:
Kaltsiy karbid. (laboratoriya usuli)
SaS 2 + 2H 2 O → C 2 N 2 + Ca(OH) 2
Kaltsiy karbidini ishlab chiqarish (sanoatda):
CaO + 3C CaC 2 + CO
kaltsiy oksidi koks kaltsiy karbid
CaCO 3 CaO+CO 2
kaltsiy karbonat kaltsiy oksidi
Metanning termik parchalanishi.
2CH 4 BILAN 2 N 2 + 3H 2
Asetilen gomologlarini - bir qator alkinlarning uglevodorodlarini olish usullari:
Dehidrogalogenatsiya - qo'shni yoki bitta uglerod atomida ikkita halogen atomini o'z ichiga olgan dihaloalkanlardan ikkita galogen vodorod molekulasini yo'q qilish:
Reaksiya galogen hosilalari ustida ishqorlarning spirtli eritmasi ta'sirida sodir bo'ladi.
2 N 5 UCH 3 - SVr 2 - CH 3 + 2KON
CH 3 -C ≡ CH + 2KVr+ 2H 2 HAQIDA,
2,2 - dibromopropan propin
Kimyoviy xossalari
Galogenlar bilan o'zaro ta'siri
Qo'shilish reaktsiyalari
Bir nechta bog'lanishlar mavjudligiga sifatli reaktsiya - brom suvining rangi o'zgarishi!
Qo'shilish reaktsiyalari ikki bosqichda sodir bo'ladi.


atsetaldegid
Metalllar bilan.
Reaksiyalarning mahsuloti atsetilenidlar - yomon eriydigan, beqaror, portlovchi moddalar!
Kumush atsetilidning kulrang-oq cho'kmasi yoki mis atsetilidining qizil-jigarrang cho'kmasi hosil bo'lishi terminal uchlik bog'lanishiga sifatli reaktsiyadir!
Yonish.
Oksidlanish reaksiyalari.
Asetilen benzol va vinil asetilenga polimerlanishi mumkin.
Vinilxloridning polimerizatsiyasi

Polivinilxlorid (PVX) bardoshli plastmassa, sun'iy teri, moyli mato, dielektriklar va boshqalarni ishlab chiqarish uchun ishlatiladi.
Asetilenni qo'llash
Organik sintezda xom ashyo (tolalar, bo'yoqlar, laklar, dori vositalari, PVX, xloropren kauchuk, sirka kislotasi, erituvchilar va boshqalar ishlab chiqarish)
Metalllarni kesish va payvandlashda.
V. Bilimlarni mustahkamlash.
Muammolar va mashqlarni yechish
54-bet – 1,3,5,6-mashqlar.
55-bet – 8-mashq
55-bet – 1-topshiriq.
V I . Reflektsiya. Darsni yakunlash
VI I . Uy vazifasi
13-band
Bilan. 55 - muammolar 2, 3
Etilen va asetilenning molekulyar tuzilmalari orasidagi farqlarni tushuntiring.
Qaysi uglevodorod etinning eng yaqin gomologi hisoblanadi?
Quyidagi o'zgarishlarni amalga oshirish uchun ishlatilishi mumkin bo'lgan reaksiya tenglamalarini tuzing, reaktsiyalar sodir bo'lish shartlarini ko'rsating va reaktsiya mahsulotlarini nomlang:

Asetilen olish va uning xossalarini o'rganish bo'yicha tajribalar bir vaqtning o'zida ko'rsatiladi. Asetilenni darsga oldindan tayyorlamaslik va portlash xavfi tufayli uni gazometrda saqlash kerak emas.
^ Asetilenni tayyorlash. Asetilen ishlab chiqarishning eng qulay usuli bu kaltsiy karbidining suv bilan o'zaro ta'siri:
CaC 2 + 2H 2 O C 2 H 2 + Ca(OH) 2
Reaksiya uchun kolba juda kichik hajmda bo'lmasligi kerak, chunki reaktsiya paytida hosil bo'lgan qalin suyuqlik shishadi va ko'pik gaz bilan chiqish trubkasi orqali o'tishi mumkin. Agar kolba juda katta bo'lsa, barcha havo qurilmadan chiqib ketguncha ko'p vaqt ketadi va agar siz shu daqiqagacha kutsangiz, asetilenning katta yo'qotilishi sodir bo'ladi. 250 ml li kolbadan foydalanish qulay. Agar kattaroq sig'imli kolba ishlatilsa, atsetilen bilan tajribalarni havo almashinuvini talab qilmaydigan reaktsiyalar bilan boshlash mumkin, bu ularni ancha tejamkorlik bilan amalga oshirishga imkon beradi.
Kaltsiy karbidiga suv qo'shilsa, reaktsiya har doim juda shiddatli davom etadi; shuning uchun asetilen beixtiyor iste'mol qilinadi va u barcha mo'ljallangan tajribalarni ko'rsatish uchun etarli bo'lmasligi mumkin. Siz ikki yo'l bilan tinchroq va bir xil asetilen oqimini olishingiz mumkin: etil spirtini kaltsiy karbidiga qo'shing va shundan keyingina suv qo'shing yoki suv o'rniga osh tuzining to'yingan eritmasidan foydalaning.
Kolbaga 7-8 dona no‘xat o‘lchamdagi kaltsiy karbid bo‘lagi soling, voronkali tiqinni mahkam soling, voronkaga osh tuzining to‘yingan eritmasini quying va undan bir necha tomchi kolbaga soling. Eritmaning keyingi qo'shilishi pufakchalarni hisoblash imkonini beradigan tezlikda bir xil gaz oqimi o'rnatilishi uchun amalga oshiriladi. Talabalar reaktsiya etilen va metan ishlab chiqarishdan farqli o'laroq, qizdirilmasdan sodir bo'lishiga jalb qilinadi.
Hosil bo'lgan gaz ballonlarda suvni siljitish usuli yordamida yig'iladi (havo almashinuvining to'liqligini tekshirgandan so'ng) yoki to'g'ridan-to'g'ri tegishli tajribalar uchun ishlatiladi. Asetilenning suvda sezilarli eruvchanligi tufayli, ba'zida uni osh tuzi eritmasi ustiga yig'ish tavsiya etiladi, ammo tajriba shuni ko'rsatadiki, oddiy suvdan foydalanish juda mumkin.
^ Asetilenni suvda eritish . Asetilen suvda metan va etilenga qaraganda yaxshiroq eriydi.
1. Asetilenni probirkadagi suvdan bir necha daqiqa o'tkazing. Shundan so'ng, suv qaynaguncha qizdiriladi va probirkaning teshigiga yondirilgan parcha keltiriladi. Suvdan ajralib chiqqan asetilen miltillaydi.
2. Toza (havosiz) atsetilen solingan silindr yoki probirka rangli sovuq suv solingan stakanga solinadi. Tsilindr (probirka) chayqalganda, undagi suv darajasi sezilarli darajada ko'tariladi. Agar silindr shu holatda tripodda mahkamlangan bo'lsa va keyingi darsga qadar qoldirilsa, bu hodisa yanada aniqroq bo'ladi.
^ Asetilenni asetonda eritish . Asetilen asetonda yaxshi eriydi. Bunday eritma shaklida odatda po'lat tsilindrlarda (g'ovakli plomba bilan) saqlanadi.
3-4 ml aseton atsetilenli kichik tsilindrga quyiladi. Tsilindr tiqin bilan yopiladi, bir necha marta chayqatiladi va rangli suvli hammomga solinadi. Vilka ochilganda silindrda suv ko'tariladi.
^ Asetilenning yonishi . Asetilenning to'liq yonishi quyidagi tenglama bilan ifodalanadi:
2C 2 H 2 + 5O 2 4CO 2 + 2H 2 O
Tashqi yonish sxemasi va bu holda ishlab chiqilgan harorat gazlarning hajmli nisbatiga kuchli bog'liq.
Tsilindrda to'plangan asetilen suvni almashtirish usuli yordamida yondiriladi. Gaz tutunli olov bilan yonadi. Olov silindr ichida harakat qilganda, kuyikish hosil bo'lishi kuchayadi, chunki silindrda yonish kislorodning ko'proq etishmasligi bilan sodir bo'ladi. Asetilen yoqiladi va qurilmaning chiqish trubkasida (14-rasm) trubaning teshigi qanchalik kichik bo'lsa, gaz kamroq tutunli alanga bilan yonishi va gazning nozik oqimida to'liq yonish sodir bo'lishiga e'tibor bering. .
^ Asetilenning kislorod bilan portlashi . Yontirilganda asetilen va kislorod aralashmasi juda katta kuch bilan portlaydi. Shuning uchun tajribani po'lat silindrda yoki yorilishi xavfli bo'lmagan bunday qobiqda o'tkazish mumkin. Asetilen portlashini ko'rsatishning eng yaxshi usuli sovun pufakchalarida.
Qurilmadagi asetilen va gazometrdan kislorod bir vaqtning o'zida sovunli suvga o'tkaziladi, 30-40 ml suvga 1 g sovun va 4-5 ml glitserin miqdorida temir stakanda oldindan tayyorlanadi. Ular stoldan idishlarni olib, uzoq parchalangan gazlar aralashmasi bilan hosil bo'lgan pufakchalarga o't qo'yishadi. Kuchli, ammo zararsiz portlash sodir bo'ladi.
^ Asetilenning brom va kaliy permanganat eritmasi bilan reaksiyasi. Asetilenning toʻyinmaganligini koʻrsatadigan tajribalarni ikki usulda oʻtkazish mumkin: a) asetilenni bromli suvga va kaliy permanganat eritmasiga oʻtkazish, b) bu eritmalarni atsetilen bilan silindrlarga quyish.
Birinchi usuldan foydalangan holda tajribalarni ko'rsatishda eritmalarning rangi o'zgarishi (ayniqsa, bromli suv) juda sekin sodir bo'ladi. Eritmalarni shisha tayoq bilan aralashtirish jarayonni biroz tezlashtiradi.
Ikkinchi usul yordamida tajribalarni ko'rsatishda tsilindrlardagi eritmalari bo'lgan gaz chayqatiladi; Bunday holda, rang o'zgarishi tezroq sodir bo'ladi.
Asetilenning tuzilishiga asoslanib, talabalar odatda uning brom bilan reaktsiyalari uchun tenglamalarni to'g'ri tuzadilar:

Asetilenning kaliy permanganat bilan reaksiyasi, xuddi etilenning reaksiyasi kabi, bu erda faqat umumiy ma'noda ko'rib chiqilishi mumkin.
Agar atsetilenning brom va kaliy permanganat bilan reaksiyasi gazni eritmalar orqali o‘tkazish yo‘li bilan ko‘rsatilsa, u holda eritmalarning rangsizlanishiga (etilen bilan solishtiring) vaqtni reaksiyani tahlil qilish uchun ishlatish mumkin. Bunday tajriba qoralama ostida o'tkazilishi kerak, chunki atmosferaga nisbatan ko'p asetilen (zaharli aralashmalar bilan) chiqariladi. Tajribani muhokama qilish quyidagicha boshlanishi mumkin: “Asetilen molekulasida uch tomonlama aloqa mavjudligiga asoslanib, biz uni oson oksidlanishi va qo'shilish reaktsiyalariga kirishishi kerak deb taxmin qilamiz. Qaysi mezonlar bo‘yicha tajribada bu reaksiyalar sodir bo‘lishini aniqlashimiz mumkin?” Talabalar javob bergandan so'ng, o'qituvchi savol beradi: "Agar eritmalarning rangi o'zgarib ketsa, bu reaktsiyalarni tenglamalar bilan qanday ifodalash mumkin?"
^ Asetilenning xlorda yonishi . Asetilen, boshqa uglevodorodlar kabi, xlorda yonib, vodorod xlorid va ko'mir hosil qiladi:
C 2 H 2 + CI 2 2C + 2HCI
1. Xlor tsilindriga sekin yonib turgan asetilen solingan kavisli shisha naycha kiritiladi. Asetilen xlorda yonishda davom etib, kuyikish hosil qiladi. Tsilindrni sinfda xlor bilan to'ldirishingiz mumkin, unga ozgina maydalangan kaliy permanganat quyib, konsentrlangan xlorid kislota qo'shing.
2. Tsilindrga asta-sekin xlorli kavisli trubka kiritiladi, u orqali asetilen oqadi (avval tozaligi tekshirilgan).
Stotu). Asetilen xlorda yonuvchan. Tajriba asetilenning katta kimyoviy faolligini ko'rsatadi.
3. Shisha tsilindrga ozgina oqartirgich quyib, ustiga suyultirilgan xlorid kislota quying. U erda bir nechta kaltsiy karbidlari tashlanadi. Bir muncha vaqt o'tgach, silindrda alanga chaqnashlari kuzatiladi, keyin so'nadi, keyin yana paydo bo'ladi va yuqoridan pastga aylanadi.
Oqartirish kislota bilan reaksiyaga kirishganda, xlor ajralib chiqadi:
CaCIOCl + 2HCI CaCI 2 + H 2 O + CI 2
va kaltsiy karbid suv bilan reaksiyaga kirishganda - asetilen (em. 51-bet). Asetilen va xlor qo'shilish reaktsiyasiga kiradi, uning issiqligi xlorda (silindrda) va havoda (silindrning ochilishida) asetilenni yoqadi. Oqartirish bu erda olinadi, chunki u suyultirilgan xlorid kislotasi bilan reaksiyaga kirishganda xlor hosil qiladi, kaliy permanganat esa konsentrlangan kislota bilan reaksiyaga kirishganda uni chiqaradi. Erkin suvning mavjudligi etarli miqdorda asetilenni olish uchun zarur.
^ Polivinilxlorid bilan tajribalar . Polivinilxlorid bilan tanishishda siz uning issiqlik, kimyoviy reagentlar va erituvchilar bilan aloqasini hisobga olishingiz kerak. Oxirgi ikkita tajriba bu erda tasvirlanmagan, chunki ular polietilen bilan bir xil tarzda amalga oshiriladi.
A) Vinil plastmassa yoki polivinilxlorid plyonka bo'laklari (moyli mato, izolyatsiya) probirka yoki chinni idishda ehtiyotkorlik bilan qizdiriladi.
Polimerning suyuq holatga o'tmasligiga, balki parchalanishiga ishonch hosil qiling. Chiqarilgan gazsimon parchalanish mahsulotlariga ho'l lakmus qog'ozi va keyin ammiak eritmasi bilan namlangan tayoq keltiriladi. Birinchi holatda qog'ozning qizarishi, ikkinchisida esa oq tuman hosil bo'lishi kuzatiladi. Ular polivinilxloridning parchalanishi paytida vodorod xlorid ajralib chiqadi degan xulosaga kelishadi.
B) Polivinilxlorid bo'laklari chiqish trubkasi bo'lgan tiqin bilan yopilgan probirkada qizdiriladi. Gazsimon parchalanish mahsulotlari probirkaga suv bilan chiqariladi. Olingan suvli eritmaga kumush nitratning ozgina eritmasi va 1-2 tomchi nitrat kislota qo'shiladi. Kumush xlorid cho'kmasi hosil bo'lishi kuzatiladi, bu polimerning parchalanishi paytida vodorod xloridning ajralib chiqishini ko'rsatadi.
Siz allaqachon bilganingizdek, asetilen metanning to'liq bo'lmagan parchalanishi mahsulotidir. Bu jarayon piroliz deb ataladi (yunoncha bayramdan - olov, lizis - parchalanish). Nazariy jihatdan, asetilenni etilenning gidrogenlanishi mahsuloti sifatida ko'rsatish mumkin:
Amalda, asetilen, piroliz usulidan tashqari, ko'pincha kaltsiy karbididan olinadi:

Asetilen molekulasi strukturasining o'ziga xos xususiyati (21-rasm) uglerod atomlari o'rtasida uch tomonlama bog'lanish mavjud, ya'ni u etilendan ham to'yinmagan birikma bo'lib, molekulasida qo'sh uglerod-uglerod bog'i mavjud.

Guruch. 21.
Asetilen molekulasining modellari: 1 - shar va tayoq; 2 - masshtab
Asetilen alkinlarning gomologik qatori yoki asetilen uglevodorodlarining asoschisidir.
Asetilen rangsiz, hidsiz gaz, suvda ozgina eriydi.
Keling, asetilenning kimyoviy xossalarini ko'rib chiqaylik, bu uning ishlatilishiga asoslanadi.
Asetilen molekulasidagi uglerod miqdori yuqori bo'lganligi sababli havoda tutunli alanga bilan yonadi, shuning uchun asetilenni yoqish uchun kislorod ishlatiladi:
Kislorod-asetilen olovining harorati 3200 ° C ga etadi. Bu olov metalllarni kesish va payvandlash uchun ishlatilishi mumkin (22-rasm).

Guruch. 22.
Oksi-asetilen olovi metallni kesish va payvandlash uchun ishlatiladi
Barcha to'yinmagan birikmalar singari, asetilen ham qo'shilish reaktsiyalarida faol ishtirok etadi. 1) galogenlar (galogenlash), 2) vodorod (gidrogenlash), 3) vodorod galogenidlari (gidrogalogenlash), 4) suv (gidratlanish).
Masalan, gidroxlorlanish reaktsiyasini ko'rib chiqing - vodorod xlorid qo'shilishi:

Asetilen gidroxlorlash mahsuloti nima uchun xloretilen deb atalishini tushunasiz. Nima uchun vinilxlorid? Chunki bir valentli etilen radikali CH 2 =CH- vinil deyiladi. Vinilxlorid polimer - polivinilxlorid ishlab chiqarish uchun boshlang'ich birikma bo'lib, u keng qo'llaniladi (23-rasm). Hozirgi vaqtda vinilxlorid asetilenni gidroxlorlash yo'li bilan emas, balki boshqa usullar bilan ishlab chiqariladi.

Guruch. 23.
Polivinilxloridning qo'llanilishi:
1 - sun'iy teri; 2 - elektr lenta; 3 - simli izolyatsiyalash; 4 - quvurlar; 5 - linolyum; 6 - moyli mato
Polivinilxlorid sizga tanish bo'lgan polimerizatsiya reaktsiyasi yordamida ishlab chiqariladi. Vinilxloridning polivinilxloridga polimerlanishini quyidagi sxema yordamida tasvirlash mumkin:

yoki reaksiya tenglamalari:

Katalizator sifatida Hg 2+ kationini o'z ichiga olgan simob tuzlari ishtirokida sodir bo'ladigan hidratsiya reaktsiyasi taniqli rus organik kimyogari M. G. Kucherov nomi bilan ataladi va ilgari juda muhim organik birikma - atsetaldegidni olish uchun keng qo'llanilgan:

Brom qo'shilish reaktsiyasi - bromlash - ko'p (ikki yoki uch) bog'lanishga sifatli reaktsiya sifatida ishlatiladi. Bromli suv orqali asetilen (yoki etilen yoki boshqa ko'pchilik to'yinmagan organik birikmalar) o'tkazilganda uning rangi o'zgarishi kuzatilishi mumkin. Bunday holda, quyidagi kimyoviy o'zgarishlar sodir bo'ladi:


Asetilen va to'yinmagan organik birikmalarga yana bir sifatli reaktsiya kaliy permanganat eritmasining rangi o'zgarishi hisoblanadi.
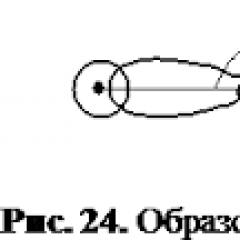
Asetilen - kimyo sanoatining eng muhim mahsuloti bo'lib, u keng qo'llaniladi (24-rasm).

Guruch. 24.
Asetilenni qo'llash:
1 - metallarni kesish va payvandlash; 2-4 - organik birikmalar ishlab chiqarish (erituvchilar 2, polivinilxlorid 3, elim 4)
Yangi so'zlar va tushunchalar
- Alkinlar.
- Asetilen.
- Asetilenning kimyoviy xossalari: yonishi, galogen vodorod qo'shilishi, suv (Kucherov reaktsiyasi), galogenlar.
- Polivinilxlorid.
- Ko'p bog'lanishlarga sifatli reaktsiyalar: brom suvi va kaliy permanganat eritmasining rangsizlanishi.
Savol va topshiriqlar

Alkinlar (aka asetilen uglevodorodlari) umumiy formulasi CnH2n-2 bo'lgan uglerod atomlari o'rtasida uch tomonlama aloqani o'z ichiga olgan uglevodorodlardir. Uchlik bog'lanishdagi uglerod atomlari sp - gibridlanish holatida bo'ladi.
Asetilenning bromli suv bilan reaksiyasi
Asetilen molekulasida uchlik aloqa mavjud, brom uni buzadi va asetilenga qo'shiladi. Terabrometan hosil bo'ladi. Brom tetrabrometan hosil bo'lishida sarflanadi. Bromli suv (sariq) - rangi o'zgargan.
Bu reaksiya etilen uglevodorodlar qatoriga qaraganda pastroq tezlikda boradi. Reaktsiya ham bosqichlarda sodir bo'ladi:
HC ≡ CH + Br 2 → CHBr = CHBr + Br 2 → CHBr 2 - CHBr 2
asetilen → 1,2-dibrometan → 1,1,2,2-tetrabrometan
Bromli suvning rangi o'zgarishi atsetilenning to'yinmaganligini isbotlaydi.
Asetilenning kaliy permanganat eritmasi bilan reaksiyasi
Kaliy permanganat eritmasida asetilenning oksidlanishi sodir bo'ladi va molekula uchlik bog'lanish joyida parchalanadi va eritma tezda rangsizlanadi.
3HC ≡ CH + 10KMnO 4 + 2H 2 O → 6CO 2 + 10KOH + 10MnO 2
Bu reaksiya ikki va uch bog`lanishga sifat reaksiyasidir.
Asetilenning kumush oksidning ammiak eritmasi bilan reaksiyasi
Agar atsetilen kumush oksidning ammiak eritmasidan o'tkazilsa, atsetilen molekulasidagi vodorod atomlari osongina metallar bilan almashtiriladi, chunki ular yuqori harakatchanlikka ega. Bu tajribada vodorod atomlari kumush atomlari bilan almashtiriladi. Kumush atsetilid hosil bo'ladi - sariq cho'kma (portlovchi).
CH ≡ CH + OH → AgC≡CAg↓ + NH 3 + H 2 O
Bu reaksiya uchlik bog`lanishga sifatli reaksiya hisoblanadi.