Qaysi kislota eng xavfli hisoblanadi? Dunyodagi eng kuchli kislota. Eng kuchli ortiqcha suyuqlik. Eng ajoyib moddalar Eng kuchli kislorodsiz kislota
Inson har doim o'z raqobatchilariga hech qanday imkoniyat qoldirmaydigan materiallarni topishga intilgan. Qadim zamonlardan beri olimlar dunyodagi eng qattiq, eng engil va eng og'ir materiallarni qidirmoqdalar. Kashfiyotga chanqoqlik kashfiyotga olib keldi ideal gaz va mukammal qora tan. Biz sizga eng ko'p taqdim etamiz ajoyib moddalar dunyoda.
1. Eng qora modda
Dunyodagi eng qora modda Vantablack deb ataladi va uglerod nanotubalari toʻplamidan iborat (qarang. Uglerod va uning allotroplari). Oddiy qilib aytganda, material son-sanoqsiz "sochlardan" iborat bo'lib, ular bir marta ushlanganda, yorug'lik bir naychadan ikkinchisiga o'tadi. Shunday qilib, yorug'lik oqimining taxminan 99,965% so'riladi va faqat kichik bir qismi orqaga qaytariladi.
Vantablackning kashfiyoti ushbu materialdan astronomiya, elektronika va optikada foydalanish uchun keng istiqbollarni ochadi.
2. Eng tez alangalanuvchi modda
Xlor triflorid eng tez yonuvchi moddadir insoniyatga ma'lum. Bu kuchli oksidlovchi va deyarli hamma bilan reaksiyaga kirishadi kimyoviy elementlar. Xlor triflorid betonni yoqishi va shishani osongina yoqishi mumkin! Xlor trifloriddan foydalanish uning ajoyib alangalanishi va xavfsiz foydalanishni ta'minlashning iloji yo'qligi sababli amalda mumkin emas.
3. Eng zaharli modda
Eng kuchli zahar botulinum toksinidir. Biz uni Botoks nomi ostida bilamiz, u kosmetologiyada shunday deb ataladi, u erda u o'zining asosiy qo'llanilishini topdi. Botulinum toksini Clostridium botulinum bakteriyalari tomonidan ishlab chiqarilgan kimyoviy moddadir. Botulinum toksini eng zaharli modda ekanligiga qo'shimcha ravishda, oqsillar orasida eng katta molekulyar og'irlikka ega. Moddaning fenomenal toksikligi shundan dalolat beradiki, atigi 0,00002 mg min/l botulinum toksini zararlangan hududni yarim kun davomida odamlar uchun o'limga olib kelishi uchun etarli.
4. Eng issiq modda
Bu kvark-gluon plazmasi deb ataladi. Ushbu modda oltin atomlarining yorug'lik tezligiga yaqin to'qnashuvi natijasida yaratilgan. Kvark-glyuon plazmasining harorati 4 trillion daraja Selsiyga teng. Taqqoslash uchun, bu ko'rsatkich Quyosh haroratidan 250 000 marta yuqori! Afsuski, materiyaning umri soniyaning trilliondan bir trilliondan bir qismi bilan cheklangan.
5. Eng kostik kislota
Bu nominatsiyada chempion ftor-surma kislota H. Ftorid-surma kislotasi sulfat kislotadan 2×10 16 (ikki yuz kvintillion) marta kaustik hisoblanadi. Bu juda faol modda bo'lib, oz miqdorda suv qo'shilsa, portlashi mumkin. Ushbu kislotaning bug'lari o'lik zaharli hisoblanadi.
6. Eng portlovchi modda
Eng portlovchi modda geptanitrokubandir. Bu juda qimmat va faqat shu maqsadda ishlatiladi ilmiy tadqiqot. Ammo biroz kamroq portlovchi oktogen harbiy ishlarda va quduqlarni burg'ilashda geologiyada muvaffaqiyatli qo'llaniladi.
7. Eng radioaktiv modda
Poloniy-210 - bu tabiatda mavjud bo'lmagan, ammo odamlar tomonidan ishlab chiqarilgan poloniyning izotopi. Miniatyurani yaratish uchun ishlatiladi, lekin ayni paytda juda kuchli energiya manbalari. U juda qisqa yarim umrga ega va shuning uchun og'ir nurlanish kasalligini keltirib chiqarishi mumkin.
8. Eng og'ir modda
Bu, albatta, to'liqlikdir. Uning qattiqligi tabiiy olmosnikidan deyarli 2 baravar yuqori. Fullerit haqida ko'proq "Dunyodagi eng qiyin materiallar" maqolamizda o'qishingiz mumkin.
9. Eng kuchli magnit
Dunyodagi eng kuchli magnit temir va azotdan iborat. Ayni paytda ushbu modda haqida batafsil ma'lumot keng omma uchun mavjud emas, ammo yangi super-magnit hozirda qo'llanilayotgan eng kuchli magnitlar - neodimiydan 18% kuchliroq ekanligi allaqachon ma'lum. Neodim magnitlari neodimiy, temir va bordan qilingan.
10. Eng suyuq modda
Superfluid Geliy II mutlaq nolga yaqin haroratlarda deyarli yopishqoqlikka ega emas. Bu xususiyat uning tufaylidir noyob mulk oqish va har qanday qattiq materialdan tayyorlangan idishdan to'kib tashlang. Geliy II issiqlik tarqalmaydigan ideal issiqlik o'tkazgich sifatida foydalanish istiqbollariga ega.
Kimyogarlarning bir necha avlodi qaysi kislota eng kuchli ekanligi haqida bahslashdi. IN turli vaqtlar Bu nom nitrat, sulfat va xlorid kislotalariga berilgan. Ba'zilar gidroflorik kislotadan kuchliroq birikma bo'lishi mumkin emasligiga ishonishgan. Yaqinda kuchli kislotali xususiyatlarga ega bo'lgan yangi birikmalar olindi. Balki ular orasida dunyodagi eng kuchli kislota topilgandir? Ushbu maqola bizning davrimizning eng kuchli turg'un kislotalarining xususiyatlarini ko'rib chiqadi va ularning qisqacha kimyoviy tavsiflarini beradi.
Kislota tushunchasi
Kimyo aniq miqdoriy fandir. Va "Eng kuchli kislota" unvoni ma'lum bir moddaga tegishli bo'lishi kerak. Har qanday aloqaning mustahkamligini tavsiflovchi asosiy ko'rsatkich nima bo'lishi mumkin?
Birinchidan, kislotaning klassik ta'rifini eslaylik. Bu so'z asosan vodorod va kislota qoldig'idan iborat murakkab kimyoviy birikmalar uchun ishlatiladi. Murakkab tarkibidagi vodorod atomlarining soni kislota qoldig'ining valentligiga bog'liq. Masalan, xlorid kislota molekulasida faqat bitta vodorod atomi mavjud; va sulfat kislota allaqachon ikkita H + atomiga ega.

Kislotalarning xossalari
Barcha kislotalarning bir qismi bor kimyoviy xossalari, bu kimyoviy birikmalarning berilgan sinfi uchun umumiy deb atash mumkin.

Yuqoridagi barcha xususiyatlarda har qanday ma'lum kislotaning yana bir "mahorati" namoyon bo'ladi - bu vodorod atomidan voz kechish, uni boshqa kimyoviy moddaning atomi yoki har qanday birikmaning molekulasi bilan almashtirish qobiliyati. Aynan shu qobiliyat kislotaning "kuchini" va uning boshqa kimyoviy elementlar bilan o'zaro ta'sir qilish darajasini tavsiflaydi.
Suv va kislota
Suvning mavjudligi kislotaning vodorod atomlarini berish qobiliyatini sezilarli darajada kamaytiradi. Bu vodorodning o'zini shakllantirishga qodir ekanligi bilan izohlanadi kimyoviy bog'lanishlar kislota va suv molekulalari orasida, shuning uchun uning asosdan ajralish qobiliyati suyultirilmagan kislotalarga qaraganda kamroq.
Super kislota
"Super kislota" so'zi 1927 yilda mashhur kimyogar Jeyms Konant yordamida kimyoviy lug'atga kiritilgan.
Ushbu kimyoviy birikmaning mustahkamligi uchun standart konsentrlangan sulfat kislota hisoblanadi. Kimyoviy yoki konsentrlangan sulfat kislotadan kislotaliroq bo'lgan har qanday aralashma super kislota deyiladi. Superkislotaning qiymati uning har qanday asosga ijobiy elektr zaryadini berish qobiliyati bilan belgilanadi. Kislotalikni aniqlash uchun asosiy parametr sifatida mos keladigan H 2 SO 4 indikatori olinadi. Kuchli kislotalar orasida juda noodatiy nom va xususiyatlarga ega moddalar mavjud.
Ma'lum kuchli kislotalar
Noorganik kimyo kursidan eng mashhur kislotalar gidroiyodik (HI), gidrobromik (HBr), xlorid (HCl), sulfat (H 2 SO 4) va nitrat (HNO 3) kislotalardir. Ularning barchasi yuqori kislotalilik indeksiga ega va ko'pchilik metallar va asoslar bilan reaksiyaga kirisha oladi. Ushbu seriyada eng kuchli kislota "aqua regia" deb ataladigan nitrat va xlorid kislota aralashmasidir. Bu seriyadagi eng kuchli kislota formulasi HNO 3+3 HCl. Ushbu birikma hatto oltin va platina kabi qimmatbaho metallarni ham eritishga qodir.

Ajablanarlisi shundaki, vodorodning eng kuchli halogen - ftor bilan birikmasi bo'lgan gidroflorik kislota "Kimyodagi eng kuchli kislota" unvoni uchun da'vogarlar qatoriga kiritilmagan. Ushbu moddaning yagona xususiyati shishani eritish qobiliyatidir. Shuning uchun bunday kislota polietilen idishlarda saqlanadi.
Kuchli organik kislotalar
"Eng kuchli kislota" unvoni uchun da'vogarlar organik kimyo» - chumoli va sirka kislotalari. Chumoli kislota gomologik toʻyingan kislotalar qatorida eng kuchli hisoblanadi. U o'z nomini oldi, chunki uning bir qismi chumolilarning sekretsiyalarida mavjud.

Sirka kislotasi chumoli kislotadan bir oz kuchsizroq, lekin uning tarqalish spektri ancha kengroq. U ko'pincha o'simlik sharbatlarida uchraydi va turli organik moddalarning oksidlanishida hosil bo'ladi.
Kimyo sohasidagi so'nggi o'zgarishlar an'anaviy organik moddalar bilan raqobatlasha oladigan yangi moddani sintez qilish imkonini berdi. Triflorometansülfonik kislota sulfat kislotadan yuqori kislotalik indeksiga ega. Bundan tashqari, CF3SO3H normal sharoitda fizik-kimyoviy xususiyatlarga ega barqaror gigroskopik suyuqlikdir. Bugungi kunda ushbu birikmaga "Eng kuchli organik kislota" unvoni berilishi mumkin.
Ko'pchilik kislotalik darajasi sulfat kislotadan sezilarli darajada yuqori bo'lishi mumkin emas deb o'ylashlari mumkin. Ammo yaqinda olimlar kislotalilik parametrlari sulfat kislotadan bir necha ming marta yuqori bo'lgan bir qator moddalarni sintez qilishdi. Protik kislotalarning Lyuis kislotalari bilan reaksiyaga kirishishi natijasida olingan birikmalar g'ayritabiiy darajada yuqori kislotalik qiymatlariga ega. IN ilmiy dunyo ular deyiladi: murakkab protik kislotalar.
Sehrli kislota
Ha. Hammasi to'g'ri. Sehrli kislota. Bu shunday deyiladi. Sehrli kislota vodorod ftorid yoki ftorsulforik kislotaning antimon pentaflorid bilan aralashmasidir. Kimyoviy formula Ushbu ulanish rasmda ko'rsatilgan:

Bu g'alati ism Sehrli kislota 1960-yillarning boshida kimyogarlarning Rojdestvo bayramida olingan. J. Olahning tadqiqot guruhi a'zolaridan biri bu ajoyib suyuqlikda mumli shamni eritib, kulgili nayrang ko'rsatdi. Bu yangi avlodning eng kuchli kislotalaridan biri, ammo kuchliligi va kislotaligi bo'yicha undan oshib ketadigan modda allaqachon sintez qilingan.
Dunyodagi eng kuchli kislota
Karboran kislotasi karboran kislotasi bo'lib, u dunyodagi eng kuchli birikma hisoblanadi. Eng kuchli kislota formulasi quyidagicha ko'rinadi: H(CHB11Cl11).
Ushbu yirtqich hayvon 2005 yilda Kaliforniya universitetida Novosibirsk Kataliz instituti SB RAS bilan yaqin hamkorlikda yaratilgan.
Sintez g'oyasi olimlarning ongida yangi, shu paytgacha ko'rilmagan molekulalar va atomlar orzusi bilan birga paydo bo'ldi. Yangi kislota sulfat kislotadan million marta kuchliroq, ammo u umuman agressiv emas va eng kuchli kislotani shisha idishda osongina saqlash mumkin. To'g'ri, vaqt o'tishi bilan shisha eriydi va harorat oshishi bilan bu reaktsiya tezligi sezilarli darajada oshadi.

Bu ajoyib yumshoqlik yangi birikmaning yuqori barqarorligi bilan bog'liq. Barcha kislotali kimyoviy moddalar singari, karboran kislotasi ham o'zining yagona protonini berib, oson reaksiyaga kirishadi. Bunda kislota asos shunchalik barqarorki, kimyoviy reaksiya bundan keyin ham davom etmaydi.
Karboran kislotaning kimyoviy xossalari
Yangi kislota ajoyib H+ proton donori hisoblanadi. Bu moddaning kuchini belgilaydigan narsa. Karboran kislotasi eritmasi dunyodagi boshqa kislotalarga qaraganda ko'proq vodorod ionlarini o'z ichiga oladi. IN kimyoviy reaksiya SbF 5 - antimon pentaflorid, ftor ylonini bog'laydi. Bunday holda, ko'proq vodorod atomlari ajralib chiqadi. Shuning uchun karboran kislotasi dunyodagi eng kuchli hisoblanadi - uning eritmasidagi protonlarning suspenziyasi sulfat kislotadan 2 × 10 19 marta ko'pdir.
Biroq kislotali asos Bu aloqa hayratlanarli darajada barqaror. Ushbu moddaning molekulasi o'n bitta brom atomidan va bir xil miqdordagi xlor atomidan iborat. Kosmosda bu zarralar murakkab, geometrik muntazam figurani hosil qiladi, bu ikosahedr deb ataladi. Atomlarning bunday joylashuvi eng barqaror hisoblanadi va bu karboran kislotasining barqarorligini tushuntiradi.

Karboran kislotasining ma'nosi
Dunyodagi eng kuchli kislota o'z ijodkorlariga munosib mukofotlar va ilmiy dunyoda e'tirofga sazovor bo'ldi. Yangi moddaning barcha xususiyatlari to'liq tushunilmagan bo'lsa-da, bu kashfiyotning ahamiyati laboratoriyalar va tadqiqot institutlari doirasidan tashqariga chiqishi allaqachon ayon bo'lmoqda. Karboran kislotasi turli sanoat reaktsiyalarida kuchli katalizator sifatida ishlatilishi mumkin. Bundan tashqari, yangi kislota eng o'jar kimyoviy moddalar - inert gazlar bilan o'zaro ta'sir qilishi mumkin. Hozirgi vaqtda ksenonning reaksiyaga kirishishi uchun ish olib borilmoqda.
Shubhasiz, yangi kislotalarning ajoyib xususiyatlari fan va texnikaning turli sohalarida qo'llanilishini topadi.
Ko'p kislotalar mavjud, ular hatto minimal miqdorda ham odamlar uchun xavf tug'diradi. Ko'pchilik sulfat kislota eng xavfli ekanligiga ishonishadi, ammo bu mutlaqo to'g'ri emas. Karboran kislotasi eng kuchli hisoblanadi, uni faqat maxsus idishlarda saqlash mumkin. U sulfat kislotadan ko'p marta kuchliroqdir va boshqa kimyoviy moddalarga chidamli bo'lgan metallar, shisha va boshqa moddalarni tezda eritib yuborish imkonini beradi. Ammo agar karboran kislotasi juda kam uchraydi va faqat laboratoriya sharoitida bo'lsa, unda siz boshqa kuchli moddaga duch kelishingiz mumkin. Kundalik hayot. Ko'pgina mutaxassislarning fikriga ko'ra, eng zaharli kislota gidrosiyan kislotasi bo'lib, uni nafaqat laboratoriyada, balki oziq-ovqat mahsulotlarida ham topish mumkin.
Qanday qilib zaharlanish mumkin?
Hidrosiyan kislotasi juda zaharli hisoblanadi. Inson tanasiga kirganda, zaharlanish belgilari juda tez paydo bo'ladi. Ushbu modda tanaga uni o'z ichiga olgan mahsulotlar bilan, shuningdek, siyanid bilan ishlov berilgan mahsulotlar bilan kirishi mumkin.
Ushbu zaharli moddaning ko'p qismi bodomda mavjud. Umumiy miqdor 3% gacha yetishi mumkin. Biror kishi zaharlanish uchun faqat bir hovuch bodom yeyishi kerak. Bundan tashqari, bu xavfli modda rezavorlar va ba'zi mevalarning urug'larida mavjud. Aksariyat kislotalar tarkibida:
- shaftoli - 2,8% gacha;
- o'rik - 1,6% gacha;
- olxo'ri - 0,95% gacha;
- gilos - taxminan 0,8%;
- olma - taxminan 0,6%.
Bodom donalari va meva yadrolarida gidrosiyan kislotasi sof shaklda emas, balki amigdalin glikozid shaklida mavjud. Aynan shu modda yong'oqlarga o'ziga xos ta'm va xushbo'ylikni beradi. Inson tanasida bir marta amigdalin uchta komponentga bo'linadi, ulardan biri gidrosiyan kislotasi. Achchiq bodom bu moddaga ayniqsa boy, shuning uchun kattalar bu mahsulotni oz miqdorda iste'mol qilishlari mumkin, lekin bolalar uni umuman iste'mol qilmasliklari kerak.
Urug'li rezavorlar va mevalardan tayyorlangan sharoblar katta xavf tug'diradi. Chuqur, olxo'ri va o'rik bilan gilos bilan to'ldirilgan sharob zaharlanishga olib kelishi mumkin.
Urug'lar bilan birga rezavorlardan tayyorlangan kompotlar va murabbo sog'liq uchun xavf tug'dirmaydi. 80 gradusgacha qizdirilganda gidrosiyan kislotasi xavfsiz komponentlarga parchalanadi.
Qanchalik kislota zaharlanishga olib keladi
 Zaharlanish uchun ovqatlanishingiz kerak bo'lgan oziq-ovqat miqdori sezilarli darajada farq qilishi mumkin. Bu odamning yoshiga, tana vazniga, umumiy holat salomatlik va surunkali patologiyalarning mavjudligi. Ammo amal qilish kerak bo'lgan o'rtacha ko'rsatkichlar mavjud.
Zaharlanish uchun ovqatlanishingiz kerak bo'lgan oziq-ovqat miqdori sezilarli darajada farq qilishi mumkin. Bu odamning yoshiga, tana vazniga, umumiy holat salomatlik va surunkali patologiyalarning mavjudligi. Ammo amal qilish kerak bo'lgan o'rtacha ko'rsatkichlar mavjud.
Agar siz 30 ta bodom yong'og'i, 50 dan ortiq o'rik yadrosi, 70 dan ortiq olxo'ri yoki olcha yadrosini iste'mol qilsangiz, kuchli intoksikatsiya paydo bo'lishi mumkin. Agar siz 100 dan ortiq olma urug'ini iste'mol qilsangiz, zaharlanishingiz mumkin.
Zaharli kislotaning o'zi ta'siri ostida o'limga olib keladigan zaharlanish paydo bo'lishi mumkin. Amigdalinning kritik dozasi inson tanasining kilogrammiga 1 mg ni tashkil qiladi. O'limga olib keladigan zaharlanish uchun 40 dona achchiq bodom yoki 100 dona o'rik yadrosini iste'mol qilish kifoya.
O'zgarmagan shaklda bodom yong'oqlarini chindan ham yaxshi ko'radigan gurmeler noziklikni faqat ixtisoslashgan do'konlarda sotib olishlari kerak. Paketda ishlab chiqaruvchi va mahsulot tarkibi haqidagi barcha ma'lumotlar bo'lishi kerak. Hatto shirin bodom ham ortiqcha iste'mol qilinsa, zaharlanishga olib keladi.
Achchiq bodom endi faqat ma'lum dori-darmonlar va kosmetika mahsulotlarini ishlab chiqarishda qo'llaniladi. Bunday yong'oqlar amalda iste'mol qilinmaydi.
Zaharlanish belgilari
Hidrosiyan kislotasi bir marta qonga kirib, qizil qon tanachalari bilan aloqa qiladi, shu bilan birga kislorodning ajralishini va uning to'qimalarga keyingi o'tkazilishini bloklaydi. Shu sababli qondagi kislorod miqdori juda ko'payadi, ammo u organlarga umuman etib bormaydi, bu esa gipoksiyaga olib keladi. Miya birinchi navbatda ta'sir qiladi. Ushbu organning barcha funktsiyalari jiddiy ravishda inhibe qilinadi va organizmdagi barcha tizimlar va boshqa muhim organlarning ishi buziladi.
Ushbu kislota bilan zaharlanganda quyidagi xarakterli belgilar paydo bo'ladi:
- teri va barcha shilliq pardalar yorqin pushti rangga aylanadi;
- kuchli bosh og'rig'i, shuningdek, bosh aylanishi, lablar xiralashadi va o'quvchilar kengayadi;
- nomutanosiblik mavjud, odam odatdagidek oyoqqa turolmaydi, harakatlarni muvofiqlashtirish buziladi;
- yurak urish tezligi nafas olish kabi tezlashadi;
- jabrlanuvchi ko'krak qafasidagi og'riq va nafas qisilishi his qiladi;
- ko'ngil aynishi va qusish paydo bo'ladi;
- og'izda metall ta'mi va achchiqligi bor;
- nazoratsiz ichak harakatlari bo'lishi mumkin.
Jabrlanuvchi achchiq bodomning o'ziga xos hidini chiqaradi, uning yordamida odam zaharlanganligini aniqlash mumkin. Vaziyat juda og'ir bo'lsa, u holda tez nafas olish tezda sekin puls bilan almashtiriladi. Nafas olish markazining falaji yuzaga keladi, konvulsiyalar boshlanadi.
Agar gidrosiyan kislotasi bilan zaharlangan bo'lsa, jabrlanuvchiga 3 daqiqa ichida yordam ko'rsatilmasa, o'lim sodir bo'ladi.
Tezkor yordam
Kuchli kislota - gidrosiyan kislotasi bilan zaharlanish bo'lsa, darhol tez yordam chaqirishingiz kerak. Shifokorlar kelishidan oldin jabrlanuvchiga birinchi yordam ko'rsatiladi, bu quyidagi chora-tadbirlardan iborat:

Hidrosiyan kislotasi uchun antidot metilen ko'kning kuchsiz eritmasi hisoblanadi. Ushbu vosita odatda shoshilinch shifokorlar tomonidan beriladi.
Birinchi yordam ko'rsatilgandan so'ng, jabrlanuvchini barcha qattiq kiyimlardan olib tashlash va yotoqqa yotqizish, boshini yostiq bilan ko'tarish kerak. Agar odamda ongi chalkash bo'lsa, unda ammiak bilan namlangan paxta sumkasini hidlash tavsiya etiladi. Ammiak, qonga bir marta kirib, kislotani zararsizlantiradi.
Agar odamda nafas olish yoki puls bo'lmasa, imkon qadar tezroq ko'krak qafasini siqish va sun'iy nafas olishni amalga oshirish kerak. Bunday chora-tadbirlar hayotiy jarayonlar to'xtatilgandan keyin birinchi daqiqalarda amalga oshirilishi kerak.
Kasalxona sharoitida bemorga normal qon aylanishini tiklash uchun antikonvulsanlar, antidotlar va preparatlar qo'llaniladi. Tiklanish jarayonida bemorga vitaminlar majmuasi buyuriladi.
Hidrosiyan kislotasi bilan zaharlangandan so'ng, odam bir muddat jismoniy va ruhiy stressdan qochishi kerak. Bu vaqtda bemorga ko'p miqdorda suyuqlik, jumladan sut ichish tavsiya etiladi. Shuningdek, siz toza havoda ko'p yurishingiz, muvozanatli dietaga rioya qilishingiz va barcha yomon odatlardan voz kechishingiz kerak.
Fanning jadal rivojlanishi olimlarga fizika, kimyo va boshqa sohalarda yangi shov-shuvli kashfiyotlar qilish imkonini beradi. Ilmiy dunyo noyob, ilgari ko'rilmagan xususiyatlarga ega yangi moddalarning yaratilishi haqidagi yangiliklardan muntazam ravishda hayratda. Albatta, oddiy odamlar har doim ham bunday kashfiyotlarga ergashmaydi. Dunyodagi eng kuchli kislota 2005 yilda Amerikada yaratilganini hamma ham bilmaydi. Ko'pchilik uchun bu kimyoviy moddalarning eng kuchlisi maktabda yaxshi o'rganilgan sulfat kislota bo'lib qoladi.
Karboran kislotasi dunyodagi eng kuchli hisoblanadi
2005 yilda AQShning Kaliforniya universitetida ishlaydigan olimlar misli ko'rilmagan kuchli yangi kislota yaratishga muvaffaq bo'lishdi. Ixtiro qilingan birikma konsentrlangan sulfat kislotadan million marta kuchliroqdir. Olimlar o'sha paytda ilmiy olamda haqiqiy kashfiyotga aylanadigan yangi molekulani topishga kirishdilar va ijobiy natijaga erishdilar.
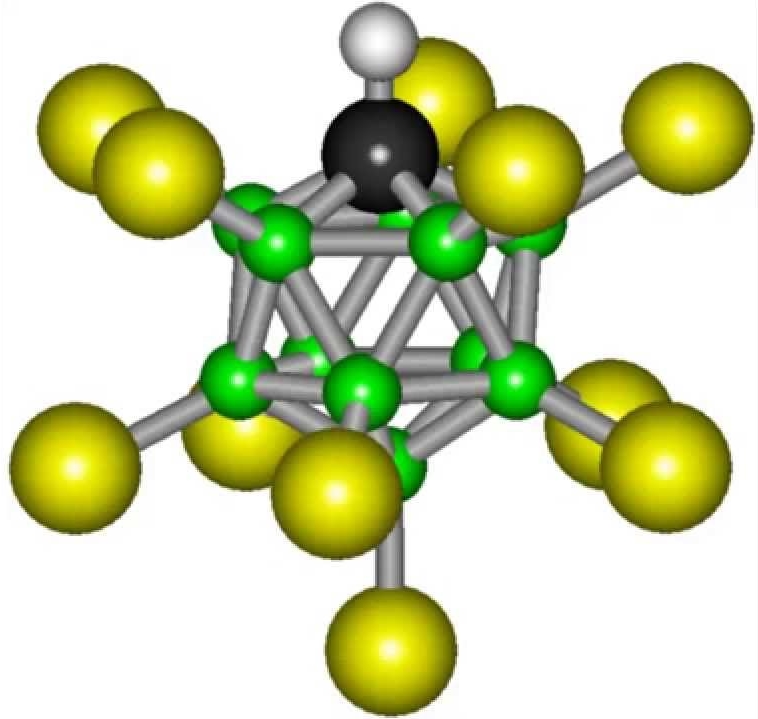
Karboran kislotasining formulasi unchalik murakkab emas: H(CHB11Cl11). Ammo oddiy laboratoriyada bunday moddani sintez qilish hali ham mumkin bo'lmaydi. Karboran kislotasi oddiy suvdan trillion martadan ko'proq kislotali.
Eng kuchli kislotaning o'ziga xos xususiyati
Agar biror joyda dunyodagi eng kuchli kislota tilga olinadigan bo'lsa, inson tasavvuri o'z yo'lidagi hamma narsani eritib yuboradigan moddani tasavvur qiladi. Aslida, halokatli xususiyatlar kimyoviy moddaning kuchining asosiy belgisi emas. Masalan, ko'pchilik eng kuchli kislota gidroflorik kislota ekanligiga ishonishgan, chunki u shishani eritadi. Ammo bu haqiqatdan uzoqdir. Hidroflorik kislota shisha idishlarni korroziyaga olib keladi, lekin uni polietilen idishlarda saqlash mumkin.

Dunyodagi eng kuchli karbon kislotasi sifatida e'tirof etilgan uni shisha idishlarda osongina saqlash mumkin. Gap shundaki, bu kimyoviy muhim kimyoviy barqarorlik bilan ajralib turadi. Boshqa shunga o'xshash birikmalar singari, karboran kislotasi reagentlar bilan reaksiyaga kirishganda, zaryadlangan vodorod atomlarini chiqaradi. Bunday reaktsiyadan so'ng kompozitsiya engil salbiy zaryadga ega va atrofdagi materiallarga halokatli ta'sir ko'rsatmaydi.
Karboran kislotasi bilan keyingi ish
Albatta, karboran kislotasini yaratuvchilar jahon ilmiy hamjamiyatida yaxshi ma'lum bo'ldi. Bundan tashqari, ilm-fan rivojiga qo'shgan ulkan hissasi uchun ajoyib olimlar ko'plab munosib mukofotlar bilan taqdirlangan. Yangi moddadan foydalanish endi ilmiy laboratoriyalar bilan cheklanmaydi: karboran kislotasi sanoatda kuchli katalizator sifatida ishlatiladi.

Dunyodagi eng kuchli kislotaning o'ziga xos xususiyati uning inert gazlar bilan o'zaro ta'sir qilish qobiliyatidir. Bugungi kunda ksenon va karboran kislotasi o'rtasidagi reaktsiya ehtimolini aniqlash uchun ko'plab tadqiqotlar olib borilmoqda. Olimlar eng kuchli kislotaning boshqa xususiyatlarini ham o‘rganish ustida tinim bilmay ishlamoqda.
Eng mashhur kuchli kislota
Olimlar karboran kislotasini yaxshi bilishadi. Oddiy odamlar ko'pincha sulfat kislota eng kuchli ekanligiga ishonishadi. Bu sanoatda moddaning tez-tez ishlatilishi bilan bog'liq. Ko'pincha mineral o'g'itlar ishlab chiqaruvchilari tomonidan superfosfatlar va ammoniy sulfatlar ishlab chiqarish uchun foydalaniladi.
Sulfat kislota metallurgiya sanoatida keng qo'llaniladi. Bundan tashqari, metallarni oksidlanishdan tozalash uchun ham ishlatiladi. Suyuq yoqilg'i ishlab chiqarishni sulfat kislota ishlatmasdan amalga oshirish mumkin emas. U quyidagi mahsulotlarni tozalash uchun ishlatilishi mumkin:
- moylash moylari;
- kerosin;
- kerosin;
- mineral yog'lar.

Biroq, ko'pchilikni sulfat kislota dunyodagi eng kuchli ekanligiga ishontiradigan narsa nafaqat sanoatda qo'llanilishi. Bu fikr moddaning tana go'shtiga tushganda uni o'zlashtirishi sababli shakllangan. Sulfat kislotaning bu xususiyati ko'pincha jinoyat filmlarini suratga olishda qo'llaniladi.
Eng kuchli organik kislota
Agar organik kimyoda eng kuchli kislota haqida gapiradigan bo'lsak, unda bu erda etakchilik formik kislotaga tegishli. Ushbu modda chumolilar sekretsiyasida topilgani uchun shunday nomlandi. Formik kislota keng qo'llanilishiga ega. Ko'pincha tibbiyotda qo'llaniladi, chunki u og'riq qoldiruvchi va tirnash xususiyati beruvchi xususiyatlarga ega. Formik kislota ko'karishlar, varikoz tomirlari va shishishni davolash uchun ishlatiladigan ko'plab malhamlarda mavjud. Ushbu moddani o'z ichiga olgan dorilar aknedan xalos bo'lishga yordam beradi.

Chumoli kislota kimyo sanoatida ham keng qo'llaniladi. U qishloq xo'jaligi va asalarichilikda ham qo'llaniladi. Ushbu modda oziq-ovqatda E236 qo'shimchasi sifatida ham qo'llaniladi.
Tarqalganligiga qaramay, formik kislota jiddiy xavf tug'dirishi mumkin. Konsentrlangan moddaning teriga tegishi kuyish yoki kuchli og'riqlarga olib keladi. Hatto chumoli kislota bug'ini nafas olish nafas yo'llariga zarar etkazishi mumkin. Ammo moddaning ijobiy xususiyati shundaki, u organizmda to'planmasdan tezda chiqariladi.
Ko'p odamlar o'zlari uchun eng kuchli kislota degan savolga javob topishga harakat qilmoqdalar. Buni tushunish juda qiyin emas, lekin siz maxsus adabiyotlarni o'qishingiz kerak. Faqat javobni bilmoqchi bo'lganlar uchun bu savol, bu maqola yozilgan.
Ko'p odamlar eng kuchli kislota gidroflorik kislota deb hisoblashadi, chunki u shishani eritishi mumkin. Bu hukm amalda asossizdir. Boshqalarning tushunishida eng kuchli kislota sulfat kislotadir. Oxirgi bayonotda to'liq mantiqiy tushuntirish mavjud. Gap shundaki, sanoatda ishlatiladiganlar orasida sulfat kislota juda kuchli. Tirik to'qimalar bilan aloqa qilganda, u go'shtni kuyishi va shifolash uchun uzoq vaqt talab qiladigan va muammoli bo'lgan og'ir kuyishlarni qoldirishi mumkin. Uni ishlab chiqarish maxsus moddiy xarajatlarni talab qilmaydi. Va ishonch bilan aytish mumkinki, u eng kuchli emas. Fan o'ta kislotalar deb ataladigan narsalarni biladi. Biz ular haqida batafsilroq gaplashamiz. Ammo uy sharoitida kuchli kislotalarning eng keng tarqalgani hali ham sulfat kislotadir. Shuning uchun u xavfli.
Xo'sh, qanday qilib kislota kuchli va yumshoq bo'lishi mumkin? Javob kimyogarlar kislotaning kuchini qanday aniqlashda. Kislota kuchi - kislotaning asosiy molekulalarga vodorod ionini qo'shish qobiliyati. Yana bir misol - mis choynak ichidagi ohak konlarini tozalash uchun kislota tanlash, dedi u. Aqlli uy egasi nitrat kislotadan ko'ra xlorid kislotani tanlaydi, chunki xlorid kislotaning xlorli qismi misga hujum qilmaydi, nitrat kislotaning nitrat qismi esa choynakni zaharli jigarrang bug'lar bilan eritib yuboradi.
Ko'pgina zamonaviy kimyogarlar dunyodagi eng kuchli kislota karboran deb hisoblashadi. Buni chuqur tadqiqot natijalari tasdiqlaydi. Bu kislota konsentrlangan sulfat kislotadan million marta kuchliroqdir. Uning ajoyib xususiyati probirkada saqlanish qobiliyati bo'lib, yuqorida sanab o'tilgan qatordagi boshqa ko'plab moddalarga ega emas. Eng kostik deb hisoblangan kimyoviy tarkibni shisha idishlarda saqlab bo'lmaydi. Gap shundaki, karboran kislotasi sezilarli kimyoviy barqarorlikka ega. Unga o'xshash boshqa moddalar singari, boshqa reagentlar bilan reaksiyaga kirishganda, u vodorod atomlarini ularga zaryad bilan beradi. Biroq, reaktsiyadan keyin qolgan kompozitsiya, garchi u manfiy zaryadga ega bo'lsa-da, juda barqaror va bundan keyin harakat qila olmaydi. Karboran kislotasi oddiy formulaga ega: H (CHB 11 Cl 11). Ammo oddiy laboratoriyada tayyor moddani olish oson emas. Shunisi e'tiborga loyiqki, u oddiy suvdan trillion martadan ko'proq kislotali. Ixtirochining fikricha, bu modda yangi kimyoviy moddalarning rivojlanishi natijasida paydo bo'ldi.
Yangi "kuchli, ammo yumshoq" kislotalar karbonat kislotalar deb ataladi. Ularning kuchining siri ikki xil. Eng muhimi, kislotaning karbonat qismi o'ta zaif asos bo'lib, ftorsulfat kislotaning ftorsulfat qismidan kuchsizroq bo'lib, u eng kuchli kislota bo'yicha oldingi rekordchi edi. Ikkinchidan, karboranlar ajoyib kimyoviy barqarorlikka ega.
Ridning so'zlariga ko'ra, ular o'n bitta bor atomidan va bitta uglerod atomidan iborat ikosahedral joylashuvga ega, bu, ehtimol, barcha kimyodagi atomlarning kimyoviy jihatdan eng barqaror klasteridir. Bu shuni anglatadiki, kislotaning karboran qismi gidroflorik kislotada ftorid va nitrat tomonidan namoyon bo'ladigan korroziya va parchalanish kimyosida ishtirok eta olmaydi. azot kislotasi. Natijada, karbon kislotalari hosil bo'ladigan ko'pincha nozik, musbat zaryadlangan molekulalarni yo'q qilmasdan, zaif asosli molekulalarga vodorod ionlarini qo'shishi mumkin.
Eng kostik moddalar ro'yxati gidroflorik, gidroflorik va boshqa kuchli kislotalarni o'z ichiga oladi. Sanoat reagentlari kiritilmagan. Biroq, siz hali ham oltingugurt, xlorid, azot va boshqalar kabi keng tarqalgan kislotalardan ehtiyot bo'lishingiz kerak. Men hech kimni qo'rqitmoqchi emasman, lekin bu ro'yxatdagi moddalar odatda sog'likka hujum qilish va tashqi ko'rinishni qasddan buzish uchun ishlatiladi.
Bu ularning kuchli, ammo yumshoq sifati, deya qo'shimcha qildi Rid. Ushbu musbat zaryadlangan molekulalarning hech biri avval xona haroratida "shisha"lanmagan, chunki ilgari ishlatilgan kislotalar ularni parchalagan. Ridning ta'kidlashicha, kuchli, ammo yumshoq karbonat kislotalari bu qiyinchilikni engib, kimyogarlarga mavjudligi odatda tez o'tadigan muhim molekulalarni yaqindan ko'rib chiqishga imkon beradi. Kislotalangan molekulalar oziq-ovqat hazm qilish, benzinni yaxshilash, polimer hosil qilish va farmatsevtik sintezni o'z ichiga olgan juda ko'p kislotali katalizlangan kimyoviy o'zgarishlarda muhim qisqa muddatli oraliq mahsulotlardir.
 oziq-ovqatlarda mavjud bo'lgan yog' kislotalari orasida chumoli kislotasi eng kuchli hisoblanadi. Ko'pincha sabzavotlarni saqlash va dorivor maqsadlarda ishlatiladi, lekin faqat eritma shaklida.
oziq-ovqatlarda mavjud bo'lgan yog' kislotalari orasida chumoli kislotasi eng kuchli hisoblanadi. Ko'pincha sabzavotlarni saqlash va dorivor maqsadlarda ishlatiladi, lekin faqat eritma shaklida.
Yana shuni aytish kerakki, eng kuchli kislota karborandir. Ammo bugungi kunda sanoatda va kundalik hayotda ishlatiladigan moddalardan ehtiyot bo'lishimiz kerak. Kimyo juda foydali va murakkab fan, ammo oddiy birikmalarni keng ishlab chiqarish maxsus bilimlarni talab qilmaydi va shuning uchun etarli miqdorda kislota olish oson. Bu ehtiyotsizlik bilan muomala qilish yoki yomon niyatlarni amalga oshirish xavfini oshiradi.
Karbon kislotalari qanchalik kuchli? Ularning eng kuchlisi konsentrlangan sulfat kislotadan kamida million marta va avvalgi rekordchi ftorsulfat kislotadan yuzlab marta kuchliroqdir. Konsentrlangan sulfat kislota allaqachon suyultirilgan hovuz kislotasi yoki oshqozon kislotasidan bir milliard marta kuchliroqdir. Karbonat kislotalarining kislotaligiga teng yoki undan yuqori kislotali muhitlar ilgari surma pentafloridni ftorsulfat kislotaga qo'shish orqali erishilgan, ammo bu aralashmalar juda korroziv va boshqa cheklovlarga ega.
Kimyo tilida gapiradigan bo'lsak, kislotalar vodorod kationlarini chiqarish qobiliyatini namoyon qiluvchi moddalar yoki hosil bo'lish natijasida elektron juftini qabul qilish qobiliyatiga ega bo'lgan moddalardir. kovalent bog'lanish. Biroq, oddiy suhbatda kislota ko'pincha suvli eritmalarda hosil bo'lganda H30+ ning ortiqcha miqdorini hosil qiladigan birikmalar sifatida tushuniladi. Eritmada bu kationlarning mavjudligi moddaga nordon ta'm va indikatorlarga reaksiyaga kirishish qobiliyatini beradi. Ushbu materialda qaysi moddaning eng kuchli kislota ekanligi haqida gapiramiz, shuningdek, boshqa kislotali moddalar haqida gapiramiz.
Bunday kuchli kislotalar superkislotalar deb ataladi va ular uglevodorodli kreking deb ataladigan jarayonda neftdagi uglevodorodlar bilan reaksiyaga kirishadi. Bu benzinning oktan darajasini oshirishda muhim jarayondir. Ridning aytishicha, yangi kislotalar bu jarayonni tushunish va takomillashtirishda juda muhim bo'lishi mumkin. Karboran kislotalari bu sohani yanada uzoqroqqa olib boradi.
Eng mashhur kuchli kislota
An'anaviy kislotalar bilan tartibsiz reaksiyaga kirishadigan va shuning uchun juda foydali bo'lmagan ko'plab boshqa molekulalar mavjud. Karboran kislotalari hech qanday vahshiyliksiz juda toza kislotalikni ta'minlaydi. Shunday qilib, farmatsevtika va neft mahsulotlarini ishlab chiqarish uchun muhim bo'lgan reaktsiyalarning toza kislotali katalizlanishi mumkin bo'lishi kerak.
Hidroflorik kislota antimon pentaflorid (HFSbF5)
Moddaning kislotaliligini tavsiflash uchun vodorod ionlari kontsentratsiyasining manfiy o'nlik logarifmi bo'lgan PH ko'rsatkichi mavjud. Oddiy moddalar uchun bu ko'rsatkich 0 dan 14 gacha. Biroq, bu ko'rsatkich HFSbF5 ni tavsiflash uchun mos emas, bu ham "super kislota" deb ataladi.
Rid deydi: Bizning tadqiqotimiz ilgari hech qachon yaratilmagan molekulalarni yaratishni o'z ichiga oladi. Karboran kislotalari buni amalga oshirishga imkon beradi. Bu tadqiqotning haqiqiy qiymati. Ilm-fan rivojlanadi va shu bilan birga talabalar olim bo'lishlari bilan kashfiyot hayajonini boshdan kechiradilar.
Kaliforniya universiteti, Riversayd, doktorlik nomzodi tadqiqot universiteti, Janubiy Kaliforniyaning ichki qismi, shtat va butun dunyodagi jamoalar uchun muhim masalalar bo'yicha innovatsion tadqiqotlar uchun jonli laboratoriya. Kuchli kislota pH qiymati sifatida aniqlanadi, bu kislotani kuchli qiladigan vodorodning kuchidir. Biroq, pH qiymati ortib borayotgan tartibda ishlamaydi. PH qiymati qanchalik past bo'lsa, kislota kuchliroq bo'ladi. PH shkalasi 1 dan 7 gacha bo'lgan pH qiymati 7 dan kam bo'lgan eritmalar kislotalar, pH 7 dan yuqori bo'lgan eritmalar esa asoslar hisoblanadi.
Ushbu moddaning faolligi to'g'risida aniq ma'lumotlar yo'q, ammo ma'lumki, hatto HFSbF5 ning 55% eritmasi ham oddiy odamlarda eng kuchli kislotalardan biri hisoblangan konsentrlangan H2SO4 dan deyarli 1 000 000 marta kuchliroqdir. Biroq, surma pentaflorid juda kam uchraydigan reagent bo'lib, moddaning o'zi faqat laboratoriya sharoitida yaratilgan. U sanoat miqyosida ishlab chiqarilmaydi.
Eng kuchli kislotalar ro'yxati va ulardan foydalanish
PH qiymati 1 dan past bo'lgan kislotalar eng kuchli deb hisoblanadi va pH qiymati 13 dan yuqori bo'lgan eritmalar kuchli asos hisoblanadi. pH qiymati 2 va foydali kislotalardan biri hisoblanadi. Unda mavjud bo'lgan tatarning tuzi yoki kremi sharob tayyorlash paytida tabiiy ravishda rivojlanadi. U natriy bikarbonat bilan aralashtiriladi va pishirilgan mahsulotlar sifatida sotiladi. U pishirishda ishlatiladi va o'ziga xos nordon ta'mga ega.
Bu shisha qopqog'ida yoki pastki qismida topilgan olmoslarning manbai ekanligi haqiqatdir. Bu sifatida ishlatiladi organik birikma, va u barcha tirik organizmlar yordamida ishlab chiqariladi. Ushbu shirinliklar ular haqida ogohlantirishlarga ega bo'lib, mijozlarga og'iz tirnash xususiyati keltirishi mumkinligi haqida xabar beradi. Limon odatda limonda mavjud va pH qiymatiga ega. U odatda tsitrus mevalarida uchraydi, shuningdek, aerob organizmlarning metabolizmida yuzaga keladigan limon kislotasi siklida oraliq mahsulot vazifasini bajaradi.Bu kuchli va qutulish mumkin bo'lgan kislota bo'lib, oziq-ovqat va ichimliklar lazzatlarida, masalan, alkogolsiz ichimliklarda ishlatiladi. va limonadlar.
Karboranoik kislota (H(CHB11Cl11))
Yana bir super kislota. H(CHB11Cl11)) maxsus idishlarda saqlanishi mumkin bo'lgan dunyodagi eng kuchli kislotadir. Moddaning molekulasi ikosahedr shakliga ega. Karboran kislotasi sulfat kislotadan ancha kuchli. U metallarni va hatto shishani ham eritishi mumkin.
Ushbu modda Amerika Qo'shma Shtatlaridagi Kaliforniya universitetida Novosibirsk katalitik jarayonlar instituti olimlari ishtirokida yaratilgan. Amerika universiteti xodimlaridan biri aytganidek, yaratilish g'oyasi avval hech kimga noma'lum bo'lgan molekulalarni yaratish istagi edi.
U muzqaymoqqa qo'shiladi, u erda yog'larning chiqishiga to'sqinlik qiluvchi emulsifikator vazifasini bajaradi. Bundan tashqari, tozalash vositasi sifatida ishlaydi va bug'lanish moslamalari va qozonlardan ohakni olib tashlash uchun ishlatilishi mumkin. U suvni yumshatadi, uni kir yuvish vositalari va sovunlarni tayyorlashda foydali qiladi. U hidsiz va kosmetika va parhez qo'shimchalarida ishlatilishi mumkin.
Demak, u sanoat va mahalliy mahsulotlarning keng assortimentida qo'llaniladi. Oltingugurt oltingugurt deb ham ataladi; pH qiymati 5 va bu kimyoviy birikma. Uning eritmada mavjudligini tasdiqlovchi dalillar kam, lekin u gaz fazasida mavjud. Buning uchun asoslar odatiy anionlar, bisulfat va sulfitdir. U kamaytiruvchi va dezinfektsiyalovchi sifatida ishlaydi. Ular, shuningdek, engil oqartiruvchi sifatida ishlaydi va xlorli oqartirgichlar tomonidan yo'q qilingan materiallarga yordam berishi mumkin.
H(CHB11Cl11)) ning mustahkamligi uning vodorod ionini mukammal tarzda berishi bilan bog‘liq. Ushbu moddaning eritmalarida bu ionlarning konsentratsiyasi boshqalarga qaraganda ancha yuqori. Molekulaning boshqa qismi, vodorod ajralib chiqqandan so'ng, o'n bitta uglerod atomini o'z ichiga oladi, ular ikosahedrni tashkil qiladi, bu korroziya inertligini oshiradigan ancha barqaror tuzilishdir.
pH qiymati 5 va u mineral kislotadir. Stomatologik mahsulotlarda ishlatiladigan zang inhibitori oziq-ovqat qo'shimchasi elektrolitlar agenti disperslash agenti uy tozalash mahsulotlarida qo'llaniladigan sanoat etch. Bundan tashqari, u kristalli qattiq moddadir, qaytaruvchi vosita sifatida ishlaydi va konjugatsiya qiluvchi asosga ega.
Yana bir kuchli kislota ko'proq tanish vodorod ftoriddir. Sanoat uni yechimlar shaklida ishlab chiqaradi, ko'pincha qirq, ellik yoki etmish foiz. Ushbu modda o'z nomini vodorod ftorid uchun xom ashyo bo'lib xizmat qiluvchi florspatga bog'liq.
Ushbu moddaning rangi yo'q. H20 da eritilganda issiqlikning sezilarli darajada chiqishi sodir bo'ladi. Past haroratlarda HF suv bilan kuchsiz birikmalar hosil qilishga qodir.
U havodan namlikni yutadi va rangsiz kristall qattiq moddadir. U sirop hosil qiladi va yuqori haroratda chiqarilganda suvda eriydi. Bu pH qiymati 0 va u rangsiz suyuqlikdir. uchun ishlatiladi. Noorganik va organik nitratlar ishlab chiqarish O'g'itlar uchun nitro birikmalarini ishlab chiqarish Bo'yoqlar-oraliq mahsulotlar Organik kimyoviy moddalar Portlovchi moddalar. Agar odam doimo bug'larga duchor bo'lsa, u kimyoviy penomonit va surunkali bronxitga olib kelishi mumkin.
Ushbu modda shisha va boshqa ko'plab materiallarni korroziyaga olib keladi. Uni tashish uchun polietilen ishlatiladi. Aksariyat metallar bilan juda yaxshi reaksiyaga kirishadi. Parafin bilan reaksiyaga kirishmaydi.
Juda zaharli va giyohvandlik ta'siriga ega. Yutilgan bo'lsa, u o'tkir zaharlanishga, gematopoezning buzilishiga, organ etishmovchiligiga va nafas olish tizimining buzilishiga olib kelishi mumkin.
Bu rangsiz suyuqlik bo'lib, suvga tushganda oq bug'lar chiqaradi. Ushbu kislotaning yana ikkita nomi oltingugurt oksidi va sulfat angidriddir. U kimyoviy moddalar va portlovchi moddalar ishlab chiqarishda keng qo'llaniladi. Masalan, sintetik yuvish vositalari, dori-darmonlar, sanoat bo'yoqlari va pigmentlari, o'g'itlar va boshqalar ishlab chiqarishda qo'llaniladi. Uzoq muddatli ta'sir qilish salomatlikka salbiy ta'sir ko'rsatishi va inson tanasiga jiddiy zarar etkazishi mumkin.
Hidroklorik kislota pH qiymatiga ega. Bu agressiv va eng kuchli kislota bo'lib, u asosan laboratoriya sharoitida qo'llaniladi. Ushbu kislota hosil bo'lishi vodorod xloridni suvda eritish orqali amalga oshiriladi. U xloridlar, o'g'itlar ishlab chiqarish va o'lish kabi ko'p narsalar uchun ishlatiladi. Kislotadan foydalanishning boshqa turlari orasida to'qimachilik, galvanizatsiya va kauchuk ishlab chiqarish kiradi. Agar odam ushbu kuchli xlorid kislotaga duchor bo'lsa, unda ta'sir qilish quyidagi narsalarga olib keladi.


Modda ikki asosli kuchli kislotadir. Murakkab tarkibidagi oltingugurt eng yuqori oksidlanish darajasiga ega (ortiqcha olti). U hidsiz va rangsizdir. Ko'pincha suv yoki sulfat angidrid bilan eritmada ishlatiladi.
H2S04 olishning bir necha yo'li mavjud:
- Sanoat usuli (dioksid oksidlanishi).
- Minora usuli (azot oksidi yordamida ishlab chiqarish).
- Boshqalar (oltingugurt dioksidi bilan o'zaro ta'siridan moddani olish asosida turli moddalar, juda keng tarqalgan emas).
Konsentrlangan H2SO4 juda kuchli, ammo uning eritmalari ham jiddiy xavf tug'diradi. Qizdirilganda u juda kuchli oksidlovchi moddadir. Metallar bilan o'zaro ta'sirlashganda ular oksidlanadi. Bunda H2S04 oltingugurt dioksidigacha qaytariladi.
H2SO4 juda kostik hisoblanadi. U teriga, nafas olish yo'llariga, shilliq pardalarga va insonning ichki organlariga ta'sir qilishi mumkin. Uni nafaqat tana ichiga olish, balki bug'larini nafas olish ham juda xavflidir.
Chumoli kislotasi (HCOOH)
Bu modda bitta asosli to'yingan kislotadir. Qizig'i shundaki, uning kuchiga qaramay, u parhez qo'shimchasi sifatida ishlatiladi. Oddiy sharoitlarda u rangsiz, asetonda eriydi va suv bilan oson aralashadi.
HCOOH yuqori konsentratsiyalarda xavflidir. O'n foizdan kam konsentratsiya bilan u faqat bezovta qiluvchi ta'sirga ega. Yuqori darajalarda u to'qimalarni va ko'plab moddalarni korroziyaga olib kelishi mumkin.
Teri bilan aloqa qilganda konsentrlangan HCOOH juda kuchli kuyishga olib keladi, bu esa kuchli og'riqni keltirib chiqaradi. Moddaning bug'lari ko'zlarga, nafas olish organlariga va shilliq pardalarga zarar etkazishi mumkin. Uni ichkariga kiritish jiddiy zaharlanishni keltirib chiqaradi. Shu bilan birga, juda zaif konsentratsiyalarda kislota tanada osongina qayta ishlanadi va undan chiqariladi.

Metanol bilan zaharlanganda organizmda chumoli kislotasi ham hosil bo'ladi. Bu uning ishi bu jarayon optik asabning shikastlanishi tufayli ko'rishning buzilishiga olib keladi.
Bu modda oz miqdorda mevalarda, qichitqi o'tlar va ba'zi hasharotlarning sekretlarida uchraydi.
Azot kislotasi (HNO3)
Nitrat kislota bir asosli kuchli kislotadir. H20 bilan har xil nisbatda yaxshi aralashadi.
Ushbu modda kimyo sanoatining eng mashhur mahsulotlaridan biridir. Uni tayyorlashning bir necha usullari mavjud, ammo eng ko'p ishlatiladigan ammiakning platina katalizatori ishtirokida oksidlanishidir. HNO3 ko'pincha qishloq xo'jaligi uchun o'g'itlar ishlab chiqarishda qo'llaniladi. Bundan tashqari, u ishlatiladi harbiy soha, portlovchi moddalarni yaratishda, zargarlik sanoatida, oltin sifatini aniqlashda, shuningdek, ayrim dori vositalarini (masalan, nitrogliserin) yaratishda.

Ushbu modda odamlar uchun juda xavflidir. HNO3 bug'lari nafas yo'llari va shilliq pardalarga zarar etkazadi. Teriga tushgan kislota juda uzoq vaqt davolashni talab qiladigan yaralarni qoldiradi. Teri ham sariq rangga ega bo'ladi.
Issiqlik yoki yorug'lik ta'sirida HNO3 juda zaharli gaz bo'lgan azot dioksidiga parchalanadi.
HNO3 shisha bilan reaksiyaga kirishmaydi, shuning uchun bu material moddani saqlash uchun ishlatiladi. Kislota birinchi marta alkimyogar Jobir tomonidan olingan.