Какая кислота самая опасная. Самая сильная кислота в мире. Наиболее сильная сверхтекучесть. Самые удивительные вещества Самая сильная бескислородная кислота
Человек всегда стремился отыскать материалы, которые не оставляют никаких шансов своим конкурентам. Издревле учёные искали самые твердые материалы в мире , самые лёгкие и самые тяжелые. Жажда открытий привела к открытию идеального газа и идеально чёрного тела. Представляем вам самые удивительные вещества в мире.
1. Самое черное вещество
Самое чёрное вещество в мире называется Vantablack и состоит из совокупности углеродных нанотрубок (см. углерод и его аллотропные модификации). Проще говоря, материал состоит из бесчисленного множества «волосков», попав в которые, свет отскакивает от одной трубки к другой. Таким образом поглощается около 99,965% светового потока и лишь ничтожная часть отражается обратно наружу.
Открытие Vantablack открывает широкие перспективы применения этого материала в астрономии, электронике и оптике.
2. Самое горючее вещество
Трифторид хлора является самым горючим веществом из когда-либо известных человечеству. Является сильнейшим окислителем и реагирует практически со всеми химическими элементами. Трифторид хлора способен прожечь бетон и легко воспламеняет стекло! Применение трифторида хлора практически невозможно из-за его феноменальной воспламеняемости и невозможности обеспечить безопасность использования.
3. Самое ядовитое вещество
Самый сильный яд — это ботулотоксин. Мы знаем его под названием ботокс, именно так он называется в косметологии, где нашел свое основное применение. Ботулотоксин — это химическое вещество, которое выделяют бактерии Clostridium botulinum. Помимо того, что ботулотоксин — самое ядовитое вещество, так он ещё и обладает самой большой молекулярной массой среди белков. О феноменальной ядовитости вещества говорит тот факт, что достаточно всего 0,00002 мг мин/л ботулотоксина, чтобы на полдня сделать зону поражения смертельно опасной для человека.
4. Самое горячее вещество
Это, так называемый, кварк-глюонная плазма. Вещество было создано с помощью столкновением атомов золота при почти световой скорости. Кварк-глюонная плазма имеет температуру 4 триллиона градусов Цельсия. Для сравнения, этот показатель выше температуры Солнца в 250 000 раз! К сожалению, время жизни вещества ограничено триллионной одной триллионной секунды.
5. Самая едкая кислота
В этой номинации чемпионом становится фторидно-сурьмяная кислота H. Фторидно-сурьмяная кислота в 2×10 16 (двести квинтиллионов) раз более едкая, чем серная кислота. Это очень активное вещество, которое может взорваться при добавлении небольшого количества воды. Испарения этой кислоты смертельно ядовиты.
6. Самое взрывоопасное вещество
Самое взрывоопасное вещество — гептанитрокубан. Он очень дорогой и применяется лишь для научных исследований. А вот чуть менее взрывоопасный октоген успешно применяется в военном деле и в геологии при бурении скважин.
7. Самое радиоактивное вещество
«Полоний-210» — изотоп полония, который не существует в природе, а изготавливается человеком. Используется для создания миниатюрных, но в тоже время, очень мощных источников энергии. Имеет очень короткий период полураспада и поэтому способен вызывать тяжелейшую лучевую болезнь.
8. Самое тяжёлое вещество
Это, конечно же, фуллерит. Его твердость почти в 2 раза выше, чем у натуральных алмазов. Подробнее о фуллерите можно прочитать в нашей статье Самые твердые материалы в мире .
9. Самый сильный магнит
Самый сильный магнит в мире состоит из железа и азота . В настоящее время, широкой общественности недоступны детали об этом веществе, однако уже сейчас известно, что новый супер-магнит на 18% мощнее самых сильных магнитов применяющихся сейчас — неодимовых. Неодимовые магниты изготавливаются из неодима, железа и бора.
10. Самое текучее вещество
Сверхтекучий Гелий II почти не имеет вязкости при температурах близких к абсолютному нулю. Этим свойством обусловлено его уникальное свойство просачиваться и выливаться из сосуда, изготовленного из любого твёрдого материала. Гелий II имеет перспективы использования в качестве идеального термопроводника, в котором не рассеивается тепло.
О том, какая кислота самая сильная, спорили не одно поколение химиков. В разные времена это звание получала азотная, серная, соляная кислота. Некоторые считали, что сильнее плавиковой кислоты соединения быть не может. В последнее время получены новые соединения с сильными кислотными свойствами. Может быть, именно среди них имеется самая сильная кислота в мире? В этой статье рассмотрены характеристики наиболее сильных стойких кислот нашего времени и даны их краткие химические характеристики.
Понятие кислоты
Химия - точная количественная наука. И звание «Самая сильная кислота» должно быть обоснованно приписано тому или иному веществу. Что же может являться главным показателем, который характеризует силу любого соединения?
Для начала давайте вспомним классическое определение кислоты. В основном это слово применяется для сложных химических соединений, которые состоят из водорода и кислотного остатка. Количество атомов водорода в соединении зависит от валентности кислотного остатка. Например, в молекуле соляной кислоты присутствует лишь один атом водорода; а серная кислота уже владеет двумя атомами Н + .

Свойства кислот
Все кислоты обладают некоторыми химическими свойствами, которые можно назвать общими для данного класса химических соединений.

Во всех вышеназванных свойствах проявляется еще одно «умение» любой известной кислоты - это способность отдавать атом водорода, заменяя его на атом другого химического вещества или молекулу какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с остальными химическими элементами.
Вода и кислота
Наличие воды значительно уменьшает способность кислоты отдавать атомы водорода. Это объясняется тем, что водород способен образовывать собственные химические связи между молекулами кислоты и воды, тем самым его способность отделяться от основания меньше, чем у неразбавленных кислот.
Суперкислота
Слово «суперкислота» введен в химический словарь в 1927 году, с легкой руки знаменитого химика Джеймса Конанта.
Эталоном крепости этого химического соединения является концентрированная серная кислота. Химическое вещество или какая-либо смесь, превышающая показатель кислотности концентрированной серной кислоты, называется суперкислотой. Значение сверхкислоты определяется ее способностью придавать положительный электрический заряд любому основанию. За базовый параметр для определения кислотности принят соответствующий показатель H 2 SO 4 . Среди кислот сильного действия наблюдаются вещества с довольно необычными названиями и свойствами.
Известные сильные кислоты
Самые известные кислоты из курса неорганической химии - это йодоводородная (HI), бромоводородная (HBr), соляная (HCl), серная (H 2 SO 4) и азотная (HNO 3) кислоты. Все они обладают большим показателем кислотности и способны реагировать с большинством металлов и оснований. В этом ряду самой сильной кислотой является смесь азотной и соляной кислоты, получившая название «царская водка». Формула самой сильной кислоты этого ряда -HNO 3+3 HCl. Это соединение способно растворять даже драгоценные металлы - такие, как золото и платину.

Как ни странно, плавиковая кислота, которая представляет собой соединение водорода самым сильным галогеном - фтором, в претенденты на звание «Самая сильная кислота в химии» так и не попала. Единственной особенностью этого вещества является способность растворять стекло. Поэтому хранят такую кислоту в полиэтиленовой таре.
Сильные органические кислоты
Претенденты на титул «Самая сильная кислота в органической химии» - муравьиная и уксусная кислоты. Муравьиная кислота является самой сильной в гомологическом ряду предельных кислот. Свое название она получила из-за того, что некоторая часть ее содержится в выделениях муравьев.

Уксусная кислота чуть слабее муравьиной, но спектр ее распространения гораздо шире. Она часто встречается в соках растений и образуется при окислении различной органики.
Последние разработки в области химии позволили синтезировать новое вещество, способное конкурировать с традиционными органическими веществами. Трифторметансульфокислота имеет показатель кислотности выше, чем у серной. При этом CF3SO3H является стабильной гигроскопичной жидкостью с установленными физико-химическими свойствами при нормальных условиях. На сегодня титул "Самая сильная органическая кислота" может быть присвоен этому соединению.
Многие могут подумать, что степень кислотности не может быть значительно выше показателя серной кислоты. Но в последнее время ученые синтезировали ряд веществ, у которых параметры кислотности в несколько тысяч раз превышают значения серной кислоты. Аномально высокими значениями кислотности обладают соединения, получаемые при взаимодействии протонных кислот с кислотами Льюиса. В научном мире они называются: комплексные протонные кислоты.
Магическая кислота
Да. Все правильно. Магическая кислота. Так и называется. Магическая кислота является смесью фтороводорода или фтор сульфороновой кислоты с пентафлоридом сурьмы. Химическая формула этого соединения представлена на рисунке:

Такое странное название магическая кислота получила на рождественской вечеринке химиков, которая произошла в начале 1960 годов. Один из сотрудников исследовательской группы Дж. Олаха показал забавный фокус, растворив восковую свечу в этой удивительной жидкости. Эта одна из самых сильных кислот нового поколения, но вещество, которое превзойдет ее по силе и кислотности, уже синтезировано.
Самая сильная кислота в мире
Carborane acid - карборановая кислота, которая является на сегодняшний день самой сильным соединением в мире. Формула самой сильной кислоты выглядит таким образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете при тесном сотрудничестве с Новосибирским институтом катализа СО РАН.
Сама идея синтеза возникла в головах ученых вместе с мечтой о новых, невиданных доселе молекулах и атомах. Новая кислота в миллион раз сильнее серной, при этом она совершенно не агрессивна, и самая сильная кислота легко может храниться в стеклянной бутылке. Правда, со временем стекло все-таки растворяется, а при повышении температуры скорость такой реакции значительно увеличивается.

Такая удивительная мягкость обусловлена высокой стабильностью нового соединения. Как и все химические вещества, относящиеся к кислотам, карборановая кислота легко вступает в реакцию, отдавая свой единственный протон. При этом основание кислоты является настолько стабильным, что химическая реакция дальше не идет.
Химические свойства карборановой кислоты
Новая кислота - отличный донор протона Н + . Именно это и определяет силу этого вещества. Раствор карборановой кислоты содержит больше ионов водорода, чем любая другая кислота в мире. В химической реакции SbF 5 - пентафторид сурьмы, связывает илон фтора. При этом высвобождаются новые и новые атомы водорода. Поэтому карборановая кислота и является сильнейшей в мире - взвесь протонов в ее растворе больше аналогичного показателя серной кислоты в 2×10 19 раз.
Однако кислотное основание этого соединения потрясающе стабильно. Молекула этого вещества состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную фигуру, которую называют икосаэдром. Такое расположение атомов является наиболее устойчивым, и это объясняет стабильность карборановой кислоты.

Значение карборановой кислоты
Самая сильная кислота в мире принесла своим создателям заслуженные награды и признание в научном мире. Хотя все свойства нового вещества до конца не изучены, уже становится ясным, что значение этого открытия выходит за рамки лабораторий и научно-исследовательских институтов. Карборановую кислоту можно использовать в качестве мощного катализатора при различных промышленных реакциях. Кроме этого, новая кислота может взаимодействовать с наиболее упрямыми химическими веществами - инертными газами. В настоящее время ведутся работы, допускающие возможность вступления в реакцию ксенона.
Несомненно, удивительные свойства новых кислот найдут свое применение в самых различных областях науки и техники.
Существует много кислот, которые даже в минимальном объёме представляют опасность для человека. Многие люди считают, что самой опасной является серная кислота, но это совершенно не так. Наиболее сильной считается карборановая кислота, которую допускается хранить только в особых сосудах. Она во много раз сильнее серной кислоты и позволяет быстро растворять металлы, стекло и иные вещества, устойчивые к действию иных химических веществ. Но если карборановая кислота встречается очень редко, и то в лабораторных условиях, то с иным сильнодействующим веществом можно столкнуться в повседневной жизни. По мнению многих специалистов, самая ядовитая кислота – это синильная, и встретить её можно не только в лаборатории, но и в продуктах питания.
Как можно получить отравление
Синильная кислота является очень токсичной. При попадании в организм человека признаки отравления появляются достаточно быстро. Попасть в организм это вещество может с продуктами, которые её содержат, а также с той продукцией, которая подвергалась обработке цианидами.
Больше всего этого ядовитого вещества содержится в миндальных орехах. Общее количество может доходить до 3%. Человеку достаточно съесть небольшую горсть миндаля, чтобы получить отравление. Помимо этого, такое опасное вещество содержится в косточках ягод и некоторых фруктов. Больше всего кислоты содержат:
- персик – до 2,8%;
- абрикос – до 1,6%;
- слива – до 0,95%;
- вишня – около 0,8%;
- яблоко – приблизительно 0,6%.
В миндальных зёрнышках и ядрышках фруктов синильная кислота присутствует не в чистом виде, а в форме гликозида амигдалина. Именно это вещество придаёт специфический привкус и аромат орешкам. Попав в организм человека, амигдалин распадается на три составляющие, одной из которых и выступает синильная кислота. В особенности богат таким веществом горький миндаль, поэтому взрослым можно кушать такой продукт в небольших количествах, а детям его вообще кушать нельзя.
Большую опасность представляют вина, приготовленные из ягод и фруктов с косточками. Привести к отравлению может вино, настоянное на вишне с косточками, сливе и абрикосах.
Компоты и варенье, приготовленные из ягод вместе с косточками, опасности для здоровья не представляют. При прогревании уже до 80 градусов синильная кислота разлагается на безопасные компоненты.
Сколько кислоты вызовет отравление
 Количество продукции, которую нужно съесть, чтобы отравиться, может значительно колебаться. Это зависит от возраста человека, его массы тела, общего состояния здоровья и наличия хронических патологий. Но есть средние величины, которых следует придерживаться.
Количество продукции, которую нужно съесть, чтобы отравиться, может значительно колебаться. Это зависит от возраста человека, его массы тела, общего состояния здоровья и наличия хронических патологий. Но есть средние величины, которых следует придерживаться.
Сильнейшая интоксикация может быть, если съесть 30 миндальных орешков, больше 50 абрикосовых ядрышек, более 70 сливовых или вишнёвых. Получить отравление можно, если съесть более 100 яблочных зёрнышек.
Под воздействием самой ядовитой кислоты могут быть смертельные отравления. Критическая доза амигдалина составляет 1 мг на один килограмм массы тела человека. Достаточно съесть 40 зёрнышек горького миндаля или же 100 ядрышек абрикосов, чтобы получить смертельное отравление.
Гурманам, которые сильно любят миндальные орешки в неизменном виде, нужно покупать лакомство только в специализированных магазинах. На упаковке должна быть вся информация о производителе и составе продукта. Даже сладкий миндаль может привести к отравлению, если кушать его без меры.
Горький миндаль сейчас используется только при производстве некоторых лекарственных препаратов и косметической продукции. Такие орешки практически не употребляют в пищу.
Симптоматика отравления
Синильная кислота, попав в кровоток, вступает в связь с эритроцитами, при этом блокируя открепление кислорода и дальнейшую его передачу тканям. За счёт этого в крови сильно увеличивается количество кислорода, а вот в органы он совершенно не поступает, что приводит к гипоксии. Первоочерёдно страдает головной мозг. Все функции этого органа сильно угнетаются, и нарушается работа всех систем и прочих важных органов в организме.
При отравлении этой кислотой появляются такие характерные признаки:
- кожа и все слизистые становятся яркой розовой окраски;
- сильная головная боль, а также головокружение, губы немеют и расширяются зрачки;
- наблюдается нарушение равновесия, человек не может нормально стоять на ногах, нарушается координация движений;
- пульс учащается, как и дыхание;
- пострадавший ощущает боль в груди и нехватку воздуха;
- возникает тошнота и рвота;
- во рту ощущаются привкус металла и горечь;
- может быть неконтролируемая дефекация.
От пострадавшего исходит характерный аромат горького миндаля, по которому и можно определить, что человек отравился. Если состояние очень тяжёлое, то учащённое дыхание быстро сменяется медленным пульсом. Возникает паралич дыхательного центра, и начинаются судороги.
Если при отравлении синильной кислотой помощь пострадавшему не оказать в течение 3 минут, то наступит смерть.
Неотложная помощь
При отравлении сильной кислотой – синильной, необходимо сразу же вызвать скорую помощь. До приезда врачей пострадавшему оказывают первую помощь, которая заключается в таких мероприятиях:

Антидотом синильной кислоты является слабый раствор метиленовой сини. Это средство обычно дают врачи скорой помощи.
После оказания первой помощи с пострадавшего следует снять всю тесную одежду и уложить в постель, приподняв голову подушками. Если у человека спутанное сознание, то ему рекомендуется понюхать ватку, смоченную нашатырным спиртом. Нашатырь, попав в кровь, нейтрализует кислоту.
Если у человека отсутствует дыхание и пульс, необходимо как можно скорее провести непрямой массаж сердца и сделать искусственное дыхание. Такие мероприятия необходимо проводить в первые несколько минут, после прекращения процессов жизнедеятельности.
В условиях больничного стационара больному вводят противосудорожные препараты, антидоты и препараты для восстановления нормального кровообращения. В процессе выздоровления больному показан комплекс витаминов.
После отравления синильной кислотой человек ещё некоторое время должен избегать физических и умственных нагрузок. В это время больному рекомендовано пить много жидкости, в том числе и молока. А также следует много гулять на свежем воздухе, придерживаться рационального питания и отказаться от всех вредных привычек.
Стремительное развитие науки позволяет ученым делать новые сенсационные открытия в области физики, химии и в других направлениях. Систематически научный мир потрясают новости о создании новых веществ с уникальными, не виденными ранее свойствами. Конечно, простые люди не всегда следят за подобными открытиями. Не все знают, что самая сильная кислота в мире была создана в Америке в 2005 году. Для многих наиболее сильным подобным химическим веществом остается серная кислота, хорошо изученная в школе.
Карборановая кислота – самая сильная в мире
В 2005 году ученым, работающим в Калифорнийском университете в США, удалось создать новую кислоту невиданной силы. Изобретенное соединение в миллион раз превосходит по силе концентрированную серную кислоту. Ученые в тот момент задались целью найти новую молекулу, которая станет настоящим открытием в научном мире, и им удалось добиться положительного результата.
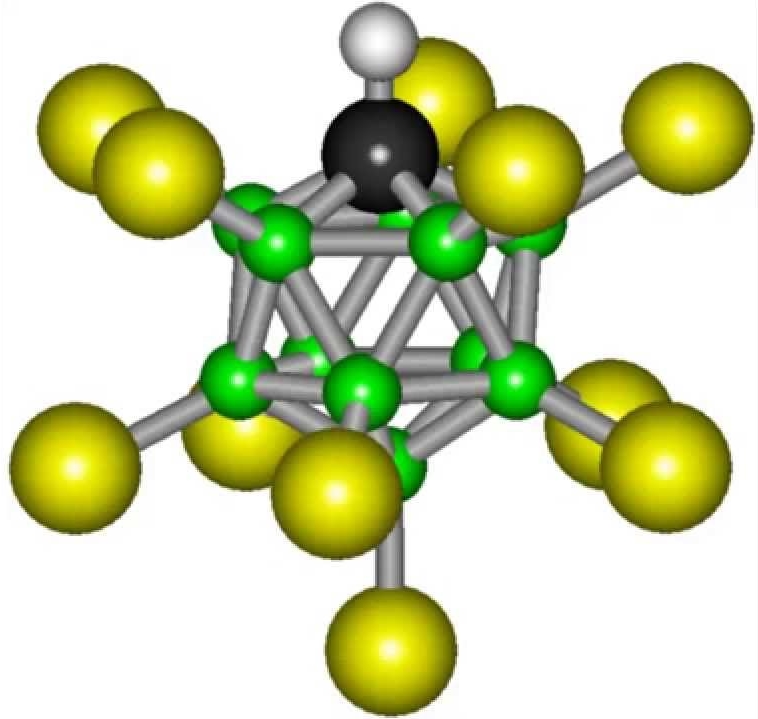
Формула карборановой кислоты не отличается сложностью: H(CHB11Cl11). Но все же синтезировать такое вещество в условиях обычной лаборатории не получится. Карборановая кислота превосходит по кислотности обычную воду в более чем триллиард раз.
Уникальное свойство самой сильной кислоты
Если где-нибудь упоминается о наиболее сильной в мире кислоте, человеческая фантазия рисует вещество, которое растворяет все на своем пути. На самом деле, разрушительные свойства совсем не являются основным признаком силы химического вещества. К примеру, многие полагали, что наиболее мощной кислотой является плавиковая, поскольку она растворяет стекло. Но это далеко от истины. Плавиковая кислота разъедает стеклянную тару, но может храниться в емкостях из полиэтилена.

Признанная наиболее сильной в мире карборановая кислота может легко храниться в стеклянных сосудах. Дело в том, что этому химическому веществу свойственна значительная химическая стабильность. Как и другие подобные соединения, карборановая кислота, вступая в реакцию с реагентами, отдает заряженные атомы водорода. После такой реакции состав имеет незначительный отрицательный заряд и не оказывает разрушительное воздействие на окружающие материалы.
Дальнейшие работы с карборановой кислотой
Конечно, создатели карборановой кислоты стали хорошо известны в мировом научном сообществе. Более того, гениальные ученые были удостоены многих заслуженных наград за значительный вклад в развитие науки. Использование нового вещества уже не ограничивается рамками научных лабораторий: карборановая кислота используется в промышленности в качестве мощнейшего катализатора.

Уникальной особенностью наиболее сильной в мире кислоты является ее способность взаимодействовать с инертными газами. Сегодня проводится множество исследований, целью которых является возможность возникновения реакции между ксеноном и карборановой кислотой. Также ученые не покладая рук работают над изучением других свойств мощнейшей кислоты.
Наиболее известная сильная кислота
О карборановой кислоте хорошо известно ученым. Простые люди чаще всего считают, что самой сильной является серная кислота. Это обусловлено частым использованием вещества в промышленности. Зачастую его применяют производители минеральных удобрений для получения суперфосфатов и сульфатов аммония.
Серная кислота широко применяется в металлургической промышленности. Ее также используют для очистки металлов от окисления. Не обходится без использования серной кислоты производство жидкого топлива. С ее помощью проводят очистку следующих продуктов:
- смазочных масел;
- керосина;
- парафина;
- минеральных жиров.

Но не только промышленное использование заставляет многих людей полагать, что серная кислота является самой сильной в мире. Подобное мнение сложилось из-за того, что вещество, попадая на плоть, обугливает ее. Такое свойство серной кислоты часто используется при съемках криминальных фильмов.
Самая сильная органическая кислота
Если говорить о самой сильной кислоте органической химии, то лидерство тут принадлежит муравьиной кислоте. Вещество так было названо из-за обнаружения его в выделениях муравьев. Муравьиная кислота имеет обширную сферу использования. Ее часто используют в медицине, поскольку она обладает анальгезирующими и раздражающими свойствами. Муравьиная кислота присутствует во многих мазях, которые применяются для лечения ушибов, варикозных расширений вен, отеков. Лекарства с этим веществом позволяют избавиться от прыщей.

Муравьиную кислоту также широко применяют в химической промышленности. Ее используют также в сельском хозяйстве и пчеловодстве. Вещество также применяется в пище как добавка Е236.
Несмотря на свою распространенность, муравьиная кислота может представлять серьезную угрозу. Попадание концентрированного вещества на кожные покровы вызывает ожоги или сильную боль. Даже вдыхание паров муравьиной кислоты может стать причиной повреждений дыхательных путей. Но положительным свойством вещества является то, что оно быстро выводится из организма, не накапливаясь в нем.
Многие пытаются выяснить для себя ответ на вопрос о том, какая она - самая сильная кислота . Разобраться в этом не очень сложно, однако необходимо почитать специальную литературу. Для тех, кто хочет просто узнать ответ на данный вопрос, написана эта статья.
Многие считают, что самая сильная кислота - плавиковая, ведь она способна растворять стекло. Это суждение практически необосновано. В понимании иных самая сильная кислота - серная. Последнее утверждение имеет вполне логическое объяснение. Дело в том, что серная кислота является очень сильной среди тех, которые применяются в промышленности. При контакте с живой тканью она способна обугливать плоть, оставлять сильные ожоги, которые заживают долго и проблематично. Её производство не требует особых материальных затрат. И можно с уверенностью утверждать, что она не является самой сильной. Науке известны так называемые суперкислоты. Речь о них пойдёт далее. А на бытовом уровне самой распространённой из сильных кислот является всё же серная. Именно поэтому она представляет опасность.
Так как же кислота может быть сильной и нежной? Ответ заключается в том, как химики определяют прочность кислоты. Кислотная прочность - это способность кислоты добавлять ион водорода к основным молекулам. Другим примером является выбор кислоты для очистки известковых отложений внутри медного чайника, отметил он. Мудрый домовладелец выбирает соляную кислоту, а не азотную кислоту, потому что хлорная часть хлористоводородной кислоты не нападает на меди, тогда как нитратная часть азотной кислоты растворяет чайник в беспорядке токсичных коричневых паров.
Многие современные ученые-химики считают, что самая сильная кислота в мире - карборановая. Это подтверждено результатами тщательных исследований. Данная кислота мощнее серной концентрированной более чем в миллион раз. Её феноменальным свойством является способность храниться в пробирке, которым не обладают многие другие вещества из упомянутого ряда. Химический состав , который считался самым едким, не мог сохраняться в стеклянной таре. Дело в том, что карборановая кислота обладает значительной химической стабильностью. Как и другие подобные ей вещества, при реакции с иными реагентами она жертвует им атомы водорода с зарядами. Однако оставшийся после реакции состав, хоть и имеет отрицательный заряд, но является очень устойчивым и не может действовать далее. Карборановая кислота имеет несложную формулу: H(CHB 11 Cl 11). Но добыть готовое вещество в обычной лаборатории непросто. Стоит отметить, что она кислее обычной воды более чем в триллиард раз. По словам изобретателя, данное вещество появилось в результате разработки новых химикалий.
Новые «сильные, но нежные» кислоты называются карбонатными кислотами. Секрет их силы двоякий. Самое главное, что карбонатная часть кислоты является чрезвычайно слабым основанием, слабее, чем фторсульфатная часть фторсерной кислоты, которая была предыдущим рекордным держателем для самой сильной кислоты. Во-вторых, карбораны обладают исключительной химической стабильностью.
По словам Рида, у них есть икосаэдрическое расположение одиннадцати атомов бора плюс один атом углерода, который, вероятно, является наиболее химически устойчивым кластером атомов во всей химии. Это означает, что карборановая часть кислоты не может участвовать в химии коррозии и разложения, которую показывают фторид и нитрат в плавиковой кислоте и азотной кислоте. В результате кислоты карборана могут добавлять ионы водорода к слабоосновным молекулам, не разрушая часто деликатные положительно заряженные молекулы, которые образуются.
Фтористоводородную, плавиковую и другие сильные кислоты список самых едких веществ содержит. Промышленные реагенты туда не входят. Однако всё же необходимо опасаться таких распространённых кислот, как серная, соляная, азотная и прочие. Не хотелось бы пугать кого-либо, но для осуществления посягательств на здоровье и умышленного уродования внешности используются, как правило, вещества именно из этого перечня.
Это и есть их сильные, но нежные качества, добавил Рид. Ни одна из этих положительно заряженных молекул не была «помещена в бутылку» при комнатной температуре раньше, потому что ранее используемые кислоты разлагали их. Сильные, но нежные карбонановые кислоты преодолевают эту трудность, позволяя химикам более внимательно рассмотреть важные молекулы, существование которых, как правило, мимолетно, сказал Рид. Подкисленные молекулы являются важными недолговечными промежуточными продуктами в огромном разнообразии катализируемых кислотой химических превращений, включая переваривание пищевых продуктов, улучшение бензина, образование полимера и синтез фармацевтических препаратов.
 является то, что среди жирных кислот, которые содержатся в продуктах питания, самой сильной является муравьиная. Она часто применяется для консервации овощей и в медицинских целях, но только в форме раствора.
является то, что среди жирных кислот, которые содержатся в продуктах питания, самой сильной является муравьиная. Она часто применяется для консервации овощей и в медицинских целях, но только в форме раствора.
Необходимо ещё раз сказать, что самой сильной кислотой является карборановая. Но на сегодняшний день необходимо больше опасаться веществ, которые используются в промышленности и быту. Химия - довольно полезная и сложная наука, но широкое производство несложных составов не требует особых знаний, а посему и кислоту добыть в достаточном количестве просто. Это создаёт повышенную опасность в случае неаккуратного обращения или реализации плохих намерений.
Насколько сильны кислоты карборана? Самый сильный из них, по крайней мере, в миллион раз сильнее, чем концентрированная серная кислота, и в сотни раз сильнее, чем предыдущий рекордсмен, фторсерная кислота. Концентрированная серная кислота уже более чем в миллиард раз сильнее разбавленной кислоты бассейна или кислоты в желудке. Кислотные среды, имеющие или превышающие кислотность карбонатных кислот, были достигнуты ранее добавлением пентафторида сурьмы к фторсерной кислоте, но эти смеси являются очень коррозионными и имеют другие ограничения.
Если говорить языком химии, то кислоты – это те вещества, которые проявляют способность отдачи катионов водорода, или же вещества, которые имеют возможность приема электронной пары в результате образования ковалентной связи. Однако в обычном разговоре под кислотой чаще всего понимают только те соединения, которые при образовании водных растворов дают избыток H30+. Наличие данных катионов в растворе придает веществу кислый вкус, возможность реагировать на индикаторы. В этом материале мы расскажем о том, какое вещество - самая сильная кислота, а также расскажем о других кислотных веществах.
Кислоты, которые являются такими сильными, называются суперкислотами, и они реагируют с углеводородами из нефти в процессе, называемом растрескиванием углеводородов. Это важный процесс повышения октановых уровней бензина. Новые кислоты могут стать очень важными для понимания и улучшения этого процесса, сказал Рид. Карборановые кислоты продвинули это поле еще дальше.
Наиболее известная сильная кислота
Есть много других молекул, реакции которых с традиционными кислотами беспорядочны и поэтому не очень полезны. Карборановые кислоты обеспечивают очень чистую кислотность без свирепости. Таким образом, должен быть возможен более чистый кислотный катализ реакций, важных для производства фармацевтических препаратов и нефтепродуктов.
Пентафторид сурьмы фтористоводородной кислоты (HFSbF5)
Для описания кислотности того или иного вещества существует показатель PH, который является отрицательным десятичным логарифмом концентрации ионов водорода. Для обычных веществ этот показатель находится в пределах от 0 до 14. Однако для описания HFSbF5, который называют еще “суперкислотой”, этот показатель не подходит.
Рид говорит: Наши исследования связаны с созданием молекул, которые никогда не были сделаны раньше. Карборановые кислоты позволяют нам это делать. Это истинная ценность этого исследования. Наука развивается, и в то же время студенты испытывают острые ощущения от открытия, поскольку они становятся учеными.
Университет Калифорнии, Риверсайд, является докторантным исследовательским университетом, живой лабораторией для новаторского исследования проблем, имеющих решающее значение для внутренней части Южной Калифорнии, государства и общин во всем мире. Сильная кислота определяется как значение рН, которое является силой водорода, что делает кислоту сильной. Однако значение рН не работает в порядке возрастания. Чем ниже значение рН, тем сильнее будет кислота. Шкала рН варьируется от 1 до раствора, значение рН которого меньше 7, рассматривается как кислоты, тогда как растворы с рН более 7 считаются основаниями.
Точных данных об активности данного вещества не существует, однако известно, что даже 55% раствор HFSbF5 почти в 1 000 000 сильнее концентрированной H2SO4, которая в обывательских умах считается одной из самых сильных кислот. Тем не менее, пентафторид сурьмы является достаточно редким реагентом, а само вещество создавалась лишь в лабораторных условиях. В промышленных масштабах оно не выпускается.
Список самых сильных кислот и их использование
Кислоты с величиной рН менее 1 считаются самыми сильными, а растворы, имеющие значение выше 13, считаются сильным основанием. Значение рН составляет 2 и считается одним из полезных кислот. Соль или сливки тартара, найденные в этом, развиваются естественным образом во время изготовления вина. Он смешивается с бикарбонатом натрия и коммерчески продается в качестве выпечки. Он используется при приготовлении пищи и обладает уникальным кислым вкусом.
Это факт, что он является источником алмазов, найденных на пробке бутылки или ее нижней части. Это используется как органическое соединение, и оно производится с помощью всех живых организмов. Эти сладости предупреждают о них, информируя клиентов о том, что они могут вызвать раздражение рта. Лимон, как правило, содержится в лимонах и имеет значение рН. Обычно она содержится в пищу цитрусовых, и она также действует как промежуточное звено в цикле лимонной кислоты, которое происходит в метаболизме аэробных организмов, Это сильная и съедобная кислота, которая используется в еде и напитке на вкус, например, безалкогольные напитки и лимонады.
Карборановая кислота (H{CHB11Cl11})
Еще одна суперкислота. H{CHB11Cl11}) - самая сильная кислота в мире из тех, которые допускаются к хранению в специальной посуде. Молекула вещества имеет вид икосаэдра. Карборановая кислота гораздо сильнее серной. Она способна растворить металлы и даже стекло.
Создано данное вещество в Калифорнийском университете Соединенных Штатов Америке при участии ученых из Новосибирского института каталитических процессов. Как сказал один из сотрудников американского университета, идеей создания служило стремление создать молекулы, ранее никому не известные.
Он добавляется в мороженое, где он действует как эмульгатор, который предотвращает выделение жиров. Он также действует как очищающий агент и может использоваться для удаления извести из испарителей и котлов. Он смягчает воду, что делает ее полезной при изготовлении моющих средств для стирки и мыла. Он не имеет запаха и может использоваться в косметических и диетических добавках.
Следовательно, он используется в широком спектре промышленных, а также отечественных продуктов. Серный также известен как сернистый; значение рН составляет 5 и это химическое соединение. Существует мало свидетельств того, что это существует в растворе, но оно существует в газовой фазе. Основаниями этого являются обычные анионы, бисульфат и сульфит. Это действует как восстановитель и дезинфицирующие средства. Они также действуют как мягкие отбеливатели и могут помочь тем материалам, которые уничтожаются хлорсодержащими отбеливателями.
Сила H{CHB11Cl11}) обусловлена тем, что она прекрасно отдает ион водорода. В растворах этого вещества концентрация данных ионов намного выше, чем в других. Другая же часть молекулы, после отдачи водорода включает в себя одиннадцать углеродных атомов, которые и образуют икосаэдр, который является достаточно стабильной структурой, повышая коррозионную инертность.
Значение рН составляет 5 и это минеральная кислота. Ингибитор ржавчины Пищевая добавка Используется в стоматологических продуктах Электролитный агент Диспергирующий агент Промышленный травитель Используется в домашних чистящих средствах. Это также кристаллическое твердое вещество, действует как восстановитель и имеет конъюгирующее основание.
Еще одной самой сильной кислотой является более знакомый нам фтористый водород. Промышленность выпускает ее в виде растворов, чаще всего сорока-, пятидесяти- или семидесятипроцентных. Своим названием вещество обязано плавиковому шпату, который служит сырьем для фтороводорода.
Данное вещество не имеет цвета. При растворении в H20 происходит значительное выделение теплоты. При небольших температурах HF способен образовывать слабые соединения с водой.
Он поглощает влагу из воздуха и представляет собой бесцветное кристаллическое твердое вещество. Он образует сироп и растворим в воде, когда он выделяется с высокой температурой. Это значение рН равно 0, и это бесцветная жидкость. Он используется для. Производство неорганических и органических нитратов Производство нитросоединений для удобрений Красители-промежуточные продукты Органические химические вещества Взрывчатые вещества. Если человек постоянно подвергается воздействию паров, это может вызвать химический пеномонит и хронический бронхит.
Вещество разъедает стекло и многие другие материалы. Для ее транспортировки используют полиэтилен. Очень хорошо реагирует с большинством металлов. Не вступает в реакции с парафином.
Достаточно токсична и оказывает наркотический эффект. При попадании внутрь может вызвать острое отравление , нарушение кроветворения, сбой в работе органов, нарушение в работе дыхательной системы.
Это бесцветная жидкость, которая при выпуске в воду отдает белые пары. Двумя другими названиями этой кислоты являются серная окись и серный ангидрид. Он широко используется в производстве химических веществ и взрывчатых веществ. Например, он используется при изготовлении синтетических моющих средств, медикаментов, промышленных красителей и пигментов, удобрений и т.д. длительное воздействие может оказывать негативное воздействие на здоровье и может сильно повредить организм человека.
Соляная кислота имеет значение рН. Это агрессивная и самая мощная кислота, которая в основном используется в лабораторных условиях. Образование этой кислоты осуществляют с помощью растворения хлористого водорода в воде. Он используется для многих вещей, таких как производство хлоридов, удобрений и умирающих. Другие виды использования кислоты включают текстиль, гальванизацию и изготовление резины. Если человек подвергается воздействию этой сильной соляной кислоты , то воздействие приведет к следующим вещам.


Вещество представляет собой сильную кислоту с двумя основами. Сера в соединении имеет высшую степень окисления (плюс шесть). Не имеет запаха и цвета. Чаще всего используется в растворе с водой или серным ангидридом.
Существует несколько способов получения H2S04:
- Промышленный метод (окисление диоксида).
- Башенный метод (получение с помощью оксида азота).
- Другие (основаны на получение вещества из взаимодействия диоксида серы с различными веществами, мало распространены).
Концентрированная H2SO4 очень сильная, однако и ее растворы представляют серьезную опасность. При нагревании представляет собой достаточно сильный окислитель. При взаимодействии с металлами происходит их окисление. При этом H2S04 восстанавливается до диоксида серы.
H2SO4 очень едкая. Она способна поражать кожу, дыхательные пути , слизистые оболочки и внутренние органы человека. Очень опасно не только попадание ее внутрь организма, но и вдыхание ее паров.
Муравьиная кислота (HCOOH)
Данное вещество представляет собой насыщенную кислоту с одной основой. Интересно, что, несмотря на свою силу, она используется как пищевая добавка. В нормальных условиях не имеет цвета, хорошо растворяется в ацетоне и легко смешивается с водой.
HCOOH опасна при высоких концентрация. С концентрацией меньше десяти процентов она оказывает лишь раздражающий эффект . При более высоких – способна разъедать ткани и многие вещества.
Концентрированная HCOOH при попадании на кожу вызывает очень сильный ожог, что вызывает серьезный болевой синдром . Пары вещества способны повредить глаза, органы дыхания и слизистые оболочки. Попадание ее внутрь вызывает серьезное отравление. Однако кислота в очень слабых концентрациях легко перерабатывается в организме и выводится из него.

При отравлениях метанолом в организме также образуется муравьиная кислота. Именно ее работа в данном процессе приводит к нарушениям зрения из-за повреждения зрительного нерва.
Данное вещество содержится в небольшом количестве во фруктах, крапиве, выделениях некоторых насекомых.
Азотная кислота (HNO3)
Азотная кислота является сильной кислотой с одной основой. Хорошо смешивается с H20 в различных пропорциях.
Данное вещество является одним из самых массовых продуктов химической промышленности. Существует несколько методов ее получения, однако чаще всего применяется окисление аммиака в присутствии платинового катализатора. Используется HNO3 чаще всего при производстве удобрений для сельского хозяйства . Кроме того, ее используют в военной сфере, при создании взрывчатки, в ювелирной промышленности, для определения качества золота, а также при создании некоторых лекарств (например, нитроглицерина).

Вещество очень опасно для человека. Пары HNO3 повреждают дыхательные пути и слизистые оболочки. Кислота, попавшая на кожу, оставляет после себя язвы, которые очень долго заживают. Также кожный покров приобретает желтый оттенок.
Под воздействием высокой температуры или света HNO3 распадается до диоксида азота, который является достаточно токсичным газом.
HNO3 не вступает в реакции со стеклом, поэтому именно этот материал используют для хранения вещества. Впервые кислота была получена алхимиком Джабиром.